Bisulfite de sodium
Le bisulfite de sodium ou hydrogénosulfite de sodium est un sel de formule brute NaHSO3. Il n'existe qu'en solution aqueuse et ne peut être isolé. Il est utilisé comme additif alimentaire (E222).
| Bisulfite de sodium | |
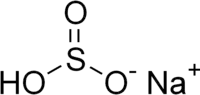
| |
| Identification | |
|---|---|
| Synonymes |
Sulfite acide de sodium, hydrogénosulfite de sodium |
| No CAS | |
| No ECHA | 100.028.680 |
| No CE | 231-548-0 |
| No RTECS | VZ2000000 |
| PubChem | 656672 |
| ChEBI | 26709 |
| No E | E222 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | HNaO3S |
| Masse molaire[1] | 104,061 ± 0,006 g/mol H 0,97 %, Na 22,09 %, O 46,13 %, S 30,81 %, |
| Précautions | |
| Directive 67/548/EEC[2] | |
 Xn |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est obtenu par la réaction :
Il est également utilisé dans l'industrie comme agent réducteur, par exemple dans les effaceurs d'encre.
Traitement de l'eau
Le bisulfite de sodium est notamment utilisé dans les stations de potabilisation pour la production de l'eau de boisson. En effet en différents points de la filière de traitement, des composés oxydants (ozone, chlore actif) sont utilisés pour purifier l'eau. Cependant les concentrations de ces composés doivent être par la suite réduites avant que l'eau ne puisse être distribuée et consommée.
Le bisulfite de sodium va réagir avec la molécule de chlore actif, ici l'acide hypochloreux (HOCl) afin de la neutraliser. Le produit chloré final de la réaction est NaCl, molécule qui a perdu son pouvoir oxydant.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « hydrogénosulfite de sodium », sur ESIS, consulté le 5 mars 2010
- Entrée « Sodium hydrogensulfite solution » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 5 mars 2010 (JavaScript nécessaire)

![{\displaystyle SO_{2}\ {\xrightarrow[{}]{Na_{2}CO_{3}}}\ NaHSO_{3}}](https://img.franco.wiki/i/ec6cbbf32a0b7dfaa3bf975e7ef83b0f92f8f8dc.svg)
