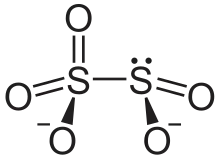
Disulfite
Un disulfite, généralement appelé métabisulfite, est un composé chimique contenant l'ion disulfite, ou métabisufite, de formule brute S2O52−[1]. Il s'agit d'un dimère de l'ion bisulfite HSO3−.
En solution aqueuse, il se décompose sous l'effet d'un acide en bisulfite et dioxyde de soufre SO2 :
Préparation
Plusieurs voies permettent d'obtenir des disulfites :
- Déshydratation de bisulfites
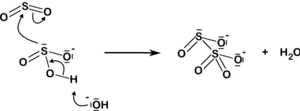
En solution aqueuse, l'ion disulfite se forme en petites quantités par déshydratation de bisulfite par l'équilibre :
Bien que cet équilibre soit naturellement fortement déplacé vers la gauche, l'évaporation d'un sel de bisulfite tend à le déplacer vers la droite, produisant des quantités significatives de disulfite.
L'ion disulfite résulte de l'acide disulfureux H2S2O5, lui-même issu de l'acide sulfureux H2SO3 par déshydratation :
- Addition de dioxyde de soufre sur des sulfites
L'ion disulfite résulte également de l'addition de dioxyde de soufre SO2 à l'ion sulfite SO3− :
| HSO3− SO32− + SO2 |
 |
Notes et références
- (en) Union internationale de chimie pure et appliquée, Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005, Cambridge, RSC–IUPAC, , 366 p. (ISBN 0-85404-438-8, lire en ligne [PDF]), p. 130.