Anthracène
L'anthracène ou anthraxène est un composé chimique de formule C14H10 synthétisé pour la première fois par Richard Anschütz. C'est un hydrocarbure aromatique polycyclique composé de trois noyaux benzèniques (benzène) fusionnés en alignement. On l'obtient à partir du goudron. Il est utilisé pour la production industrielle d'alizarine, un pigment rouge naturel d'origine végétale, ainsi que dans les conservateurs pour le bois, des insecticides et des revêtements de surface.
| Anthracène | |
 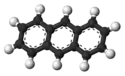  Structure de l'anthracène. |
|
| Identification | |
|---|---|
| Nom UICPA | anthracène |
| Synonymes |
anthraxène anthracine paranaphtalène |
| No CAS | |
| No ECHA | 100.003.974 |
| No CE | 204-371-1 |
| PubChem | 8418 |
| ChEBI | 35297 |
| SMILES | |
| InChI | |
| Apparence | cristaux ou flocons blancs[1]. |
| Propriétés chimiques | |
| Formule | C14H10 [Isomères] |
| Masse molaire[2] | 178,229 2 ± 0,011 9 g/mol C 94,34 %, H 5,66 %, |
| Susceptibilité magnétique | 130,3×10-6 cm3·mol-1[3] |
| Propriétés physiques | |
| T° fusion | 217,5 °C [4] |
| T° ébullition | 340 °C [4] |
| Solubilité | 0,001 3 g·l-1 (eau,20 °C) [1] |
| Paramètre de solubilité δ | 20,3 MPa1/2 (25 °C)[5] |
| Masse volumique | 1,24 g·cm-3 (solide,20 °C) [4] |
| T° d'auto-inflammation | 538 °C [1] |
| Point d’éclair | 121 °C [1] |
| Limites d’explosivité dans l’air | 0.6 - ? Vol.%[1] |
| Pression de vapeur saturante | à 25 °C : 0,08 Pa[1] |
| Point critique | [6] |
| Thermochimie | |
| S0solide | 207,15 J·mol-1·K-1 [7] |
| ΔfH0gaz | 227,1 kJ·mol-1 [7] |
| ΔfH0solide | 125,5 kJ·mol-1 [7] |
| Cp | 211,7 J·mol-1·K-1 (solide,25 °C) 184,7 J·mol-1·K-1 (gaz,25 °C) [7] |
| Cristallographie | |
| Système cristallin | monoclinique[9] |
| Classe cristalline ou groupe d’espace | [9] |
| Paramètres de maille | a = 8,56 Å b = 6,04 Å |
| Précautions | |
| SGH[10] | |
  Attention |
|
| SIMDUT[11] | |
Produit non contrôlé |
|
| NFPA 704 | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[12] | |
| Écotoxicologie | |
| DL50 | 430 mg·kg-1 (souris, i.p.) [13] |
| LogP | 4,5 [4] |
| Composés apparentés | |
| Isomère(s) | Phénanthrène |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physico-chimiques
L'anthracène est incolore, mais présente une fluorescence bleue à 400 et 440 nm lorsqu'il est soumis aux ultraviolets, lesquels peuvent également provoquer sa photodimérisation :
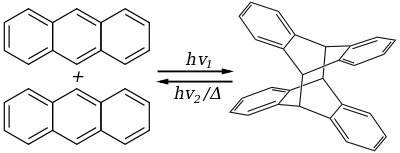
Il est utilisé comme scintillateur dans la détection de particules de haute énergie telles que photons, électrons et particules α. C'est également un semi-conducteur organique.
Production et synthèse
L'anthracène est extrait du goudron minéral par une suite d'opérations :
- une première distillation concentre l'hydrocarbure dans une fraction particulière avec une concentration d'environ 7 % ;
- une étape de centrifugation permet une seconde concentration jusqu'à 20-35 % ;
- une série de cristallisations dans des solvants spécifiques tels la pyridine, l'acétone, l'acétophénone ou le diméthylacétamide permet d'atteindre une pureté de 95 %[14].
Contrairement aux autres HAP, l'anthracène ne serait pas cancérogène, mais est néanmoins considéré comme une substance à risque.
Toxicologie, écotoxicologie
Selon une étude faite sur Daphnia pulex (espèce fréquemment utilisée pour les tests de toxicité), le caractère toxique de l’anthracène peut être synergiquement exacerbé par les UV solaires ou la lumière du soleil[15]
Notes et références
- ANTHRACENE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », Journal of the American Chemical Society, vol. 91, no 8, , p. 1991-1998
- Entrée « Anthracene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 juin 2009 (JavaScript nécessaire)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5, présentation en ligne), p. 294
- « Properties of Various Gases » [archive du ], sur flexwareinc.com (consulté le )
- (en) « Anthracene », sur NIST/WebBook, consulté le 30 juin 2009
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co., (ISBN 978-0-88415-859-2)
- (en) R.B. Campbell, J. M. Robertson et J. Trotter, « The crystal structure of hexacene, and a revision of the crystallographic data for tetracene », Acta Crystallographica, vol. 15, no 5, , p. 289-290
- « Anthracène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » [archive du ], sur http://monographs.iarc.fr, CIRC, (consulté le )
- (en) « Anthracène », sur ChemIDplus, consulté le 30 juin 2009
- Gerd Collin, Hartmut Höke, Jörg Talbiersky, Ullmann's Encyclopedia of Industrial Chemistry, Anthracene, Wiley-VCH Verlag GmbH & Co,
- Alfred P.M. & Giesy J.P. (1985) Solar radiation induced toxicity of anthracene to Daphnia pulex. Environ. Toxicol. Chem., 4, 210-226





