Anhydride maléique
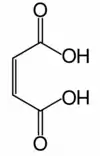
L'anhydride maléique (anhydride cis-butènedioïque) est l'anhydride de l'acide maléique (acide carboxylique) :
| Anhydride maléique | |
| |
| Identification | |
|---|---|
| Nom UICPA | anhydride cis-butènedioïque |
| Synonymes |
2,5-Furanedione |
| No CAS | |
| No ECHA | 100.003.247 |
| No CE | 203-571-6 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores ou blancs, d'odeur âcre[1]. |
| Propriétés chimiques | |
| Formule | C4H2O3 [Isomères] |
| Masse molaire[2] | 98,056 9 ± 0,004 2 g/mol C 48,99 %, H 2,06 %, O 48,95 %, |
| Propriétés physiques | |
| T° fusion | 53 °C[1] |
| T° ébullition | 202 °C[1] |
| Solubilité | dans l'eau : 400 g l−1[1] |
| Paramètre de solubilité δ | 27,8 MPa1/2 (25 °C)[3] |
| Masse volumique | 1,5 g/cm3[1], 1,3 g/cm3 (liquide à 70 °C) |
| T° d'auto-inflammation | 475 °C[1] |
| Point d’éclair | 102 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 1,4–7,1 % vol[1] |
| Pression de vapeur saturante | 20 Pa à 20 °C 25 Pa à 25 °C 45 Pa à 30 °C 200 Pa à 50 °C |
| Thermochimie | |
| Cp | |
| Précautions | |
| SGH[5] | |
   Danger |
|
| SIMDUT[6] | |
  D1B, D2A, D2B, E, |
|
| NFPA 704 | |
| Transport | |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,25 ppm haut : 0,32 ppm[7] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il se présente généralement sous la forme de cristaux blancs à transparents.
Production et synthèse
Comme son nom l'indique, l'anhydride maléique peut être obtenu par déshydratation de l'acide maléique (hydraté, il donne l'acide maléique). Il a longtemps été synthétisé par oxydation du benzène ou d'autres composés aromatiques. Ce procédé est devenu obsolète à cause de l'augmentation du prix du benzène et des normes liées à sa toxicité. De plus, le bilan carbone de cette méthode est mauvais : on part d'une molécule à six carbones pour obtenir une molécule à quatre carbones, deux atomes de carbone sont donc libérés sous forme de CO2.
L'anhydride maléique est aujourd'hui majoritairement synthétisé par oxydation du butane grâce à des catalyseurs de type VPO (oxyde mixte de vanadium et de phosphore)[8] :
- 2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O.
Réactions
L'anhydride maléique peut être utilisé dans de très nombreuses réactions chimiques grâce aux différentes fonctions qu'il présente. On peut citer par exemple :
- la formation d'acide maléique par hydratation. En utilisant à la place de l'eau un alcool, un ester peut être obtenu ;
- l'utilisation comme diénophile dans la réaction de Diels-Alder ;
- l'anhydride maléique peut être un ligand dans des complexes métalliques tels que Pt(PPh3)2(AM) ou Fe(CO)4(AM).
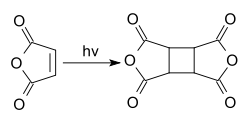
L'anhydride maléique se dimérise lors d'une réaction photochimique[9] en dianhydride cyclobutanetétracarboxylique, CBTA. Ce composé est utilisé dans la production de polyimides et comme un film d'alignement pour les écrans à cristaux liquides[10].
Utilisations
Environ 50 % de la production mondiale d'anhydride maléique est utilisée pour la synthèse de résines polyesters insaturées. La synthèse se fait par polycondensation de polyols et de polyacides ou d'anhydrides.
La seconde utilisation industrielle importante (environ 15 % de la production) est la synthèse de 1,4-butanediol par hydrogénation, c'est un monomère pour la formation de plusieurs polymères : polyuréthanes thermoplastiques, polytéréphtalate de butylène, fibres Élasthanne, etc.
Références
- ANHYDRIDE MALEIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5, présentation en ligne), p. 294
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub., (ISBN 978-0-88415-857-8)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Anhydride maléique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Maleic anhydride », sur hazmap.nlm.nih.gov (consulté le )
- Kurt Lohbeck, Herbert Haferkorn, Werner Fuhrmann et Norbert Fedtke, « Maleic and Fumaric Acids », Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, (DOI 10.1002/14356007.a16_053)
- Conditions de la réaction de Horie et al., 2010 : microréacteur, lampe à vapeur de mercure, solvant : acétate d'éthyle, 15 °C.
- Horie, T. ; Sumino, M. ; Tanaka, T. ; Matsushita, Y. ; Ichimura, T. et Yoshida, J. I., Photodimerization of Maleic Anhydride in a Microreactor Without Clogging, 2010, Organic Process Research & Development, 100128104701019, DOI 10.1021/op900306z.