Éthylènediamine
L'éthylènediamine ou 1,2-diaminoéthane (abrégé en quand utilisé en ligand) est un composé organique de formule C2H4(NH2)2. Elle est très largement utilisée comme « bloc de construction » en synthèse chimique, avec environ 500 000 tonnes produites en 1998[9].
| Éthylènediamine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | éthane-1,2-diamine | |
| Synonymes |
1,2-diaminoéthane |
|
| No CAS | ||
| No ECHA | 100.003.154 | |
| No CE | 203-468-6 | |
| No RTECS | KH8575000 | |
| SMILES | ||
| InChI | ||
| Apparence | Liquide incolore, odeur proche de l'ammoniac | |
| Propriétés chimiques | ||
| Formule | C2H8N2 [Isomères] |
|
| Masse molaire[2] | 60,098 3 ± 0,002 6 g/mol C 39,97 %, H 13,42 %, N 46,61 %, |
|
| pKa | 9,98[3] | |
| Propriétés physiques | ||
| T° fusion | 8 °C[4] | |
| T° ébullition | 116 °C[4] | |
| Solubilité | Totalement soluble dans l'eau | |
| Paramètre de solubilité δ | 25,2 MPa1/2 (25 °C)[5] | |
| Masse volumique | 0,90 g·cm-3[4] | |
| T° d'auto-inflammation | 385 °C[4] | |
| Point d’éclair | 34 °C[4] | |
| Limites d’explosivité dans l’air | 2,7 Vol.-% - 67 g·m-3 16,6 Vol.-% - 415 g·m-3[4] |
|
| Pression de vapeur saturante | 12,4 mbar à 20 °C 22,6 mbar à 30 °C 39,4 mbar à 40 °C 66,3 mbar à 50 °C[4] |
|
| Conductivité électrique | 9×10-6 S·m-1 à 25 °C[4] | |
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC[4] | ||
 Xn  C |
||
| Transport[4] | ||
| Écotoxicologie | ||
| DL50 | 1 g·kg-1 (souris, oral)[6] 200 mg·kg-1 (souris, i.p.)[7] |
|
| CL50 | 300 mg·m-3 (souris, inhalation)[8] | |
| LogP | -2,04[4] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés[4]
L'éthylènediamine est un liquide incolore avec une odeur proche de celle de l'ammoniac, et une amine très basique. C'est un liquide inflammable, dont les vapeurs peuvent former un mélange explosif avec l'air quand il est chauffé au-dessus de son point d'éclair. Elle est miscible à l'eau et est hygroscopique. Les solutions aqueuses d'éthylènediamine réagissent fortement avec les alcalins. Elle génère de la fumée au contact de l'air humide. L'éthylènediamine se décompose lorsqu'elle est chauffée, notamment en oxydes d'azote. Elle réagit de façon dangereuse avec :
- l'épichlorohydrine
- les agents oxydants
- les acides
- le prop-2-énal
- le perchlorate d'argent
- les acétates de vinyle.
Synthèse
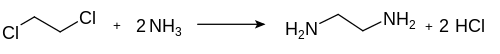
L'éthylènediamine est synthétisée par réaction entre l'ammoniac et le 1,2-dichloroéthane ou le 1,2-dibromoéthane :
Cette réaction produit un mélange d'éthylènediamine et de polyamines linéaires.
Applications
L'éthylènediamine est utilisée en grande quantité pour la production de nombreux composés chimiques. Elle forme des dérivés avec les acides carboxyliques (y compris les acides gras), les nitriles, les alcools (à haute température), les agents alkylants, le sulfure de carbone ainsi que les composés carbonylés (aldéhydes et cétones). De par sa nature bi-fonctionnelle, avec deux groupes amines, elle forme facilement des hétérocycles tels que des imidazolidines. L'éthylènediamine est un ligand chélateur connu pour ses complexes, tels que le [Co(éthylènediamine)3]3+.
Précurseur de chélateurs
Le dérivé le plus connu de l'éthylènediamine est l'EDTA, synthétisé à partir de l'éthylènediamine, du formaldéhyde et d'un cyanure (cyanure de potassium par exemple) par synthèse de Strecker. L'hydroxyéthyléthylènediamine est aussi un chélateur important dans le commerce, synthétisé à partir de l'éthylènediamine. Le ligand salen, obtenu par condensation du salicylaldéhyde et de l'éthylènediamine, est un chélateur commun utilisé en recherche, mais qui n'est pas commercialement important[9].
Précurseur de produits pharmaceutiques et agrochimiques
De nombreux composés bioactifs contiennent un lien N-CH2-CH2-N, comme l'aminophylline et certains antihistaminiques[10]. Des sels de l'éthylènebisdithiocarbamate sont des fongicides importants commercialement, vendus sous les noms de Manèbe, Mancozèbe, Zinèbe et Métiram. Certains fongicides possédant un groupe imidazoline sont dérivés de l'éthylènediamine[9].
Polymères
L'éthylènediamine, de par sa bi-fonctionnalité, est très utilisée pour la formation de différents polyesters. Elle est très utilisée dans la production de fibres polyuréthane. La classe de dendrimères PAMAM dérive de l'éthylènediamine[9].
Tetraacétyléthylènediamine
L'activateur de javel tétraacétyléthylènediamine est synthétisé à partir de l'éthylènediamine. Son dérivé le N,N-éthylènebis(stéaramide) (EBS) est un agent de démoulage important commercialement, et un tensioactif pour l'essence et l'huile de moteur.
Applications spécialisées
L'éthylènediamine est aussi utilisée comme :
- solvant, car elle est miscible avec des solvants polaires et est utilisée pour solubiliser des protéines comme l'albumine et la caséine. Elle est aussi utilisée dans certains bains de galvanoplastie ;
- inhibiteur de corrosion dans les peintures et les antigels.
- agent chimique pour le développement de photographie couleur, liant, adhésif, adoucissant, agent de réticulation par irradiation UV pour époxys et colorant.
Le dihydroïodure d'éthylènediamine est utilisé comme complément alimentaire pour le bétail, comme source d'iode.
L'éthylènediamine (édamine) est un additif organique commun au milieu de Murashige et Skoog, milieu de culture de plantes in vitro.
Éthylènamines
L'éthylènediamine est le premier membre du groupe des éthylènamines, un groupe d'amines polyéthylénées, les autres membres étant :
- la diéthylènetriamine, abrégée en dien ou DETA, (H2N-CH2CH2-NH-CH2CH2-NH2, un analogue du diéthylène glycol)
- la triéthylènetétramine, abrégée en trien ou TETA, (H2N-CH2CH2-NH-CH2CH2-NH-CH2CH2-NH2)
- la tétraéthylènepentamine, abrégée en TEPA, (H2N-CH2CH2-NH-CH2CH2-NH-CH2CH2-NH-CH2CH2-NH2),
- la pentaéthylènehexamine, abrégée en PEHA, (H2N-CH2CH2-NH-CH2CH2-NH-CH2CH2-NH-CH2CH2-NH-CH2CH2-NH2)
et ainsi de suite jusqu'au polyéthylène amine. On compte aussi la pipérazine, un analogue du dioxane.
Diamines proches
En termes de quantités produites, l'éthylènediamine est la deuxième diamine la plus importante, après le diaminohexane, précurseur du Nylon 6-6. Parmi les autres composés proches de l'éthylènediamine on compte la tétraméthyléthylènediamine (TMEDA), (CH3)2N-CH2CH2-N(CH3)2 et la tétraéthyléthylènediamine (TEEDA), (C2H5)2N-CH2CH2-N(C2H5)2.
Notes et références
- Council Regulation (EC) No 129/2007 of 12 February 2007 providing for duty-free treatment for specified pharmaceutical active ingredients bearing an international non-proprietary name (INN) from the World Health Organisation and specified products used for the manufacture of finished pharmaceuticals
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441.
- Entrée « Ethylenediamine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 mars 2011 (JavaScript nécessaire)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- Meditsina Truda i Promyshlennaya Ekologiya. Industrial Medicine and Ecology. Vol. (1), Pg. 38, 1997 PMID
- Chimica Therapeutica. Vol. 4, Pg. 136, 1969.
- Toxicometric Parameters of Industrial Toxic Chemicals Under Single Exposure, Izmerov, N.F., et al., Moscow, Centre of International Projects, GKNT, 1982Vol. -, Pg. 66, 1982.
- Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. DOI 10.1002/14356007.a02_001
- (en) Kotti, S. R. S. S.; Timmons, C. and Li, G., « Vicinal diamino functionalities as privileged structural elements in biologically active compounds and exploitation of their synthetic chemistry », Chemical Biology & Drug Design, vol. 67, no 2, , p. 101–114 (PMID 16492158, DOI 10.1111/j.1747-0285.2006.00347.x)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ethylenediamine » (voir la liste des auteurs).