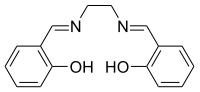
Salen (ligand)
Le salen, contraction de salicylaldéhyde et éthylènediamine (souvent abrégé en « en ») à partir desquels il est synthétisé, est un ligand chélateur utilisé en complexométrie et en catalyse homogène. Il se présente sous la forme d'une poudre jaune micacée soluble dans les solvants polaires organiques.
| Salen (ligand) | |
   |
|
| Identification | |
|---|---|
| Synonymes |
2,2'-éthylènebis(nitrilométhylidène)diphénol |
| No CAS | |
| No ECHA | 100.002.161 |
| SMILES | |
| InChI | |
| Apparence | poudre jaune[1] |
| Propriétés chimiques | |
| Formule | C16H16N2O2 [Isomères] |
| Masse molaire[2] | 268,310 4 ± 0,014 9 g/mol C 71,62 %, H 6,01 %, N 10,44 %, O 11,93 %, |
| Propriétés physiques | |
| T° fusion | 127-128 °C[1] |
| Précautions | |
| SGH[1] | |
 |
|
| Écotoxicologie | |
| DL50 | 100 mg·kg−1 (souris, i.p.)[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Nomenclature
Le diphénol salenH2 est l'acide conjugué du ligand qui est en réalité le salen2−. Ce dernier est un ligand tétradenté anionique et agit ainsi de façon similaire aux autres ligands tétradentés, même ceux qui sont macrocycliques comme le porphyrinate, la corrine, le bis(diméthylglyoximate) et certaines bases de Schiff.
Synthèse
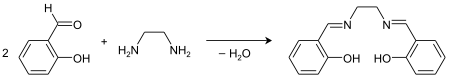
Le salen fut synthétisé pour la première fois par P. Pfeiffer en 1933[3]. Le salenH2 est souvent généré in situ, suivi de l'ajout de sel métallique. Le ligand peut être simplement préparé par condensation entre l'éthylènediamine et le salicylaldéhyde[4] :
Chimie de coordination
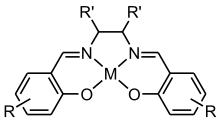
Le salenH2 forme des complexes avec la plupart des métaux de transition. Dans la plupart des cas, il forme des complexes de configuration pyramidale à base carrée de composition M(salen)L ou une sphère de coordination octaédrale avec une stœchiométrie M(salen)L2. On peut par exemple citer les complexes VO(salen) et Co(salen)Cl(py). Avec des ions métalliques d8, le salen forme des complexes plan carrés bas spin tels que le Ni(salen).
En 1938, Tsumaki a rapporté que le complexe de cobalt(II) Co(salen) peut se lier de façon réversible au dioxygène (O2), ce qui a mené à d'intensives recherches sur les complexes de cobalt et salen et sur les ligands proches pour leur capacité à stocker et transporter l'oxygène, dans l'optique de trouver des potentiels porteurs d'oxygène synthétiques[5].
Notes et références
- Fiche Sigma-Aldrich du composé N,N′-Bis(salicylidene)ethylenediamine, 98%, consultée le 20 mars 2015. + (pdf) fiche SDS.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) P. Pfeiffer, E. Breith, E. Lübbe, T. Tsumaki, « Tricyclische orthokondensierte Nebenvalenzringe », Justus Liebig's Annalen der Chemie, vol. 503, , p. 84–130 (DOI 10.1002/jlac.19335030106)
- (en) Harvey Diehl, Clifford C. Hach, « Bis(N,N'-Disalicylalethylenediamine)-μ-Aquodicobalt(II) », Inorg. Synth., vol. 3, , p. 196–201 (DOI 10.1002/9780470132340.ch53)
- (de) Tsumaki, T., « Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine », Bull. Chem. Soc. Jap., vol. 13, no 2, , p. 252–260 (DOI 10.1246/bcsj.13.252)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Salen ligand » (voir la liste des auteurs).