Diméthylglyoxime
La diméthylglyoxime, ou diacétyldioxime, est un composé chimique de formule HON=C(CH3)C(CH3)=NOH, soit la dioxime du diacétyle CH3COCOCH3. Sa forme neutre est souvent abrégée dmgH2, tandis que sa forme anionique est abrégée dmgH−, « H » indiquant l'hydrogène. Il s'agit d'un solide blanc inflammable.
| Diméthylglyoxime | |||
-biacetyl_dioxime_200.svg.png.webp)
| |||
| Structure de la diméthylglyoxime | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | (NE)-N-[(3E)-3-hydroxyiminobutan-2-ylidène]hydroxylamine | ||
| No CAS | |||
| No ECHA | 100.002.201 | ||
| No CE | 202-420-1 | ||
| No RTECS | EK2975000 | ||
| PubChem | 135399895 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide blanc inflammable légèrement odorant[1] | ||
| Propriétés chimiques | |||
| Formule | C4H8N2O2 |
||
| Masse molaire[2] | 116,118 5 ± 0,004 8 g/mol C 41,37 %, H 6,94 %, N 24,12 %, O 27,56 %, |
||
| Propriétés physiques | |||
| T° fusion | 139 à 143 °C[1] | ||
| Solubilité | 0,6 g/L[1] à 20 °C | ||
| Précautions | |||
| SGH[3] | |||
  Danger |
|||
| NFPA 704[3] | |||
| Transport[3] | |||
|
|||
| Écotoxicologie | |||
| LogP | −0,29[1] (octanol/eau) | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
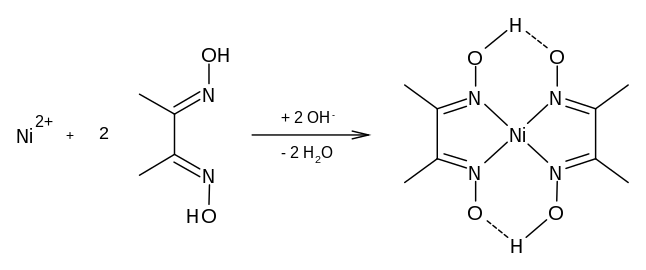
La dmgH2 est un réactif utilisé pour la détection de divers ions métalliques tels que le cobalt[4], le nickel[5] et le palladium. Ces complexes de coordination ont un intérêt théorique comme modèles d'enzymes et comme catalyseurs. Des ligands apparentés peuvent être préparés à partir d'autres dicétones telles que le benzile C6H5COCOC6H5.
Synthèse
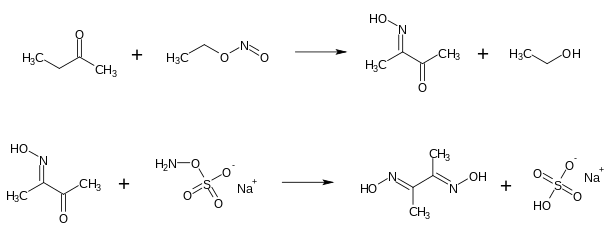
La diméthylglyoxime peut être obtenue par nitrosation de la butanone CH3COCH2CH3 par le nitrite d'éthyle O=NOCH2CH3 pour donner de l'éthanol CH3CH2OH et de la diacétylmonoxime (en) HON=C(CH3)COCH3, puis en faisant réagir cette dernière avec de l'hydroxylaminesulfonate de sodium Na+[H2NOSO3]− pour donner le produit final avec du bisulfate de sodium NaHSO4[6] - [7] :
Applications
La diméthylglyoxime est un agent complexant qui forme des chélates colorés avec des ions métalliques tels que Ni2+, Fe2+, Co2+, Cu2+, Pt2+, Pd2+ et Re7+. Ces complexes peuvent être précipités dans les conditions appropriées de pH et de température. Les complexes de cobalt, de fer, de nickel, de palladium et de rhénium conviennent aux applications de photométrie[8]. La coloration des complexes selon les métaux est la suivante[9] :
| Métal | Couleur |
|---|---|
| Nickel(II) | rouge framboise |
| Cuivre(II) | violet |
| Fer(II) | rouge |
| Cobalt(II) | brun-rouge |
| Palladium(II) | jaune |
| Platine(II) | bleu à brun |
| Plomb(II) | blanc |
| Bismuth(III) | jaune intense[10] |
En particulier, le bis(diméthylglyoximato)nickel(II) Ni(dmg)2 a une couleur rose[11] à rouge framboise[12], très peu soluble en solution ammoniacale, permet de doser le nickel(II). Le composé chélaté a une géométrie plane carrée[12] :
La coloration peut encore être détectée à une concentration de nickel de 0,015 µg/ml[10]. À l'état solide, Ni(dmg)2 forme des empilements moléculaires avec une distance Ni–Ni de 325 pm[13].
Notes et références
- Entrée « Dimethylglyoxime » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 juillet 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Dimethylglyoxime, 99% », sur Alfa Aesar (consulté le ).
- (en) G. S. Girolami, T. B. Rauchfuss et R. J. Angelici, Synthesis and Technique in Inorganic Chemistry: A Laboratory Manual, 3e éd., 1999, University Science Books, p. 213–215. (ISBN 978-0935702484)
- (de) L. Tschugaeff, « Ueber ein neues, empfindliches Reagens auf Nickel », Berichte der deutschen chemischen Gesellschaft, vol. 38, no 3, , p. 2520-2522 (DOI 10.1002/cber.19050380317, lire en ligne)
- (en) W. L. Semon et V. R. Damerell, « Dimethylglyoxime », Organic Syntheses, vol. 10, , p. 22 (DOI 10.15227/orgsyn.010.0022, lire en ligne)
- (de) K. H. Slotta et K. R. Jacobi, « Herstellung organischer Reagenzien im analytischen Laboratorium », Zeitschrift für analytische Chemie, vol. 83, , p. 1-5 (DOI 10.1007/BF01361818, lire en ligne)
- (de) « Biacetyldioxim » sur le Römpp Lexikon Chemie en ligne.
- (de) Gerhard Jander, Jander/Blasius Lehrbuch der analytischen und präparativen anorganischen Chemie, Hirzel, Stuttgart, 1985, p. 259, 359, 361.
- (de) G. Jander et H. Wendt, Lehrbuch der analytischen und präparativen anorganischen Chemie, 2e éd., S. Hirzel Verlag, Leipzig, 1954, p. 108 sqq, 191.
- (de) Wittko Francke et Wolfgang Walter, Lehrbuch der Organischen Chemie, 24e éd. révisée, S. Hirzel Verlag Stuttgart, 2004, p. 342. (ISBN 3-7776-1221-9)
- (de) Wolfgang Werner, Qualitative anorganische Analyse: für Pharmazeuten und Naturwissenschaftler, 4e éd., Deutscher Apotheker Verlag, 2006, p. 95. (ISBN 3-8047-2264-4)
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e éd., Walter de Gruyter, Berlin, 2007, p. 1715. (ISBN 978-3-11-017770-1)