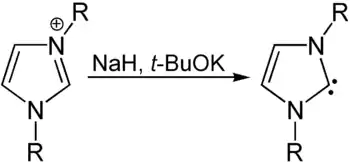Imidazoline
L'imidazoline est un composé hétérocyclique azoté de formule C3H6N2, dérivé hydrogéné de l'imidazole. C'est un cycle à cinq atomes contenant trois atomes de carbone et deux atomes d'azote, ces derniers étant en positions 1 et 3, et possédant une double liaison. L'imidazoline possède trois isomères en fonction de la position de la double liaison :
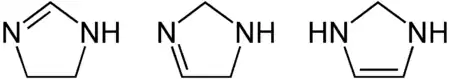 Isomères de l'imidazoline.
Isomères de l'imidazoline.
La première forme semble être la plus stable et la plus rencontrée. Dans cette position, l'azolidine possède une fonction imine et est structurellement liée aux guanidines et aux amidines.
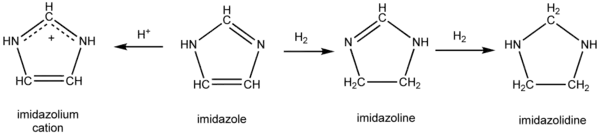 Relations chimiques entre l'imidazole et ses dérivées; de gauche droite, le cation imidazolium, l'imidazole, l'imidazoline, l'imidazolidine
Relations chimiques entre l'imidazole et ses dérivées; de gauche droite, le cation imidazolium, l'imidazole, l'imidazoline, l'imidazolidine
Synthèse
Il existe de nombreuses façons de synthétiser des dérivés d'imidazoline, la plupart d'entre elles mettant en jeu l'éthylènediamine ou l'un de ses dérivés[1]:
- réaction entre l'éthylènediamine et un aldéhyde en présence d'hypochlorite de tert-butyle[2]
- réaction entre l'éthylènediamine et un aldéhyde en présence de diiode, de carbonate de potassium et de tert-butanol[3]. Une seconde réaction du composé obtenu avec le (diacétoxyiodo)benzène dans le DMSO en présence de carbonate de potassium permet d'obtenir le dérivé imidazole.
- réaction entre l'éthylènediamine et un aldéhyde aromatique avec le perbromure d'hydrobromure de pyridinium dans l'eau[4].
- réaction entre une amine α,α-difluoroalkylée et une β-diamine[5]. En remplaçant la β-diamine par un alcool β-aminé, un thiol β-aminé, il est possible d'obtenir respectivement l'oxazoline et la thiazoline correspondantes.
- réaction entre un sel de N-(2-iodoéthyl)arylamine et une amine primaire[6]. Cette réaction a l'avantage de former une imidazoline N,N-disubstituée, qu'il est ensuite possible de transformer en carbène (cf infra).
- réaction de chlorures de diamine N,N-diarylée dans l'orthoformiate de triéthyle en présence de micro-ondes[7]. Cette réaction a l'avantage de forme aussi une imidazoline N,N-disubstituée.
Utilisation
Tout comme l'imidazole, les composés dérivés de l'imidazoline permettent de former des carbènes stables appelés carbènes persistants qui sont utilisés comme ligand de type pour de nombreux métaux de transition.
Il est par exemple possible de former un carbène d'imidazoline à partir d'un imidazole disubstitué par réduction par l'hydrure de sodium et le tert-butoxyde de potassium:
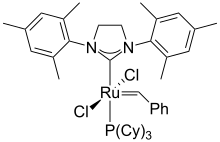
On trouve l'imidazoline notamment dans la deuxième génération de catalyseur de Grubbs.
Rôle biologique
Beaucoup d'imidazolines sont biologiquement actives[8]. La plupart des dérivés bio-actifs portent un substituent (aryle ou alkyle) sur le carbone entre les deux azotes. Parmi ces composés, on trouve notamment l'oxymétazoline, la xylométazoline, la tétrahydrozoline ou encore la naphazoline.
Notes et références
- Synthèse de 2-imidazolines
- (en) Midori Ishihara et Hideo Togo, « Facile Preparation of 2-Imidazolines from Aldehydes with tert-Butyl Hypochlorite », Synthesis, , p. 1939-1942. (DOI 10.1055/s-2007-983726)
- (en) Midori Ishihara et Hideo Togo, « An Efficient Preparation of 2-Imidazolines and Imidazoles from Aldehydes with Molecular Iodine and (Diacetoxyiodo)benzene », Synthesis, , p. 227-230. (DOI 10.1055/s-2005-923604)
- (en) Shinsei Sayama, « A Convenient Synthesis of Oxazolines and Imidazolines from Aromatic Aldehydes with Pyridinium Hydrobromide Perbromide in Water », Synlett, , p. 1479-1484. (DOI 10.1055/s-2006-941597)
- (en) Tsuyoshi Fukuhara, Chihiro Hasegawa et Shoji Hara, « A facile synthesis of oxazolines, thiazolines, and imidazolines using α,α-difluoroalkylamines », Synthesis, , p. 1528-1534. (DOI 10.1055/s-2007-966038)
- (en) B. A. Bhanu Prasad et Scott R. Gilbertson, « One-Pot Synthesis of Unsymmetrical N-Heterocyclic Carbene Ligands from N-(2-Iodoethyl)arylamine Salts », Org. Lett, vol. 11, , p. 3710-3713. (DOI 10.1021/ol901189m)
- (en) Adila Aidouni, Albert Demonceau et Lionel Delaude, « Microwave-Assisted Synthesis of N-Heterocyclic Carbene Precursors », Synlett, , p. 493-495 (DOI 10.1055/s-2006-932455)
- (en) N. MacInnes and S. Duty, « Locomotor effects of imidazoline I2-site-specific ligands and monoamine oxidase inhibitors in rats with a unilateral 6-hydroxydopamine lesion of the nigrostriatal pathway », Br J Pharmacol, vol. 143, no 8, , p. 952–959 (PMID 15545290, PMCID 1575965, DOI 10.1038/sj.bjp.0706019)
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Imidazoline » (voir la liste des auteurs) et en allemand « Imidazoline » (voir la liste des auteurs).
Voir aussi
- récepteur d'imidazoline
- imidazole
- imidazolidine