Synthèse de Strecker
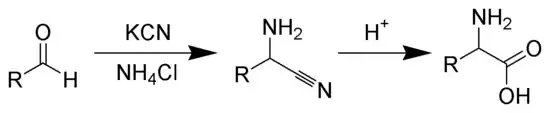
La synthèse de Strecker, nommée d'après Adolph Strecker qui l'a découverte et publiée pour la première fois en 1850, est une série de réactions chimiques permettant la synthèse d'un acide aminé à partir d'un aldéhyde (ou d'une cétone)[1] - [2] - [3]. L'aldéhyde est condensé avec du chlorure d'ammonium en présence de cyanure de potassium pour former un α-aminonitrile, qui est ensuite hydrolysé pour donner l'acide aminé désiré[4] - [5].
Si l'utilisation de sels d'ammonium donne des acides aminés non substitués, celui d'une amine primaire ou secondaire fonctionne aussi et donne des acides aminés substitués. De même, l'utilisation de cétones à la place d'aldéhydes donne des acides aminés α,α-disubstitués[6].
La synthèse originale d'Adolph Strecker de 1850 donne un mélange racémique d'α-aminonitriles, mais de récentes procédures utilisant des auxiliaires asymétriques[7] ou des catalyseurs asymétriques[8] - [9] ont été développées et permettent d'obtenir un seul isomère[10].
Mécanisme réactionnel
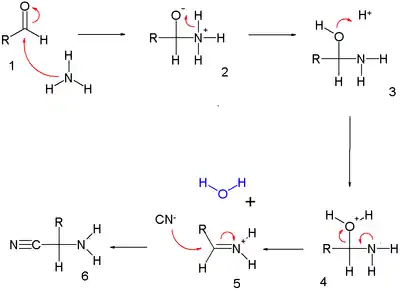
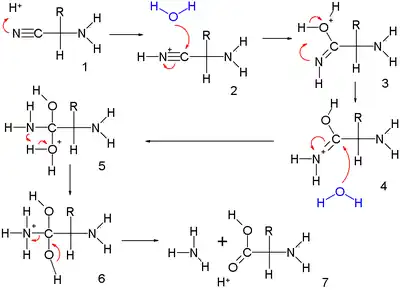
Le mécanisme réactionnel de cette réaction est décrit ci-dessous:
Dans la première partie, l'aldéhyde (1.1) réagit avec l'ammoniac par addition nucléophile pour former un hémiaminal (1.3); ce dernier attire un proton pour former un ion iminium (1.5) par élimination d'eau. Une seconde addition nucléophile, cette fois-ci de l'ion cyanure, forme l'aminonitrile (1.6).
Dans la seconde partie, l'aminonitrile activé par un proton (2.1) subit une double addition nucléophile d'eau pour former l'intermédiaire (2.6). Celui-ci élimine de l'ammoniac et un proton pour donner le produit final (2.7).
Utilisation
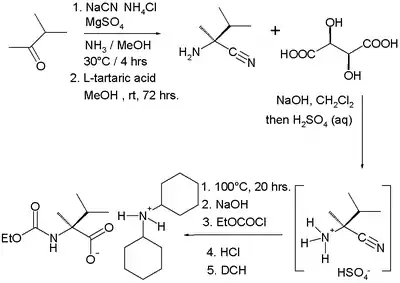
Un exemple d'utilisation actuelle de la synthèse de Strecker est la synthèse de masse d'un dérivé de L-valine en partant de la 3-méthylbutan-2-one[11] :
Le produit de la réaction initiale entre la 3-méthylbutan-2-one, le cyanure de sodium et l'ammoniac est résolu par application d'acide L-tartrique. L'acide aminé final est isolé comme sel d'acide par la dicyclohexylamine.
Notes et références
- (de) A. Strecker, « Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper », Liebigs Ann. Chem., vol. 75, no 1, , p. 27–45 (ISSN 0075-4617, DOI 10.1002/jlac.18500750103).
- (de) A. Strecker, « Ueber einen neuen aus Aldehyd. Ammoniak und Blausäure entstehenden Körper », Liebigs Ann. Chem., vol. 91, no 3, , p. 349–351 (ISSN 0075-4617, DOI 10.1002/jlac.18540910309).
- (en) M. Shibasaki, M. Kanai et al., Organic Reactions, vol. 70, New York (NY), John Wiley & Sons, , 656 p. (ISBN 978-0-470-25453-0, DOI 10.1002/0471264180.or070.01), chap. 1 (« The Catalytic Asymmetric Strecker Reaction »), p. 1-119.
- (en) E. C. Kendall et B. F. McKenzie, « dl-Alanine », Org. Synth., vol. 9, , p. 4 (ISSN 0078-6209, DOI 10.15227/orgsyn.009.0004).
- (en) H. T. Clarke et H. J. Bean, « α-Aminoisobutyric acid », Org. Synth., vol. 11, , p. 4 (ISSN 0078-6209, DOI 10.15227/orgsyn.011.0004).
- (en) S. Masumoto, H. Usuda et al., « Catalytic Enantioselective Strecker Reaction of Ketoimines », J. Am. Chem. Soc., vol. 125, no 19, , p. 5634–5635 (ISSN 0002-7863, DOI 10.1021/ja034980+).
- (en) F. A. Ishitani, R. E. Reddy et al., « Asymmetric strecker synthesis using enantiopure sulfinimines: A convenient synthesis of α-amino acids », Tetrahedron Lett., vol. 35, no 50, , p. 9351–9354 (ISSN 0040-4039, DOI 10.1016/S0040-4039(00)78540-6).
- (en) H. Ishitani, S. Komiyama et al., « Catalytic Asymmetric Strecker Synthesis. Preparation of Enantiomerically Pure α-Amino Acid Derivatives from Aldimines and Tributyltin Cyanide or Achiral Aldehydes, Amines, and Hydrogen Cyanide Using a Chiral Zirconium Catalyst », J. Am. Chem. Soc., vol. 122, no 5, , p. 762–766 (ISSN 0002-7863, DOI 10.1021/ja9935207).
- (en) J. Huang et E. J. Corey, « A New Chiral Catalyst for the Enantioselective Strecker Synthesis of α-Amino Acids », Org. Lett., vol. 6, no 26, , p. 5027–5029 (ISSN 1523-7060, DOI 10.1021/ol047698w).
- (en) R. O. Duthaler, « Recent developments in the stereoselective synthesis of α-aminoacids », Tetrahedron, vol. 50, no 6, , p. 1539–1650 (ISSN 0040-4020, DOI 10.1016/S0040-4020(01)80840-1).
- (en) J. T. Kuethe, D. R. Gauthier et al., « A Concise Synthesis of (S)-N-Ethoxycarbonyl-α-methylvaline », J. Org. Chem., vol. 72, no 19, , p. 7469–7472 (ISSN 0022-3263, DOI 10.1021/jo7012862).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Strecker amino-acid synthesis » (voir la liste des auteurs).