Actine
L'actine est une protéine bi-globulaire de 5,46 nm de diamètre qui joue un rôle important dans l'architecture et les mouvements cellulaires [EN]. Elle est présente dans toutes les cellules du corps (c’est une protéine ubiquitaire), mais elle est particulièrement abondante dans les cellules musculaires. Elle peut représenter jusqu'à 15 % de la masse totale protéique des cellules. Cette protéine a été hautement conservée lors de l'évolution des eucaryotes, puisque l'identité entre un isotype d'actine humaine et l'actine de levure (S. cerevisiae) est supérieure à 90 %. La plupart des cellules eucaryotes possèdent de nombreux gènes d'actine codant des protéines légèrement différentes[1] - [2].
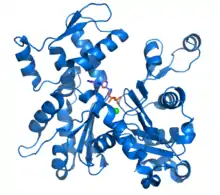

Structure
L'actine est une protéine dont le diamètre est de 5,46 nm. Elle est constituée par un polypeptide de 375 acides aminés qui contient un acide aminé, l'histidine, ayant subi une modification post-traductionnelle rare : la 3-méthylhistidine. La détection de 3-méthylhistidine dans l'urine est le signe de nécrose cellulaire à la suite d'une blessure musculaire.
Chez les mammifères, il existe 6 isotypes d'actine :
- 3 isoformes d’actines alpha (présentes dans les muscles striés squelettiques, cardiaque et dans les muscles lisses) ;
- 2 isoformes d’actines gamma (présentes dans le muscle lisse entérique et dans les tissus non musculaires, au niveau des stéréocils (microvillosités) de la cellule auditive sensorielle) ;
- 1 isoforme d’actine beta (non-musculaire).
Dans la cellule, on la retrouve sous deux formes :
- l'actine globulaire (actine G), une forme monomérique soluble en solution aqueuse. Le monomère d'actine G est associé à un cation divalent tel que l'ion calcium ou le magnésium (le magnésium in vivo) et un nucléotide de type ATP ou ADP selon l'état de phosphorylation du nucléotide. En l'absence de ces deux cofacteurs, l'actine se dénature facilement. La thymosine bloque la polymérisation en s'associant aux monomères d'actine G liée à l'ATP ;
- l'actine filamenteuse (actine F), un polymère d'actine G formant un microfilament de 8 nm de diamètre. Ce microfilament est un arrangement hélicoïdal dextre, avec un tour d'hélice comportant 13 monomères et d'une longueur de 37 nm.
La cytochalasine B (en) est une mycotoxine qui inhibe la formation des microfilaments d'actine.
Polymérisation

Elle commence par une phase dite de nucléation pendant laquelle des dimères, trimères, ou tétramères (selon le processus de nucléation utilisé) d'actine (appelés noyaux) s'assemblent. Cette étape, défavorable thermodynamiquement, est une étape lente. Dans le contexte cellulaire, l'existence de nucléateurs de l'actine accélère cette étape et la rend de ce fait compatible avec les échelles de temps et d'espaces des processus biologiques cellulaires. On distingue 3 groupes de nucléateurs : le complexe Arp2/3 (complexe composé de 7 sous unités protéiques), les formines, et les nucléateurs dit « atypiques » comme la protéine Spire. Si la concentration en monomères d'actine (actine dite G) est supérieure à une concentration critique, l'actine G s'assemble en filaments à partir des noyaux préformés. C'est l'étape d'élongation des filaments. Cette étape rapide est souvent appelée phase de polymérisation, bien que l'actine filamenteuse (dite actine-F) ne soit pas un véritable polymère (les monomères ne sont pas liés entre eux par une liaison covalente au sein d'un filament). Une fois formés, les filaments d'actine sont à l'équilibre entre dissociation des filaments aux extrémités (-) et association de monomères aux extrémités (+). Dans les cellules, la formation spontanée de noyaux d'actine est très défavorable.
Localisation et rôle
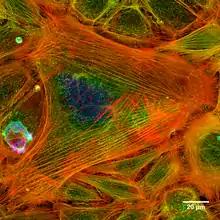
Dans la contraction musculaire, l'actine polymérisée se lie à une autre protéine, la myosine. Cette dernière s'accroche au polymère d'actine et la fait coulisser par rapport à elle; à l'autre bout du filament de myosine, un autre filament d'actine procède de façon symétrique ; les deux filaments d'actine se rapprochent donc l'un de l'autre, c'est la contraction musculaire.
Autres rôles :
- anneau contractile des cellules en division lors de la cytodiérèse permettant de séparer les cellules issues de la mitose (ou de la méiose) ;
- maintien de l'intégrité tissulaire par l'association des microfilaments avec la ceinture de desmosomes appelée jonction adhérente au pôle apical des cellules épithéliales ;
- maintien des microvillosités des cellules épithéliales intestinales ;
- émission de filopodes et de lamellipodes qui permettent à la cellule de s'allonger dans une direction donnée ce qui permet la migration cellulaire ou la prise de proies (chez les amibes et les cellules phagocytaires du système immunitaire comme les macrophages). Dans le cas de la migration cellulaire, les microfilaments d'actine se lient à des points d'adhésion focaux qui servent de points d'appui sur la matrice extracellulaire, nécessaires pour avancer. Ce sont les protéines associées aux intégrines qui se lient à l'actine ;
- création de filaments d'actine nécessaires à la reproduction par bourgeonnement de la levure Saccharomyces cerevisiae[3].
Des parasites intracellulaires tels que Listeria sont capables de détourner la machinerie cellulaire qui contrôle la polymérisation de l'actine pour former des microfilaments derrière eux, ce qui permet de les propulser.
Notes et références
- Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC, « The evolution of compositionally and functionally distinct actin filaments », Journal of Cell Science, vol. 128, no 11, , p. 2009–19 (PMID 25788699, DOI 10.1242/jcs.165563).
- Ghoshdastider U, Jiang S, Popp D, Robinson RC, « In search of the primordial actin filament. », Proc Natl Acad Sci U S A., vol. 112, no 30, , p. 9150-1 (PMID 26178194, DOI 10.1073/pnas.1511568112).
- Actin cable dynamics in budding yeast (Hyeong-Cheol Yang and Liza A. Pon) http://www.pnas.org/content/99/2/751.short.
Voir aussi
Bibliographie
- (en) Johanna L. Miller, « Actin assembly is a physics problem », Physics Today, (DOI 10.1063/PT.6.1.20230223b
 )
)
Articles connexes
- ACTA2, l'une des isoformes de l'actine alpha
- Troponine
- Tropomyosine
- Complexe Arp2/3