Tropomyosine
La tropomyosine est une protéine fibreuse dimérique (composée d'une sous-unité alpha et d'une sous-unité bêta) logée dans la gouttière du microfilament d'actine. Elle s'enroule autour de celui-ci pour le stabiliser.
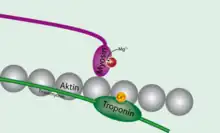
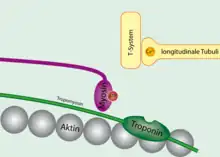
La tropomyosine est également une protéine de régulation qui masque les sites de liaison actifs entre la tête de la myosine et l'actine. Ainsi, pour permettre la contraction musculaire, le taux de Ca2+ va augmenter dans le cytosol et ce Ca2+ va se lier à la troponine. Le complexe troponine-Ca2+ va se déplacer en entraînant avec elle la tropomyosine, la retirant ainsi du site de liaison de l'actine G (actine globulaire). La myosine va finalement pouvoir se lier à l'actine et achever la libération de puissance permise par hydrolyse de l'ATP, grâce au démasquage actif du site de liaison permis par la troponine. Le filament va se déplacer, et la contraction musculaire va pouvoir aboutir[1]. On notera néanmoins que ce système n'est pas applicable en ce qui concerne la contraction des muscles lisses, où l'on observe aucune inhibition du site de liaison par la tropomyosine.
Dans les filaments, il y a un dimère de tropomyosine tous les sept monomères d'actine.
Elle est associée à la troponine dans les cellules musculaires striées. Elle représente 4 % du poids sec d'un muscle[2].
Chez l'être humain, quatre gènes en assurent la synthèse : TPM1, TPM2, TPM3, TPM4. Chacun peuvent avoir des épissages différents, constituant plus de quarante isoformes[3]. Chacune de ces dernières ont des affinités différentes avec l'actine ainsi qu'avec les différentes molécules qui y sont liées[4], comme la cofiline, la calmoduline, la gelsoline...
Notes et références
- Cours de Physiologie d'Anh Tuan Dinh-Xuan.
- « Dictionnaire de l'Académie de Médecine - Bienvenue », sur academie-medecine.fr (consulté le ).
- Geeves MA, Hitchcock-DeGregori SE, Gunning PW, A systematic nomenclature for mammalian tropomyosin isoforms, J Muscle Res Cell Motil, 2015;36:147–153.
- Gunning P, O’Neill G, Hardeman E, Tropomyosin-based regulation of the actin cytoskeleton in time and space, Physiol Rev, 2008;88:1–35.