Procédé Solvay
Le procédé Solvay est un procédé chimique destiné à synthétiser du carbonate de sodium. Au XXe siècle, c'était le principal procédé industriel employé. Le procédé Solvay est concurrencé par l'extraction du carbonate de sodium dans les gisements de carbonates naturels, tels le natron, que l'on trouve par exemple en Égypte ou en Amérique du Nord, ou encore le trona.
._-_Solvay_Process_Company%252C_SA_Wetside_Building%252C_Between_Willis_and_Milton_Avenue%252C_Solvay%252C_HAER_NY%252C34-SOLV%252C1D-22_(CT).tif.jpg.webp)
Histoire
Jusqu'en 1789 et souvent encore au début du XIXe siècle, le carbonate de sodium, cet ingrédient nécessaire aux industries du verre, du savon, des textiles et du papier, provenait de cendres de plantes aquatiques type algues ou terrestres type chénopodiacées, dénommées soudes, par exemple la salicorne, ou du chauffage du natron dans les pays désertiques lointains. En 1791, le chimiste français Nicolas Leblanc met au point le procédé Leblanc après l'avoir inventé dans les années 1780 : il permet d'obtenir du carbonate de sodium à partir de sel marin, d'acide sulfurique, de charbon de bois, de calcaire. Le procédé Leblanc, exigeant en énergie de chauffage, a été utilisé jusque dans les années 1870, où il a été supplanté par le procédé Solvay.
Le procédé Solvay dit à l'ammoniac a été découvert par le chimiste belge Ernest Solvay qui ouvre sa première usine en Belgique en 1863[1]. Ce procédé économique est encore utilisé actuellement.
Déroulement
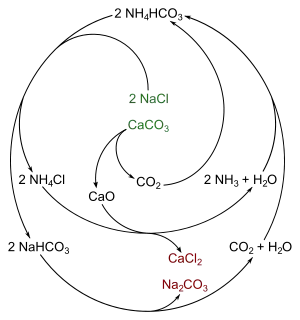
Le procédé Solvay produit finalement du carbonate de sodium (Na2CO3) à partir de sel (chlorure de sodium NaCl) et de craie (carbonate de calcium CaCO3) en utilisant habilement l'alcali ammoniac (NH3); on obtient en outre du chlorure de calcium (CaCl2), un sous-produit qui n'est pas un déchet mais peut être un produit utile. Le procédé utilise de l'ammoniac qui n'est pas consommé mais réutilisé après régénération et recyclage, à partir de l'intermédiaire NH4Cl.
- La première étape est l'obtention du bicarbonate d'ammonium, sel très soluble dans l'eau[2].
- CO2 dissous + NH3 dissous + H2O milieu aqueux → NH4HCO3 aq
- La seconde étape est la formation à température ordinaire du bicarbonate de sodium NaHCO3, peu soluble à froid[3].
- NH4HCO3 aq + NaClaq saumure → NaHCO3 précipité (en partie) + NH4Cl aq soluble
- La troisième étape est le chauffage, souvent au coke, du bicarbonate de sodium qui engendre de la soude Solvay poudreuse, dans un flux de vapeur d'eau et de gaz carbonique qui s'échappe vers le haut[4].
- 2 NaHCO3 sel → Na2CO3 poudre + H2O vapeur + CO2 gaz
- Les autres étapes correspondent à la régénération de l'alcali ou à l'apport complémentaire de CO2 initial :
- CaCO3 roche calcaire → CaO solide poudreux + CO2 gaz récupéré
- 2 NH4Cl aq soluble + CaO → 2 NH3 gaz récupéré + CaCl2 aq soluble + H2O
Bilan global et commentaire
Le bilan global des réactions est :
- 2 NaCl + CaCO3 → Na2CO3 + CaCl2
Le produit recherché est obtenu par calcination de bicarbonate de soude (aussi appelé : monohydrogénocarbonate de sodium):
Le bicarbonate de soude est formé en faisant passer du dioxyde de carbone dans une solution aqueuse basique de chlorure de sodium : en milieu basique le dioxyde de carbone se transforme en ion bicarbonate, qui précipite en présence de l'ion sodium ; le procédé utilise, comme base, l'ammoniaque :
Le dioxyde de carbone nécessaire s'obtient en chauffant de la craie (carbonate de calcium CaCO3) à une température d'environ 1 000 °C :
Très basique, CaO permet de retransformer l'ammonium (dans la solution de chlorure d'ammonium) en ammoniac, en produisant du chlorure de calcium :
Le procédé Solvay est moins polluant et moins coûteux que le procédé Leblanc. Le sel et la craie, voire la roche calcaire, sont abondants et peu coûteux. L'ammoniac est recyclé pendant la réaction. Le chlorure de calcium, sous-produit de la réaction, est un sel hygroscopique et même déliquescent, utilisé en hiver pour faire fondre la neige accumulée sur les routes.
Notes et références
- Il utilise à partir de 1873 son procédé dans son usine-soudière française à Dombasle à proximité de l'ancien pays Saulnois en Lorraine
- Elle fait intervenir l'anion bicarbonate et le cation ammonium. Le premier résulte du premier équilibre suivant : CO2 + H2O H2CO3 H+ + HCO3−. Le second résulte de la formation d'ammoniaque : NH3 + H2O NH4+ + OH−. Tout se passe comme si l'eau ou solvant du milieu aqueux fournissait au premier l'anion hydroxyde et au second le cation hydronium, soit d'une manière simplifiée : H2O H+ + OH− pour 2 H2O H3O+(aq)+ HO−(aq)
- Sa solubilité pour 100 g d'eau est de l'ordre de 9,61 g à 20 °C. Le procédé est plus efficace lorsque les saumures sont froides. Le Larousse universel de Claude Augé en 1922 décrit le procédé Solvay par un résumé fort radical : une décomposition par le sel (marin) d'une solution de bicarbonate d'ammonium. Ne pas oublier que les acteurs de la chimie aqueuse sont des ions et leurs éventuelles propriétés de dispersion ou d'associations dans le milieu solvant eau.
- Ce gaz carbonique est recyclé, mais la majeure partie provient de la calcination du calcaire, réaction de l'antique four à chaux : CaCO3 roche calcaire → chaux vive CaO et CO2 gaz
