Procédé Leblanc
Le procédé Leblanc est un ancien procédé chimique, fortement coûteux en énergie, qui permettait d'obtenir du carbonate de sodium à partir de sel marin et de carbonate de calcium (qu'on trouve dans la craie, le calcaire). Le carbonate de sodium était un ingrédient nécessaire aux industries du verre, mais aussi du savon, des textiles (blanchissage du linge et dégraissage des laines) et du papier. Le procédé est supplanté 72 ans plus tard par le procédé Solvay, moins énergivore.
Histoire
Avant la découverte du procédé Leblanc, le carbonate de sodium provenait en particulier de cendres de plantes (algues ou végétaux nommés soudes, tels que la salicorne). Au XVIIIe siècle, la déforestation a amené la France à importer du carbonate de sodium, appelé soude à l'époque.
En 1783, l'Académie des sciences offre un prix de 2 400 livres à celui qui trouvera une méthode pour obtenir du carbonate de sodium à partir de sel marin. La solution est trouvée en 1789 par le chimiste français Nicolas Leblanc à l'issue d'une recherche initiée en 1771. L'industrie est opérationnelle en 1791. Ce procédé est un exemple du fait la Révolution industrielle avait commencé plusieurs années avant la Révolution française.
Déroulement
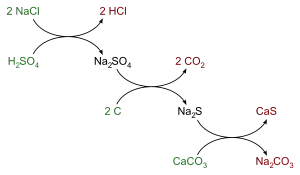
Ce procédé comporte trois réactions chimiques et de grosses dépenses énergétiques, puisque les deux dernières étapes nécessitent un chauffage à 950 °C :
- Première étape : attaque à l'acide sulfurique à chaud
Le sel marin ou chlorure de sodium NaCl est chauffé avec de l'acide sulfurique (H2SO4) fort coûteux pour produire du sulfate de sodium (Na2SO4) et de l'acide chlorhydrique (HCl) gazeux selon l'équation suivante :
- 2 NaClsolide + H2SO4 → Na2SO4 + 2 HCl (réaction à chaud)
Le chlorure d'hydrogène (HCl) est un sous-produit valorisable, qui a longtemps été rejeté directement dans l'air ou dans les rivières, se transformant ensuite en acide chlorhydrique dans l'environnement.
- Deuxième étape : la réduction
- Na2SO4 + 4C → Na2S + 4 COgaz
Le sulfate de sodium obtenu est d'abord mélangé avec du charbon de bois réducteur.
- Troisième étape : la calcination
- Na2S + CaCO3 → Na2CO3 + CaS
Le sulfure de sodium obtenu est ensuite mélangé avec de la craie (carbonate de calcium CaCO3). Le sous-produit sulfure de calcium CaS n'est pas valorisable. Le rejet de millions de tonnes de sulfure de calcium très alcalin dans l'environnement a longtemps été une énorme source de pollution[1].
Le carbonate de sodium est soluble dans l'eau et est donc récupéré par lavage à l'eau puis évaporation de l'eau.
Si on résume de façon simplifiée les deux dernières opérations où le mélange est porté continûment à plus de 940 °C, le sulfate de sodium obtenu est mélangé avec du charbon de bois, puis de la craie (ou carbonate de calcium CaCO3). On a une réaction d'oxydo-réduction :
- le carbone est oxydé en dioxyde de carbone (CO2) ;
- dans le même temps, le sulfate de sodium est réduit en sulfure.
On obtient un mélange solide de carbonate de sodium (Na2CO3) et de sulfure de calcium (CaS).
L'équation globale de fin du procédé s'écrit :
- Na2SO4 + CaCO3 + 2 C → Na2CO3 + CaS + 2 CO2
Pollution des produits joints
Ce procédé est polluant. Le sulfure de calcium CaS de l’étape de la calcination finale n’avait au début pas d’utilité dans d’autres processus industriels et était rejeté dans la nature ; l’acide chlorhydrique (le HCl de la première étape) était par contre précieusement récupéré en France. Toutefois les sols étaient facilement contaminés car il y avait de fortes projections d’acides et parfois des fuites.
Les problèmes environnementaux suscités amenèrent à l’adoption au Royaume-Uni de l’Alkali Act de 1863, qui réglementait l'usage et l'élimination de l'acide chlorhydrique, parfois directement rejeté dans les rivières. La pression socio-politique et les contraintes édictées par l’Alkali Act favorisèrent la recherche de débouchés et d’utilisations alternatives des déchets engendrés, qui aboutit au procédé Deacon qui permettait de convertir l'acide chlorhydrique en chlore utile dans l'industrie textile.
Le déchet principal issu du procédé Leblanc, le sulfure de calcium, put trouver une application industrielle grâce au procédé de Claus qui permettait d’en extraire le soufre, lequel pouvait être alors vendu comme tel.
Le procédé Leblanc fut utilisé jusque dans les années 1870, où il fut supplanté par le procédé Solvay. Le coût de chauffage, même adapté à des houilles bas de gamme, n’a jamais fait disparaître les collectes de soude paysanne par combustion de cendres végétales ; il n’en fut pas de même du procédé Solvay, nettement plus économique, qui ouvrait une nouvelle ère industrielle.
Bibliographie
- Robert Perrin, Jean-Pierre Scharff, Chimie industrielle, Masson, Paris, 1993, 1 136 p. en deux tomes avec bibliographie et index (ISBN 978-2-225-84037-1) et (ISBN 978-2-225-84181-1). En particulier, partie du tome 1 sur la soude.
- (en) Jöst, Müller (2006) Chlorine: Innovation and Industrial Evolution, in Joint Production and Responsability in Ecological Economics, Baumgärtner, Faber et Schiller, Cheltenham: Edward Elgar, 2006
Notes et références
- David M. Kiefer, « It was all about alkali », Today's Chemist at Work, vol. 11, no 1, , p. 45–6 (lire en ligne)
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :