Oxyde de manganèse(II)
L'oxyde de manganèse(II), ou monoxyde de manganèse, est le corps composé chimique, solide ionique, composé normalement en proportion équivalente d'ions oxydes et de cations manganeux ou manganèse à l'état II, de formule MnO.
| Oxyde de manganèse(II) | ||
_oxide_.JPG.webp)
| ||
 | ||
| __ Mn2+ __ O2− | ||
| Identification | ||
|---|---|---|
| Nom UICPA | oxyde de manganèse(II) | |
| Synonymes |
oxyde manganéseux, |
|
| No CAS | ||
| No ECHA | 100.014.269 | |
| No CE | 215-695-8 | |
| No RTECS | OP0900000 | |
| PubChem | 14940 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux gris vert ou poudre verte inodore[1] | |
| Propriétés chimiques | ||
| Formule | MnO | |
| Masse molaire[2] | 70,937 4 ± 0,000 3 g/mol Mn 77,45 %, O 22,55 %, |
|
| Propriétés physiques | ||
| T° fusion | 1 650 °C[1], également selon le Perry,s | |
| Solubilité | insoluble dans l'eau, soluble dans les acides ou dans le chlorure d'ammonium aqueux[3] | |
| Masse volumique | 5,45 g cm−3 à (25 °C[4], 5,18 g cm−3 à (20 °C selon le Perry,s Chemical Handbook | |
| Thermochimie | ||
| S0solide | 59,74 J·K-1·mol-1 | |
| ΔfH0solide | −385,4 kJ·mol-1 | |
| Cp | 0,622 J·K-1·mol-1 | |
| Cristallographie | ||
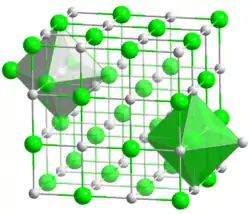
| Système cristallin | cubique (modèle classique de la Halite) | |
| Symbole de Pearson | ||
| Classe cristalline ou groupe d’espace | Fm3m, No. 225 | |
| Structure type | octahèdre (Mn2+), octahèdre (O2−) |
|
| Paramètres de maille | a = 4,445 Å | |
| Propriétés optiques | ||
| Indice de réfraction | 2,16 | |
| Précautions | ||
| SGH[4] | ||
 Danger |
||
| NFPA 704[4] | ||
| Transport[1] | ||
non soumis à règlementation |
||
| Écotoxicologie | ||
| DL50 | 1 g kg−1 (souris, s.c.)[5] | |
| Minéralogie | ||
| Échelle de Mohs | 5,5 | |
| Unités du SI & CNTP, sauf indication contraire. | ||
Présentation
Cet oxyde manganeux anhydre, qui a aussi la particularité d'être souvent non stochiométrique avec un excès d'ions oxydes, est basique. Il est insoluble dans l'eau, mais se dissout dans des acides, en formant suivant le milieu des sels comportant l'ion manganeux rose pâle (ou son complexe hexahydraté).
L'oxyde manganeux se trouve à l'état naturel, il s'agit de la manganosite, un minéral microcristallin vitreux, de maille cubique, gris émeraude, s'assombrissant ou virant au noir lorsqu'il est exposé à la lumière, parfois assez rare[6].
Réactions chimiques et obtention
L'oxyde de manganèse(II) peut être obtenu en réduisant par exemple sous un balayage de gaz hydrogène, le solide dioxyde de manganèse[7] :
- MnO2solide brun-noir + H2gaz → MnOsolide verdâtre + H2Oliquide ou vapeur.
Industriellement, l'agent réducteur, outre le dihydrogène parfois onéreux, peut être simplement le gaz monoxyde de carbone, par exemple obtenu par craquage du méthane :
- MnO2solide brun-noir + COgaz → MnO + CO2gaz.
Un autre moyen d'obtenir de l'oxyde de manganèse(II) consiste à chauffer du carbonate de manganèse MnCO3, qui se dissocie suivant la réaction[8] :
- MnCO3 solide blanc chauffé sous cloche à décomposition → MnO + CO2gaz.
Ce procédé de calcination est réalisé sous inertage, sans trace de gaz oxygène ou d'air, donc en milieu anaérobie, pour éviter la formation d'oxyde de manganèse(III) Mn2O3.
Structure cristallo-chimique et propriétés physiques
L'oxyde de manganèse(II) a la même structure que le sel de cuisine ou sel gemme, avec les cations et les anions tous deux organisés en réseaux d'octaèdres[7]. La composition du MnO peut varier du corps stœchiométrique MnO à MnO1,045[7].
En dessous de −155,15 °C, l'oxyde manganeux est antiferromagnétique[7]. Le monoxyde de manganèse a la particularité d'être un des premiers composés dont la structure magnétique a été trouvée par diffraction de neutrons en 1951[9] - [10]. L'étude a aussi permis de montrer que les ions Mn2+ forment un sous-réseau cubique à faces centrées où chaque plan est ferromagnétique et couplé symétriquement avec les plans adjacents.
Utilisations
L'oxyde de manganèse(II) est le plus stable aux hautes températures dans la famille des différents oxydes de manganèse. Il compte parmi les plus stables des différents autres composés manganésés.
En sidérurgie, cet oxyde est produit en grande quantité dans le laitier. Il augmente nettement le caractère réfractaire des laitiers basiques (ce qui n'est pas toujours souhaitable), et la fusibilité des laitiers acides. De par son comportement basique, il est rarement exploité pour favoriser les réactions chimiques associées au laitier. Sous la forme d'inclusions dans une pièce en acier, il s'avère peu nocif ou joue un rôle peu rétrograde vis-à-vis des propriétés mécaniques.
L'oxyde commun entre dans la composition de céramiques, d'émaux ou de verres colorés. L'oxyde de manganèse de grande pureté sert à fabriquer des céramiques spécifiques[11].
Cet oxyde commun entre dans la composition de peintures, il sert aussi dans le blanchiment du suif et en l'impression textile.
On l'utilise également en catalyse, par exemple pour la production de l'alcool allylique.
En agriculture, associé avec du sulfate de manganèse principalement hydraté, l'oxyde de manganèse entre dans la composition d'engrais et d'additifs alimentaires. Plusieurs milliers de tonnes sont destinées chaque année à cet usage[12].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Manganese(II) oxide » (voir la liste des auteurs).
- Entrée « Manganese(II)oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 janvier 2013 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Manganese & compounds: Overview (National Pollutant Inventory Australien)] »
- Fiche Sigma-Aldrich du composé Manganese(II) oxide, consultée le 2 janvier 2013.
- Zhurnal Vsesoyuznogo Khimicheskogo Obshchestva im. D.I. Mendeleeva. Journal of the D.I. Mendeleeva All-Union Chemical Society, vol. 19, p. 186, 1974.
- Le minéral manganosite sur Mindat
- Greenwood, Norman N., Earnshaw, Alan (1997). Chemistry of the Elements (2e éd.). Butterworth–Heinemann. (ISBN 0080379419).
- W.H. McCarroll (1994), Oxides- solid sate chemistry, Encyclopedia of Inorganic chemistry, Éd. R. Bruce King, John Wiley & Sons. (ISBN 0-471-93620-0)
- J.E. Greedon (1994), Magnetic oxides in Encyclopedia of Inorganic chemistry, Éd. R. Bruce King, John Wiley & Sons. (ISBN 0-471-93620-0)
- C. G. Shull, W. A. Strauser et E. O. Wollan, Neutron Diffraction by Paramagnetic and Antiferromagnetic Substances, Phys. Rev., 83, 333 - 345 (1951), DOI 10.1103/PhysRev.83.333
- Utilisation du manganèse dans l'Encyclopedia Britannia
- Arno H. Reidies, Manganese Compounds, Ullmann's Encyclopedia of Chemical Technology, 2007, Wiley-VCH, Weinheim. DOI 10.1002/14356007.a16_123


