Manganate de potassium
Le manganate de potassium ou manganate(VI) de potassium est un composé inorganique de formule K2MnO4. Ce sel vert est notamment rencontré comme intermédiaire lors de la production industrielle du permanganate de potassium.
| Manganate de potassium | ||
| ||
 | ||
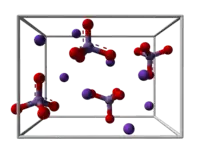
| Structure et apparence du manganate de potassium. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | manganate(VI) de potassium | |
| No CAS | ||
| No ECHA | 100.030.592 | |
| Apparence | Cristaux rhombiques verts, s'assombrissent avec le temps par formation d'une pellicule de permanganate de potassium[1]. | |
| Propriétés chimiques | ||
| Formule | K2MnO4 |
|
| Masse molaire[2] | 197,132 2 ± 0,001 4 g/mol K 39,67 %, Mn 27,87 %, O 32,46 %, |
|
| Propriétés physiques | ||
| Masse volumique | 2,703 g·cm-3[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Structure
K2MnO4 est constitué de cations K+ et d'anions MnO42−. Il cristallise dans le système orthorhombique avec comme paramètres de maille, a = 766,7 pm, b = 589,5 pm et c = 1 035,9 pm. Le groupe d'espace est Pnma (no 62) et il y a quatre K2MnO4 dans l'unité cellulaire. Les anions sont tétraédriques avec une distance Mn-O moyenne de 165,9 ± 0,8 pm et l'angle O-Mn-O moyen est de 109,5 ± 0,7°. L'accroissement de 3 pm de la distance Mn-O par rapport à celle dans le permanganate de potassium est cohérent avec le calcul des orbitales moléculaires des ions manganates. Les cations K+ sont entourés de 8 atomes d'oxygène formant un antiprisme irrégulier[3].
Production
Comme intermédiaire dans la production de KMnO4, K2MnO4 est industriellement produit suivant[4] :
Au laboratoire, K2MnO4 peut être préparé en chauffant une solution de KMnO4 et de KOH puis en récupérant les cristaux verts obtenus après refroidissement[5] :
- 2 KMnO4 + 2 KOH → 2 K2MnO4 + 1⁄2 O2 + H2O.
Réactions
K2MnO4 se décompose vers 600 °C en donnant de l'oxygène, l'hypomanganate (K3MnO4) et l'oxyde de manganèse(III) (Mn2O3). Il est relativement stable en solution basique mais se décompose rapidement en milieu acide en permanganate (KMnO4) et oxyde de manganèse(IV) (MnO2)[1] - [6].
L'oxydation anodique du manganate permet d'obtenir le permanganate suivant[4] :
Utilisations
La majorité du manganate(VI) de potassium produit est utilisé pour synthétiser le permanganate de potassium. Il est également utilisé pour le traitement de surface du magnésium et comme réactif oxydant[7].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Potassium manganate » (voir la liste des auteurs).
- Reidies 2000, p. 233.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Gus J. Palenik, « Crystal Structure of Potassium Manganate », Inorg. Chem., vol. 6(3), , p. 507–511 (DOI 10.1021/ic50049a015).
- Reidies 2000, p. 235.
- (en) Nyholm, R. S. et Woolliams, P. R., « Manganates(VI) », Inorg. Synth., vol. 11, , p. 56–61 (ISBN 978-0-470-13242-5, DOI 10.1002/9780470132425.ch11).
- (en) N. N. Greenwood, Chemistry of the elements, Oxford Boston, Butterworth-Heinemann, (ISBN 978-0-7506-3365-9, OCLC 37499934), p. 1050.
- Reidies 2000, p. 233-234.
Voir aussi
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (en) Arno H. Reidies, Manganese Compounds, Weinheim, Germany, Wiley-VCH, (ISBN 3-527-30673-0, DOI 10.1002/14356007.a16_123).
