(Méthylcyclopentadiényl)manganèse tricarbonyle
Le (méthylcyclopentadiényl)manganèse tricarbonyle est un composé organométallique (carbonyle de métal) de formule chimique (η5-CH3C5H4)Mn(CO)3 dont la géométrie est dite « demi-sandwich » ou « en tabouret de piano ». C'est un toxique cellulaire qui libère en se dégradant des composés qui contiennent du manganèse, lequel est un métal devenant neurotoxique au-delà des doses qui en font un oligoélément.
| (Méthylcyclopentadiényl)manganèse tricarbonyle | |
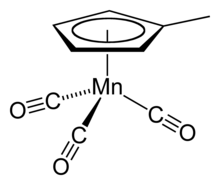 Structure du (méthylcyclopentadiényl)manganèse tricarbonyle |
|
| Identification | |
|---|---|
| Synonymes |
MeCpMn(CO)3 |
| No CAS | |
| No ECHA | 100.031.957 |
| No CE | 235-166-5 |
| No RTECS | OP1450000 |
| PubChem | 25511 |
| SMILES | |
| InChI | |
| Apparence | liquide orange foncé à l'odeur agréable |
| Propriétés chimiques | |
| Formule | C9H7MnO3− |
| Masse molaire[1] | 218,088 1 ± 0,008 6 g/mol C 49,57 %, H 3,24 %, Mn 25,19 %, O 22,01 %, |
| Propriétés physiques | |
| T° fusion | 2,2 °C[2] |
| T° ébullition | 232,8 °C[2] |
| Solubilité | 10 mg·l-1[2] à 20 °C |
| Masse volumique | 1,39 g·cm-3[2] |
| T° d'auto-inflammation | 257 °C[2] |
| Point d’éclair | 96 °C[2] |
| Pression de vapeur saturante | 6,3 Pa[2] |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Photodégradable et thermodégradable, ce produit inventé et mis sur le marché dans les années 1950 par la société Ethyl Corporation (qui est aussi à l'origine du plomb tétraéthyle) est principalement utilisé comme additif des carburants (antidétonant) depuis les années 1970, en de plus fortes concentrations quand il a remplacé le plomb dans l'essence sans plomb, du fait de la forte toxicité de ce dernier. Sa combustion dans les moteurs automobiles contribue à une pollution de l'atmosphère en composés de manganèse.
Description
Il s'agit d'un liquide orange foncé à l'odeur agréable.
La molécule est constituée d'un anion cyclique aromatique méthylcyclopentadiényle C5H4CH3−, d'un atome de manganèse Mn, et de trois groupes carbonyle CO.
Histoire industrielle
Cette molécule a été inventée par un groupe pétrochimique (l'Ethyl Corporation), basé à Richmond dans les années 1950 pour augmenter le degré d'octane des carburants[3]. Des doutes quant à son innocuité pour la santé et l'environnement étaient déjà émis au début des années 1970[4].
Le MMT n'a été autorisé dans l'essence qu'en 1977 aux États-Unis. En 1995, Ethyl Corporation a reçu une dispense de l’Agence de protection environnementale américaine (U.S. EPA) autorisant son usage dans l’essence sans plomb aux États-Unis (hors essence reformulée) à un taux équivalent à 8,3 mg Mn/L (manganèse par litre)[5].
En 1979 lors d'une crise du pétrole, l'EPA, à la demande du gouvernement et de l'industrie a autorisé l'ajout de MMT dans l'essence sans plomb pour quelques mois et alors qu'il était prévu d'interdire le plomb dans l'essence fin 1995[3]
Selon l'Ethyl Corporation plus de 70 millions de livres (pounds) de MMT ont été vendus aux États-Unis de 1976 à 1998[3].
Utilisation
Il a été historiquement utilisé (depuis les années 1970[6]), en complément au tétraéthyle de plomb (CH3CH2)4Pb, comme additif pour carburant pour en accroître l'indice d'octane en réduisant leur sensibilité à l'auto-allumage — et donc leur tendance à produire des cliquetis[7].
Ce produit a d'abord été utilisé à des doses correspondant en 1975 à environ 0,025 g de manganèse/gal pour le fuel oil et à 0,08 à 0,5 g/gal pour les turbine fuels[7]. Il était aussi initialement utilisé à faible dose dans l'essence plombée puis à doses bien plus importantes lors de l'introduction sur le marché de l'essence sans plomb (qu'il a ainsi remplacé, avec le benzène ou d'autres composés) ; le dosage est alors passé à 0,125 grammes de manganèse/gal, de manière à éviter le cliquetis tout en protégeant le moteur d'autres effets du manganèse[7].
Environnement et sûreté
L’impact de l’utilisation du MMT sur l’homme et l’environnement est fonction :
- du MMT dans sa forme chimique originale, inaltérée; et/ou
- du manganèse issu de sa combustion avec l’essence et émis par les pots d’échappement.
MMT sous sa forme originale (en tant que composé chimique avant combustion)
Le (méthylcyclopentadiényl)manganèse tricarbonyle (MMT) concentré (avant combustion) est source d'une toxicité cellulaire [8]. Il affecte notamment le fonctionnement des mitochondries et par suite la respiration cellulaire[9].
Une toxicité pulmonaire est observée in vitro et en laboratoire chez le rat, la souris et le hamster[10], sans causer la même toxicité pulmonaire que la bléomycine ou le cyclophosphamide chez la souris de laboratoire et le rat de laboratoire[11]
Les personnes exposées chroniquement à de fortes doses de MMT risquent de développer une maladie neurodégénérative irréversible (le manganisme).
Il convient de préciser que le grand public n’est pas ou très peu exposé au MMT dans sa forme originale, avant que celui-ci ne soit brulé lors de la combustion de l’essence. Comme l’explique l’Agence américaine de protection de l’environnement (US EPA) dans leur analyse de risque du MMT, « l’exposition au MMT, hormis les cas de contact professionnel ou accidentel, n’est pas été considéré comme posant un risque important pour la population »[12].
Manganèse issu de la combustion du MMT
Lors de la combustion, le méthylcyclopentadiényl manganèse tricarbonyle (MMT) en se dégradant libère dans l’environnement des particules de manganèse via le pot d’échappement du véhicule. Le manganèse est neurotoxique au-delà des doses qui en font un oligoélément et peut, chez des individus qui y seraient plus exposés, ou plus vulnérables, causer une intoxication au manganèse. Selon des tests publiés en 1975 par les industriels producteurs d'additifs de carburants, la quantité de manganèse émise dans l'air par une voiture moyenne (sur banc de test) était comparable à la quantité de plomb particulaire émis par un moteur alimenté par de l'essence plombée. Et la taille des particules de manganèse (essentiellement du Mn3O4) émises par le pot d'échappement était de 0,2 à 0,4 micron ; 98,7 % de ce manganèse étant émis sous forme inorganique selon l'Ethyl Corporation Research Laboratories[7]. Selon une estimation faite en 1975 par ces mêmes producteurs, si toute l'essence était sans plomb (avec 0,1 g de manganèse par gallon sous forme de MMT) l'air urbain des États-Unis ne devrait pas contenir plus de 0,02 à 0,2 µg/m3 de manganèse, avec une valeur moyenne de 0,05 µg/m3 et une infime concentration de manganèse organique.
Il ne semble pas y avoir de données publiées sur ce que devient le produit émis dans l'environnement nocturne. Lynam en 1998 ajoute qu'il a été démontré que le MMT diminue significativement les émissions de NOx[6]. Et selon lui seuls moins de 15 % du manganèse provenant de la combustion du MMT sont émis dans l'air à partir du tuyau d'échappement (principalement dans la fraction de PM 2,5 sous forme de phosphate de manganèse et moindrement de sulfate de manganèse et d'une faible proportion d'oxyde de manganèse.
Des études faites à Toronto dans les années 1990 ont conclu à une faible exposition de la population générale (0,008 microgramme/m3 d'air-médian), soit bien moins que les limites fixées par l'EPA aux États-Unis. Les analyses d'air faites à Toronto ont aussi montré une faible rémanence dans l'air (niveaux ambiants de dans l'air à Toronto comparables à des niveaux mesurés dans des zones où le MMT n'est pas utilisé[6]).
À proximité des voies les plus circulantes, l'exposition augmente cependant et dans certaines régions ce manganèse s'ajoute à celui émis par les centrales aux charbon et les usines métallurgiques. Une étude a cherché à Montréal à évaluer les teneurs de l'air en MMT, en manganèse respirable (MnR) et le manganèse total (MnT) dans 5 micro-environnements a priori plus exposés au MMT : une station d'essence, un parking souterrain, le centre-ville, une zone proche d'une autoroute et une autre près d'une raffinerie de pétrole. Les taux moyens de MnR, MnT et MMT étaient respectivement de 0,036 microgramme/m3, 0,103 microgramme/m3 et 0,005 microgramme/m3. Les ratios MnR/MnT variaient de 25 % à 43 % (35 % en moyenne), tandis que le ratio moyen MMT/MnT était de 5 %. Le taux de MnR était de 0,053 microgramme/m3 près de l'autoroute, atteignant le seuil de référence de l'EPA (qui était de 0,05 microgramme/m3). Cette étude a estimé que l'exposition environnementale quotidienne du grand public était dans les années 1990 de 0,010 microgramme kg−1 j−1 pour la fraction "inhalation" et que cette contribution à l'exposition totale (via l'air, l'eau, la peau et les aliments) reste faible. même à proximité d'une autoroute[5].
En 2005, alors qu'on en savait toujours peu sur ses effets sanitaires et environnementaux potentiels[3], une étude a estimé la part de la pollution automobile dans les dépôts de Mn et de MMT par rapport au volume de trafic sur des sites proches d'une autoroute dans le Grand Toronto, où le MMT est toujours utilisé. Les apports en manganèse ont été estimés selon le trafic moyen (Annual Average Daily Traffic ou AADT), la densité de véhicules, leur consommation de carburant, la distance qu'ils parcourent et la concentration en Mn (mg l-1) de l'essence[13]. Une analyse par régression linéaire multiple a été utilisée pour évaluer les apports pour la période 2002-2010. les résultats étaient à 99 % prédictifs des taux mesurés pour deux sites ; « les 15 % prédits d'émissions par les pots d'échappement pour une essence contenant 10 mg de Mn/L, représentaient 1290,03 g/an pour le site N°1 et 555,94 g/an pour le site 2 »[13]. La circulation ajoute donc 5,73 et 2,47 mg/g de Mn chaque année respectivement pour ces 2 sites, apports qui selon les auteurs peuvent encore être considérées comme négligeables par rapport à l'abondance naturelle du Mn dans le sol[13].
Si la circulation n'augmente pas et sur la base de cette modélisation, il faudrait de respectivement plus 95 ans et plus de 256 ans pour doubler sur ces deux sites la teneur du sol en Mn[13].
Il ne semble cependant pas y avoir d'étude qui ait comparé la biodisponibilité du manganèse émis par les pots d'échappement à celui qui est dans les sols, en grande partie complexé dans l'humus ou l'argile.
Évaluation globale des risques
Le méthylcyclopentadiényl manganèse tricarbonyle (MMT) est rapidement dégradé à haute température (dans le moteur d'une voiture notamment). Il est en outre rapidement dégradé par la lumière (photodégradation à une longueur d'onde comprise entre 340 et 440 nanomètres) en présence d'oxygène avec différentes molécules intermédiaires et sous-produits de dégradation.
Il devrait donc être dégradé en quelques secondes à quelques minutes en plein soleil [7], et ne pas poser de problème de santé publique en tant que tel (mais le manganèse qui en résulte reste neurotoxique).
Il n’apparait pas non plus que l’homme et l’environnement subissent une exposition importante aux composés de manganèse (phosphate de manganèse, sulfate de manganèse et tétraoxyde de manganèse) issus de la combustion du MMT. Dans une étude de risque sur les effets sanitaires des composés de manganèse issus de la combustion du MMT, le ministère fédéral de la Santé du Canada a conclu que l’exposition à ces composés ne constituait pas un risque important pour la population[14]. En 2013, un rapport d’évaluation sanitaire a été développé par ARCADIS Consulting et vérifié par un groupe d’experts indépendants selon la méthodologie fournie par la Commission européenne dans le respect des critères définis par la Directive européenne ‘qualité des carburants’. Les conclusions du rapport sont les suivantes : « Pour le MMT et les produits issus de sa transformation, lorsque le MMT est utilisé en tant qu’additif pour le carburant, aucun problème majeur n’a été identifié pour la santé humaine et l’environnement, que l’exposition soit au MMT ou aux produits issus de sa transformation (combustion) lors d’utilisation jusqu’à 18 mg Mn/l. En fonction des besoins locaux et de la technologie de contrôle des émissions du véhicule disponible, une utilisation de MMT dont le taux se situe entre 8,3 mg Mn/l et 18 mg Mn/l est justifiée scientifiquement et est susceptible de produire des effets bénéfiques pour l’économie et l’environnement sans produire d’effets négatifs »[15].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Methyl cyclopentadienyl manganese tricarbonyl » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 février 2013 (JavaScript nécessaire)
- Davis, J. M. (1998). Methylcyclopentadienyl manganese tricarbonyl: health risk uncertainties and research directions. Environmental health perspectives, 106(Suppl 1), 191 (PDF, 11pages).
- Piver WT. Potential dilemma: the methods of meeting auto- motive exhaust emission standards of the Clean Air Act of 1970. Environ Health Perspect 8:165-190 (1974).
- Zayed, J., Thibault, C., Gareau, L., & Kennedy, G. (1998). Airborne manganese particulates and methylcyclopentadienyl manganese tricarbonyl (MMT) at selected outdoor sites in Montreal. Neurotoxicology, 20(2-3), 151-157 (résumé).
- Lynam, D. R., Roos, J. W., Pfeifer, G. D., Fort, B. F., & Pullin, T. G. (1998) Environmental effects and exposures to manganese from use of methylcyclopentadienyl manganese tricarbonyl (MMT) in gasoline. Neurotoxicology, 20(2-3), 145-150 (résumé).
- Ter Haar, G. L., Griffing, M. E., Brandt, M., Oberding, D. G., & Kapron, M. (1975) Methylcyclopentadienyl manganese tricarbonyl as an antiknock : Composition and fate of manganese exhaust products. Journal of the Air Pollution Control Association, 25(8), 858-859. Rem : Tous les auteurs de cet article font partie des Ethyl Corporation Research Laboratories
- Anantharam, V., Kitazawa, M., Wagner, J., Kaul, S., & Kanthasamy, A. G. (2002) Caspase-3-dependent proteolytic cleavage of protein kinase Cδ is essential for oxidative stress-mediated dopaminergic cell death after exposure to methylcyclopentadienyl manganese tricarbonyl. The Journal of neuroscience, 22(5), 1738-1751.
- Autissier, N., Dumas, P., Brosseau, J., & Loireau, A. (1977). Action du manganese methylcyclopentadienyle tricarbonyle (MMT) sur les mitochondries I. Effects du MMT, in vitro, sur la phosphorylation oxydative des mitochondries hepatiques de rats. Toxicology, 7(1), 115-122 (résumé).
- Pertti J. Hakkinen & Wanda M. Haschek (1982) Pulmonary toxicity of methylcyclopentadienyl manganese tricarbonyl: Nonciliated bronchiolar epithelial (Clara) cell necrosis and alveolar damage in the mouse, rat, and hamster ; Toxicology and Applied Pharmacology Volume 65, Issue 1, August 1982, Pages 11–22 (résumé)
- Hakkinen, P. J., Morse, C. C., Martin, F. M., Dalbey, W. E., Haschek, W. M., & Witschi, H. R. (1983) Potentiating effects of oxygen in lungs damaged by methylcyclopentadienyl manganese tricarbonyl, cadmium chloride, oleic acid, and antitumor drugs. Toxicology and applied pharmacology, 67(1), 55-69 (résumé)
- (en) « Methylcyclopentadienyl Manganese Tricarbonyl (MMT)- Priority Existing Chemical Assessment Report No. 24 », sur https://www.nicnas.gov.au/, (consulté le )
- Bhuie AK, Ogunseitan OA, White RR, Sain M & Roy DN (2005), Modeling the environmental fate of manganese from methylcyclopentadienyl manganese tricarbonyl in urban landscapes. Science of The Total Environment, Vol.339, n°1–3, 1er mars 2005, Pages 16–178 (résumé)
- (en) Government of Canada, Office of the Auditor General of Canada., « Fuel additive MMT », sur www.oag-bvg.gc.ca (consulté le )
- (en) « Mark Jackson, James A. Haley Veterans Hospital (2016) Health and environment risk assessment for the metallic fuel additive mmt ®1 Overall Summary MAIN CONCLUSIONS », sur ResearchGate (consulté le )
Voir aussi
Articles connexes
- Carburant
- Manganèse
- Agent antidétonant
- Composé organométallique
- Pollution automobile
- Pollution routière
- Glencore (Glencore Manganèse France)
- Intoxication par le manganèse (= Manganisme)
- United States emission standards (en)
Bibliographie
- Autissier, N., Dumas, P., Brosseau, J., & Loireau, A. (1977). Action du manganese methylcyclopentadienyle tricarbonyle (MMT) sur les mitochondries I. Effects du MMT, in vitro, sur la phosphorylation oxydative des mitochondries hepatiques de rats. Toxicology, 7(1), 115-122 (résumé).
- Davis, J. M. (1998). Methylcyclopentadienyl manganese tricarbonyl: health risk uncertainties and research directions. Environmental health perspectives, 106(Suppl 1), 191.
- Hakkinen, P. J., Morse, C. C., Martin, F. M., Dalbey, W. E., Haschek, W. M., & Witschi, H. R. (1983) Potentiating effects of oxygen in lungs damaged by methylcyclopentadienyl manganese tricarbonyl, cadmium chloride, oleic acid, and antitumor drugs. Toxicology and applied pharmacology, 67(1), 55-69 (résumé)
- Kitazawa, M., Wagner, J. R., Kirby, M. L., Anantharam, V., & Kanthasamy, A. G. (2002) Oxidative stress and mitochondrial-mediated apoptosis in dopaminergic cells exposed to methylcyclopentadienyl manganese tricarbonyl. Journal of Pharmacology and Experimental Therapeutics, 302(1), 26-35.
- Ressler, T., Wong, J., Roos, J., & Smith, I. L. (2000). Quantitative speciation of Mn-bearing particulates emitted from autos burning (methylcyclopentadienyl) manganese tricarbonyl-added gasolines using XANES spectroscopy. Environmental science & technology, 34(6), 950-958.
- Ter Haar, G. L., Griffing, M. E., Brandt, M., Oberding, D. G., & Kapron, M. (1975) Methylcyclopentadienyl manganese tricarbonyl as an antiknock : Composition and fate of manganese exhaust products. Journal of the Air Pollution Control Association, 25(8), 858-859