Liste des degrés d'oxydation des éléments
Il s'agit d'une liste de l'ensemble des degrés d'oxydation des éléments chimiques, excluant les valeurs non entières de celui-ci. Les valeurs les plus courantes sont notées en gras. Ce tableau est basé sur le travail de Greenwood et Earnshaw publié en 1997[1] complété avec d'autres références.
Tableau des degrés d'oxydation
- (colonne) : Éléments
- (lignes) : Gaz nobles
| Numéro atomique | Élément | Degrés d'oxydation négatifs | Degrés d'oxydation positifs | Groupe de l'élément | Références | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| −5 | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | ||||
| 1 | hydrogène | −1 | H | +1 | 1 | |||||||||||||
| 2 | hélium | He | 18 | |||||||||||||||
| 3 | lithium | Li | +1 | 1 | [1] | |||||||||||||
| 4 | béryllium | Be | +1 | +2 | 2 | [2] | ||||||||||||
| 5 | bore | −5 | −1 | B | +1 | +2 | +3 | 13 | [3] - [4] | |||||||||
| 6 | carbone | −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | 14 | |||||||
| 7 | azote | −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | 15 | |||||||
| 8 | oxygène | −2 | −1 | O | +1 | +2 | 16 | |||||||||||
| 9 | fluor | −1 | F | 17 | ||||||||||||||
| 10 | néon | Ne | 18 | |||||||||||||||
| 11 | sodium | −1 | Na | +1 | 1 | [1] | ||||||||||||
| 12 | magnésium | Mg | +1 | +2 | 2 | [5] | ||||||||||||
| 13 | aluminium | −2 | −1 | Al | +1 | +2 | +3 | 13 | [6] - [7] - [8] - [9] | |||||||||
| 14 | silicium | −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | 14 | |||||||
| 15 | phosphore | −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | 15 | |||||||
| 16 | soufre | −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | 16 | |||||||
| 17 | chlore | −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 17 | [10] | ||||||
| 18 | argon | Ar | 18 | |||||||||||||||
| 19 | potassium | −1 | K | +1 | 1 | [1] | ||||||||||||
| 20 | calcium | −1 | Ca | +1 | +2 | 2 | [11] - [12] | |||||||||||
| 21 | scandium | Sc | +1 | +2 | +3 | 3 | ||||||||||||
| 22 | titane | −2 | −1 | Ti | +1 | +2 | +3 | +4 | 4 | [13] - [14] - [15] | ||||||||
| 23 | vanadium | −3 | −1 | V | +1 | +2 | +3 | +4 | +5 | 5 | [14] | |||||||
| 24 | chrome | −4 | −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [14] | |||||
| 25 | manganèse | −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | |||||
| 26 | fer | −4 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | 8 | [16] - [17] - [18] | |||||
| 27 | cobalt | −3 | −1 | Co | +1 | +2 | +3 | +4 | +5 | 9 | [14] | |||||||
| 28 | nickel | −2 | −1 | Ni | +1 | +2 | +3 | +4 | 10 | [19] - [20] | ||||||||
| 29 | cuivre | −2 | Cu | +1 | +2 | +3 | +4 | 11 | [17] | |||||||||
| 30 | zinc | −2 | Zn | +1 | +2 | 12 | [17] - [21] | |||||||||||
| 31 | gallium | −5 | −4 | −2 | −1 | Ga | +1 | +2 | +3 | 13 | [8] - [22] | |||||||
| 32 | germanium | −4 | −3 | −2 | −1 | Ge | +1 | +2 | +3 | +4 | 14 | [21] | ||||||
| 33 | arsenic | −3 | −2 | −1 | As | +1 | +2 | +3 | +4 | +5 | 15 | [8] - [23] - [24] | ||||||
| 34 | sélénium | −2 | −1 | Se | +1 | +2 | +3 | +4 | +5 | +6 | 16 | |||||||
| 35 | brome | −1 | Br | +1 | +3 | +4 | +5 | +7 | 17 | |||||||||
| 36 | krypton | Kr | +2 | 18 | ||||||||||||||
| 37 | rubidium | −1 | Rb | +1 | 1 | [1] | ||||||||||||
| 38 | strontium | Sr | +1 | +2 | 2 | |||||||||||||
| 39 | yttrium | Y | +1 | +2 | +3 | 3 | [28] | |||||||||||
| 40 | zirconium | −2 | Zr | +1 | +2 | +3 | +4 | 4 | [1] - [21] | |||||||||
| 41 | niobium | −3 | −1 | Nb | +1 | +2 | +3 | +4 | +5 | 5 | [14] - [29] | |||||||
| 42 | molybdène | −4 | −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [14] | |||||
| 43 | technétium | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | ||||||
| 44 | ruthénium | −4 | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | [14] - [17] | ||||
| 45 | rhodium | −3 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | 9 | [14] | ||||||
| 46 | palladium | Pd | +1 | +2 | +3 | +4 | +5 | +6 | 10 | |||||||||
| 47 | argent | −2 | −1 | Ag | +1 | +2 | +3 | +4 | 11 | [17] - [34] - [35] | ||||||||
| 48 | cadmium | −2 | Cd | +1 | +2 | 12 | [21] | |||||||||||
| 49 | indium | −5 | −2 | −1 | In | +1 | +2 | +3 | 13 | [8] - [36] - [37] | ||||||||
| 50 | étain | −4 | −3 | −2 | −1 | Sn | +1 | +2 | +3 | +4 | 14 | [8] - [38] | ||||||
| 51 | antimoine | −3 | −2 | −1 | Sb | +1 | +2 | +3 | +4 | +5 | 15 | [8] - [39] - [40] - [41] | ||||||
| 52 | tellure | −2 | −1 | Te | +1 | +2 | +3 | +4 | +5 | +6 | 16 | [8] - [42] - [43] - [44] | ||||||
| 53 | iode | −1 | I | +1 | +3 | +4 | +5 | +6 | +7 | 17 | [45] - [46] | |||||||
| 54 | xénon | Xe | +2 | +4 | +6 | +8 | 18 | [45] | ||||||||||
| 55 | césium | −1 | Cs | +1 | 1 | [1] | ||||||||||||
| 56 | baryum | Ba | +1 | +2 | 2 | |||||||||||||
| 57 | lanthane | La | +1 | +2 | +3 | [48] | ||||||||||||
| 58 | cérium | Ce | +2 | +3 | +4 | |||||||||||||
| 59 | praséodyme | Pr | +2 | +3 | +4 | |||||||||||||
| 60 | néodyme | Nd | +2 | +3 | +4 | [21] | ||||||||||||
| 61 | prométhium | Pm | +2 | +3 | [21] - [49] | |||||||||||||
| 62 | samarium | Sm | +2 | +3 | ||||||||||||||
| 63 | europium | Eu | +2 | +3 | ||||||||||||||
| 64 | gadolinium | Gd | +1 | +2 | +3 | |||||||||||||
| 65 | terbium | Tb | +1 | +2 | +3 | +4 | [49] | |||||||||||
| 66 | dysprosium | Dy | +2 | +3 | +4 | [21] | ||||||||||||
| 67 | holmium | Ho | +2 | +3 | [49] | |||||||||||||
| 68 | erbium | Er | +2 | +3 | [49] | |||||||||||||
| 69 | thulium | Tm | +2 | +3 | ||||||||||||||
| 70 | ytterbium | Yb | +2 | +3 | ||||||||||||||
| 71 | lutétium | Lu | +2 | +3 | 3 | [49] | ||||||||||||
| 72 | hafnium | −2 | Hf | +1 | +2 | +3 | +4 | 4 | [14] - [50] | |||||||||
| 73 | tantale | −3 | −1 | Ta | +1 | +2 | +3 | +4 | +5 | 5 | [14] - [21] | |||||||
| 74 | tungstène | −4 | −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | 6 | [14] | |||||
| 75 | rhénium | −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | ||||||
| 76 | osmium | −4 | −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | [17] - [51] - [52] | |||
| 77 | iridium | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | 9 | [1] - [53] - [54] - [55] | |||
| 78 | platine | −3 | −2 | −1 | Pt | +1 | +2 | +3 | +4 | +5 | +6 | 10 | [17] - [56] - [57] | |||||
| 79 | or | −3 | −2 | −1 | Au | +1 | +2 | +3 | +5 | 11 | [17] | |||||||
| 80 | mercure | −2 | Hg | +1 | +2 | +4 | 12 | [17] - [58] | ||||||||||
| 81 | thallium | −5 | −2 | −1 | Tl | +1 | +2 | +3 | 13 | [8] - [59] - [60] - [61] | ||||||||
| 82 | plomb | −4 | −2 | −1 | Pb | +1 | +2 | +3 | +4 | 14 | [8] - [62] - [63] - [64] | |||||||
| 83 | bismuth | −3 | −2 | −1 | Bi | +1 | +2 | +3 | +4 | +5 | 15 | [65] - [66] - [67] | ||||||
| 84 | polonium | −2 | Po | +2 | +4 | +5 | +6 | 16 | [68] | |||||||||
| 85 | astate | −1 | At | +1 | +3 | +5 | +7 | 17 | ||||||||||
| 86 | radon | Rn | +2 | +6 | 18 | [69] - [70] - [1] - [71] | ||||||||||||
| 87 | francium | Fr | +1 | 1 | ||||||||||||||
| 88 | radium | Ra | +2 | 2 | ||||||||||||||
| 89 | actinium | Ac | +2 | +3 | [72] | |||||||||||||
| 90 | thorium | Th | +1 | +2 | +3 | +4 | [73] | |||||||||||
| 91 | protactinium | Pa | +2 | +3 | +4 | +5 | [74] | |||||||||||
| 92 | uranium | U | +1 | +2 | +3 | +4 | +5 | +6 | [75] - [76] | |||||||||
| 93 | neptunium | Np | +2 | +3 | +4 | +5 | +6 | +7 | [21] | |||||||||
| 94 | plutonium | Pu | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | [21] - [77] - [78] | |||||||
| 95 | américium | Am | +2 | +3 | +4 | +5 | +6 | +7 | +8 | [1] - [79] | ||||||||
| 96 | curium | Cm | +2 | +3 | +4 | +6 | [21] - [80] - [81] - [82] | |||||||||||
| 97 | berkélium | Bk | +2 | +3 | +4 | |||||||||||||
| 98 | californium | Cf | +2 | +3 | +4 | |||||||||||||
| 99 | einsteinium | Es | +2 | +3 | +4 | [84] | ||||||||||||
| 100 | fermium | Fm | +2 | +3 | ||||||||||||||
| 101 | mendélévium | Md | +2 | +3 | ||||||||||||||
| 102 | nobélium | No | +2 | +3 | ||||||||||||||
| 103 | lawrencium | Lr | +3 | 3 | ||||||||||||||
| 104 | rutherfordium | Rf | +4 | 4 | ||||||||||||||
| 105 | dubnium | Db | +5 | 5 | [85] | |||||||||||||
| 106 | seaborgium | Sg | +6 | 6 | [86] | |||||||||||||
| 107 | bohrium | Bh | +7 | 7 | [87] | |||||||||||||
| 108 | hassium | Hs | +8 | 8 | [88] | |||||||||||||
En 1919, dans l'un de ses premiers articles sur la règle de l'octet, Irving Langmuir présente ses résultats sous la forme du graphique montré ci-après[89]. La périodicité des états d'oxydation, manifeste sur la figure, a été l'un des arguments décisifs en faveur de cette règle de l'octet.
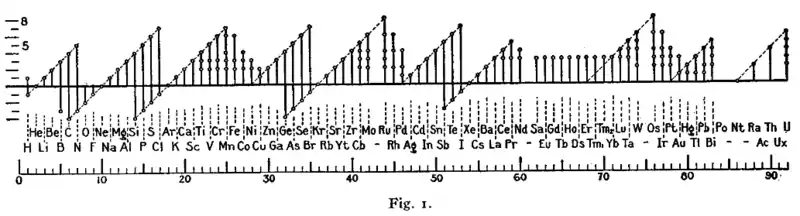
Représentation graphique des nombres d'oxydation en fonction du numéro atomique
Notes et références
- (en) Norman N.Greenwood et Alan Earnshaw, Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, , 27–28 p.
- (en) A. Shayesteh et K. Tereszchuk, « Infrared Emission Spectra of BeH and BeD », J. Chem. Phys., no 118, , p. 1158 (DOI 10.1063/1.1528606, lire en ligne)
- (en) James Keeler et Peter Wothers, Chemical Structure and Reactivity : An Integrated Approach, Oxford University Press, (lire en ligne)
- Melanie Schroeder, Eigenschaften von borreichen Boriden und Scandium-Aluminium-Oxid-Carbiden (Thèse Universitaire), (lire en ligne)
- (en) Shaun P. Green, Cameron Jones et Andreas Stasch, « Stable Magnesium(I) Compounds with Mg-Mg Bonds », Science, no 318, , p. 1754 (DOI 10.1126/science.1150856, lire en ligne)
- (en) D. C. Tyte, « Red (B2Π–A2σ) Band System of Aluminium Monoxide », Nature, no 202, , p. 383 (DOI 10.1038/202383a0)
- (en) Werner Uhl, « Organoelement Compounds Possessing Al—Al, Ga—Ga, In—In, and Tl—Tl Single Bonds », Advances in Organometallic Chemistry, no 51, , p. 53 (DOI 10.1016/S0065-3055(03)51002-4)
- (de) Ralf Alsfasser, Moderne anorganische Chemie, De Gruyter, , 801 p. (ISBN 978-3-11-017838-8)
- (de) Marco Wendorff et Caroline Röhr, « Sr14[Al4]2[Ge]3: Eine Zintl-Phase mit isolierten [Ge]4−- und [Al4]8−-Anionen / Sr14[Al4]2[Ge]3: A Zintl Phase with Isolated [Ge]4−- and [Al4]8− Anions », Zeitschrift für Naturforschung B, vol. 62, , p. 1227 (DOI 10.1515/znb-2007-1001)
- (en) Maria I. Lopez et Juan E. Sicre, « Physicochemical properties of chlorine oxides. 1. Composition, ultraviolet spectrum, and kinetics of the thermolysis of gaseous dichlorine hexoxide », J. Phys. Chem., no 94, , p. 3860 (DOI 10.1021/j100372a094, lire en ligne)
- (en) Sven Krieck, Helmar Görls et Matthias Westerhausen, « Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(μ-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes », Journal of the American Chemical Society, vol. 132, no 35, , p. 12492 (DOI 10.1021/ja105534w, lire en ligne)
- (en) D. J. Pegg et J. S. Thompson, « Evidence for a stable negative ion of calcium », Phys. Rev. Lett., no 59, , p. 2267 (DOI 10.1103/PhysRevLett.59.2267, lire en ligne)
- (en) Nils Andersson et Walter J. Balfour, « Emission spectra of TiH and TiD near 938 nm », J. Chem. Phys., no 118, , p. 3543 (lire en ligne)
- (en) Helmut Werner, Landmarks in Organo-Transition Metal Chemistry, A personal View, Springer, (ISBN 978-0-387-09847-0)
- (en) Amanda C. Bowman et Jason England, « Electronic structures of homoleptic [tris(2,2'-bipyridine)M]n complexes of the early transition metals (M = Sc, Y, Ti, Zr, Hf, V, Nb, Ta; n = 1+, 0, 1-, 2-, 3-): an experimental and density functional theoretical study », Inorg. Chem., no 52, , p. 2242 (DOI 10.1021/ic302799s, lire en ligne)
- (en) Yurii D. Perfiliev et Virender K. Sharma, « Higher Oxidation States of Iron in Solid State: Synthesis and Their Mössbauer Characterization », ACS Symposium Series, no 985, , p. 112 (DOI 10.1595/147106704X10801, lire en ligne)
- (en) Changhoon Lee et Myung-Hwan Whangbo, « Late transition metal anions acting as p-metal elements », Frontiers in Solid State Chemistry, no 10, , p. 444 (lire en ligne)
- (en) Changhoon Lee et Myung-Hwan Whangbo, « Analysis of Electronic Structures and Chemical Bonding of Metal-rich Compounds. 2. Presence of Dimer (T–T)4− and Isolated T2− Anions in the Polar Intermetallic Cr5B3-Type Compounds AE5T3 (AE = Ca, Sr; T = Au, Ag, Hg, Cd, Zn) », Zeitschrift für anorganische und allgemeine Chemie, no 636, , p. 36 (lire en ligne)
- Dr_Klaus_Jonas1975">(en) Dr Klaus Jonas, « Dilithium-Nickel-Olefin Complexes. Novel Bimetal Complexes Containing a Transition Metal and a Main Group Metal », Angew. Chem. Int. Ed., no 14, , p. 752 (DOI 10.1002/anie.197507521)
- (en) John E. Ellis, « Adventures with Substances Containing Metals in Negative Oxidation States », Inorganic Chemistry, no 45, , p. 3167 (lire en ligne)
- (de) Arnold F Holleman, Lehrbuch der Anorganischen Chemie, De Gruyter, (ISBN 3-11-007511-3)
- (de) Patrick Hofmann, Ein Programm zur interaktiven Visualisierung von Festkörperstrukturen sowie Synthese, Struktur und Eigenschaften von binären und ternären Alkali- und Erdalkalimetallgalliden (Thèse Universitaire), (lire en ligne)
- (en) Bobby D. Ellis et Charles L. B. Macdonald, « Stabilized Arsenic(I) Iodide: A Ready Source of Arsenic Iodide Fragments and a Useful Reagent for the Generation of Clusters », Inorg. Chem., no 43, , p. 5981 (DOI 10.1021/ic049281s, lire en ligne)
- (en) Ulrik K. Klaening, Benon H. J. Bielski et K. Sehested, « Arsenic(IV). A pulse-radiolysis study », Inorg. Chem., no 28, , p. 2717 (DOI 10.1021/ic00313a007, lire en ligne)
- (en) Carsten Lau et Bernhard Neumüller, « Se2NBr3, Se2NCl5, Se2NCl−6: New Nitride Halides of Selenium(III) and Selenium(IV) », Chemistry - A European Journal, no 2, , p. 1373 (DOI 10.1002/chem.19960021108, lire en ligne)
- (en) U. K. Klaning et K. Sehested, « Selenium(V). A pulse radiolysis study », J. Phys. Chem., no 90, , p. 5460 (DOI 10.1021/j100412a112, lire en ligne)
- (en) P. Colarusso et B. Guo, « High-Resolution Infrared Emission Spectrum of Strontium Monofluoride », J. Molecular Spectroscopy, no 175, , p. 158 (DOI 10.1006/jmsp.1996.0019, lire en ligne)
- (en) Matthew R. MacDonald et Joseph W. Ziller, « Synthesis of a Crystalline Molecular Complex of Y2+, [(18-crown-6)K][(C5H4SiMe3)3Y] », J. Am. Chem. Soc., no 133, , p. 15914 (DOI 10.1021/ja207151y, lire en ligne)
- (en) R.S. Ram et N. Rinskopf, « Fourier transform emission spectroscopy and ab initio calculations on NbCl », Journal of Molecular Spectroscopy, no 228, , p. 544 (DOI 10.1016/j.jms.2004.02.001, lire en ligne)
- (en) Robert H. Crabtree, « Chemistry. A new oxidation state for Pd? », Science, no 295, , p. 288 (DOI 10.1126/science.1067921, lire en ligne)
- (en) David C. Powers et Tobias Ritter, « Palladium(III) in Synthesis and Catalysis », Top. Organomet. Chem., no 35, , p. 129 (lire en ligne)
- (en) W.E. Falconer et F.J. DiSalvo, « Dioxygenyl hexafluoropalladate(V) O2+PdF6−: A quinquevalent compound of palladium », Journal of Inorganic and Nuclear Chemistry, no 28, , p. 59 (DOI 10.1016/0022-1902(76)80595-7, lire en ligne)
- (en) Wanzhi Chen et Shigeru Shimada, « Synthesis and Structure of Formally Hexavalent Palladium Complexes », Science, no 295, , p. 308 (DOI 10.1126/science.1067027, lire en ligne)
- (en) N. E. Tran et J. J. Lagowski, « Metal Ammonia Solutions: Solutions Containing Argentide Ions », Inorg. Chem., no 40, , p. 1067 (lire en ligne)
- (en) Sebastian Riedel et Martin Kaupp, « The highest oxidation states of the transition metal elements », Coordination Chemistry Reviews, no 253, , p. 606 (DOI 10.1016/j.ccr.2008.07.014, lire en ligne)
- (en) Arnold M. Guloy et John D. Corbett, « Synthesis, Structure, and Bonding of Two Lanthanum Indium Germanides with Novel Structures and Properties », Inorg. Chem., no 35, , p. 2616 (DOI 10.1021/ic951378e, lire en ligne)
- (en) A.J. Downs, Chemistry of Aluminium, Gallium, Indium and Thallium, Springer Netherlands, , 526 p. (ISBN 978-0-7514-0103-5, lire en ligne)
- (en) Garegin A. Papoian et Roald Hoffmann, « Hypervalent Bonding in One, Two, and Three Dimensions: Extending the Zintl–Klemm Concept to Nonclassical Electron-Rich Networks », Angewandte Chemie International, no 39, , p. 2408 (lire en ligne)
- (de) Michael Boss et Denis Petri, « Neue Barium-Antimonid-Oxide mit den Zintl-Ionen [Sb]3−, [Sb2]4− und 1∞[Sbn]n− / New Barium Antimonide Oxides containing Zintl Ions [Sb]3−, [Sb2]4− and 1∞[Sbn]n− », Zeitschrift für anorganische und allgemeine Chemie, no 631, , p. 1181 (DOI 10.1002/zaac.200400546, lire en ligne)
- (en) P Šimon et F. de Proft, « Monomeric Organoantimony(I) and Organobismuth(I) Compounds Stabilized by an NCN Chelating Ligand: Syntheses and Structures », Angewandte Chemie International Edition, no 49, , p. 5468 (DOI 10.1002/anie.201002209, lire en ligne)
- (en) « Production of Sb(IV) Chloro Complex by Flash Photolysis of the Corresponding Sb(III) and Sb(V) Complexes in CH3CN and CHCl3 », Bulletin of the Chemical Society of Japan, no 73, , p. 1599 (DOI 10.1246/bcsj.73.1599)
- « Tellurium: tellurium iodide »
- (en) Thorsten Heinze et Herbert W. Roesky, « Synthesis and Structure of the First Tellurium(III) Radical Cation », Angewandte Chemie International Edition, no 30, , p. 1677 (DOI 10.1002/anie.199116771, lire en ligne)
- (en) Peter M. Watkins, « Ditellurium decafluoride - A Continuing Myth », Journal of Chemical Education, no 51, , p. 520 (lire en ligne)
- (en) Linus Pauling, General Chemistry, Dover Publications, , 959 p. (ISBN 978-0-486-65622-9, lire en ligne), « Oxygen Compounds of Nonmetallic Elements »
- (en) Ulrik K. Kläning et Knud Sehested, « Laser flash photolysis and pulse radiolysis of iodate and periodate in aqueous solution. Properties of iodine(VI) », J. Chem. Soc., Faraday Trans. 1, no 77, , p. 1707 (DOI 10.1039/F19817701707, lire en ligne)
- (en) B. Guo et K.Q. Zhang, « High-Resolution Fourier Transform Infrared Emission Spectrum of Barium Monofluoride », J. Molecular Spectroscopy, no 170, , p. 59 (DOI 10.1006/jmsp.1996.0019, lire en ligne)
- (en) R. S. Ram et P. F. Bernath, « Fourier Transform Emission Spectroscopy of New Infrared Systems of LaH and LaD », J. Chem. Phys., no 104, , p. 6444 (lire en ligne)
- (en) G. Meyer, « All the Lanthanides Do It and Even Uranium Does Oxidation State +2 », Angewandte Chemie International Edition, no 53, , p. 3550 (DOI 10.1002/anie.201311325, lire en ligne)
- (ru) G.S. Marek et S.I. Troyanov, « Crystal structure and thermodynamic characteristics of monobromides of zirconium and hafnium », Russian Journal of Inorganic Chemistry, no 24, , p. 890
- (en) Jeanette A. Krause et Upali Siriwardane, « Preparation of [Os3(CO)11]2− and its reactions with Os3(CO)12; structures of [Et4N] [HOs3(CO)11] and H2OsS4(CO) », Journal of Organometallic Chemistry, no 454, , p. 263 (DOI 10.1016/0022-328X(93)83250-Y)
- (en) Willie J. Carter et John W. Kelland, « Mononuclear hydrido alkyl carbonyl complexes of osmium and their polynuclear derivatives », Inorganic Chemistry, no 21, , p. 3955 (DOI 10.1021/ic00141a019, lire en ligne)
- « Chemical & Engineering News - Iridium dressed to the nines »
- (de) Yu Gong et Mingfei Zhou, « Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State », Angewandte Chemie International Edition, no 48, , p. 7879 (DOI 10.1002/anie.200902733, lire en ligne)
- (en) Guanjun Wang et Mingfei Zhou, « Identification of an iridium-containing compound with a formal oxidation state of IX », Nature, no 514, , p. 475 (lire en ligne)
- (en) « An experimental proof for negative oxidation states of platinum: ESCA-measurements on barium platinides », Chemical Communications, , p. 838 (DOI 10.1039/b514631c, lire en ligne)
- (en) George B. Kauffman et Joseph J. Thurner, « Ammonium Hexachloroplatinate(IV) », Inorganic Syntheses, no 9, , p. 182 (lire en ligne)
- (en) Xuefang Wang et Lester Andrews, « Mercury Is a Transition Metal: The First Experimental Evidence for HgF4 », Angew. Chem. Int. Ed., no 46, , p. 8371
- (en) Zhen-Chao Dong et John D. Corbett, « Na23K9Tl15.3: An Unusual Zintl Compound Containing Apparent Tl57−, Tl48−, Tl37−, Tl5− Anions », Inorganic Chemistry, no 35, , p. 3107 (DOI 10.1021/ic960014z, lire en ligne)
- (en) Matthias Driess, Molecular Clusters of the Main Group Elements, Wiley, , 444 p. (ISBN 978-3-527-30654-1), « Theory and Concepts in Main-Group Cluster Chemistry »
- (en) Sonja Henkel et Karl Wilhelm Klinkhammer, « Tetrakis(hypersilyl)dithallium(Tl—Tl): A Divalent Thallium Compound », Angew. Chem. Int. Ed., no 33, , p. 681 (lire en ligne)
- Ferro Riccardo, Intermetallic Chemistry, Amsterdam/Oxford, Elsevier, , 786 p. (ISBN 978-0-08-044099-6)
- (en) Iliya Todorov et Slavi C. Sevov, « Heavy-Metal Aromatic Rings: Cyclopentadienyl Anion Analogues Sn56− and Pb56− in the Zintl Phases Na8BaPb6, Na8BaSn6Na8EuSn6 », Inorganic chemistry, no 43, , p. 6490 (DOI 10.1021/ic000333x, lire en ligne)
- (en) Siew-Peng Chia et Hong-Wei Xi, « A Base-Stabilized Lead(I) Dimer and an Aromatic Plumbylidenide Anion », Angew. Chem. Int. Ed., no 52, , p. 6298 (DOI 10.1002/anie.201301954)
- (en) S. M. Godfrey, Chemistry of arsenic, antimony, and bismuth, Springer, (ISBN 0-7514-0389-X)
- (en) Arthur J. Ashe III, « Thermochromic Distibines and Dibismuthines », Advances in Organometallic Chemistry, no 30, , p. 77 (lire en ligne)
- (en) A. I. Aleksandrov et I. E. Makarov, « Formation of Bi(II) and Bi(IV) in aqueous hydrochloric solutions of Bi(III) », Bulletin of the Academy of Sciences of the USSR, Division of chemical science, no 36, , p. 217 (DOI 10.1007/BF00959349)
- (en) John S. Thayer, Relativistic Effects and the Chemistry of the Heavier Main Group Elements, Springer, (ISBN 978-1-4020-9974-8, DOI 10.1007/978-1-4020-9975-5_2)
- (en) L. Stein, « Ionic Radon Solution », Science, no 168, , p. 362 (DOI 10.1126/science.168.3929.362, lire en ligne)
- (en) Kenneth S. Pitzer, « Fluorides of radon and element 118 », J. Chem. Soc., Chem. Commun., no 18, , p. 760 (DOI 10.1039/C3975000760b, lire en ligne)
- (en) A. G. Sykes, Advances in Inorganic Chemistry, Academic Press, , « Recent Advances in Noble-Gas Chemistry »
- (en) J.D. Farr et A.L. Giorgi, « The crystal structure of actinium metal and actinium hydride », Journal of Inorganic and Nuclear Chemistry, no 18, , p. 42 (DOI 10.1016/0022-1902(61)80369-2, lire en ligne)
- (en) Mathias S. Wickleder, Blandine Fourest et Peter K. Dorhout, The Chemistry of the Actinide and Transactinide Elements, vol. 3, Springer, (DOI 10.1007/1-4020-3598-5_3)
- (en) Philip A. Sellers et Sherman Fried, « The Preparation of Some Protactinium Compounds and the Metal », Journal of the American Chemical Society, no 76, , p. 5935 (DOI 10.1021/ja01652a011, lire en ligne)
- (en) A. G. Sykes, Advances in Inorganic Chemistry, vol. 34, Academic Press, , 393 p. (ISBN 0-12-023634-6)
- (en) A. L. Bowman et G. P. Arnold, « The crystal structure of UC2 », Acta Crystallographica, no 21, (DOI 10.1107/s0365110x66003670, lire en ligne)
- (en) R. A. Kent, « Mass spectrometric studies of plutonium compounds at high temperatures. II. Enthalpy of sublimation of plutonium(III) fluoride and the dissociation energy of plutonium(I) fluoride », J. Am. Chem. Soc., no 90, , p. 5657 (DOI 10.1021/ja01023a002, lire en ligne)
- (ru) Yu. M. Kiselev et M. V. Nikonov, « On the existence of plutonium tetroxide », Doklady Physical Chemistry, no 425, , p. 73 (DOI 10.1134/S0012501609040022, lire en ligne)
- (en) M. V. Nikonov et Yu. M. Kiselev, « Americium volatility from ozonized alkaline solutions », Radiochemistry, no 56, , p. 11 (lire en ligne)
- (en) V. P. Domanov et Yu. V. Lobanov, « Formation of volatile curium(VI) trioxide CmO3 », Radiochemistry, no 53, , p. 453 (lire en ligne)
- (en) V. P. Domanov, « Possibility of generation of octavalent curium in the gas phase in the form of volatile tetraoxide CmO4 », Radiochemistry, no 55, , p. 46 (lire en ligne)
- (en) Andréi Zaitsevskii et W. H. Eugen Schwarz, « Structures and stability of AnO4 isomers, An = Pu, Am, and Cm: a relativistic density functional study », Phys Chem Chem Phys., no 16, , p. 8997 (lire en ligne)
- (en) A. G. Sykes, Advances in Inorganic Chemistry, vol. 28, Academic Press, , « Recent Advances in Noble-Gas Chemistry »
- (en) P.D. Kleinschmidt, « Thermochemistry of the actinides », Journal of Alloys and Compounds, no 213, , p. 169 (lire en ligne)
- (en) Andreas Türlera et Robert Eichler, « Chemical studies of elements with Z ⩾ 104 in gas phase », Nuclear Physics A, no 944, , p. 640 (lire en ligne)
- (en) S. Hübener et S.Tau, « Physico-chemical characterization of seaborgium as oxide hydroxide », Radiochim. Acta, no 89, , p. 737 (DOI 10.1524/ract.2001.89.11-12.737)
- « Gas chemical investigation of bohrium (Bh, element 107)", Eichler et al., GSI Annual Report 2000 »
- (en) Ch. E. Düllmann et W. Brüchle, « Chemical investigation of hassium (element 108) », Nature, no 418, , p. 859 (lire en ligne)
- (en) Irving Langmuir, « The Arrangement of Electrons in Atoms and Molecules », J. Am. Chem. Soc., no 41, , p. 868 (lire en ligne)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « List of oxidation states of the elements » (voir la liste des auteurs).
Article connexe
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.