Maladie d'Alzheimer
La maladie d'Alzheimer (en allemand [alt͡shaɪ̯mɐ]) est une maladie neurodégénérative incurable à ce jour du tissu cérébral qui entraîne la perte progressive et irréversible des fonctions mentales et notamment de la mémoire. C'est la cause la plus fréquente de démence chez l'être humain.
| Causes | Inconnu (d) |
|---|---|
| Symptômes | Perte de mémoire qui perturbe la vie quotidienne (d), désorientation dans le temps et dans l’espace (d), difficulté à planifier ou à résoudre des problèmes (d), difficulté à exécuter les tâches familières à la maison, au travail ou durant les loisirs (d), difficultés à interpréter les images et évaluer les distances (d), altération du jugement (d), désengagement du travail ou des activités sociales (d), problèmes d'expression orale ou écrite (d), changements d'humeur et de la personnalité (d), objets égarés et perte de la capacité à reconstituer un parcours (d) et démence |
| Traitement | Mémantine, donépézil, rivastigmine, galantamine et physostigmine |
|---|---|
| Médicament | Quétiapine, aripiprazole, galantamine, donépézil, rispéridone, mémantine, rivastigmine, rivastigmine, mémantine et pyritinol (en) |
| Spécialité | Neurologie |
| CISP-2 | P70 |
|---|---|
| CIM-10 | G30, F00 |
| CIM-9 | 331.0, 290.1 |
| OMIM | 104300 |
| DiseasesDB | 490 |
| MedlinePlus | 000760 |
| eMedicine | 1134817 |
| MeSH | D000544 |
| GeneReviews | alzheimer |
| Patient UK | Alzheimers-disease |
![]() Mise en garde médicale
Mise en garde médicale
En 2015, il y a approximativement 48 millions de personnes dans le monde atteintes de la maladie d'Alzheimer[1]. Le plus souvent, la maladie débute chez les personnes ayant plus de 65 ans ; seuls 4 % à 5 % des cas d'Alzheimer commencent avant cet âge[2]. Environ 6 % des personnes de 65 ans et plus sont touchées, mais ces chiffres diffèrent en fonction des pays. En 2010, la démence causée par la maladie a provoqué environ 486 000 morts dans le monde[3].
Dans les pays développés, c'est l'une des maladies les plus coûteuses pour la société[4] - [5].
Face à la prévalence de la maladie, des efforts de recherche médicale visent à développer des médicaments capables de stopper le processus neurodégénératif. Les pistes principales sont de s'attaquer aux plaques amyloïdes qui se forment entre les neurones durant la maladie et aux agrégats de protéines tau formant les dégénérescences neurofibrillaires à l'intérieur des neurones[6].
Histoire

Ce n'est qu'en 1907 qu'Alois Alzheimer (1864-1915), un psychiatre et neuropathologiste allemand, publia le premier cas de la maladie qui portera son nom, chez une patiente de 51 ans, Auguste Deter (en). Il suivit son cas jusqu'à sa mort en 1906 et décrivit les altérations anatomiques observées sur son cerveau. Durant les cinq années suivantes, onze cas similaires furent rapportés dans la littérature médicale, certains employant déjà le terme de maladie d'Alzheimer[7].
Les caractéristiques particulières de la maladie furent isolées pour la première fois par le psychiatre Emil Kraepelin (1856-1926), après le retrait de certains symptômes présents dans le cas initial d'Auguste D. (délire, hallucination et artériosclérose)[8]. Il inclut cette toute nouvelle maladie d'Alzheimer, qu'il appela également démence présénile, comme un sous-type des démences séniles dans son manuel de psychiatrie publié en 1910[9].
Durant la majeure partie du XXe siècle, le diagnostic de maladie d'Alzheimer fut réservé aux individus âgés de 45 à 65 ans qui développaient des démences. Le terme de démence sénile de type Alzheimer fut utilisé durant un certain temps pour décrire les cas d'Alzheimer supérieur à 65 ans, et Alzheimer classique ceux plus jeunes.
En 1977, lors d'une conférence sur la maladie d’Alzheimer, il est conclu que les manifestations cliniques et pathologiques des démences séniles et pré-séniles étaient identiques, bien que les auteurs n’excluent pas qu'elles aient des origines différentes[10]. Cela aboutit à un diagnostic de Maladie d'Alzheimer indépendant de l'âge[11].
Finalement, le terme unique de maladie d'Alzheimer fut formellement adopté dans la nomenclature médicale pour décrire les individus de tout âge présentant un ensemble particulier de symptômes, de progression dans le temps et de caractéristiques neuropathologiques[12].
L'après-baby boom (ou papy boom), la maitrise de la fécondité et le progrès médical conduisent les sociétés à devoir vivre une période où les personnes âgées seront très nombreuses. Cette maladie fait donc l'objet d'une attention particulière, notamment en France avec l'observatoire national sur la recherche sur la maladie d'Alzheimer (ONRA)[13].
En 2009, la maladie d'Alzheimer correspond à plus de la moitié des cas de démence de la personne âgée dans les pays riches.
Stades d'évolution
La démence est un syndrome dans lequel on observe une dégradation de la mémoire, du raisonnement, du comportement et de l’aptitude à réaliser les activités quotidiennes[14].
Critères de démence
Les critères de démence du DSM-IV reposent sur l'installation de troubles intellectuels portant de manière partielle ou complète sur :
- la mémoire : amnésie des faits récents puis anciens ;
- des troubles des fonctions exécutives : faire des projets, organiser, ordonner dans le temps, avoir une pensée abstraite ;
- une aphasie : perturbation du langage (manque du mot) ;
- une apraxie : altération de la capacité à réaliser une activité motrice malgré des fonctions motrices intactes (difficulté à s'habiller) ;
- une agnosie : impossibilité de reconnaître ou d’identifier des objets malgré des fonctions sensorielles intactes.
Ces troubles ont un retentissement socioprofessionnel. Leur évolution se fait de manière progressive et irréversible (déclin continu).
Signes précurseurs
On peut retrouver des signes précurseurs de la maladie d'Alzheimer jusqu'à 12 ans avant le diagnostic[15].
La maladie d'Alzheimer débute habituellement par des troubles de la mémoire. Certains patients remarquent que leur mémoire fonctionne moins bien qu'autrefois et consultent leur médecin pour cela. Chez d'autres patients, c'est l'entourage qui remarque les difficultés de mémoire. Les symptômes liés à la mémoire (plainte mnésique) ne sont cependant pas spécifiques de la maladie d'Alzheimer (voir diagnostics différentiels).
La maladie peut aussi se manifester par d'autres symptômes comme une dépression, une perte d'indépendance fonctionnelle (nécessité d'une aide humaine dans les gestes de la vie quotidienne), des chutes répétées, une diminution de l'orientation spatiale[16] - [17] - [18], un amaigrissement ou encore des troubles du comportement. Une étude publiée en a permis d'identifier dix pathologies significativement plus fréquentes chez les malades d’Alzheimer dans les deux à dix ans précédant le diagnostic que chez des témoins du même âge : dépression, anxiété, troubles de l’adaptation au stress, perte d’audition, constipation, spondylarthrose cervicale, pertes de mémoire, fatigue et malaises, chutes, perte de poids[19].
La maladie évolue en quatre étapes, avec une progression caractéristique de troubles cognitifs.
Pré-démentiel

Les premiers symptômes sont souvent confondus avec les effets normaux du vieillissement ou du stress[20] . Ce sont d'abord les activités complexes de la vie quotidienne qui sont affectées[21].
Le déficit le plus notable est la perte de mémoire des faits récemment appris et une difficulté à acquérir de nouvelles informations[22] - [23]. Des problèmes apparaissent au niveau des fonctions exécutives comme l'attention, la planification, la flexibilité et l'abstraction ou des défauts de mémoire sémantique (mémoire du sens des mots et des concepts) [22]. Une apathie peut être observée dès ce stade et reste le symptôme le plus persistant à travers l'évolution de la maladie[24].
Cette caractéristique de la maladie est également appelée trouble cognitif léger[23]. Cependant, le fait qu'il corresponde avec certitude au premier stade de la maladie d'Alzheimer reste controversé[25].
Léger
L'évolution des symptômes participe à la confirmation du diagnostic, notamment avec l’aggravation des troubles de la mémoire, des difficultés d'apprentissage et le besoin d'aide dans l'accomplissement des tâches de la vie quotidienne. Chez certains malades, des symptômes autres que mémoriels apparaissent et révèlent la maladie : troubles du langage, des fonctions exécutives, de l'identification (agnosie) ou encore d'exécution des mouvements (apraxie)[26].
La maladie d'Alzheimer n'affecte pas de façon égale toutes les formes de mémoire. En effet, étant contrôlées par des structures cérébrales différentes, elles ne sont pas détériorées à la même vitesse par la maladie.
L'atteinte de la mémoire épisodique (création et gestion des souvenirs de la vie de la personne) est le trouble le plus précoce et le plus marqué dans la maladie d'Alzheimer, notamment avec des difficultés lors des étapes d'encodage, de stockage, de récupération des informations. Ces troubles peuvent être évalués avec le test de Gröber et Buschke[27].
La mémoire sémantique (les faits appris, comme « Rome est la capitale de l'Italie ») et la mémoire implicite (mémoire des gestes, comme faire du vélo) sont moins affectées au stade léger[28] - [29].
Le langage
Les problèmes de langage (aphasie) sont caractérisés pour l'essentiel à ce stade par un « manque du mot » (ou aphasie léthologique), à l'origine d'un appauvrissement du vocabulaire et de la fluidité du discours ainsi que de l'expression orale et écrite[26] - [30]. À ce stade, la personne touchée par la maladie d'Alzheimer est cependant toujours capable de communiquer des idées simples de manière adéquate[26] - [30] - [31].
La motricité
De même, bien que la personne reste capable de réaliser des tâches motrices fines, comme l'écriture, le dessin ou l'habillage, certaines difficultés apparaissent dans la coordination et la planification des mouvements (apraxie)[26]. Au stade léger de la maladie, la personne reste indépendante lors des tâches courantes, mais va requérir de l'assistance ou de la supervision pour les activités complexes[26].
Modéré
La détérioration progressive des différentes fonctions cognitives conduit finalement au début de la dépendance lorsque le sujet n'est plus capable de réaliser seul les activités les plus courantes[26]. Les difficultés du langage deviennent évidentes lorsque l'incapacité à se rappeler le vocabulaire (aphasie léthologique) conduit le patient à effectuer des substitutions incorrectes de mots (paraphasie) de plus en plus fréquentes. Les capacités de lecture et d'écriture se perdent progressivement[26] - [31]. Les séquences motrices complexes deviennent moins coordonnées, ce qui augmente les risques de chutes[26]. À ce stade, les problèmes de mémoire s'aggravent et la personne peut commencer à ne plus reconnaître ses proches[26]. La mémoire à long terme, jusque-là épargnée, commence à se détériorer[26].
Les changements comportementaux et neuropsychiatriques apparaissent. Les manifestations classiques sont des errements, de l'irritabilité et une labilité émotionnelle qui conduit à des pleurs, des poussées d'agressivité soudaines ou de la résistance irrationnelle au soin[26]. Des périodes de grande confusion apparaissent, notamment au coucher du soleil également appelé syndrome crépusculaire (la luminosité influant sur le caractère)[32]. Environ 30 % des patients Alzheimer développent des symptômes délirants et notamment des délires de changements d'identité[26]. Les patients perdent également la conscience de leur maladie et des limitations qu'elle entraîne (anosognosie)[26]. Enfin, ils peuvent souffrir d'incontinence urinaire[26]. Ces différents symptômes peuvent créer un stress important chez les proches et l'aide soignant, stress qui peut être réduit en passant d'un soin à domicile au placement en maison de soin spécialisée[26] - [33].
Avancé
Durant la phase finale de la maladie d'Alzheimer, le patient est complètement dépendant du personnel de soin[26] et des aidants. Le langage est réduit à quelques phrases simples ou même seulement à des mots, ce qui conduit finalement à une perte complète de la parole[26] - [31]. Les personnes perçoivent encore les émotions de leur vis-à-vis et sont capables d'y répondre par des signes émotionnels[26]. Une certaine agressivité peut encore être présente, mais le plus souvent les conséquences de la maladie sont une extrême apathie couplée à un état de fatigue constant[26].
Les patients les plus avancés ne sont plus capables d'effectuer la moindre tâche motrice sans assistance[26]. La musculature et la mobilité sont détériorées au point que le patient reste alité et ne peut plus se nourrir seul[26]. La maladie d'Alzheimer est une maladie terminale, mais la cause de la mort est souvent due à un facteur externe, comme une infection, des escarres ou une pneumonie, plutôt que la maladie elle-même[26].
Causes

Lors de la maladie d'Alzheimer, le cerveau est victime d'un double processus de dégénérescence et d’inflammation. Au niveau cellulaire, il est atteint par deux types de lésions, chacune causée par une accumulation de protéines qui entraîne un dysfonctionnement des neurones :
- au niveau extracellulaire, l'accumulation du peptide β-amyloïde provoque la formation des plaques amyloïdes ;
- au niveau intracellulaire, l'accumulation de protéine Tau entraîne la formation de neurofibrilles[34].
Les progressions différentes de ces deux types de lésion participent à une lésion plus globale du cerveau générant une atrophie de certaines parties du cortex.
Plaque amyloïde
_presenile_onset.jpg.webp)
Origine
Les plaques amyloïdes correspondent à l'accumulation extracellulaire d’un peptide appelé « β-amyloïde » ou « peptide Aβ42 » (42, parce que constituée de quarante-deux acides aminés). Cette protéine est une forme clivée anormale d'une glycoprotéine membranaire appelée « protéine précurseur de la protéine β-amyloïde » (ou APP pour Amyloïd Protein Precursor). C'est une enzyme, la β-secretase, qui provoque, pour des raisons encore mal comprises, le clivage anormal de la protéine APP. En temps normal cette protéine de la membrane des neurones est clivée par des secretases en peptide P3 non toxique.
L'apparition de plaque amyloïde est due au vieillissement normal. L'accumulation anormale sous-jacente à la maladie d'Alzheimer reste cependant inexpliquée.
Le peptide Aβ42 est un peptide insoluble qui ne peut être dégradé efficacement par les cellules environnantes. Il s'accumule dans le milieu extracellulaire, formant des plaques séniles qui compriment les neurones. Le peptide β-amyloïde est donc une protéine neurotoxique. Il s'agit d'un peptide anti-microbien[35], ce qui pourrait être le signe de la présence d'une infection[36]. Ceci doit être mis en relation avec le fait qu'on a découvert un microbiote également dans le cerveau[37]. En effet, certains types de en:Gamma secretase, produits par les astrocytes (cellules gliales)[38] - [39] - [40] - [41], génèrent certaines formes de Bêta-amyloïde (42.a.a ou Aβ42) qui s’agrègent[42]. On trouverait un mécanisme semblable dans les formes héréditaires[43] de la maladie, par modification de la Préséniline 1 qui est un constituant de la gamma secrétase. Des études ont montré une modification du microbiote des malades avec une surabondance de bactéries inflammatoires comme Escherichia/Shigella[44].
Localisation et progression
Les plaques amyloïdes sont principalement localisées dans le néocortex et l'hippocampe. Au niveau du lobe pariétal, une région associative impliquée dans les circuits de la mémoire, les plaques amyloïdes et l'accumulation du peptide Aβ42 corrèlent significativement avec les symptômes cognitifs de la maladie d'Alzheimer[45] - [46].
Mécanismes pathologiques
La présence de plaques amyloïdes entraîne un dysfonctionnement des neurones environnants, puis la mort neuronale par apoptose ou par nécrose.
Les plaques séniles libèrent du peroxyde d'hydrogène (H2O2), et entraînent un stress oxydant sur les neurones environnants. En présence d'un ion métallique (tels que le cuivre et le fer, tous deux présents dans le cerveau), des radicaux libres (OH°, hydroxyles) sont produits (par la réaction de Fenton). Ces radicaux libres vont arracher des atomes d'hydrogène à la membrane plasmique du neurone (composée de molécules carbonées présentant de nombreux atomes d'hydrogène). L'intégrité de la membrane plasmique est altérée et devient plus perméable aux petites molécules radicalaires. La membrane laisse pénétrer d'autres radicaux libres qui s'attaqueront à l'ADN du neurone, entraînant la destruction des fonctions de la cellule privée d'information génétique. La membrane étant abîmée par les radicaux libres, les ions calcium et des fragments ß-amyloïdes vont également pénétrer dans la cellule et activer les phosphokinases à calcium (PKC) dont le rôle est d'éliminer la membrane neuronale abîmée. La PKC suractivée va éliminer des portions de membrane saines et accélérer le processus de destruction. Les radicaux libres et les fragments d'Aß42 vont ainsi pénétrer en surnombre dans le corps du neurone, affecter son fonctionnement et contribuer à l'apoptose.
D'autre part, le stress oxydatif provoque une réaction inflammatoire par le recrutement de la microglie qui va accélérer la destruction des neurones.
Dégénérescences neurofibrillaires


La protéine tau est une macromolécule essentielle à la stabilité de la tubuline, protéine constituant majoritairement l'assemblage des microtubules qui forment le cytosquelette des axones. Les protéines Tau se positionnent perpendiculairement à l'axone et assurent la rigidité des microtubules et le bon transport axonal.
Des protéines Tau se détachent périodiquement des microtubules, mais sont remplacées et rapidement dégradées chez le sujet sain. La maladie d'Alzheimer est caractérisée par des protéines Tau se détachant des microtubules et restant dans le milieu intracellulaire. Elles ne sont pas toutes dégradées et vont donc s'agréger, formant des neurofibrilles. Trop de neurofibrilles bloquent le fonctionnement du neurone car elles ne permettent pas l'activité de l'axone. Les neurofibrilles compriment le neurone et provoquent une mort neuronale par apoptose.
L'accumulation des protéines Tau et l'enchevêtrement neurofibrillaire sont liés à l'apparition de manifestations cognitives tels que les symptômes de démences[45].
Il existe plusieurs explications au détachement des protéines Tau, la principale reposant sur un problème de phosphorylation. La protéine tau possède 85 sites potentiels de phosphorylation. Lorsqu'elle est peu phosphorylée, elle va favoriser la polymérisation des dimères de tubuline en microtubules. À l'inverse, quand elle est très phosphorylée, elle ne peut pas s'attacher aux microtubules. Dans la maladie d'Alzheimer, les protéines Tau seraient hyperphosphorylées. Elles se détachent, s'agrègent en paires de filaments appariées en hélice pour former des neurofibrilles. La cause de l'augmentation de la phosphorylation est inconnue. Une hypothèse avance que les radicaux libres, dus à la présence de plaques amyloïdes, détériorent la paroi membranaire des axones et laissent ainsi pénétrer des ions calcium qui vont sur-activer des kinases et conduire à la phosphorylation des protéines tau. Ces protéines vont donc être hyperphosphorylées et changer de conformation.
Mécanismes pathologiques
Atrophie corticale
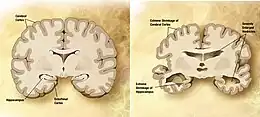
La maladie d'Alzheimer est caractérisée par une perte de neurones et de synapses dans le cortex cérébral et certaines régions subcorticales. Cette perte anormale entraîne une atrophie des régions affectées, incluant le lobe temporal, pariétal et une partie du Lobe frontal et du gyrus cingulaire[49]. Le cerveau peut ainsi perdre 8 à 10 % de son poids tous les dix ans, contre 2 % chez un sujet sain. L'atrophie corticale s'accompagne d'une dilatation des ventricules cérébraux et des sillons corticaux ainsi que d'une perte neuronale affectant particulièrement le système cholinergique (noyau basal de Meynert, septum, cortex entorhinal, amygdale et hippocampe).
Les études utilisant l'IRM et le PET scan ont documenté une réduction de certaines régions spécifiques chez les personnes atteintes de la maladie d'Alzheimer lorsqu'elles progressent d'un trouble cognitif léger vers une maladie d'Alzheimer, en comparaison des images de sujets sains âgés[50] - [51].
Effets des lésions selon la localisation
Selon les endroits touchés par les lésions causées par la démence d'Alzheimer, les résultats seront différents :
- l'atteinte de l'hippocampe joue sur les processus de mémorisation : enregistrement, restitution et organisation des souvenirs;
- les lésions au lobe frontal occasionnent des troubles des fonctions exécutives[52];
- les lésions au cortex postérieur provoquent aphasie, agnosie et apraxie ;
- l'atteinte du système limbique a des conséquences sur les émotions, les liens entre souvenirs et comportements, le sommeil et l'appétit[52] ;
- les lésions à la formation réticulée occasionnent des problèmes de vigilance et des troubles du sommeil.
Diagnostic
Actuellement, il n'est pas recommandé de recourir au dépistage de la maladie, c'est-à-dire à la recherche de la maladie chez des personnes qui n'ont aucun symptôme[53]. En effet, en l'absence de traitement curatif, cette stratégie n'est pas pertinente au plan de la santé publique. Par contre, il est recommandé de reconnaître la maladie chez des personnes qui ont des symptômes ou des signes évocateurs. Il est alors question de détection et de diagnostic.
Avant 2007 un diagnostic de certitude ne pouvait être établi qu’uniquement en post-mortem, grâce à l’étude anatomo-pathologique du cerveau. Grâce aux avancées de la recherche et de la technologie, un diagnostic non équivoque de maladie d’Alzheimer du vivant du patient est possible[54].
Il faut noter d'autre part que des examens cérébraux post mortem peuvent attester d’un stade avancé de la maladie d'Alzheimer, sans que les malades n'aient présenté de signes cliniques de type altération cognitive. Ces observations ont entraîné le développement du concept de réserve cognitive (en), qui influe sur le profil d'évolution des signes cliniques : absence de signes au début de la maladie puis accélération rapide passé un « seuil » pour les personnes dotées d'une forte réserve[55].
Par le généraliste
Le médecin généraliste évalue si les symptômes ne sont pas le signe d'une autre pathologie puis il propose un dépistage. Si les troubles cognitifs sont avérés, il réoriente le patient vers un centre mémoire spécialisé. Il peut utiliser les tests de diagnostics suivants :
- Le MMSE (Mini Mental State Evaluation, ou Test de Folstein) est le test le plus répandu et celui recommandé par la Haute Autorité de santé[56]. Il comporte 18 questions ou tâches et il est réalisable en 15 minutes environ. Il fournit un score variant de 0 à 30 points : un score inférieur à 24 sur 30 est suspect de démence ; un score de 28 ou plus est normal. Ce résultat doit cependant être interprété selon le niveau éducatif du patient car un haut niveau peut améliorer le score et donc fausser le test (quel est son dernier diplôme obtenu, quel est son (ancienne) activité professionnelle). Il faudra s'assurer de l'absence de confusion avant sa réalisation. Il est recommandé de ne pas faire ce test dès l'arrivée des patients dans le service mais à distance de quelques jours.
- Le test Codex[57] : ce test réalisable en 3 minutes combine une épreuve de mémoire et un test de l'horloge : ces éléments forment un arbre de décision complété pour certains patients par des questions sur l'orientation spatiale. Il est redondant avec certains autres tests (réalisés en routine en gériatrie hospitalière) mais il est plus rapide et particulièrement adapté à la médecine de ville.
- Le « test de l'horloge »[58] : il consiste à faire dessiner à la personne le cadran d'une montre. On demande au patient d'indiquer une heure choisie par l'examinateur. Par exemple, mettez une petite aiguille et une grande aiguille pour indiquer cinq heures moins le quart. Il est réalisable en 2 minutes environ.
- Le « test des 5 mots » de Dubois[59] : ce test évalue la mémoire en distinguant les processus d'encodage et de rappel.
- D'autres tests peuvent également être réalisés en pratique courante : le MoCA[60], les fluences verbales
En centre spécialisé
Le diagnostic de la maladie d’Alzheimer en centre spécialisé est réalisé en deux étapes :
Première étape : Rechercher l’existence de troubles des fonctions cognitives et/ou constater l’existence d’un syndrome démentiel par un bilan neuropsychologique[54].
Il détermine les troubles cognitifs du patient à travers une série de tests dont :
- le test de Gröber et Buschke pour explorer la mémoire[61] ;
- le test Trail Making Test[62], pour explorer les fonctions exécutives et l'attention ;
- le test de Stroop pour explorer l'attention[63] ;
- les tests de dénomination, pour explorer le langage ;
- la copie de figures complexes (ex. : la figure complexe de Rey).
Il évalue la mémoire, l’orientation dans le temps et dans l’espace, le raisonnement, le langage, la compréhension et l’attention. Ces tests permettent de distinguer des patients atteints d’une maladie d’Alzheimer, même à un stade très précoce, des personnes saines puis des patients atteints de démence.
Deuxième étape : Rechercher des signes spécifiques.
- L’Imagerie par Résonance Magnétique (IRM) :
L’IRM permet de détecter une atrophie corticale, notamment une atrophie des hippocampes. Elle permet par ailleurs d’éliminer d’autres causes de démences telles que la présence de lésions vasculaires, d’une tumeur cérébrale ou d’un hématome.
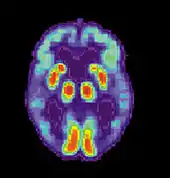
- La Tomographie par émission de positons (TEP)
Elle permet de mettre en évidence un hypo-métabolisme (c’est-à-dire un fonctionnement moins efficace du cerveau) et de visualiser les lésions cérébrales caractéristiques de la maladie, notamment les plaques amyloïdes.
- La Ponction Lombaire (PL)
Elle permet le dosage dans le liquide céphalo-rachidien de marqueurs biologiques spécifiques de la maladie d’Alzheimer (protéines tau et tau phosphorylées, peptide béta-amyloïde). Cet examen est demandé de plus en plus fréquemment car il constitue un apport important à l’hypothèse diagnostique.
- Les examens de laboratoire
Les analyses de sang et d’urine permettent de dépister des pathologies pouvant entraîner des troubles cognitifs rapidement réversibles avec la mise en place d’un traitement adapté (carence en vitamine, en hormone, infection…). Les dosages de la vitamine B12 et B9 ainsi qu’un bilan thyroïdien sont utiles pour exclure d’autres causes de démence[54].
- la tomographie par émission monophotonique (TEMP) utilise aussi des marqueurs de perfusion ou du métabolisme cérébral. Cette imagerie fonctionnelle est utile pour le diagnostic étiologique des démences, lorsque les données cliniques ou d'imagerie IRM ne suffisent pas à poser le diagnostic. En particulier, la TEMP est utile pour identifier les démences frontotemporales. La TEMP peut aussi être réalisée avec des traceurs du système dopaminergique : c'est le Dat-scan, un autre examen d'imagerie isotopique utile pour différencier la maladie d'Alzheimer de la démence à corps de Lewy, une autre démence dégénérative. Dans cette maladie, il y a une hypofixation du traceur au niveau du striatum (zone de fixation normale pour cet examen). La Dat-scan utilise un traceur fixant spécifiquement les transporteurs de la dopamine marquée à l'iode 123.-
Autres possibilités de diagnostic
En France, le laboratoire GIPSA-lab travaille sur un robot capable de reconnaître les signes de la maladie lors d'un face-à-face avec une personne[64]. En , le magazine économique américain Forbes place ce robot prénommé Nina par les chercheurs parmi dix robots humanoïdes incroyablement réalistes dans le monde en retenant que son apprentissage en profondeur lui permet de corriger lui-même ses erreurs et qu'il utilise le contact visuel comme moyen de communication[65].
Diagnostics différentiels
La troisième étape du diagnostic est un bilan pour écarter les pistes de d'autres conséquences qui pourraient être causées par les symptômes relevés. Ces trois étapes permettent d'établir un diagnostic qui établit si le patient a la maladie d'Alzheimer ou non.
On peut évoquer le diagnostic de maladie d'Alzheimer dans de nombreuses situations différentes. Néanmoins de nombreuses autres maladies ou conditions peuvent expliquer certains symptômes et doivent être écartées avant d'établir de manière certaine le diagnostic de maladie d'Alzheimer.
- Au stade initial de la maladie, un oubli bénin, un trouble cognitif léger (mild cognitive impairment, MCI)).
- Troubles cognitifs liés aux médicaments (iatrogènes) : prise de benzodiazépines, médicaments à effet anticholinergique (antidépresseurs tricycliques, antihistaminiques de première génération, antispasmodiques anticholinergiques, neuroleptiques phénothiaziniques).
- Les troubles anxieux ou la dépression peuvent également entraîner des pertes de mémoire sans gravité. Cependant, ces troubles sont parfois associés à la maladie d'Alzheimer et un traitement d'épreuve par antidépresseur peut aider au diagnostic.
- Le syndrome d'apnées du sommeil peut-être évoqué devant des ronflements, une somnolence et un surpoids. Un bilan spécialisé en centre du sommeil avec une prise en charge adaptée peut améliorer les troubles de la mémoire.
- Le syndrome confusionnel.
- Tout trouble d'origine métabolique (hypoglycémie, hyponatrémie, hypothyroïdie) ou toxique (drogues, alcool).
Une fois le diagnostic de démence posé, une évaluation cognitive globale, fonctionnelle, thymique et comportementale en centre mémoire spécialisé va permettre de poser le diagnostic étiologique de la démence[66] :
- Maladie d'Alzheimer.
- D'autres formes de démences d'origine dégénératives comme la démence à corps de Lewy, les démences associées à la maladie de Parkinson, la démence frontotemporale (avec ses variantes : démence sémantique et aphasie primaire progressive), la maladie de Huntington, la paralysie supranucléaire progressive, la maladie de Creutzfeldt-Jakob, l'atrophie corticale postérieure.
- Démences non dégénératives comme la démence vasculaire, la démence traumatique, l'hydrocéphalie à pression normale, les démences métaboliques ou infectieuses…
- L'association d'un tableau évoquant la maladie d'Alzheimer avec des signes cliniques et/ou radiologiques de lésions cérébrales d'origine vasculaire est en faveur d'une démence mixte.
Facteurs de risque
Le premier facteur de risque reste avant tout l'âge (supérieur à 65 ans), ce qui fait de la maladie d'Alzheimer une maladie du vieillissement. Dans les formes non familiales, le principal facteur génétique est l'allèle ε4 du gène de l'apolipoprotéine E, surtout s'il est présent à l'état homozygote[67]. Cependant, l'utilisation du génotypage dans la pratique courante ou le dépistage n'est pas recommandé à ce jour du fait de l'absence de prise en charge spécifique. Voir génétique. La petite taille, surtout chez les hommes, semble corrélée à un risque plus élevé de contracter la maladie[68] - [69]. Une consommation excessive d'alcool doublerait également les risques de développer la maladie d'Alzheimer[70].
Facteurs de risque cardiovasculaires
Les maladies cardiovasculaires relativement précoces (à partir du milieu de vie)[71] - [72] - [73] - [74] peuvent être un facteur de risque.
Un traitement contre l'hypertension artérielle limite le risque de mourir précocement, mais aussi celui d'être admis pour une longue durée dans un centre de soins (risque diminué de 49 %), pour des raisons encore incomprises. De manière générale, l'hypertension est un facteur de risque de démence[75]. Certains se demandent même si la maladie d’Alzheimer n'est pas une maladie vasculaire plutôt que neurodégénérative[76], notamment liée à une hypoperfusion cérébrale[77] et à une mauvaise irrigation du cerveau[78], comme dans d'autres formes de démence peut-être[79].
L'hypercholestérolémie[80] est également un facteur de risque. Un régime riche en acides gras polyinsaturés oméga-3 et omega-6, et pauvre en acides gras saturés pourrait à l'inverse diminuer le risque de développer la maladie d'Alzheimer[81]. Par contre, aucun bénéfice d'un traitement avec des oméga-3 n'a été détecté lorsque la maladie est déjà présente[82]. Toutefois, selon une étude scientifique de 2010 une supplémentation de la variante d'oméga-3 spécifique dite EPA (acide eïcosapentaènoïque) est associée à une diminution de l'atrophie de l'amygdale (région du cerveau), et action physique sur le cerveau[83].
Facteurs de risques métaboliques
Le diabète est un facteur de risque. Les diabétiques courent un risque environ deux fois plus élevé d'être concerné par la démence vasculaire ou la maladie d'Alzheimer que le reste de la population[84]. Même pour les non-diabétiques un taux élevé de glucose élève significativement le risque[85].
Facteurs de risques viraux
Depuis plus de 30 ans, le professeur Ruth Itzhaki multiplie les études sur les virus, en particulier le virus de l'herpès commun HSV-1, soupçonnés d'être impliqués dans la maladie d'Alzheimer[86].
Ruth Itzhaki pense que le virus de la Covid-19 SARS-CoV-2, comme le virus de la varicelle VZV, augmentent le risque de maladie d'Alzheimer en réactivant le HSV-1 latent dans le cerveau. Les porteurs du gène ApoE4 semblent particulièrement vulnérables. Des neurologues de 25 pays ont mis en place le Consortium de l'Alzheimer's Association[87] pour étudier les séquelles neuropsychiatriques chroniques de l'infection par le Sars-Cov-2[88].
Autres
D'autres facteurs de risque de la maladie d'Alzheimer ont été évoqués[89], parmi lesquels des antécédents personnels de dépression[90]. Une méta-analyse met en avant la faiblesse physique comme facteur de risque[91]. Les blessures à la tête et les traumatismes crâniens augmentent un peu le risque[92] - [93].
Facteurs de risque comportementaux
Le tabagisme augmenterait sensiblement le risque de survenue de la maladie d'Alzheimer[94].
L'inactivité physique a été longuement étudiée et semble pouvoir être retenue parmi les facteurs de risque[95].
Une étude suggère un lien entre la consommation d'acide gras trans et l'apparition de la maladie d'Alzhzeimer[96].
D'autres facteurs de risque de la maladie d'Alzheimer ont été évoqués[89], parmi lesquels un niveau socioculturel bas[97].
Facteurs de risque médicamenteux
L'usage des anxiolytiques[98] (en particulier des benzodiazépines[99]) et des somnifères[100] augmenterait le risque de survenance de la maladie d'Alzheimer. Le risque serait majoré de 20 % à 50 %.
Mise en cause de l'aluminium
L'aluminium est suspecté à partir des années 1990 comme cause ou comme l'une de causes de cette maladie. Cette suspiscion est alimentée par le fait que des dépôts d'aluminium sont retrouvés par certaines études dans le cerveau des victimes de la maladie d'Alzheimer, et par le fait que sur le modèle animal il induit des lésions neurologiques proches (dégénérescence des neurofibrilles, agrégats de protéine-Tau…) arguments retenus par exemple par Crapper et al. en 1973[101] - [102] et 1976[103] puis par Trapp & al. en 1978[104] ; Scott & al. en 1993[105] ; Kawahara & al. en 1994[106] ; Chong & Suh en 1995[107]. En outre sa teneur augmente dans le système nerveux avec l'âge, tout comme le risques d'apparition de la maladie d'Alzheimer notaient Mc Dermott et ses collègues en 1979)[108].
En 1980-1990, de l'aluminium est retrouvé en quantité significative et croissante avec l'âge dans le sang des malades d'Alzheimer et dans les plaques séniles (sous forme d'aluminosilicate)[109], ainsi que sur les neurones sièges de la dégénérescence des neurofibrilles[110] - [111]
La démonstration faite antérieurement de sa neurotoxicité dans la genèse des encéphalopathies progressives des dialysés (caractérisées par une démence progressive avec difficultés d'élocution, grimaces faciales, troubles moteur et modifications électroencéphalographiques), a encouragé l'hypothèse d'un rôle-clé de l'aluminium dans le syndrome d'Alzheimer par exemple en 1988 par Birchall et Chappell[112] et par Zatta et al.[113] (qui précisent leurs travaux en 1995[114]) ; par Harrington & al. en 1994[115] ; par Corain & al. (1990)[116], Jacqmin-Gaddaet coll. en 1996[117] concluent à un lien entre les taux d'aluminium (et de silicium) de l'eau de boisson et la santé mentale de personnes âgées mais l'aluminium semble être délétère quand le taux de silicium est faible, et inversement protecteur en présence d'un pH alcalin et d'un taux élevé de silicium dans l'eau.
En 1996, Suarez & al. montrent que chez le rat l'aluminium (à des taux comparables à ceux dosées dans le cerveau de malades d'Alzheimer) est source de perturbations cellulaires et biochimiques[118], peu après que deux équipes (celles de Deloncle et al.[119] et de Sahin et al.[120] aient en 1995 publié de travaux concluant qu'une intoxication chronique par l’aluminium conduit à une augmentation de la perméabilité de la barrière hémato-encéphalique et induit des troubles neurologiques dont tremblements, troubles de l'équilibre, puis convulsions…
La nourriture ou l'eau de boisson sont des sources potentielles d'aluminium ; Martyn et al. en 1989 ont montré qu'en Angleterre, dans les régions où l'eau contient naturellement un taux d'aluminium de plus de 110 pg par litre, l'incidence de la maladie d'Alzheimer est multiplié par 1,5 par rapport aux régions où l'eau du robinet en contient moins de 10 Fg/L[121] - [122] - [123]. Des résultats semblables ont été publiés en Norvège par Flaten en 1987[124] et 1990[125]) et au Canada par Neri & Hewitt en 1991[126] et par Forbes & Mc Lachlan en 1996[127]).
Mais cette hypothèse est rapidement controversée par exemple par Lukiw en 1997[128] (notamment parce que de l'aluminium s'accumule aussi dans le système nerveux de personnes âgées ne déclarant pas la maladie d'Alzheimer) et le reste bien que certains comme Savory et al. en 1996 aient tenté de proposer une méthode pour sortir de cette controverse[129]…).
Mise en cause du mercure
Certains indices suggèrent une relation entre l'exposition au mercure et la maladie d'Alzheimer[130]. Le taux de mercure est plus élevé dans le cerveau des malades d'Alzheimer, et tout particulièrement dans le noyau basal de Meynert au centre de l'encéphale, là où la dégénérescence neuronale est la plus forte chez les malades[131] - [132]. Les malades ont presque toujours un taux de mercure sanguin anormalement élevé (2 à 3 fois plus élevé que pour l'échantillon témoin)[133] et le taux sanguin du mercure est plus élevé chez les malades qui ont le plus de protéines β-amyloïdes se déposant dans le cerveau.
Ce mercure aurait pour principale origine les plombages dentaires : l’OMS considère que le mercure-vapeur émis par les amalgames dentaires est la 1re source d’exposition mercurielle des populations occidentales[134]. Les amalgames perdent environ 50 % de leur mercure (soit 1/2 gramme environ par amalgame), en 10 ans, avant stabilisation, et de nombreuses études récentes ont confirmé que le taux de mercure du cerveau est corrélé au nombre d’amalgames[135] - [136] - [137] - [138] - [139].
On a montré en 1993 comment le mercure induit une neurodégénérescence caractéristique de la maladie d’Alzheimer, à la suite d'une exposition chronique à de faibles doses de mercure-vapeur[140]. En 2004, une revue des connaissances et études récentes montre une grande cohérence des études disponibles[141]. Cependant, les amalgames dentaires contenant du mercure ont fait l'objet de nombreuses études qui n'apportent pas la preuve de leur responsabilité au regard des maladies neurodégénératives[142] - [143].
Pronostic
Quand on a un doute au sujet de la maladie d'Alzheimer, on peut consulter un médecin généraliste qui renvoie en général vers un neurologue ou un neuropsychologue[144].
Pour confirmer qu'un patient est atteint de la maladie d'Alzheimer, on évalue d'abord ses fonctions cognitives (fonctions qui organisent et contrôlent les actes d'une personne, par exemple la mémoire, le langage). Ensuite, on fait une IRM (Imagerie par Résonance Magnétique) pour lequel l'attente était d'environ 30 jours en 2015[145]. Pratiquer cet examen coûte environ 300 €, avec un remboursement presque total de la sécurité sociale (les 20 € restant à la charge du patient pouvant être remboursés par la mutuelle)[146]. La troisième étape du diagnostic est un bilan pour écarter les pistes de d'autres conséquences qui pourraient être causées par les symptômes relevés. Ces trois étapes permettent d'établir un diagnostic qui établit si le patient a la maladie d'Alzheimer ou non[147].
Conséquences familiales et sociales
La famille comprend les enfants, les frères et sœurs, nièces et neveux, etc. En se référant au nombre estimé en 2007 de 800 000 malades en France et en considérant une moyenne de 3 cellules familiales autour d'un malade, ce sont plus de 2 400 000 personnes qui sont concernées plus ou moins directement par la maladie d'Alzheimer. C'est un problème majeur de société, la progression du nombre de malades étant d'environ 250 000 cas par an[148].
La famille a des ressources limitées en temps pour offrir à la personne malade le soutien dont elle a besoin de façon de plus en plus continue au fur et à mesure de l'évolution de la maladie. Pourtant, dans 70 % des cas, c'est la famille qui prend en charge la personne malade et lui permet de rester à domicile.
On a pris conscience de l'apport considérable de l'aidant naturel (aussi nommé aidant familial) et les professionnels se rendent compte que l'« aide aux aidants » est probablement une des manières de répondre à cet énorme défi de santé publique. Le soutien apporté aux aidants joue un rôle important dans le choix du couple aidant/aidé de rester ou non à domicile. J.-M. Caire, B. Sarrazy et S. Tétreault[149] ont mis en évidence un certain nombre de conditions qui facilitent le maintien à domicile telles que la flexibilité des interventions proposées, le fait de préserver du temps pour les aidants, la formation de ces derniers pour s’adapter aux situations nouvelles du quotidien ou encore le respect par l’équipe de professionnels du point de vue de la personne malade et du proche qui la soutient.
En France, 70 % des époux et 50 % des enfants d'une personne souffrant de la maladie d'Alzheimer lui consacrent plus de 6 heures par jour. 24 % des aidants — et 54 % lorsqu'il s’agit des enfants de la personne — doivent réaménager leur activité professionnelle. 20 % des aidants naturels d'une personne atteinte de la maladie d'Alzheimer déclarent différer, voire renoncer à une consultation, une hospitalisation ou un soin pour eux-mêmes par manque de temps[150].
Si la prévalence de la maladie continue d'augmenter, elle mobilisera à elle seule et pour le simple nursing un dixième de la population active. Par ailleurs, il semblerait que la mortalité des personnes aidant soit supérieure à celle de personnes du même âge ne s'occupant pas d'un malade, mais cela n'est pas clairement établi à ce jour[151]. Dans le cadre du Plan Alzheimer 2008-2012, a été mis en place un métier le technicien-coordinateur de l’aide psychosociale aux aidants en réponse aux problématiques de ces aidants.
Prévention
Aucune méthode ne protège définitivement de la maladie d’Alzheimer, mais des facteurs de diminution du risque sont connus.
Activité cognitive et niveau scolaire
Le maintien d'activité cognitive régulière aiderait à réduire les risques de la maladie, la dégradation des facultés intellectuelles étant d'autant réduite que le nombre d'activités augmente[152]. Par exemple, la pratique de jeux de société ralentit le déclin des fonctions cognitives[153]. Il est possible que la pratique de jeux réduise aussi la dépression et contribue à moins de risque de démence[154].
De même, avoir fait des études longues semble corrélé avec une meilleure protection contre l'apparition des symptômes : le cerveau peut être atteint, mais les signes cliniques de dégénérescence cognitives sont retardés de 7 à 10 ans. Ce retard aboutit à diviser par deux la possibilité d'en manifester les symptômes pour la population la plus instruite[155]. Cet effet retardateur des symptômes a été constaté dans de nombreuses études, bien qu'elles présentent toutes des biais et aboutissent à des résultats détaillés divergents. Les différences portent sur l'effet protecteur des études dans le cas du stade de la démence grave, ou dans le cas de cerveaux de poids élevé auquel cas l'effet protecteur est divergent. Les mécanismes mis en œuvre dans cette faculté à compenser les causes de la maladie, désignés comme « réserve cognitive » ne sont pas connus, et il n'y a pas de certitudes sur l'effet ou non d'autres facteurs tels que le style de vie dans les périodes ultérieures de la vie[156].
Activité physique
L'exercice physique tout au long de la vie pourrait prévenir le risque de maladie d'Alzheimer chez les sujets à risque[157], peut-être en diminuant le risque d'hypertension et d'accident cardiovasculaire[158]. Par ailleurs, l'exercice pourrait aussi avoir des impacts positifs au niveau du système immunitaire. Plusieurs études ont démontré un bienfait dans la réduction de facteurs inflammatoires et une amélioration cognitive après un programme d'exercice de 16 semaines chez les personnes âgées souffrant de troubles cognitifs modérés. En effet, l'exercice modéré pourrait contrecarrer les effets reliés à une baisse de performance du système immunitaire lié à l'âge (appelée « immunosénescence ») pouvant être impliqués dans le processus de déclin cognitif lié à la maladie d'Alzheimer[159].
Une revue générale des méta-analyses a trouvé des preuves solides que les personnes physiquement actives ont un risque plus faible d'environ 35 % de développer la maladie que leurs pairs physiquement inactifs, et se portent un peu mieux s'ils ont déjà la maladie[160].
Alimentation
Certaines études cliniques tendent à démontrer que la consommation de viande (sauf poisson et volaille) et de produits d'origine animale dans leur ensemble favoriserait le développement de la maladie d'Alzheimer[161] - [162]. Outre l'augmentation du risque liée au cholestérol, il est notamment évoqué dans une étude le rôle de la méthionine[163] - [164], transformée en homocystéine par le métabolisme intermédiaire. Une hyperhomocystéinémie est un facteur augmentant le risque cardiovasculaire, et semblerait jouer un rôle dans l'apparition de la maladie d'Alzheimer. En effet, l'augmentation d'homocystéine est associée à la diminution de la concentration sanguine de vitamine B12 et de l'acide folique[82]. Selon certaines théories, la hausse du nombre de cas développant la maladie d'Alzheimer pourrait correspondre à la hausse de la consommation de viande dans le monde : ainsi, une recherche de l’American Society for Nutrition (en), concernant des populations d'Amérique latine, de Chine et d'Inde, conclut que « la consommation de viande a été plus élevée chez ceux dont on a diagnostiqué une démence »[165].
Des recommandations alimentaires combinant régime méditerranéen ont été développées spécifiquement pour réduire le risque de maladie d'Alzheimer[166], suivre ces recommandations permettrait de réduire le risque d'environ 50 %[167].
Lumière et rythmes biologiques
Les malades Alzheimer dorment moins bien que la moyenne des gens. Ils sont parfois agités et comme surstimulés tard dans la nuit[168] - [169].
- Une explication est que la maladie semble dégrader un type spécial de cellules de l'œil (cellules ganglionnaires de la rétine) qui (via la mélanopsine) informent le cerveau du fait qu’il fait jour ou nuit (rythme circadien)[168]. Si ceci est confirmé, de nouvelles pistes de traitement pourraient améliorer le sommeil de ces patients. Ces cellules comptent pour 1 % à 2 % des capteurs photosensibles de l'œil, et ne jouent aucun rôle dans la vision[168]. Chez 30 donneurs d'organes étudiés il y avait environ 24 % de cellules à mélanopsine en moins dans les rétines de malades d'Alzheimer que chez des personnes non affectées par cette maladie. De plus, ces cellules semblaient différentes chez les malades d'Alzheimer. Au lieu d’être rondes avec de longs filaments sillonnant la rétine « comme les restes d’une toile d'araignée abandonnée », elles semblaient dégénérées, avec des filaments minces formant un réseau moins étendu. Des colorants fluorescents ont permis d’étudier le tissu rétinien pour la protéine dite « amyloïde β », typique du cerveau affecté par la maladie d'Alzheimer[168]. Ils ont permis de montrer que cette protéine toxique est également accumulée autour des cellules à mélanopsine. En 2015, on ne sait pas encore si les cellules à mélanopsine se dégradent avant ou après le début des symptômes de la maladie ou ses manifestations dans d’autres parties du système nerveux central. Si elles se dégradaient précocement, elles pourraient permettre un diagnostic plus rapide et aisé car la rétine est la seule partie du cerveau qui n’est pas couverte par le crâne. Préserver ces cellules de la maladie ou stimuler celles qui n’ont pas encore été touchées permettrait sans doute de soulager les patients de leurs troubles du sommeil, qui conduisent en outre à un « cercle vicieux », car délétères pour le système immunitaire et la mémoire. Une mauvaise immunité peut rendre l’organisme moins efficace face aux protéines toxiques qui envahissent le cerveau de ces patients[168]. Il reste à étudier s’il y a une corrélation entre la gravité de la dégénérescence et la sévérité des insomnies[168].
- L'exposition à la lumière naturelle semble améliorer certains symptômes. La prise de mélatonine, associée à une luminothérapie pourrait améliorer les troubles du sommeil, en agissant comme inducteur de sommeil mais aussi comme facteur d'allongement de la durée de celui-ci[170]. L'exposition à la lumière naturelle diminuerait aussi chez ces malades les symptômes de dépression (-19 %), les limitations fonctionnelles au quotidien (- 53 %), la détérioration cognitive (- 5 %). Chez les malades observés, la prise de mélatonine facilitait l'endormissement. L'association lumière + mélatonine a aussi diminué les comportements agressifs (- 9 %), les phases d'agitation et de réveil nocturne. Il est donc conseillé[171] « de bien éclairer les pièces en journée (… et) à l'inverse, de diminuer les sources de lumière en soirée pour que l'organisme reçoive le signal que la nuit est là ».
Traitements médicamenteux des facteurs de risques cardiovasculaires
Les traitements médicamenteux contre les facteurs de risques cardiovasculaires semblent diminuer la survenance de la maladie d'Alzheimer, ou la reculer.
- Les traitements contre l'hypertension[172] - [173] - [174], et notamment les diurétiques, et surtout ceux qui agissent sur le potassium, ont été associés à un moindre risque de maladie d’Alzheimer[175]. Ils diminuent le risque de n'importe quelle forme de démence.
Les antihypertenseurs visant l'angiotensine semblent également diminuer le risque de MA[176]. - traitement contre l'hypercholestérolémie par des statines[177].
Anti-inflammatoires
La prise régulière d'aspirine ou d'anti-inflammatoires non stéroïdiens (AINS) pendant 2 à 3 ans dans les stades présymptomatiques pourrait réduire le risque d'incidence de la maladie d'Alzheimer[178] - [179].
Par contre, les études ont révélé une augmentation du risque de cardiotoxicité lié à l’inhibiteur Cox-2 (Celecoxib)[159].
Prise en charge
En France, un patient atteint de la maladie d'Alzheimer sur deux n'est pas diagnostiqué, et donc sans prise en charge adaptée[180]. Un dépistage et une prise en charge précoce sont conseillés pour favoriser le maintien à domicile le plus longtemps possible[181].
Stimulation cognitive
En France, des équipes spécialisées Alzheimer à domicile (ESAD)[182] ont été mises en place à la suite de la mesure 6 du plan Alzheimer 2008-2012[183]. Ces équipes proposent de la stimulation cognitive, mais également des mises en situation pour travailler les activités de la vie quotidienne et permettre à la personne de rester autonome à son domicile plus longtemps. Les interventions envers les aidants familiaux des patients semblent capables de retarder l'entrée en institution gériatrique, en particulier les interventions d'un type éducatif.
La Mnémothérapie[184] - [185] notamment musicale.
Aide aux aidants familiaux
Les aidants familiaux, par leur manière de se comporter, peuvent contrôler les troubles psychocomportementaux des malades. L'éducation des aidants, la notion de « base de sécurité » (un aidant choisi par le malade pour se sécuriser), de réseau d'aidants (autour de l'aidant principal), de tuteur de résilience pour l'aidant, sont autant d'éléments qui font de l'aidant familial un « traitement » en soi[186].
Prises en charge sociale
Le maintien à domicile le plus longtemps possible est souvent la solution demandée par les patients mais elle n'est pas toujours possible. Dès lors, pour remédier à cette situation et offrir une palette plus large de types d’accompagnement, de nouvelles formes d’habitats spécifiques dits alternatifs, telles que les colocations, se sont développées depuis la fin des années 1980 dans quelques pays d’Europe tels la Suède, l’Allemagne, la France, la Belgique ou encore la Suisse. Le but étant de pouvoir offrir aux personnes atteintes de la maladie d’Alzheimer, la possibilité de mener une vie au plus proche de celle qui était la leur auparavant, et de réduire leur isolement social et relationnel grâce à un rythme plus proche de celui de la vie familiale, tout en intégrant les proches dans un cadre de vie adapté. Toutefois, certaines évaluations récentes de ces structures amènent à nuancer le rôle que peuvent prendre les proches dans ce type de projet, leur rapport aux colocations pouvant parfois s’avérer similaire à celui qu’ils et elles auraient à l’égard d’une institution médico-sociale. Et ce, selon que l’initiative du projet émane justement des proches ou d’associations, ou au contraire d’institutions spécialisées ou d’une volonté étatique plus globale, et selon le type de politiques sociales édictées dans chaque pays (ou même états ou cantons pour les pays fédéraux – Allemagne, Suisse) sur la question de la prise en charge des personnes atteintes de troubles cognitifs et apparentés[187].
La prise en charge sociale consiste à trouver une solution pérenne la plus adaptée à la personne en fonction de ses souhaits et de ses capacités. Les démarches sont souvent faites par les familles aidées des médecins et des assistantes sociales.
Traitements médicamenteux
Les traitements actuellement autorisés et disponibles sur le marché sont principalement symptomatiques et soupçonnés de ralentir l’évolution de la maladie ils ont été réévalués en 2016 par la Haute Autorité de Santé qui a estimé que leur efficacité était « au mieux modeste, sans pertinence clinique » et a préconisé l'arrêt de leur remboursement par la Sécurité sociale[188] - [189].
Traitements spécifiques des démences
Les traitements de la maladie d'Alzheimer ont évolué avec la recherche[190]: inhibiteurs d'acétylcholinestérase, antagoniste NMDA (récepteur glutamate), anti-amyloïde et anti-protéine tau.
Inhibiteurs de l'acétylcholinestérase
Ils inhibent la dégradation de l'acétylcholine, une molécule permettant la transmission entre certains neurones du cerveau par l'intermédiaire de ses synapses. Ainsi, ils visent à corriger le déficit en acétylcholine observé dans le cerveau des personnes atteintes de cette maladie.
Plusieurs inhibiteurs ont été testés de façon rigoureuse et ont prouvé une certaine efficacité, dans les formes légères à modérément sévères : le donépézil[191], la rivastigmine, et la galantamine. En 2007 la Commission française de la transparence a réévalué quatre anticholinestérasiques et a conclu à une amélioration du service médical rendu (ASMR) mineure[192]. D'après la revue Prescrire leurs effets sont modestes, de quelques mois, chez environ 10 % des patients[193].
Bien que modestes, leurs effets sont significativement supérieurs à ceux du placebo : ralentissement ou retard du déclin cognitif et de la perte d'autonomie.
L'effet de ces traitements est stabilisateur, ils ne permettent pas de guérir la maladie, ni de récupérer le niveau de performances préexistant à sa survenue. Leurs utilisations exposent à de nombreuses interactions médicamenteuses, ainsi qu'à des effets indésirables.
Les anticholinestérasiques ont des effets secondaires[194], surtout de type digestif (nausées et vomissement). Certains induiraient une surmortalité cardiovasculaire et des tremblements et/ou une aggravation de symptômes parkinsoniens[195] ce qui a été à l'origine de controverses portant notamment sur leur justification économique[196]. The National Institute for Health and Care Excellence reconnait leur intérêt[197]. Par contre, en France, la Haute Autorité de Santé, ne recommandent plus leur utilisation dans la maladie d'Alzheimer en dehors d'un cadre très précis[198].
Antagonistes du NMDA
- Les récepteurs neuronaux au N-méthyl-D-aspartate (NMDA) jouent un rôle important dans les processus de mémorisation. Il semble que lors de la maladie d'Alzheimer ces récepteurs soient hyperstimulés par le glutamate, ce qui serait délétère selon la théorie de l'exitotoxicité. Elle est réservée aux stades moyens ou avancés[199].
- La vitamine D a démontré une efficacité en synergie avec la mémantine. La mémantine et la vitamine D isolément n'ont guère amélioré l'état de patients atteints de la maladie d'Alzheimer mais ont permis des améliorations cognitives significatives en six mois lorsqu'elles sont prises conjointement[200].
Dans une étude[201], la vitamine E a montré une efficacité substantielle tandis que la mémantine n’a offert aucun bénéfice, conduisant même à un déclin plus agressif que le placebo.
Psychotropes
Peu d'études ont été réalisées chez le patient atteint de la maladie d'Alzheimer concernant l'utilisation des psychotropes[202]. La plupart des recommandations sont faites à partir d'extrapolation des données issues des patients jeunes ou de l'expérience clinique.
Les études réalisées chez les patients atteints d'une maladie d'Alzheimer montrent que ces médicaments sont malgré tout très utilisés[203] : ils sont prescrits chez plus de 2⁄3 des patients atteints d'une maladie d'Alzheimer.
- Les antidépresseurs : la prévalence de la dépression est estimée entre 37 % et 50 % des patients[204] - [205]. Ils n'ont pas prouvé d'efficacité[206] sur l'évolution de la maladie d'Alzheimer, mais ils peuvent avoir une efficacité sur la dépression associée, l'anxiété et les troubles du comportement[207].
- Les neuroleptiques sont fortement déconseillés chez les patients atteints d'une maladie d'Alzheimer[202] - [208] sauf dans des situations particulières d'agitation majeure avec des risques de blessure pour le patient ou les soignants[202]. Ce traitement nécessite une réévaluation constante et doit être arrêté dès que possible. Par ailleurs, les effets indésirables de ces traitements sont nombreux[209] chez ces patients : ils majorent le risque d'accident vasculaire cérébral et entraînent une mortalité accrue. L'arrêt de ces traitements en dehors des phases d'agitation aiguë ne semble pas aggraver les troubles du comportement[210].
- Les hypnotiques et anxiolytiques peuvent aggraver les troubles cognitifs[211]. Ils doivent donc être utilisés avec précaution.
Triglycérides à chaîne moyenne (huiles)
Ces triglycérides ont souvent une action spectaculaire dans le traitement de la maladie d'Alzheimer. Une demande de brevet a été déposée en 1996 aux États-Unis qui conduira aux gélules AXONA (disponibles aux États-Unis) qui contiennent des triglycérides[212]. L'amélioration peut être spectaculaire[213] mais temporaire. Certaines personnes ne réagissent pas à ce traitement.
Vitamine D
De nombreuses études ont montré que la maladie d'Alzheimer et le déficit en vitamine D sont légèrement corrélés[214] - [215] - [216] - [217] - [218].
Gossypétine
Selon une étude coréenne publiée en 2022, la tisane d'Hibiscus sabdariffa, appelée bissap en Afrique de l'ouest, activerait « les cellules immunitaires du cerveau qui éliminent la protéine bêta-amyloïde » grâce à son principe actif, un composé flavonoïde appelé gossypétine[219] - [220].
Recherche
Animaux transgéniques
Afin d'étudier l'apparition de la maladie, des souris transgéniques sont utilisées pour reproduire les symptômes observés chez l'homme. Les mutations sont donc principalement effectuées sur les gènes de la protéine tau et/ou de la protéine amyloïde. Cependant, les résultats sur ces modèles animaux restent difficiles à interpréter, notamment pour l'efficacité des éventuels traitements testés et leur transfert vers l'homme.
Les souris ayant eu une mutation sur le gène codant la protéine Tau montrent une apparition de la maladie peu prononcée et les souris ayant eu une mutation sur le gène codant la protéine amyloïde se comportent comme des souris saines. C'est seulement lorsque les deux gènes sont mutés que les souris développent une maladie semblable à celle d'Alzheimer. Cela ne se passe pas obligatoirement de façon identique chez l'homme, mais cela montrerait que les plaques amyloïdes potentialisent l'apparition de la maladie. Les neurofibrilles apparaissent dans un premier temps et lorsque les plaques amyloïdes apparaissent, la maladie se déclenche. Il est certain que chez l'homme, le processus pathologique se développe bien avant que les premiers signes cliniques n'apparaissent.
En , des chercheurs australiens ont pratiqué une série de balayages par des ultrasons du cerveau de souris transgéniques alzheimérisées (modèle APP23)[221]. Les résultats ramenaient une réduction considérable du fardeau amyloïde et une clairance des plaques dans les trois quarts des animaux traités. Il semble donc que les ultrasons puissent permettre une élimination de l'Aβ et améliorer la cognition chez la souris. Le cerveau humain, de par sa taille et sa boite crânienne plus épaisse, questionne donc sur l'efficacité similaire d'une telle thérapeutique.
Animaux sauvages
En , des chercheurs de l’Université d’Oxford publient une étude rapportant la découverte de plaques et d’enchevêtrements de protéines, habituellement considérés comme les signes révélateurs de la maladie d’Alzheimer chez l’Homme, dans le cerveau de dauphins sauvages retrouvés morts[222]. C'est la première fois que la maladie est observée chez un animal sauvage[223].
En 2022, les cerveaux de 22 odontocètes échoués, appartenant à 5 espèces différentes, ont été examinés par immunohistochimie pour rechercher la présence ou l'absence de signes neuropathologiques de la maladie d'Alzheimer (MA) : plaques amyloïdes-β, accumulation de phospho-τ et gliose. L'immunohistochimie a révélé que tous les animaux âgés avaient accumulé une pathologie de la plaque amyloïde. Chez trois animaux de trois espèces différentes, il y avait co-occurrence de plaques amyloïdes-β, accumulation intraneuronale de τ hyperphosphorylé, de fils de neuropiles et de plaques neuritiques. Un animal présentait des fils de neuropiles bien développés, une accumulation de phospho-τ et des plaques neuritiques, mais aucune plaque amyloïde. La microglie et les astrocytes étaient présents comme prévu dans tous les échantillons de cerveau examinés, mais des différences entre individus ont été observées quant à la morphologie et au nombre des cellules. L'apparition simultanée de plaques amyloïdes-β et d'une pathologie τ hyperphosphorylée dans le cerveau des odontocètes montre que ces trois espèces développent spontanément une neuropathologie de type MA. L'importance de cette pathologie vis-à-vis de la santé, et — in fine — de la mort des animaux, reste à déterminer. Cependant, elle peut contribuer à la ou aux causes d'échouages inexpliqués chez certaines espèces d'odontocètes et soutient la théorie du « leader malade », selon laquelle des congénères sains s'échoueraient par cohésion sociale[224].
Vers de nouveaux diagnostics (plus précoce et/ou non invasifs)
Le but des recherches diagnostic est de permettre un diagnostic plus sensible, plus spécifique et donc plus précoce de la maladie d'Alzheimer que l'interrogatoire et les tests neuropsychologiques. De meilleurs tests pourraient permettre un diagnostic plus précoce, quand la maladie commence à endommager le cerveau, parfois 20 ans avant de premières pertes de mémoire et troubles neurologiques détectables. Les malades pourraient alors bénéficier de traitements spécifiques plus précoces pour freiner l'évolution.
- En 2014, on estime que de nouveaux critères combinant des tests de mémoire, données d'imagerie cérébrale et marqueurs biologiques, pourraient détecter la maladie dès les premiers symptômes, « avec un taux de certitude diagnostique supérieur à 90 % »[225] - [226].
- En 2017, sachant que les rétines de patients décédées de cette maladie sont anormalement fines, avec un nerf optique dégradé, en corrélation, et sachant que c'est aussi dans la rétine que les plaques amyloïdes commencent à s'accumuler, avant qu'elles ne le fassent dans le cerveau. il a été proposé (par le Centre médical Cedars-Sinai de Los Angeles) de les détecter précocement pour améliorer le diagnostic ; après administration de curcumine, un colorant fluorochrome se liant aux plaques de protéines bêta-amyloïdes. De quoi révéler leur présence par des points de fluorescence par un simple examen du fond de l'œil.
- En 2018, une étude[227] publiée dans JAMA Ophthalmology montre que l'angiographie (l'angio-OCT ou OCTA, pour Optical coherence tomographic angiography qui offre une vue 3D de la vascularisation de la rétine) permet de détecter un déficit de vascularisation rétinienne dans la fovéa, déficit qui est l'une des signatures de la maladie ; la tache sans vaisseaux sanguins est significativement plus large chez les personnes Alzheimer en phase préclinique. Reste à montrer qu'une telle tache est toujours révélatrice de la maladie qui peut ne se révéler que dix voire vingt ans plus tard[228].
Projets de calcul distribué
Le projet international neuGRID est un système d'analyse des images d'imageries cérébrale. Il est financé par l'Union européenne, prévoit le développement d’une infrastructure numérique pour la recherche scientifique, fondée sur le système Grid. Il est équipé d’une interface d’utilisation facile, qui permettra aux chercheurs européens de neurosciences de faire avancer la recherche pour l’étude de la maladie d'Alzheimer et d'autres maladies neurodégénératives.
Immunothérapie et vaccin
Aucun vaccin ou médicament immunogénique n'est aujourd'hui commercialisé. Un vaccin pouvant soigner cette maladie semble envisageable d'après des études menées chez l'animal. Les premiers tests sur l'homme ont été très décevants avec des effets secondaires majeurs (décès observés sans empêcher l'évolution de la maladie d'Alzheimer).
En 1999, le chercheur américain Dale Schenk présente dans la revue Nature une méthode semblant guérir la maladie chez des souris. En immunisant contre le peptide A bêta des souris transgéniques qui le surexpriment, il arrive à prévenir l'apparition de dépôts chez les animaux jeunes et à limiter et même réduire leur extension chez les individus âgés.
Un premier essai clinique de phase 1 chez l'humain conduit en Angleterre a permis l'analyse suivante : les 80 patients traités supportent bien la vaccination et le quart d'entre eux produisent bien des anticorps. Un second essai a été interrompu en raison d'effets indésirables graves (méningoencéphalites). Le suivi ultérieur des patients qui ont reçu le vaccin est plus mitigé : même si chez certains patients traités les dépôts amyloïdes intracérébraux sont moins importants, le vaccin n'a pas empêché la progression de la détérioration intellectuelle jusqu'au stade terminal[229].
Un autre espoir, porté par le Japonais Tohru Hasegawa[230] est d'utiliser l'acide homocystéique comme cible d'un vaccin. Cet acide - chez des souris 3xTg-AD (transgéniques, modifiées de manière à mimer les symptômes de la maladie humaine) - semble en effet nécessaire à la progression de la dégénérescence typique de cette affection[231] - [232].
Le taux de cet acide est plus élevé dans le cerveau des souris 3xTg-AD de 4 mois que chez les souris témoins normales. Quand des souris 3xTg-AD sont soumises à une carence en vitamine B6 (ce qui augmente la quantité d'acide homocystéique dans leur cerveau), cela aggrave aussi leurs troubles mémoriels, sauf en cas d'injection d'anticorps anti-acide homocystéique. Injecter ces mêmes anticorps à des souris 3xTG-AD plus vieilles et normalement alimentées a également un effet curatif, en tous cas pour les troubles mémoriels. Les chercheurs restent prudents, car il a été vu dans le passé que la souris n'était pas un modèle parfait pour cette maladie. Le vaccin devrait être testé sur des singes avant tout essai clinique sur l'homme.
La création d'une 2e génération de vaccin est pour l'instant en développement dans des études cliniques. Ces vaccins ont pour but d'offrir une forte production d'anticorps sans effets indésirables liés à l'inflammation créé par les lymphocytes T spécifiques aux plaques amyloïde β (méningoencéphalites (en)). De nouvelles stratégies de développement de vaccins basées sur la modification d'antigènes semblent prometteuses[159].
Une équipe de chercheurs américains a publié une étude dans Science Advances du [233] dans laquelle ils pointent la bactérie Porphyromonas gingivalis, responsable de maladies chroniques des gencives. La bactérie migrerait dans le cerveau et y provoquerait des inflammations cérébrales, des lésions neuronales et donc un déclin cognitif. L'entreprise pharmaceutique Cortexyme, basée à San Francisco, a trouvé les enzymes toxiques, les gingipaines (produites par Porphyromonas gingivalis) dans 96 % des 54 échantillons de cerveaux atteints par la maladie d’Alzheimer. De plus, ils ont trouvé les bactéries elles-mêmes dans trois cerveaux. Les chercheurs ont également trouvé la bactérie dans le liquide cérébrospinal de personnes vivantes atteintes de la maladie d’Alzheimer. Un bloqueur de la gingipaïne a été testé sur l’humain. Les participants atteints de la maladie d’Alzheimer ont vu leur état s'améliorer. Les chercheurs poursuivent leurs recherches, notamment en augmentant le nombre d'échantillons testés[234] - [235]. En Australie, une équipe de Melbourne, a développé un vaccin contre la bactérie, en test depuis 2018. Cette étude de piste « Une bactérie buccale à l'origine de la maladie d'Alzheimer ? » est reprise par Sciences et vie[236].
Champs magnétiques
Selon une étude de 2010[237], des souris (normales, et transgéniques présentant des troubles jugés comparables à ceux induits par la maladie d'Alzheimer) exposées plusieurs mois à certaines ondes électromagnétiques (de type téléphone portable ; 918 MHz ; 0,25 W/kg) améliorent leur mémoire, perdent moins de capacité cognitive en vieillissant et produisent moins de plaques amyloïdes dans leur hippocampe (-35 %) et leur cortex entorhinal (-32 %). Une température cérébrale plus élevée de 1 °C et une accélération du débit sanguin cérébral sont constatées, mais le mécanisme global n'est pas compris. Si un effet similaire était constaté chez l'humain, une piste nouvelle de traitement, non médicamenteuse et non chirurgicale s'ouvrirait.
La voie du cholestérol cérébral
Un nouvel axe thérapeutique est envisagé par une équipe française de l'Inserm, dirigée par le Dr Nathalie Cartier-Lacave, qui a montré que le cholestérol cérébral, quand il est en excès, était impliqué dans le développement de la maladie. Leur stratégie consiste donc à sur-exprimer l'enzyme CYP46A1 responsable de la dégradation du cholestérol cérébral, par thérapie génique. Les résultats sur les souris se sont avérés très prometteurs[238].
La voie de l'insuline
Même si le rôle des plaques amyloïdes-β (Aβ) dans la Maladie d'Alzheimer n'est pas complètement clarifié, il est raisonnable de croire que leur diminution dans le cerveau de patients atteints de la maladie d'Alzheimer pourrait diminuer le développement des symptômes neurocognitifs de la maladie. Normalement l'évacuation de l'Aβ se fait par la barrière hémato-encéphalique (BHE), mais dans la maladie d'Alzheimer, des dysfonctions reliées à l'âge et à la maladie sont présentes et empêchent la BHE d'effectuer son travail. Des données récentes démontrent que l'administration d'une seule dose d'insuline en périphérie permettait d'augmenter l'évacuation de l'Aβ au niveau du cerveau. Par contre, l'effet à court terme de l'insuline et le phénomène de désensibilisation des récepteurs après une utilisation chronique permet difficilement de considérer l'insuline seul comme un traitement viable pour l'amélioration des fonctions cognitives en maladie d'Alzheimer. Ces résultats démontrent tout de même qu'un contrôle de l'évacuation de l'Aβ est possible et pourraient ouvrir de nouvelles perspectives de traitement dans le futur[239].
Fluoxetine
Un autre potentiel traitement très prometteur de la maladie d'Alzheimer est la Fluoxétine, qui n'est actuellement pas préconisé ou commercialisé pour cet usage. De nombreux patients atteints de maladie d'Alzheimer sont sous Fluoxetine pour le traitement d'un des symptômes secondaires, à savoir la dépression ou les troubles de l'humeur[240]. Cependant, il semble d'après plusieurs recherches menées sur ces patients que ce médicament travaille directement vers la réduction de la maladie par la neurogenèse dans l'hippocampe adulte agissant sur les cellules souches neurales[241] et la régulation des astrocytes (principales cellules gliales) dans le cerveau[242].
Lutte contre la plaque amyloïde
L'intérêt de cette voie thérapeutique est d'attaquer la maladie à son point d'origine et non sur ses dégâts secondaires. De nombreux traitements ayant pour but de réduire l'accumulation des plaques amyloïdes ou de les éliminer sont en cours d'étude. À l'heure actuelle aucun n'a pu montrer d'efficacité sur les symptômes de façon nette et durable. Devant l'importance épidémiologique et économique que prend la maladie, la Food and Drug Administration, aux États-Unis a autorisé la mise sur le marché de l'Aducanumab. Il s'agit d'un anticorps de synthèse anti-Amyloïde qui a fait preuve d'une possible efficacité et de peu de risques toxiques. Cette autorisation est soumise à la garantie d'études plus poussées sur l'efficacité et sera suspendue si les résultats ne sont pas concluant[243]. Ce traitement n'est pas utilisable en France (sauf en recherche thérapeutique éventuellement).
Donanemab
Le donanemab est un médicament expérimental développé par Eli Lilly pour réduire les protéines bêta-amyloïdes du cerveau. Il est en phase II de tests.
Lutte contre la protéine Tau
La protéine Tau étant soupçonnée d'avoir des conséquences sur la maladie d'Alzheimer, des études de phase II sont menées sur des produits anti-Tau, notamment Semorinemab.
Aducanumab
La firme pharmaceutique américaine Biogen a demandé une mise sur le marché de l'Aducanumab le 22 octobre 2019[244], un anticorps monoclonal qui cible le peptide amyloïde bêta ; certains résultats suggèrent qu'il pourrait ralentir le déclin cognitif de personnes dans la phase initiale de la maladie[245] - [246] - [247]. Un nouvel essai clinique est autorisé[248]. Après des doutes sur la pertinence des résultats des études cliniques, il est finalement reconnu, aux États-Unis, que les patients ayant reçu la plus forte dose d'Aducanumab (nom commercial Aduhelm) connaissent une amélioration clinique statistiquement significative (23 %), selon l'étude EMERGE et à l'opposé de l'étude ENGAGE. Le produit est approuvé par la FDA le pour son action constatée sur la plaques amyloïdes. Toutefois la FDA demande une nouvelle étude pour confirmer que cette diminution des plaques amyloïdes se traduit par une réelle amélioration des fonctions cognitives des patients[249] - [250].
Traitement précoce
En 2022, les efforts se concentrent sur un traitement précoce de la maladie (avant l'apparition des symptômes), notamment chez des personnes présentant un risque supérieur à la moyenne en raison de diverses anomalies génétiques, ou chez qui des marqueurs de la maladie (dont les plaques amyloïdes) sont présents (jusqu'à 25 ans avant les premiers symptômes)[251].
Épidémiologie

Deux formes de la maladie d'Alzheimer sont séparées :
- la forme familiale, plus précoce, d'origine principalement génétique et donc assez rare ;
- la forme sporadique, forme la plus répandue de la maladie et dont le risque augmente fortement avec l'âge.
Dans le monde, le nombre de cas de malades d'Alzheimer est passé de 11 millions en 1980 à 18 millions en 2000 et 25 millions en 2004[253]. Il est estimé que 35,6 millions de personnes vivent désormais avec une maladie d'Alzheimer dans le monde. Elles seront 65,7 millions en 2030 et 115,4 millions en 2050[252]. À l'échelle mondiale, la maladie d’Alzheimer est la troisième cause d'invalidité pour les plus de 60 ans (après les atteintes de la moelle épinière et les cancers en phase terminale[254]) avec une prévalence de l'ordre de 4 à 6 % à cet âge[254]. Ces chiffres proviennent essentiellement des études épidémiologiques effectuées dans les pays développés, en effet bien que cette maladie s'observe sur tous les continents, elle est peu caractérisée dans les pays en développement où l'espérance de vie est souvent plus courte et les enquêtes épidémiologiques plus rares. La maladie d'Alzheimer est cependant considérée comme une pandémie[186].
À part l'âge, les facteurs de risque génétique évoqués plus haut comme l'ApoE-e4, la petite taille, le tabagisme, certaines maladies préexistantes (diabète, hypertension, taux de cholestérol élevé)[255], l'alimentation (viande et sucre) et l'inactivité physique, n'expliquent pas entièrement les variations de prévalence constatées, et les autres facteurs de risque de la maladie sont mal connus. Les chercheurs se tournent de plus en plus vers la recherche de causes environnementales[256].
Dans ce but ils examinent les prévalences de la maladie par pays[257] - [258] — les pays nordiques européens et les États-Unis sont les plus touchés —, ou par État aux États-Unis[259], où l'État de Washington est inexplicablement le plus touché.
L’incidence — aux mêmes âges — est toujours plus forte dans les pays riches qu'ailleurs (sauf au Japon où l'incidence est très faible, et moindrement en Amérique centrale et du Sud). Ceci est vrai pour les populations urbaines supposées plus exposées aux pollutions, mais aussi pour les populations rurales (qui par exemple en Inde développent 5,4 fois moins d'Alzheimer qu'en Pennsylvanie[260]).
De même, les Afro-Américains vivant aux États-Unis sont beaucoup plus touchés que les Yorubas du Nigeria. Des chercheurs ont comparé l'incidence de Maladie d'Alzheimer (MA) dans une population Yoruba du Nigeria et chez des Afro-Américains génétiquement proches (fréquence comparable (26 à 29 %) et élevée d'allèles APOE4)[261]. Le risque de maladie d’Alzheimer pour ces individus est deux fois moindre au Nigeria (1,15 %) qu'en Amérique du Nord (2,52 %) à âge égal, ce qui plaide aussi pour une cause environnementale, au moins dans 50 % des cas[262].
Cette maladie est plus rare en Asie[263]. Le Japon est notamment une exception parmi les pays industrialisés et riches. La prévalence de la maladie y est presque 10 fois plus faible qu'en France. Cependant, un Japonais vivant à Hawaï ou aux États-Unis voit son niveau de risque augmenter (5,4 % pour les Japonais d’Hawaï) et se rapprocher de celui d'un Américain moyen, d'un Caucasien ou Européen[263] - [264]). De même, 5,7 % des Japonais ayant émigré au Brésil ont après quelques décennies le même risque de développer la maladie qu'un Brésilien moyen[265] - [266]. Cette analyse montre, comme pour l'étude sur les populations nigérianes, la prépondérance de l'environnement dans le déclenchement de la maladie. Au Japon, la maladie d'Alzheimer est rare, mais la démence vasculaire est — comme aux États-Unis — très élevée, probablement en raison d'une consommation trop importante de sel. Cette maladie diminue au Japon grâce à la prévention et à une prise en charge plus efficace de l'hypertension[267].
Aux États-Unis, pays très touché, 5,3 millions de personnes ont la maladie d'Alzheimer[268], avec une prévalence double chez les africains-américains et chez les hispaniques, par rapport à la population d'origine anglo-saxonne.
Des études récentes mettent en évidence un recul de la prévalence dans les pays développés[269] - [270], ce qui serait lié aux efforts de traitement de l'hypertension et à un meilleur niveau d'études. Cela ne signifie pas que le nombre de personnes atteintes va baisser, mais que l'âge moyen du diagnostic recule.
Impact économique

La maladie d'Alzheimer était, en 2010, dans les pays développés, l'une des maladies les plus coûteuses : 604 milliards de dollars. Aux États-Unis, elle a coûté 94 milliards de dollars à l'assurance maladie américaine en 2008[271].
Perspectives en Europe
En Europe, l’incidence des démences devrait croître en 50 ans de 1,9 million de nouveaux cas par an à 4,1 millions, selon les scénarios[272].
En Belgique, 5 à 10 % des plus de 65 ans sont touchés et près de 20 % des plus de 80 ans[273].
En France, l'étude « PAQUID » (1988-2001) a fait ressortir que 17,8 % des personnes de plus de 75 ans sont atteintes de la maladie d'Alzheimer ou d'un syndrome apparenté. D'après une évaluation ministérielle de 2004, environ 860 000 personnes seraient touchées par la maladie d’Alzheimer en France. Un chiffre qui pourrait atteindre 1,3 million en 2020 et 2,1 millions en 2040. Le nombre de nouveaux cas est d'environ 225 000 par an[274]. Ceci représente environ 900 000 malades (et dans les années 2000 environ 220 000 nouveaux cas par an), avec des tendances et projections suivantes : 1 200 000 malades en 2020, et plus de 2 000 000 vers 2040[275]. Ces chiffres s'expliquent par l'allongement de la durée de la vie, alors que la prévalence des démences chez les plus de 75 ans qui était de presque 18 % (maladie d’Alzheimer à 80 %)[276] a en revanche régulièrement baissé depuis plusieurs décennies, autrement dit, pour un individu, le risque d'être malade diminue fortement, jusqu'à 25 % de moins[277].
Histoire et société
Personnes célèbres décédées de la maladie d'Alzheimer
Voir la catégorie « Mort de la maladie d'Alzheimer »
Au cinéma
- 2001 : Iris de Richard Eyre
- 2001 : Se souvenir des belles choses de Zabou Breitman
- 2002 : La Maladie de la mémoire de Richard Dindo
- 2004 : La Mémoire du tueur (De zaak Alzheimer) de Erik Van Looy
- 2004 : N'oublie jamais (The Notebook) de Nick Cassavetes
- 2004 : A Moment to Remember de John H. Lee
- 2005 : Une grande bouffée d'amour ! (Aiguemarine C°)
- 2005 : Black de Sanjay Leela Bhansali
- 2006 : Memories of Tomorrow de Yukihiko Tsutsumi
- 2007 : Loin d'elle (Away from Her) de Sarah Polley, adaptation de la nouvelle de la romancière canadienne Alice Munro, "L'Ours traversa la montagne" (publiée dans le recueil Un, peu, beaucoup, pas du tout).
- 2007 : La Brunante de Fernand Dansereau
- 2007 : Ta mémoire… Mon Amour ! (Aiguemarine C°)
- 2008 : Cortex de Nicolas Boukhrief
- 2008 : U, Me Aur Hum de Ajay Devgan
- 2009 : Je me souviens mieux quand je peins, documentaire d'Eric Ellena et Berna Huebner
- 2009 : La Verticalidad del Tiempo, documentaire de Raùl Fernandez Rincon et Marianne Ruiz, Luca Films, Madrid
- 2010 : La Vie secrète d'une ado ordinaire (The Secret Life of the American Teenager), Saison 1, épisode 8/23 (La Visite), série télévisée de Keith Truesdell
- 2010 : L'Absence de Cyril de Gasperis
- 2010 : Le Monde de Barney de Richard J. Lewis
- 2010 : Poetry de Lee Chang-Dong
- 2011 : Je n'ai rien oublié, de Bruno Chiche, d'après le roman Small World de Martin Suter
- 2011 : La Planète des singes : Les Origines de Rupert Wyatt
- 2011 : A Thousand Days' Promise (TV Drama Sud-Coréen) ou Forget me not, œuvre coréenne de Jung Eul-young
- 2012 : Ne m'oublie pas, Vergiss mein nicht), documentaire de David Sieveking
- 2014 : Flore de Jean-Albert Lièvre
- 2014 : Still Alice de Wash Westmoreland
- 2014 : La Vie à l'envers d'Anne Giafferi
- 2015 : Floride, de Philippe Le Guay
- 2016 : Memory (TV Drama Sud-Coréen) de Kim Ji-Woo
- 2018 : La Finale de Robin Sykes
- 2018 : Vivir sin permiso (Permis de vivre) de Aitor Gabilondo
- 2020 : The Father de Florian Zeller
- 2022 : Mémoire meurtrière de Martin Campbell
Dans la littérature
Depuis 1997, on note une forte augmentation des œuvres comportant des personnages atteints de la maladie d'Alzheimer ou de maladie apparentée[278].
Récits
- Still Alice, de Lisa Genova, Pocket Books 2007
- Histoire de ma mère, de Yasushi Inoué, Stock 1997, 2004 et 2007
- Je ne suis pas sortie de ma nuit, de Annie Ernaux, Gallimard 1997 et Folio 1999
- Ton chapeau au vestiaire, de Nadine Trintignant, Fayard 1997 et Pocket 1999
- Small World, de Martin Suter, Christian Bourgois 1998, et Points Seuil 2000
- Quel jour sommes-nous ? de Firmin Le Bourhis, Chiron 2000
- La Cavale du géomètre, d'Arto Paasilinna, Gallimard/folio 2000
- Élégie pour Iris, de John Bayley (en), L’Olivier 2001
- Les jours heureux, de Laurent Graff, La Dilettante 2001 et J’ai Lu 2003
- L’Effacement de l’aube, de Ronald Nossintchouk, E-Dite 2002
- Les Corrections, de Jonathan Franzen, L’Olivier 2002 et Points Seuil 2003
- L’Éclipse, de Serge Rezvani, Actes Sud 2003
- Ultime amour, de Serge Rezvani, Les Belles Lettres 2012
- Mon vieux, de Thierry Jonquet, Seuil 2004
- Le Dernier qui part ferme la maison, de Michèle Fitoussi, Grasset 2004 et Poche 2006
- Les Cœurs décousus, de Jacqueline Girard-Frésard, Le Cherche Midi 2004
- Les Quantités Négligeables (Le combat ordinaire, Tome 2), de Manu Larcenet, Dargaud 2004
- Sœurs, de Catherine Locandro, Gallimard 2005
- Mémorial, de Cécile Wajsbrot, Zulma 2005
- Le Piano désaccordé, de Christine Devars, Anne Carrière 2005
- Devant ma mère, de Pierre Pachet, Gallimard 2007
- Rides, de Paco Roca, Delcourt 2007
- Élégie : 1996-2006. La maladie d’Alzheimer vécue à deux, de Jean Sauvy, L’harmattan 2007
- Les Artistes de la mémoire, de Jeffrey Moore, Philippe Rey, 2007
- Les Madones de Leningrad, de Debra Dean, Grasset, 2007
- Le vieux roi en son exil : récit, de Arno Geiger, Gallimard (Du monde entier), 2012
- La mémoire de ma mère Annie Girardot, de Giulia Salvatori, M. Lafon 2007
- Rainbows end, de Vernor Vinge, Robert Laffont 2007
- On n’est pas là pour disparaître, de Olivia Rosenthal, Gallimard (Verticales) 2007
- La Vie sur terre, de Dorothée Janin, Denoël 2007
- La Plume du silence - Toi et moi… et Alzheimer, de Jean Witt, Presses de la Renaissance 2007
- L'Homme inquiet de Henning Mankell, Seuil Policier 2010
- De Peur que j'oublie, de Marie-Noël Rio, Les Éditions du Sonneur, 2014
- Puzzle : journal d’une Alzheimer, de Claude Couturier, Josette Lyon 2004
- Pourquoi ma mère me rend folle, de Françoise Laborde, Ramsay 2002 et J’ai Lu 2003
- Ma mère n’est pas un philodendron, de Françoise Laborde, Fayard 2003 et J’ai Lu 2005
- Alzheimer, mode d'emploi, de Jean-Pierre Polydor, L'esprit du temps 2009
- Somebody I Used to Know: A Memoir, de Wendy Mitchell, 2018[279]
- Croix Rouges de Sacha Filipenko, éditions des Syrtes, 2018
Poésie
- Geneviève Laurencin, Au bras de l'ombre : sur les rivages de la maladie d'Alzheimer, éd. du Rocher, 2011.
- Christian Bobin, La présence pure (1999), Gallimard, « Poésie », 2008.
- François Lacore, La Lente progression des eaux, F. Lacore, 2012.
Fiction
- « L'Ours traversa la montagne » nouvelle de la romancière canadienne Alice Munro, publiée dans le recueil Un, peu, beaucoup, pas du tout, 2001, trad. de l'anglais, 2006, éd. Payot / Rivages.
- Confiteor de Jaume Cabré, 2011, trad du catalan en 2013, Actes Sud.
- Emma Healey (trad. de l'anglais), L'oubli, Paris, Pocket, , 403 p. (ISBN 978-2-266-25068-9 et 226625068X, OCLC 912823772)
En musique
- Everywhere at the end of time de « The Caretaker » est un projet musical composé de 6 albums, chacun représentant une phase de la maladie[280].
- L'étranger dans la glace d'Hubert-Félix Thiéfaine, chanson parue sur l'album Scandale mélancolique en 2005. Sur scène, en 2011, le chanteur explique que le texte de cette chanson lui a été inspiré par un proche et la dédie à "Tous ceux qui souffrent de la maladie d'Alzheimer et à leurs familles"[281].
Représentation de la maladie d'Alzheimer dans les médias
Beaucoup de gens ne savent pas ce qu'est la maladie d'Alzheimer, comment elle affecte les gens, quels sont les symptômes et quelles sont ses causes. (WHO 2022).
Préjugés
La maladie d'Alzheimer s'accompagne de son propre lot de stigmates et de préjugés (une idée ou une pensée préconçue sur quelqu'un ou un groupe de personnes sans aucune connaissance ou expérience préalable). Pour ceux qui n'ont pas reçu l'éducation appropriée, qui n'ont pas fait de recherches ou qui ne sont pas eux-mêmes atteints de la maladie, il peut être facile de faire des suppositions sur ce qu'elle implique et sur la façon dont elle affecte ceux qui en souffrent. La façon dont la maladie d'Alzheimer est dépeinte dans les médias anglophones n'aide pas à résoudre ce problème. Une étude menée par Low et Purwaningrum s'est penchée sur des articles qui examinaient la manière dont la démence était représentée au cinéma, à la télévision et dans la littérature (2017). Leurs résultats ont montré que les personnes atteintes de la maladie étaient dépeintes comme agissant anormalement, ce qui les conduisait à être exclues socialement, incomprises ou moquées. Ils ont même constaté que les gens les considéraient comme ayant "perdu leur personnalité". La façon dont les démences (ou la maladie d'Alzheimer) sont dépeintes dans les médias amène les gens à craindre ceux qui en souffrent, ce qui peut entraîner des biais. Par exemple, le biais de disponibilité s'applique ici (lorsque l'on s'appuie sur des informations facilement disponibles pour prendre des décisions (Lu, 2020)), car il se produit lorsque nous portons des jugements basés sur des informations facilement disponibles, au lieu de faire des recherches nous-mêmes. De même, elle entraîne un favoritisme de groupe - lorsque nous préférons les personnes qui nous ressemblent (ou qui font partie de notre "groupe") aux autres (Lu, 2020) - car les gens préfèrent généralement les personnes non atteintes de démence à celles qui le sont (Low & Purwaningrum, 2020).
Sous-représentation aux États-Unis
Non seulement les médias aiment montrer tous les aspects négatifs de la maladie d'Alzheimer, mais ils ont aussi tendance à sous-représenter certaines cultures. Une étude menée par Choi et al. s'est intéressée à la manière dont la maladie est représentée dans les vidéos postées sur YouTube. Ils ont constaté que de nombreuses ethnies n'étaient pas représentées autant que les Blancs, même si les Afro-Américains et les Hispaniques sont plus susceptibles de contracter la maladie (2017). Ils ont constaté que 89,9 % de toutes les vidéos représentaient des Blancs, tandis que seulement 5,9 % et 5,3 % représentaient des Africains et des Asiatiques, respectivement. Les 6,4 % restants étaient qualifiés d'"autres" (Choi et al., 2017). Cependant, Bahorik et al. ont constaté que les risques que ces races développent la maladie d'Alzheimer sont de 12,5 % pour les Blancs, 16,8 % pour les Noirs, 14,6 % pour les Asiatiques et 25,1 % pour les Hispaniques (2022). Ainsi, même si les Blancs ont le moins de chances de développer la maladie, ils sont les plus représentés dans les vidéos sur la MA. Les auteurs de l'étude affirment que ce facteur de risque est en partie dû à un certain nombre de facteurs, notamment les préjugés en matière de médecine et d'éducation et une qualité de vie inférieure. Il peut s'agir de racisme dans l'industrie médicale et d'un accès moindre à l'éducation ou à l'aide médicale (Bahorik et al., 2022). Bien que certaines ethnies soient plus susceptibles d'être diagnostiquées avec la maladie d'Alzheimer, elles sont largement sous-représentées dans les médias.
Désinformation
De nombreux détails sont omis dans la présentation de la maladie d'Alzheimer par les médias, dont certains nous échappent. Lorsqu'ils lisent un article ou regardent une vidéo, beaucoup de gens ne s'arrêtent pas pour se demander "quelle est la source de cette information" ou "quelles sont les références de cette personne pour parler de ce sujet ?" La même étude de Choi et al. s'est penchée sur ces questions. Ils ont constaté que non seulement les informations provenaient d'une source non crédible, mais aussi que le format des vidéos était discutable. Seules 9,6 % des vidéos examinées étaient qualifiées de "présentation formelle", tandis que la majorité était qualifiée de "présentation informelle" (Choi et al., 2017). En outre, seules 3,3 % des vidéos provenaient d'un chercheur, 25,5 % d'une organisation à but non lucratif ou d'une université, et 21 % d'un profane. Les chercheurs ont également constaté que de nombreuses informations manquaient dans toutes ces vidéos, notamment le fait que certains choix de mode de vie peuvent contribuer à réduire le risque de déclin cognitif qui accompagne la maladie d'Alzheimer. Il est important d'être bien informé sur cette maladie pour éviter les préjugés et les stéréotypes (une idée trop simplifiée ou généralisée d'un groupe ou d'une personne), et pour être en mesure de comprendre les personnes qui en souffrent et de les traiter sur un pied d'égalité.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Alzheimer's disease » (voir la liste des auteurs).
- (en) « Dementia Fact sheet N°362 » [archive du ], World Health Organization, (consulté le ).
- (en) Mendez MF, « Early-onset Alzheimer's disease: nonamnestic subtypes and type 2 AD », Archives of Medical Research, vol. 43, no 8, , p. 677–85 (PMID 23178565, PMCID 3532551, DOI 10.1016/j.arcmed.2012.11.009).
- (en) R. Lozano, M. Naghavi et K. Foreman, « Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. », Lancet, vol. 380, no 9859, , p. 2095–128 (PMID 23245604, DOI 10.1016/S0140-6736(12)61728-0).
- Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP, « Impact économique de la démence », Presse Med, vol. 34, no 1, , p. 35–41 (ISSN 0755-4982, PMID 15685097).
- (en) PD Meek, K McKeithan et GT Schumock, « Economic considerations in Alzheimer's disease », Pharmacotherapy, vol. 18, no 2 Pt 2, , p. 68–73 ; discussion 79–82. (PMID 9543467).
- Checler F, Buée L, « Données fondamentales sur les maladies amyloïdes et Tau dans la maladie d'Alzheimer: quelles perspectives thérapeutiques? », Annales Pharmaceutiques Françaises, vol. 67, no 2, , p. 136-153 (DOI 10.1016/j.pharma.2009.01.002, lire en ligne).
- Auguste D. :
- (de) Alzheimer Alois, « Über eine eigenartige Erkrankung der Hirnrinde » [« About a peculiar disease of the cerebral cortex »], Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich Medizin, vol. 64, nos 1–2, , p. 146–148
- (en) Alzheimer Alois, « About a peculiar disease of the cerebral cortex », Alzheimer Dis Assoc Disord, vol. 1, no 1, , p. 3–8 (PMID 3331112)
- (en) Maurer Ulrike et Maurer Konrad, Alzheimer : the life of a physician and the career of a disease, New York, Columbia University Press, (ISBN 0-231-11896-1), p. 270.
- (en) Berrios G E, « Alzheimer's disease: a conceptual history », Int. J. Ger. Psychiatry, vol. 5, no 6, , p. 355–365 (DOI 10.1002/gps.930050603).
- (en) Kraepelin Emil, Diefendorf A. Ross (traduit par), Clinical Psychiatry : A Textbook For Students And Physicians (Reprint), Kessinger Publishing, (ISBN 978-1-4325-0833-3 et 1-4325-0833-4), p. 568.
- (en) Katzman Robert, Terry Robert D, Bick Katherine L (editors), Alzheimer's disease : senile dementia and related disorders, New York, Raven Press, (ISBN 0-89004-225-X), p. 595.
- (en) Boller F, Forbes MM, « History of dementia and dementia in history: an overview », J Neurol Sci, vol. 158, no 2, , p. 125–133. (PMID 9702682, DOI 10.1016/S0022-510X(98)00128-2).
- (en) Amaducci LA, Rocca WA, Schoenberg BS, « Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosology », Neurology, vol. 36, no 11, , p. 1497–1499 (PMID 3531918).
- [PDF] Document de 140 pages sur l’observatoire national sur la recherche sur la maladie d'Alzheimer, voir aussi le site de l'ONRA.
- « La démence », sur who.int (consulté le ).
- Étude épidémiologique française ayant porté sur 3 000 sujets suivis durant 14 ans, H. Amieva et al. Ann Neurol. 2008 64;492.
- (en) Dementia: New insights into causes of loss of orientation, sciencedaily.com, 12 janvier 2016.
- (en) Yew B1, Alladi S, Shailaja M, Hodges JR, Hornberger M., Lost and forgotten? Orientation versus memory in Alzheimer's disease and frontotemporal dementia, ncbi.nlm.nih.gov, 2013.
- La perte de l'orientation, un signe de la maladie d'Alzheimer, topsante.com, 26 avril 2016.
- Sandrine Cabut, « Alzheimer : dix signes avant-coureurs de la maladie », Le Monde, (consulté le ).
- (en) G Waldemar, B Dubois, M Emre, J. Georges, I. G. McKeith, M. Rossor, P. Scheltens, P. Tariska et B. Winblad, « Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline », Eur J Neurol, vol. 14, no 1, , e1–26. (PMID 17222085, DOI 10.1111/j.1468-1331.2006.01605.x).
- (en) Nygård L, « Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment? », Acta Neurol Scand, vol. Suppl, no 179, , p. 42–46. (PMID 12603250, DOI 10.1034/j.1600-0404.107.s179.8.x).
- (en) Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ, « Multiple cognitive deficits during the transition to Alzheimer's disease », J Intern Med, vol. 256, no 3, , p. 195–204 (PMID 15324363, DOI 10.1111/j.1365-2796.2004.01386.x).
- (en) Arnáiz E, Almkvist O, « Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease », Acta Neurol Scand, vol. 107, no Suppl. s179, , p. 34–41. (PMID 12603249, DOI 10.1034/j.1600-0404.107.s179.7.x).
- (en) Landes AM, Sperry SD, Strauss ME, Geldmacher DS, « Apathy in Alzheimer's disease », J Am Geriatr Soc, vol. 49, no 12, , p. 1700–1707. (PMID 11844006, DOI 10.1046/j.1532-5415.2001.49282.x).
- (en) Petersen RC, « The current status of mild cognitive impairment—what do we tell our patients? », Nat Clin Pract Neurol, vol. 3, no 2, , p. 60–61. (PMID 17279076, DOI 10.1038/ncpneuro0402).
- (en) Förstl H, Kurz A, « Clinical features of Alzheimer's disease », European Archives of Psychiatry and Clinical Neuroscience, vol. 249, no 6, , p. 288–290. (PMID 10653284, DOI 10.1007/s004060050101).
- A.-M. Ergis, E. Eusop-Roussel, « Les troubles précoces de la mémoire épisodique dans la maladie d’Alzheimer [Early episodic memory impairments in Alzheimer's disease] » Revue Neurologique, mai 2008;164(Supplément 3):S96–S101. .
- (en) Carlesimo GA, Oscar-Berman M, « Memory deficits in Alzheimer's patients: a comprehensive review », Neuropsychol Rev, vol. 3, no 2, , p. 119–169 (PMID 1300219, DOI 10.1007/BF01108841).
- (en) Jelicic M, Bonebakker AE, Bonke B, « Implicit memory performance of patients with Alzheimer's disease: a brief review », International Psychogeriatrics, vol. 7, no 3, , p. 385–392. (PMID 8821346, DOI 10.1017/S1041610295002134).
- (en) Taler V, Phillips NA, « Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review », J Clin Exp Neuropsychol, vol. 30, no 5, , p. 501–556. (PMID 18569251, DOI 10.1080/13803390701550128).
- (en) Frank EM, « Effect of Alzheimer's disease on communication function », J S C Med Assoc, vol. 90, no 9, , p. 417–423. (PMID 7967534).
- (en) Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A, « Sundowning and circadian rhythms in Alzheimer's disease », Am J Psychiatry, vol. 158, no 5, , p. 704–711 (PMID 11329390, DOI 10.1176/appi.ajp.158.5.704, lire en ligne, consulté le ).
- (en) Gold DP, Reis MF, Markiewicz D, Andres D, « When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia », J Am Geriatr Soc, vol. 43, no 1, , p. 10–16 (PMID 7806732).
- Michael Nehls et Jill Enders (illustrateur) (trad. de l'allemand), Guérir Alzheimer : comprendre et agir à temps, Arles, Actes Sud, , 420 p. (ISBN 978-2-330-07283-4).
- (en) "2018,Nbci: Alzheimer's Amyloid-β is an Antimicrobial Peptide: A Review of the Evidence.".
- "Nbci, 2018:Infection of Fungi and Bacteria in Brain Tissue From Elderly Persons and Patients With Alzheimer's Disease.".
- "Pour la science, décembre 2018".
- "2017, Online library, Implications of γ‐secretase in microglial function".
- "2019:Astrocytes infected with Chlamydia pneumoniae demonstrate altered expression and activity of secretases involved in the generation of β-amyloid found in Alzheimer disease".
- "Reactive Astrocytes in Neurodegenerative Diseases".
- "Nbci, 2017:The role of astrocytes in amyloid production and Alzheimer's disease".
- "Youtube, Amyloid Plaque (Alzheimer): Gamma secretase and APP, 1m19/1m59".
- "Aspects génétiques de la maladie d'Alzheimer".
- "Nature 2017:Gut microbiome alterations in Alzheimer’s disease".
- (en) Tremblay C., François A, Delay C, Freland L, Vandal M, Bennett DA et Calon F, « Association of Neuropathological Markers in the Parietal Cortex With Antemortem Cognitive Function in Persons With Mild Cognitive Impairment and Alzheimer Disease. Journal of neuropathology and experimental neurology », J Neuropathol Exp Neurol, , p. 70-88 (ISSN 1554-6578, lire en ligne).
- (en) Tremblay C, Pilote M, Phivilay A, Emond V, Bennett DA et Calon F, « Biochemical Characterization of Aβ and Tau maladies in Mild Cognitive Impairment and Alzheimer's Disease », Journal of Alzheimer's Disease 12, , p. 377-390 (ISSN 1387-2877, lire en ligne).
- (en) Delacourte A, David JP, Sergeant N et al. « The biochemical pathway of neurofibrillary degeneration in aging and Alzheimer's disease » Neurology 1999;52:1158-65.
- (en) Delacourte A, Buée L. « Normal and pathological Tau proteins as factors for microtubule assembly » Int Rev Cytol. 1997;171:167-224.
- (en) Wenk GL, « Neuropathologic changes in Alzheimer's disease », J Clin Psychiatry, vol. 64 Suppl 9, , p. 7–10. (PMID 12934968).
- (en) Desikan RS, Cabral HJ, Hess CP et al., « Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer's disease », Brain, vol. 132, no Pt 8, , p. 2048–2057. (PMID 19460794, PMCID 2714061, DOI 10.1093/brain/awp123).
- (en) Moan R, « MRI software accurately IDs preclinical Alzheimer's disease », Diagnostic Imaging, (lire en ligne).
- « Maladie d’Alzheimer : que se passe-t-il dans le cerveau ? », sur Fondation pour la Recherche Médicale (consulté le ).
- Recommandations de la HAS, page 2.
- « Diagnostic de la maladie d'Alzheimer », sur Fondation pour la Recherche sur Alzheimer (consulté le ).
- Grégoria Kalpouzos, Francis Eustache, Béatrice Desgranges Réserve cognitive et fonctionnement cérébral au cours du vieillissement normal et de la maladie d’Alzheimer, Inserm, Psychologie et NeuroPsychiatrie du vieillissement. Volume 6, Numéro 2, p. 97-105, juin 2008, Article intégral.
- Recommandations HAS 2011[PDF], sur le site has-sante.fr
- test CODEX, sur le site esculape.com
- Test de l'horloge, sur le site ammppu.org
- Le test de 5 mots, sur le site esculape.com
- Test, sur le site mocatest.org
- Test de Gröber et Buschke[PDF], sur le site cofemer.fr
- (en) Ralph M. Reitan, « Validity of the Trail Making Test as an indicator of organic brain damage », Perceptual and Motor Skills, vol. 8, no 3, , p. 271-276 (ISSN 0031-5125 et 1558-688X, DOI 10.2466/pms.1958.8.3.271, lire en ligne, consulté le ).
- Test de Stroop sur le site psycho.univ-paris5.fr
- « Nina, le robot qui apprend à parler aussi avec les yeux », sur lepoint.fr, (consulté le ).
- (en) « Ten Incredibly Lifelike Humanoid Robots To Get On Your Radar », sur forbes.com, (consulté le ).
- Serge Bakchine et Marie-Odile Habert, « Classification des démences : aspects nosologiques », Médecine Nucléaire, vol. 31, no 6, , p. 278–293 (lire en ligne [PDF]).
- « Les facteurs de risque génétiques », sur alzheimer-genetique.fr (consulté le ).
- Height and Alzheimer's disease: findings from a case-control study.
- (en) M.S. Beeri, M. Davidson, J.M. Silverman, S. Noy, J. Schmeidler et U. Goldbourt, « Relationship between body height and dementia », Am J Geriatr Psychiatry, vol. 13, (lire en ligne [PDF]).
- « Alcoolisme et risque de démences », sur Inserm, (consulté le ).
- (en)Kivipelto M, Helkala EL, Laakso MP, Hanninen T, Hallikainen M, Alhainen K, et al. Midlife vascular risk factors and Alzheimer’s disease in later life: longitudinal, population based study. BMJ 2001;322:1447-51 (Résumé).
- (en)Whitmer RA, Sidney S, Selby J, Johnston SC, Yaffe K. Midlife cardiovascular risk factors and risk of dementia in late life. Neurology 2005;64:277-81 (Résumé).
- (en)Luchsinger JA, Reitz C, Honig LS, Tang MX, Shea S, Mayeux R. Aggregation of vascular risk factors and risk of incident Alzheimer disease. Neurology 2005;65:545-51 (Résumé).
- (en)Newman AB, Fitzpatrick AL, Lopez O, Jackson S, Lyketsos C, Jagust W, et al. Dementia and Alzheimer’s disease incidence in relationship to cardiovascular disease in the Cardiovascular Health Study cohort. J Am Geriatr Soc 2005;53:1101-7.
- (en)Nien-Chen Li, Austin Lee, Rachel A Whitmer, Miia Kivipelto, Elizabeth Lawler, Lewis E Kazis & Benjamin Wolozin ; Use of angiotensin receptor blockers and risk of dementia in a predominantly male population: prospective cohort analysis ; BMJ 2010;340:b5465, doi:10.1136/bmj.b5465 (2010/01/12) ; résumé, publié en Creative Commons Attribution Non-commercial License, consulté 5 avril 2010).
- (en)De la Torre JC. Is Alzheimer’s disease a neurodegenerative or a vascular disorder ? Data, dogma, and dialectics. Lancet Neurol 2004;3:184-90.
- (en) Ruitenberg A, den Heijer T, Bakker SL, van Swieten JC, Koudstaal PJ, Hofman A, et al. « Cerebral hypoperfusion and clinical onset of dementia: the Rotterdam Study » Ann Neurol. 2005;57:789-94.
- (en) Encinas M, De Juan R, Marcos A, Gil P, Barabash A, Fernandez C, et al. « Regional cerebral blood flow assessed with 99mTc-ECD SPET as a marker of progression of mild cognitive impairment to Alzheimer’s disease » Eur J Nucl Med Mol Imaging 2003;30:1473-80.
- (en) « Use of angiotensin receptor blockers and risk of dementia in a predominantly male population: prospective cohort analysis » BMJ 2010;340:b5465. DOI 10.1136/bmj.b5465.
- (en) Sjogren M, Mielke M, Gustafson D, Zandi P, Skoog I. « Cholesterol and Alzheimer’s disease—is there a relation ? » Mech Ageing Dev. 2006;127:138-47.
- (en) Morris MC, Evans DA, Bienias JL, Tangney CC, Bennett DA, Aggarwal N, Schneider J, Wilson RS, « Dietary fats and the risk of incident Alzheimer disease », Arch Neurol, vol. 60, no 2, , p. 194-200. (PMID 12580703).
- (en) Winblad B, Amouyel P, Andrieu Sandrine, Ballard C, Brayne C et & al, « Defeating Alzheimer's disease and other dementias : a priority for European science and society », The Lancet Neurology Commission, vol. 15, , p. 455-532 (ISSN 1474-4422, lire en ligne).
- « Huile de coco, café… : sont-ils réellement bénéfiques contre Alzheimer ? », sur Fondation Vaincre Alzheimer, (consulté le ).
- (en) T. Ohara, Y. Doi, T. Ninomiya, Y. Hirakawa, J. Hata, T. Iwaki, S. Kanba et Y. Kiyohara, « Glucose tolerance status and risk of dementia in the community », Neurology, vol. 77, (résumé).
- (en) P.K. Crane, R. Walker, R.A. Hubbard et al., « Glucose Levels and Risk of Dementia », N Engl J Med, vol. 369, (lire en ligne).
- https://www.fondation-alzheimer.org/herpes-et-si-la-maladie-dalzheimer-etait-dorigine-virale/
- https://www.alz.org/research/for_researchers/partnerships/sars-cov2-global-brain-study
- https://www.ft.com/content/6d0185f6-21e8-4fe3-9776-a2170af99e82
- J.-F. Dartigues, C. Berr, C. Helmer et L. Letenneur, « Épidémiologie de la maladie d’Alzheimer », Med Sci (Paris), vol. 18, nos 6-7, , p. 737-743 (DOI 10.1051/medsci/20021867737).
- (en) A.F. Jorm, « Is depression a risk factor for dementia or cognitive decline : a review » Gerontology 2000; 46:219-227.
- Meta-analysis of modifiable risk factors for Alzheimer's disease.
- Yanjun Li, Yongming Li, Xiaotao Li et Shuang Zhang, « Head Injury as a Risk Factor for Dementia and Alzheimer's Disease: A Systematic Review and Meta-Analysis of 32 Observational Studies », PloS One, vol. 12, no 1, , e0169650 (ISSN 1932-6203, PMID 28068405, PMCID 5221805, DOI 10.1371/journal.pone.0169650, lire en ligne, consulté le )
- Jieyu Zhang, Yongkang Zhang, Juntao Zou et Fei Cao, « A meta-analysis of cohort studies: Traumatic brain injury and risk of Alzheimer's Disease », PloS One, vol. 16, no 6, , e0253206 (ISSN 1932-6203, PMID 34157045, PMCID 8219123, DOI 10.1371/journal.pone.0253206, lire en ligne, consulté le )
- (en) Rusanen M, Kivipelto M, Quesenberry Jr CP, Zhou J, Whitmer RA, « Heavy smoking in midlife and long-term risk of Alzheimer disease and vascular dementia » Arch Intern Med. 2011;171:333-339.
- (en) « The Role of Physical Activityinthe Prevention and Management of Alzheimer’s Disease—Implications for Ontario » [PDF].
- (en) Takanori Honda, Tomoyuki Ohara, Masakazu Shinohara, Jun Hata, Ryuji Toh, Daigo Yoshida, Mao Shibata, Tatsuro Ishida, Yoichiro Hirakawa, Yasuhiro Irino, Satoko Sakata, Kazuhiro Uchida, Takanari Kitazono, Shigenobu Kanba, Ken-Ichi Hirata, Toshiharu Ninomiya, « Serum elaidic acid concentration and risk of dementia », Neurology, vol. 93, no 22, (DOI 10.1212/WNL.0000000000008464, lire en ligne).
- (en) Fratiglioni L, Launer LJ, Andersen K, et al. « Incidence of dementia and major subtypes in Europe: a collaborative study of population-based cohorts » Neurology 2000;54(suppl 5):S10-5.
- « L'abus de tranquillisants et de somnifères augmenterait le risque d'Alzheimer », Le Monde.fr, (lire en ligne).
- Lien possible entre les benzodiazépines et la Maladie d'Alzheimer.
- Les anxiolytiques et somnifères augmenteraient le risque d'Alzheimer.
- Crapper D.R & Dalton A.J. (1973) Alterations in short-term retention, conditioned avoidance response acquisition and motivation following aluminum induced neurofibrillary degeneration, Physiol. Behav., 10,925-933.
- Crapper D.R & Dalton A.J. (1973) Aluminum induced neurofibrillary degeneration, brain electrical activity and alterations in acquisition and retention, Phisiol. Behav., 10, 935-945.
- Crapper D.R, Krishnan S.S & Quittkat S (1976) Aluminium, neurofibrillary degeneration and Alzheimer'sdisease, Brain, 99, 67'80.
- Trapp G.A., Miner G.D, Zimmerman R.L, Mastri A.R & Heston L.L (1978) Aluminum levels in brain in Alzheimer'sdisease, Biol. Psychiat., 13,709-718.
- Scott W, Fieles A, Sygowski L.A & Caputo C.B (1993) Aggregation of tau-protein by aluminum, Brain Res.,628,77-84.
- Kawahara M, Muramoto K, Kobvayashi K, Mori H & Kurodo Y (1994), Aggregation and neurotoxicity of amyloid p-protein acceleration by aluminum, Neurobiol. Aging, 15,S49-S50.
- Chong Y.H & Suh Y.H (1995) Aggregation of amyloid precursor proteins by aluminium in vitro, Brain Res., 670, 137-141.
- Mc Dermot J.R, Smith A.I, Iqbal K & Wisniewski H.M (1979) Brain aluminum in aging and Alzheimer disease, Neurology, 29, 804_811.
- Farrar G., Altmann P & Welch S (1990), Accumulation cérébrale d'aluminium dans la maladied'Alzheimeer et le syndrome de Down, The Lancet,335'747'750.
- Perl D.P & Brody A.R, (l980) Alzheimer's diseaese : X-ray spectrometric evidence of aluminum accumulation in neurofibrillary tangle-bearing neurons, Science, 208,297-299.
- Candy & al. (1986) Aluminosilicates and seniles plaque formation in Alzheimer's disease, Lancet, I' 354-357.
- (en) Birchall J.D. & Chappel J.S (1988), Aluminium, chemical physiology, and Alzheimer's disease Lancet, 1008'101.
- (en) Zatta P, Giordano R, Corain B. & Bombi G.G (1988) Alzheimer dementia and the aluminum hypothesis, Medical Hypotheses, 26, 139-142.
- (en) Zatta et al. (1995). Different effect of aluminum upon carbonic anhydrases and Na+lK+-ATPase activities in rat, Neurosci' Lett., 197,65-6.
- (en) Harrington & al. (1994) Alzheimer's-disease-lickheanges in tau proteinp rocessing association with aluminium accumulation in brains of renal dialysis patients, Lancet, 343,993-997.
- (en) Corain & al. (1990) Alzheimer's diseaseand aluminum toxicology, Environ. Health Perso., 89,233-23.
- (en) Jacqumin-Gadda & al. (1996) Silica and aluminum in drinking water and cognitive impairment in the elderly, Eoidemiology, 7, 28r-28.
- (en) Suarez Fernandez, M. B., Torreblanca Pacios, A., Goenaga Infante, H., Soldado, A. B., Sanz Medel, A., Vega, J. A., & Novelli, A. (1996). Aluminium accumulation and toxicity in cultured neurons and astrocytes. In Metal ions in biology and medicine-International Symposium (Vol. 4, pp. 284-286).
- (en) Deloncle, R., Guillard, O., Huguet, F., & Clanet, F. (1995) Modification of the blood-brain barrier through chronic intoxication by aluminum glutamate. Biological trace element research, 47(1-3), 227-233.
- Sahin G, Taskin T, Benli K & Duru S (1995) Impairment of motor coordination in mice after ingestion of aluminum chloride, Biol. Trace Elem.R es.,50,79-85.
- (en) Martyn CN, Barker JP, Osmond C, Harris EC, Edwarson JA, Lacey RF (1989) « Geographical relation between Alzheimer’s disease and aluminium in drinking water » Lancet ; 14:59-62.
- (en) Martyn C, Coggon D, Lacey R. « Aluminium concentrations in drinking water and risk of Alzheimer’s disease » Epidemiology 1997;8:281-286.
- (en) Rondeau V, Commenges D, Jacqmin-Gadda H, Dartigues JF. « Relation between aluminum concentrations in drinking water and Alzheimer’s disease: An 8-year followup study » Am J Epidemiol. 2000;152:59-66.
- Flaten T.P (1987) Geographical associationsbetween aluminum in drinking water and dementia, Parkinson's diseaseand amyotrophic lateral sclerosisin Norway, Trace Elements in Medicine,4,17.
- Flaten T.P (1990) Geographical associationsbetween aluminum in drinking water and death rates with dementia (including Alzheimer's disease), Parkinson's disease and amyotrophiclateral sclerosis in Norway, Environ. Geochem.Health,12,152-168.
- Neri L.C & Hewitt D (1991) Aluminium, Alzheimer'sdisease, and drinking water, Lancet, 338,390.
- Forbes W.F & Mc Lachlan D.R.C (1996) Further thoughts on the aluminum'Alzheimer's diseasel ink, J.Enidemiol. Commun. Health, 50,401-403.
- Lukiw W.J (1997) Alzheimer's disease and aluminum, In Mineral and Metal Neurotoxicolory, 12, 113-!26, Yasui M., Strong M., Ota K. & Verity M.A (éds.), CRC Press, Boca Raton Florida.
- Savory (1996) Can the controversy of the role of aluminum in Alzheimer's disease be resolved ? What are the suggested approaches to this controversy and methodological issues to be considered ?, J. Toxicol.Env. Health, 48,615-635.
- M. Grosman et A. Picot, « Facteurs environnementaux impliqués dans la maladie d’Alzheimer. Le mercure dentaire, probable déterminant majeur », Médecine & Longévité, vol. 1, (résumé).
- (en)Thompson CM, Markesbery WR, Ehmann WD, Mao YX, Vance DE Regional brain trace-element studies in Alzheimer's disease. Neurotoxicology. 1988 Spring;9(1):1-7.
- (en)Ehmann WD, Markesbery WR, Alauddin M, Hossain TI, Brubaker EH ; Brain trace elements in Alzheimer's disease ; Neurotoxicology. 1986 Spring;7(1):195-206.
- (en)Increased blood mercury levels in patients with Alzheimer's disease. Hock C, Drasch G, Golombowski S, Müller-Spahn F, Willershausen-Zönnchen B, Schwarz P, Hock U, Growdon JH, Nitsch RM. J Neural Transm. 1998;105(1):59-68.
- OMS (WHO/IPCS) ; 1991 : extrait de Global Mercury Assessment (ONU; Mercury Programm, chap. 4). (lire en ligne).
- (en)Weiner JA, Nylander M. ; The relationship between mercury concentration in human organs and different predictor variables. Sci Total Environ. Septembre 1993 ; 0;138(1-3):101-15.
- (en)Nylander M, Friberg L, Lind B ; Mercury concentrations in the human brain and kidneys in relation to exposure from dental amalgam fillings. Swed Dent J. ; 1987 ; 11(5):179-87.
- (en) Eggleston DW, Nylander M J Prosthet ; Correlation of dental amalgam with mercury in brain tissue. Dent. ; décembre 1987 ; 58(6):704-7.
- (en) G. Drasch, I. Schupp, H. Höfl, R. Reinke et G. Roider, « Mercury burden of human fetal and infant tissues », Eur J Pediatr, vol. 153, no 8, , p. 607-10 (lire en ligne [PDF]).
- (en)Guzzi G, Grandi M, Cattaneo C, Calza S, Minoia C, Ronchi A, Gatti A, Severi G. Dental amalgam and mercury levels in autopsy tissues: food for thought ; Am J Forensic Med Pathol. 2006 Mar;27(1):42-5.
- (en)Pendergrass JC, Slevin JT, Haley BE. Duhr EF, HgEDTA complex inhibits GTP interactions with the E-site of brain beta-tubulin. ; Toxicol Appl Pharmacol. 1993 Oct;122(2):273-80.
- (en)Mutter J, Naumann J, Sadaghiani C, Schneider R, Walach H. Alzheimer disease: mercury as pathogenetic factor and apolipoprotein E as a moderator ; Neuro Endocrinol Lett. octobre 2004 ; 25(5):331-9.
- (en) M Bates et al., « Health effects of dental amalgam exposure: a retrospective cohort study », Int. J. Epidemiol, no 33 (4), , p. 894-902 (lire en ligne).
- (en) Does Inorganic Mercury Play a Role in Alzheimer’s Disease? A Systematic Review, J Mutter, J Alzheimers Dis. 2010; 22(2):357-74.
- « Trois professionnels à consulter en cas de doute d'Alzheimer », sur Fondation Vaincre Alzheimer, (consulté le ).
- « IRM : il faut encore 30 jours d'attente en moyenne », sur Santé Magazine, (consulté le ).
- « IRM Cerebral : tout savoir sur l'examen », sur Irm Paris 14 (consulté le ).
- « Alzheimer : diagnostiquer et annoncer la maladie », sur Allo docteurs, (consulté le ).
- Selon le rapport du prof. Ménard.
- Caire, J.-M., Sarrazy, B. & Tétreault, S. (2016). Étude sur les conditions de maintien à domicile dans le cas d'une maladie d'Alzheimer ou maladie apparentée. In M.-H. Izard (Dir.), Expériences en ergothérapie, 29e série (p. 379-388). Montpellier : Sauramps Médical.
- « Étude Pixel[PDF] »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- HAS : Maladie d'Alzheimer et maladies apparentées : suivi médical des aidants naturels.
- (en)Wilson RS, The relation of cognitive activity to risk of developing Alzheimer's disease. Neurology, 27 juin 2007.
- (en) Drew M Altschul et Ian J Deary, « Playing Analog Games Is Associated With Reduced Declines in Cognitive Function: A 68-Year Longitudinal Cohort Study », The Journals of Gerontology: Series B, , gbz149 (ISSN 1079-5014 et 1758-5368, DOI 10.1093/geronb/gbz149, lire en ligne, consulté le ).
- (en) Jean François Dartigues, Alexandra Foubert-Samier, Mélanie Le Goff et Mélanie Viltard, « Playing board games, cognitive decline and dementia: a French population-based cohort study », BMJ Open, vol. 3, no 8, , e002998 (ISSN 2044-6055 et 2044-6055, PMID 23988362, PMCID PMC3758967, DOI 10.1136/bmjopen-2013-002998, lire en ligne, consulté le ).
- « Faire des études préserverait de la maladie d'Alzheimer », L'Obs.com, (lire en ligne).
- (en) C. Brayne, P.G. Ince, H.A.D. Keage, I.G. McKeith, F.E. Matthews, T. Polvikoski et R. Sulkava, « Education, the brain and dementia: neuroprotection or compensation? », Brain, Oxford University Press, vol. 133, no 8, , p. 2210-2216 (lire en ligne).
- (en) Lautenschlager NT, Cox KL, Flicker L, Foster JK, van Bockxmeer FM, Xiao J, Greenop KR et Almeida OP, « Effect of physical activity on cognitive function in older adults at risk for Alzheimer disease: a randomized trial », JAMA, vol. 300, no 9, , p. 1027-37 (PMID 18768414, DOI 10.1001/jama.300.9.1027, lire en ligne).
- (en) J.A. Luchsinger, C. Reitz, L.S. Honig, M.X. Tang, S. Shea et R. Mayeux, « Aggregation of vascular risk factors and risk of incident Alzheimer disease », Neurology, vol. 65, , p. 545-51 (PMID 16116114, lire en ligne [PDF]).
- (en) St-Amour I, Cicchetti F et Calon F, « Immunotherapies in Alzheimer's disease: Too much, too little, too late or off-target? », Acta Neuropathologica, vol. 131, , p. 481-504 (ISSN 1432-0533, lire en ligne).
- (en) Susana López-Ortiz, Simone Lista, Pedro L. Valenzuela et José Pinto-Fraga, « Effects of physical activity and exercise interventions on Alzheimer’s disease: an umbrella review of existing meta-analyses », Journal of Neurology, (ISSN 0340-5354 et 1432-1459, DOI 10.1007/s00415-022-11454-8, lire en ligne, consulté le )
- (en) « Dietary risk factors for Alzheimer's disease are well known », British Medical Journal, (lire en ligne, consulté le ).
- (en) Christina Finn, « Too much red meat and iron supplements linked to Alzheimer's disease », sur TheJournal.ie (consulté le ).
- (en) Too much of red meat, fish may cause Alzheimer’s, sur le site indiatimes.com du .
- (en) Methionine in Meat, Other Foods May Increase Alzheimer's Risk, sur le site emaxhealth.com du .
- (en) Albanese E, Dangour AD, Uauy R, Acosta D, Guerra M, Guerra SS, Huang Y, Jacob KS, de Rodriguez JL, Noriega LH, Salas A, Sosa AL, Sousa RM, Williams J, Ferri CP, Prince MJ. « Dietary fish and meat intake and dementia in Latin America, China, and India: a 10/66 Dementia Research Group population-based study », Am J Clin Nutr. 2009;90(2):392-400. DOI 10.3945/ajcn.2009.27580.
- Topsante.com, « Alzheimer : un régime qui réduit le risque jusqu'à 53% - Top Santé », sur www.topsante.com, (consulté le )
- (en) Martha Clare Morris, Christy C. Tangney, Yamin Wang et Frank M. Sacks, « MIND diet associated with reduced incidence of Alzheimer's disease », Alzheimer's & Dementia, vol. 11, no 9, , p. 1007–1014 (ISSN 1552-5260 et 1552-5279, PMID 25681666, PMCID PMC4532650, DOI 10.1016/j.jalz.2014.11.009, lire en ligne, consulté le )
- (en) C. La Morgia, F.N. Ross-Cisneros, Y. Koronyo et al., « Melanopsin retinal ganglion cell loss in Alzheimer disease », Ann Neurol., vol. 79, (DOI 10.1002/ana.24548, lire en ligne [PDF]).
- Lindzi Wessel, « Alzheimer’s may mess with the eyes, disrupting sleep patterns », Science Mag.org, (lire en ligne).
- (en) Riemersma-van der Lek et al., « Effect of bright light and melatonin on cognitive and non cognitive function of elderly residents of group care facilities : A randomized controlled trial », JAMA, vol. 299, , p. 2642-2655 (DOI 10.1001/jama.299.22.2642).
- Cité dans un « Article de Julie Luong intitulé Lumière et mélatonine contre la maladie d'Alzheimer »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur info-alzheimer.be ().
- (en)Kehoe PG, Wilcock GK. Is inhibition of the renin-angiotensin system a new treatment option for Alzheimer’s disease? ; Lancet Neurol 2007;6:373-8.
- (en)Skoog I, Lithell H, Hansson L, Elmfeldt D, Hofman A, Olofsson B, et al. ; Effect of baseline cognitive function and antihypertensive treatment on cognitive and cardiovascular outcomes: Study on COgnition and Prognosis in the Elderly (SCOPE). Am J Hypertens 2005;18:1052-9. (CrossRef).
- (en)Forette F, Seux ML, Staessen JA, Thijs L, Babarskiene MR, Babeanu S, et al. The prevention of dementia with antihypertensive treatment: new evidence from the Systolic Hypertension in Europe (Syst-Eur) study. Arch Intern Med 2002;162:2046-52. (Résumé).
- (en)Ara S. Khachaturian et al. ; Antihypertensive Medication Use and Incident Alzheimer Disease ; Arch Neurol. 2006;63:686-692. Mis en lgine le 13 mars 2006 (doi:10.1001/archneur.63.5.noc60013) (Résumé).
- (en)Matchar DB, McCrory DC, Orlando LA, Patel MR, Patel UD, Patwardhan MB, et al. ; Systematic review: comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers for treating essential hypertension. ; Ann Intern Med 2008;148:16-29.
- (en)Jick H, Zornberg GL, Jick SS, Seshadri S, Drachman DA. Statins and the risk of dementia. Lancet 2000;356:1627-31.
- Anti-Inflammatory Drugs and Risk of Alzheimer's Disease: An Updated Systematic Review and Meta-Analysis.
- (en) Mahyar Etminan, Sudeep Gill et Ali Samii, « Effect of non-steroidal anti-inflammatory drugs on risk of Alzheimer's disease: systematic review and meta-analysis of observational studies », BMJ, vol. 327, (lire en ligne [PDF]).
- avec AFP, « Un malade d'Alzheimer sur deux ne serait pas pris en charge », Sciences et Avenir.fr, (lire en ligne).
- « Un malade d’Alzheimer sur deux ne serait pas diagnostiqué en France », Le Monde.fr, (lire en ligne).
- Amélie Wallyn, « L'ESAD : une équipe pour votre mémoire et votre autonomie ! », sur Autonome à Domicile, (consulté le )
- « Plan « Alzheimer et maladies apparentées » 2008-2012 » [PDF], sur CNSA : caisse nationale de solidarité pour l'autonomie,
- « Mnemotherapie par declenchement de la memoire involontaire », sur uspalz.com, .
- « Stimulation sensorielle », sur psychofac.fr.
- Polydor J-P, Alzheimer, mode d'emploi, le livre des aidants, préfacé par Madeleine Chapsal, prix Femina, L'esprit du temps Édition, 2009 (ISBN 2847951717).
- Avramito, M. & Hugentobler, V. (2019). Les colocations : un modèle alternatif de logements pour les personnes atteintes de la maladie d'Alzheimer. In F. Höpflinger, V. Hugentobler & D. Spini (dir.), Habitat et vieillissement. Réalités et enjeux de la diversité. Age Report IV (p. 237-247). Zurich et Genève : Seismo. Télécharger l'ouvrage entier.
- « Médicaments Alzheimer – Intérêt médical insuffisant », sur has-sante.fr (consulté le ).
- « Rapport d’évaluation des médicaments indiqués dans le traitement symptomatique de la maladie d’ALZHEIMER », sur Haute Autorité de Santé, 2016 octobre (consulté le ).
- BUEE, « Histoire des traitements de la maladie d’Alzheimer », Les Cahiers du Comité pour l'histoire de l'Inserm, , Les Cahiers du Comité pour l’histoire de l’Inserm, 2021, N°2, Vol.2, p.59-65 (lire en ligne [https://www.ipubli.inserm.fr/bitstream/handle/10608/10626/CCHI2-2_2021_BUEE_p59.pdf%5D).
- (en)Courtney C, Farrell D, Gray R, Hills R, Lynch L, Sellwood E, Edwards S, Hardyman W, Raftery J, Crome P, Lendon C, Shaw H, Bentham P; AD2000 Collaborative Group. Long-term donepezil treatment in 565 patients with Alzheimer's disease (AD2000): randomised double-blind trial. Lancet 2004;363:2105-15. .
- Amélioration du service médical rendu.
- la revue Prescrire, no 293, mars 2008.
- (en) (National Institute for Health and Clinical Excellence): Alzheimer's disease - donepezil, galantamine, rivastigmine (review) and memantine, sur guidance.nice.org.uk
- Revue Prescrire, Numéro 278, Médicaments de la maladie d'Alzheimer : à l'origine de tremblements et d'aggravation de symptômes parkinsoniens, décembre 2006.
- Revue Prescrire ; Les médicaments de la maladie d'Alzheimer, Mini dossier mis à jour le 15 février 2007.
- (en) Donepezil, galantamine, rivastigmine (review) and memantine for the treatment of Alzheimer's disease, National Institute for Health and Clinical Excellence (NICE).
- Réévaluation des médicaments Alzheimer, sur le site has-sante.fr
- (en) Areosa SA, McShane R, Sherriff F. Cochrane Database Syst Rev 2004(4);CD003154.pub2. PMID Memantine for dementia., sur le site nlm.nih.gov
- (en) Cédric Annweiler, François R. Herrmann, Bruno Fantino et Bernard Brugg, « Effectiveness of the combination of memantine plus vitamin D on cognition in patients with Alzheimer disease: a pre-post pilot study », Cognitive and Behavioral Neurology: Official Journal of the Society for Behavioral and Cognitive Neurology, vol. 25, no 3, , p. 121–127 (ISSN 1543-3641, PMID 22960436, DOI 10.1097/WNN.0b013e31826df647, lire en ligne, consulté le ).
- Maurice W. Dysken et Al. Effect of Vitamin E and Memantine on Functional Decline in Alzheimer Disease, The TEAM-AD VA Cooperative Randomized Trial http://www.drperlmutter.com/wp-content/uploads/2014/02/Vitamin-E-dementia.pdf.
- Haute Autorité de Santé « Maladie d’Alzheimer et maladies apparentées : prise en charge des troubles du comportement perturbateurs », argumentaire, HAS, mai 2009.
- Ricour C., Brutsaert S., Boland B., « Psychotropes au lieu de vie des personnes âgées, avec ou sans démence », Poster, Les rencontres Prescrire 2010.
- Benoit M, Staccini P, Brocker P, Benhamidat T, Bertogliati C, Lechowski L, et al. Symptômes comportementaux et psychologiques dans la maladie d'Alzheimer : résultats de l'étude REAL.FR. Rev Med Interne 2003;24(Suppl 3):319s-24s.
- (en)Aalten P, Verhey FR, Boziki M, Bullock R, Byrne EJ, Camus V, et al. ; Neuropsychiatric syndromes in dementia. Results from the European Alzheimer Disease Consortium: part I. Dement Geriatr Cogn Disord 2007;24(6):457-63.
- (en)Banerjee S, Hellier J, Dewey M, et al. Sertraline or mirtazapine for depression in dementia (HTA-SADD): a randomised, multicentre, double-blind, placebo-controlled trial, Lancet, 2011;378:403-411.
- Sink KM, Holden KF, Yaffe K. Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence. JAMA 2005;293(5):596-608.
- (en)Belmin J, Péquignot R, Konrat C, Pariel-Madjlessi S. Management of Alzheimer disease, Presse Med. 2007 Oct;36(10 Pt 2):1500-10. Epub 2007 Jun 29.
- (en)Rochon PA, Normand SL, Gomes T, et al. ; Antipsychotic therapy and short-term serious events in older adults with dementia. Arch Intern Med 2008;168:1090-6.
- Chevalier P., Continuer ou arrêter les neuroleptiques chez des patients déments ? Minerva 2009 8(1); 11-11.
- (en)Curran HV, Collins R, Fletcher S, Kee SC, Woods B, Iliffe S. Older adults and withdrawal from benzodiazepine hypnotics in general practice: effects on cognitive function, sleep, mood and quality of life. Psychol Med. 2003 Oct;33(7):1223-37.
- Dr Mary T. Newport, Maladie d'Alzheimer - et s'il existait un traitement ? 2014 Josette Lyon.
- Samuel T. Henderson (en) Ketone Bodies as a Therapeutic for Alzheimer’s Disease, Neurotherapeutics: The Journal of the American Society for Experimental NeuroTherapeutics, Vol. 5, No. 3, 2008.
- Thomas J. Littlejohns and al. (en) Vitamin D and the risk of dementia and Alzheimer disease, Neurology August 6, 2014 www.drperlmutter.com/wp-content/uploads/2014/08/Neurology-2014-Littlejohns-WNL.0000000000000755.pdf.
- Cedric Annweile and Al. (en) Vitamin D supplements: a novel therapeutic approach for Alzheimer patients, Front. Pharmacol., 28 January 2014 http://journal.frontiersin.org/article/10.3389/fphar.2014.00006/full.
- Balion C. et Al, Vitamin D, cognition, and dementia: a systematic review and meta-analysis, Neurology. 2012 Sep 25;79(13):1397-405, https://www.ncbi.nlm.nih.gov/pubmed/23008220.
- Scientists pinpoint how vitamin D may help clear amyloid plaques found in Alzheimer's (en), Journal of Alzheimer's Disease mars 2013, http://www.j-alz.com/content/scientists-pinpoint-how-vitamin-d-may-help-clear-amyloid-plaques-found-alzheimers.
- Cédric Annweiler et Al. (en) Higher Vitamin D Dietary Intake Is Associated With Lower Risk of Alzheimer’s Disease: A 7-Year Follow-up, The Journals of Gerontology: Series A, Volume 67, Issue 11, 1 November 2012, Pages 1205–1211 http://biomedgerontology.oxfordjournals.org/content/67/11/1205.abstract.
- (en) « Gossypetin found in hibiscus may beat Alzheimer's disease », sur Science Daily, (consulté le ).
- (en) Kyung Won Jo, Dohyun Lee, Dong Gon Cha, Eunji Oh, Yoon Ha Choi et al., « Gossypetin ameliorates 5xFAD spatial learning and memory through enhanced phagocytosis against Aβ », Alzheimer's Research & Therapy (en), vol. 14, , article no 158 (DOI 10.1186/s13195-022-01096-3
 ).
). - (en) Leinenga Gerhard, « Scanning ultrasound removes amyloid-β and restores memory in an Alzheimer’s disease mouse model », Science Translational Medicine, (lire en ligne).
- (en) Danièlle Gunn-Moore, Oksana Kaidanovich-Beilin, María Carolina Gallego Iradi et Frank Gunn-Moore, « Alzheimer's disease in humans and other animals: A consequence of postreproductive life span and longevity rather than aging », Alzheimer's & Dementia: The Journal of the Alzheimer's Association, vol. 0, no 0, (ISSN 1552-5260 et 1552-5279, PMID 28972881, DOI 10.1016/j.jalz.2017.08.014, lire en ligne, consulté le ).
- (en) « Dolphin brains show signs of Alzheimer’s Disease | University of Oxford », sur ox.ac.uk (consulté le ).
- (en) Marissa C. Vacher, Claire S. Durrant, Jamie Rose, Ailsa J. Hall, Tara L. Spires-Jones et al., « Alzheimer's disease-like neuropathology in three species of oceanic dolphin », European Journal of Neuroscience (en), (DOI 10.1111/ejn.15900).
- Alzheimer, vers un diagnostic plus précoce de la maladie ?, actualites-news-environnement.com, 10 juillet 2007.
- (en) David Holmes, Bruno Dubois: transforming the diagnosis of Alzheimer's disease, thelancet.com, juin 2014.
- Bliss Elizabeth O’Bryhim, MD, PhD & al. (2018) Association of Preclinical Alzheimer Disease With Optical Coherence Tomographic Angiography Findings| JAMA Ophthalmol. Mis en ligne le 23 aout 2018 |doi:10.1001/jamaophthalmol.2018.3556.
- Sarah Sermondadaz (2018) Une nouvelle méthode non invasive pour dépister la maladie d'Alzheimer dans la rétine , publié le 24 août.
- (en) Holmes C, Boche D, Wilkinson D, et al. Long-term effects of Aβ42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial, Lancet 2008;372:216-223.
- Le Pr Tohru Hasegawa travaille au Women's Junior College de Saga au Japon.
- (en) T. Hasegawa, N. Mikoda, M. Kitazawa et F.M. LaFerla, « Treatment of Alzheimer's Disease with Anti-Homocysteic Acid Antibody in 3xTg-AD Male Mice », PLOS One, vol. 5, no 1: e8593, (DOI 10.1371/journal.pone.0008593).
- Japon numéro 528 (1/02/2010) - Ambassade de France au Japon / ADIT.
- (en) Stephen S. Dominy1, Casey Lynch1, Florian Ermini..., Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors, advances.sciencemag.org
- Avancée inouïe pour la médecine : l’origine de la maladie d’Alzheimer a peut-être été identifiée…, handicap-info.fr
- Alzheimer : la piste des bactéries buccales se confirme, sciencesetavenir.fr, 30 janvier 2019.
- « Une bactérie buccale à l'origine de la maladie d'Alzheimer ? », sur Sciences et Avenir (consulté le ).
- (en)Arendash GW, Sanchez-Ramos J, Mori T, Mamcarz M, Lin X, Runfeldt M, Wang L, Zhang G, Sava V, Tan J, Cao C. ; Electromagnetic field treatment protects against and reverses cognitive impairment in Alzheimer's disease mice. ; J Alzheimers Dis. 2010 ; Jan;19(1):191-210. .
- Elena Sender, « Extraire le cholestérol du cerveau pour combattre Alzheimer », Science et Avenir.fr, (lire en ligne).
- (en) Vandal M, Bourassa P et Calon F, « Can insulin signaling pathways be targeted to transport Aβ out of the brain? », Frontiers in Aging Neuroscience, vol. 7, , article no 114 (ISSN 1663-4365, lire en ligne).
- (en) Yi Xie, Pei-Pei Liu, Ya-Jun Lian et Hong-Bo Liu, « The effect of selective serotonin reuptake inhibitors on cognitive function in patients with Alzheimer’s disease and vascular dementia: focusing on fluoxetine with long follow-up periods », Signal Transduction and Targeted Therapy, vol. 4, no 1, , p. 1–3 (ISSN 2059-3635, DOI 10.1038/s41392-019-0064-7, lire en ligne, consulté le ).
- (en) Keun-A Chang, Jeong a Kim, Saeromi Kim et Yuyoung Joo, « Therapeutic potentials of neural stem cells treated with fluoxetine in Alzheimer’s disease », Neurochemistry International, honoring Nobel Laureate Dr. Marshall Nirenberg on Decoding Brain Memory, vol. 61, no 6, , p. 885–891 (ISSN 0197-0186, DOI 10.1016/j.neuint.2012.03.017, lire en ligne, consulté le ).
- (en) Jinping Qiao, Junhui Wang, Hongxing Wang et Yanbo Zhang, « Regulation of astrocyte pathology by fluoxetine prevents the deterioration of Alzheimer phenotypes in an APP/PS1 mouse model », Glia, vol. 64, no 2, , p. 240–254 (ISSN 1098-1136, DOI 10.1002/glia.22926, lire en ligne, consulté le ).
- (en) « Aducanumab (marketed as Aduhelm) Information », sur FDA.
- (en) Lon Schneider, « A resurrection of aducanumab for Alzheimer's disease », The Lancet Neurology, vol. 19, no 2, , p. 111–112 (ISSN 1474-4422 et 1474-4465, DOI 10.1016/S1474-4422(19)30480-6, lire en ligne, consulté le ).
- « Médicament contre Alzheimer : des espoirs et des questions », sur Sciences et Avenir, (consulté le ).
- « Alzheimer : les essais avec l’aducanumab reprennent », Le Monde, (lire en ligne, consulté le ).
- (en) Kelly ServickDec. 5 et 2019, « Skepticism persists about revived Alzheimer’s drug after conference presentation », sur Science | AAAS, (consulté le ).
- (en-US) « FDA Gives Biogen Green Light to Relaunch Aducanumab Study on Trial Participants », sur Being Patient, (consulté le ).
- « FDA’s Decision to Approve New Treatment for Alzheimer’s Disease », sur FDA, .
- Nouveau médicament contre Alzheimer : « C'est un réel espoir » mais le professeur Amouyel attend des « études complémentaires », France info.
- Alison Abbott, « Alzheimer : vers un traitement précoce de la maladie ? », Pour la science, no 539, , p. 22-29.
- (en)World Alzheimer Report 2010[PDF].
- Source : Alzheimer's Disease International.
- (en) C.P. Ferri, M. Prince, C. Brayne, H. Brodaty, L. Fratiglioni, M. Ganguli, K. Hall, K. Hasegawa, H. Hendrie, Y. Huang, A. Jorm, C. Mathers, P.R. Menezes, E. Rimmer et M. Scazufca, « Global prevalence of dementia: a Delphi consensus study », Alzheimer's Disease International, The Lancet, vol. 366, no 9503, , p. 2112-2117 (DOI 10.1016/S0140-6736(05)67889-0).
- Société Alzheimer Canada: Facteurs de risque.
- (en) Kuller LH. « Dementia epidemiology research: it is time to modify the focus of research » J Gerontol A Biol Sci Med Sci. 2006;61(12):1314-8. .
- Alzheimer’s Epidemic Worse In Some Regions.
- World Health Rankings ALZHEIMERS/DEMENTIA.
- CDC: Mortality From Alzheimer's Disease in the United States: Data for 2000 and 2010.
- (en) Chandra V, Pandav R, Dodge HH, Johnston JM, Belle SH, DeKosky ST, Ganguli M. « Incidence of Alzheimer's disease in a rural community in India: the Indo-US study » Neurology 2001;57(6):985-9. .
- (en)Hendrie HC, Hall KS, Ogunniyi A, Gao S ; Alzheimer's disease, genes, and environment: the value of international studies. ; Can J Psychiatry. 2004 Feb;49(2):92-9.
- (en)Hendrie HC ; Lessons learned from international comparative crosscultural studies on dementia, Am J Geriatr Psychiatry, juin 2006 ; 14(6):480-8.
- (en)Shadlen MF, Larson EB, Yukawa M. The epidemiology of Alzheimer's disease and vascular dementia in Japanese and African-American populations: the search for etiological clues. ; Department of Medicine, Harborview Medical Center, School of Pharmacy, University of Washington, Seattle, États-Unis. Neurobiol Aging. 21 mars 2000 ; (2):171-81.
- (en)Graves AB, Larson EB, Edland SD, Bowen JD, McCormick WC, McCurry SM, Rice MM, Wenzlow A, Uomoto JM. Prevalence of dementia and its subtypes in the Japanese American population of King County, Washington state. The Kame Project. Department of Epidemiology and Biostatistics, University of South Florida, Tampa, États-Unis. Am J Epidemiol. 1996 octobre 15;144(8):760-71.
- (en)Yamada T, Kadekaru H, Matsumoto S, Inada H, Tanabe M, Moriguchi EH, Moriguchi Y, Ishikawa P, Ishikawa AG, Taira K, Yamori Y. ; Prevalence of dementia in the older Japanese-Brazilian population. ; Psychiatry Clin Neurosci. 2002 Feb;56(1):71-5 (Department of Internal Medicine and Health Care, Fukuoka University, Fukuoka, Japan).
- (en)Lopes MA, Bottino CM. ; Prevalence of dementia in several regions of the world: analysis of epidemiologic studies from 1994 to 2000 (Instituto de Psiquiatria, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, Brasil). Arq Neuropsiquiatr. mars 2002 ;60(1):61-9.
- (en)Fujishima M, Kiyohara Y. ; Incidence and risk factors of dementia in a defined elderly Japanese population: the Hisayama study. (Department of Medicine and Clinical Sciences, Kyushu University, Japon) ; Ann N Y Acad Sci. ; novembre 2002; Nov;977:1-8.
- Rapport 2010 de l'Association Alzheimer américaine, figures 12 et 13[PDF].
- Les nouveaux cas d’Alzheimer en recul, letemps.ch
- (en) Is the risk of Alzheimer’s disease and dementia declining?.
- Nouvelles percées concernant la maladie d’Alzheimer avec des souris transgéniques[PDF] ; L'écho des souris, 3 septembre 2011.
- (en)Wancata J, Musalek M, Alexandrowicz R, Krautgartner ; Number of dementia sufferers in Europe between the years 2000 and 2050. M. Eur Psychiatry. 2003 Oct;18(6):306-13.
- « Taux de patients belges atteints de la maladie d'Alzheimer », sur Le centre hospitalier chrétien (CHC) (consulté le ).
- no 2454 - Rapport sur la maladie d'Alzheimer et les maladies apparentées au nom de l'Office parlementaire d'évaluation des politiques de santé(rapporteuse : Mme Cécile Gallez).
- (en) Helmer C., Pasquier F, Dartigues JF. Epidemiology of Alzheimer disease and related disorders Helmer Med Sci (Paris). 2006 Mar;22(3):288-96}.
- (en)Ramaroson H, Helmer C, Barberger-Gateau P, Letenneur L, Dartigues JF ; Prevalence of dementia and Alzheimer's disease among subjects aged 75 years or over : Résultats mis à jour du programme PAQUID cohort] PAQUID. ; Unité INSERM 330, Université Victor Segalen Bordeaux II. Rev. Neurol. (Paris). 2003 Apr;159(4):405-11.
- Le nombre de nouveaux malades d’Alzheimer a-t-il baissé de 25% depuis 25 ans ?.
- Dr Douçot-Hermelin (Revue de Gériatrie 2008;33:787.
- (en-GB) Aida Edemariam, « Somebody I Used to Know by Wendy Mitchell review – dementia from the inside », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- réf..
- Hubert-Félix Thiéfaine, « L'étranger dans la glace (Homo plebis ultimae Tour au Zénith de Nantes 2011) », sur YouTube, chaîne officielle, (consulté le )
Annexes
Bibliographie
- Choi, S.K; Friedman, D.B; Tang, W & Olscamp, K. (2017). Alzheimer’s Disease in Social Media: Content Analysis of Youtube Videos. Interactive Journal of Medical Research. 6(2). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5668636/
- Low, L & Purwaningrum, F. (2020). Negative stereotypes, fear and social distance: a systematic review of depictions of dementia in popular culture in the context of stigma. BMC Geriatrics. 20: 477. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7670593/#:~:text=Depictions%20of%20dementia%20in%20popular%20culture%20are%20associated%20with%20negative,experienced%20by%20people%20with%20dementia
- Dementia. (2022). World Health Organization. https://www.who.int/news-room/fact-sheets/detail/dementia#:~:text=Currently%20more%20than%2055%20million,million%20new%20cases%20every%20year
- Altomare, D; Bocchetta, M; Bosco, P; Cavedo, E; Frisoni, G.B.; Galluzzi, S; Marizzoni, M; Pievani, M & Pini, L. (2016). Brain atrophy in Alzheimer’s Disease and aging. Ageing Research Reviews. 30: 25-48. https://www.sciencedirect.com/science/article/pii/S1568163716300022?casa_token=FQ0Bx2dp4GsAAAAA:I4hBdtHFwuB2xTmZtnPirNIHiFPC8hKlEZwkk2gLEpJEg74zHalAl6u7NucdRl85XOHcOytPYX8
- Lu, M. (2020). 50 Cognitive Biases in the Modern World. Visual Capitalist. https://www.visualcapitalist.com/50-cognitive-biases-in-the-modern-world/
- Bahorik, A; Barnes, D.E; Boscardin, W.J; Kornblith, E; Xia, F & Yaffe, K. (2022). Association of Race and Ethnicity With Incidence of Dementia Among Older Adults. Journal of the American Medical Assiociation. 327 (15): 1488-1495. https://jamanetwork.com/journals/jama/fullarticle/2791223#:~:text=Studies%20examining%20racial%20and%20ethnic,of%20dementia%20for%20Black%20adults.&text=Hispanic%20older%20adults%20are%20less,than%20have%20White%20older%20adults
Articles connexes
Liens externes
- Ressources relatives à la santé :
- GeneReviews
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Page du Gouvernement français concernant la maladie d'Alzheimer
- Portail d'Alzheimer de l'Union européenne partiellement en français
- Société Alzheimer du Canada
- Portail gouvernemental du Plan Alzheimer
- Institut du cerveau : recherche sur la maladie d'Alzheimer
- (en) Journal of Alzheimer's Disease
- (en) Journal of Alzheimer's & Dementia
- (en) The Bredesen Protocol (résumé par MyBioHack)
Guides et recommandations
- Diagnostic et la prise en charge de la maladie d’Alzheimer et apparentées a été publiée le par la Haute Autorité de santé.
- RSI, IRCEM et France Alzheimer (2014) Guide interactif pour permettre aux indépendants de mieux connaître la maladie et mieux accompagner les personnes atteintes.
