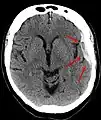
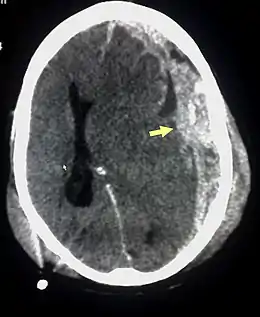
Hématome sous-dural
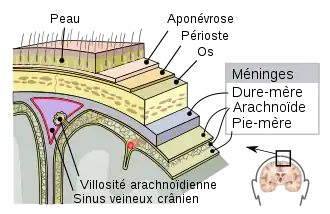
L'hématome sous-dural, ou hémorragie sous-durale, désigne l'épanchement de sang dans les espaces méningés. À la suite d'un traumatisme crânien avec lésion des petites veinules qui traversent l'espace sous-dural, l'hémorragie a lieu entre l'arachnoïde qui entoure le cerveau et le feuillet interne de la dure-mère qui est en contact avec la boîte crânienne. L'hématome ne peut pas traverser de l'autre côté du cerveau par rapport au côté d'origine de l'hémorragie. En effet, la faux du cerveau sépare en deux l'espace sous-dural. Les hématomes sous-duraux peuvent causer une augmentation de la pression intracrânienne, avec compression et lésion du cerveau.
| Spécialité | Neurochirurgie |
|---|
| CIM-10 | I62.0, P10.0 et S06.5 |
|---|---|
| CIM-9 | 852.2 et 432.1 |
| DiseasesDB | 12614 |
| MedlinePlus | 000713 |
| eMedicine |
1137207 ped/1097 emerg/267 |
| MeSH | D006408 |
![]() Mise en garde médicale
Mise en garde médicale
Le syndrome du bébé secoué est une cause fréquente de l'hématome sous-dural chez les enfants de moins de 6 mois. On attribuait généralement ce secouement à un parent ou un soignant qui, excédé par les pleurs de l'enfant et en désespoir de cause, le secoue pour le faire taire. Or en 2017, des statistiques affirment qu'un bébé secoué l'a été en moyenne 10 fois[1], ce qui invalide cette ancienne représentation des choses. 13 à 40 % des enfants ainsi secoués décèdent, et les survivants ont généralement des séquelles à vie[2].
Description
Classification
Elle est basée sur la vitesse à laquelle ils surviennent. On peut distinguer :
- l'hématome sous-dural aigu
C'est une urgence médicale, avec une détérioration neurologique aiguë due à une augmentation de la pression intracrânienne. Le taux de mortalité est élevé si un drainage chirurgical n'est pas fait[3] - [4] - [5]. Un syndrome d'hypertension intracrânienne.
Les hémorragies aiguës se développent fréquemment après une subite accélération/décélération. Le pronostic est plus grave s'il y a une contusion cérébrale associée[6]. Cependant, même si l'hématome sous-dural se développe rapidement, il est moins rapide que l'hématome épidural qui est dû à une rupture d'une ou plusieurs artères. Le taux de mortalité associé à l'hématome sous-dural aigu est compris entre 60 % et 80 %[7].
- l'hématome sous-dural chronique
Il se développe lentement, le sang coagule et devient encapsulé dans du tissu fibrotique. Cette situation survient lors de traumatismes minimes et peut être découverte à distance de l'épisode traumatique. Il peut entraîner des troubles cognitifs confondus avec une démence ou une autre pathologie neuropsychiatrique.
Les hématomes sous-duraux chroniques se développent souvent au long des jours ou semaines après un traumatisme crânien léger. 50 % des patients ne peuvent pas identifier l'accident initial[8]. Ils peuvent présenter des symptômes des mois ou des années après le traumatisme[9]. Ces hématomes peuvent être réabsorbés sans laisser de séquelles et seulement 20 % des patients voient leur situation s'aggraver[5]. Dans ce cas, le traitement standard consiste à ponctionner l'hématome par trépanation, ce qui conduit souvent à une disparition rapide des symptômes. Ils sont plus fréquents chez la personne âgée[9].
Signes et symptômes
Les symptômes d'hémorragie sous-durale débutent plus lentement que ceux de l'hémorragie épidurale, car la basse pression des veinules fait que le saignement est plus lent. Cependant ils peuvent apparaître en quelques minutes[10] - [11]. Si l'hémorragie est importante, il existe une augmentation de la pression intracrânienne avec risque de lésion cérébrale[5].
Dans l'histoire clinique, on recherche une histoire de traumatisme crânien récent avec perte de conscience ou une fluctuation des niveaux de conscience. Suivant le degré de gravité, il peut exister des convulsions, des céphalées, des paresthésies, des vertiges, une confusion spatiotemporelle ou une léthargie, une amnésie, des nausées ou des vomissements avec anorexie. D'autres signes sont témoins de la souffrance cérébrale et dépendent de l'extension des lésions : modification du comportement, de la parole, ataxie ou difficulté à la marche, respiration irrégulière, troubles auditifs ou de la vision, diplopie avec strabisme.
Examens complémentaires
Le diagnostic se fait au scanner sans injection. Son accès est facile dans les pays développés. Il n'existe pas de contre-indication (sauf la grossesse).
| Type d'hématome | Épidural | Sous-dural |
|---|---|---|
| Localisation | Entre le crâne et la dure-mère | Entre la dure-mère et l'arachnoïde |
| Vaisseaux responsables | Lobe temporo-parietal (le plus fréquent) - artère méningée moyenne
Lobe frontal - artère ethmoïdale antérieure Lobe occipital - transversales ou sinus sigmoïde Vortex - sinus sagittal supérieur | Ponts veineux |
| Les symptômes | intervalle lucide suivi par perte de conscience | La céphalée et la confusion augmentent progressivement. |
| Aspect sur le scanner | aspect en lentille biconvexe | aspect en croissant |
Sur le scanner crânien, fait sans injection de produit de contraste, l'hématome sous-dural se présente habituellement sous une forme de croissant, dont la concavité suit la courbe du cerveau, stoppé seulement par les réflexions durales telles que la faux du cerveau et le tentorium. Cependant ils peuvent avoir une forme convexe, spécialement tout au début du saignement, ce qui peut les faire confondre avec les hémorragies épidurales (hématome extradural). Le sang peut être vu comme une densité stratifiée tout au long du tentorium. Dans les cas chroniques, on peut voir l'effacement des sillons ou le déplacement médian de la jonction substance blanche/substance grise, mais le sang peut avoir une densité très proche de celle du tissu cérébral (isodense), ce qui peut masquer l'hématome.
Les hématomes sous-duraux sont plus fréquents dans les parties supérieure et latérales du frontal et au niveau des lobes pariétaux[5] - [12] ainsi que dans la fosse postérieure proche de la faux du cerveau et de la tente du cervelet[5].
Causes
Les hématomes sous-duraux sont souvent dus à des traumatismes crâniens qui, par des changements brusques de vitesse (accélération/décélération) rompent les petites veines existantes dans l'espace sous-dural[5] - [12].
D’autre part ils sont une manifestation classique du syndrome du bébé secoué (ou battu). Dans ce cas, des forces de cisaillement causent la rupture des veines avec des hémorragies intra et pré-rétiniennes.
On les trouve aussi chez les personnes âgées et les alcooliques, sans notion de traumatisme important, en raison d'une atrophie cérébrale. Cette atrophie va augmenter la longueur des ponts veineux situés entre la dure-mère et l’arachnoïde et les rend plus vulnérables aux forces de cisaillement. Une inflammation ainsi qu'une néovascularisation peuvent jouer un rôle facilitateur[13].
Une réduction brusque de la pression du liquide cérébrospinal peut aussi être la cause d'une hémorragie sous-durale.
Facteurs de risque
Les facteurs qui augmentent le risque sont surtout
- l'âge, plus fréquents chez les personnes très jeunes et les personnes très âgées. Chez l'enfant, l'espace sous-dural est plus large et les vaisseaux sont plus facilement déchirables. C'est le cas également chez les personnes très âgées, la taille du cerveau se réduisant avec l'âge avec élargissement de cet espace. Dans ces deux cas les ponts veineux s'allongent et deviennent plus vulnérables. En plus, avec l'âge, les vaisseaux sont plus fragiles ;
- la présence d'un kyste arachnoïde[14] ;
- la prise d'anticoagulants ou d'antiagrégants plaquettaires ;
- l'alcoolisme ;
- la démence ;
- Troubles de la marche (d'origine neurologique, mécaniques ou iatrogène) avec chutes fréquentes notamment chez les personnes âgées
Physiopathologie

Le sang collecté dans l'espace sous-dural va entraîner un appel d'eau par osmose, ce qui augmente encore plus son volume et comprime davantage les structures nobles du cerveau. Cela fragilise davantage les veines[8]. Le sang collecté peut même s'organiser et développer sa propre membrane[15]. Dans certains cas, si l'arachnoïde présente une lacération, le liquide cérébrospinal (LCS) et le sang peuvent se répandre dans l'espace intracrânien avec une augmentation encore plus grande de la pression[12].
Il existe une expression plus importante de vasoconstricteurs dans l'hématome sous-dural, potentiellement responsable de vasospasmes qui provoquent une réduction importante du flux sanguin cérébral, cause d'une ischémie locale[16]. Dans ce cas peut se déclencher une cascade biochimique ou cascade de coagulation qui aboutit à la mort cellulaire.
Si le patient survit, le sang coagulé est réabsorbé et remplacé par du tissu fibrotique.
Traitement
Le traitement dépend de son volume et de la vitesse évolutive.
Les petits hématomes ont besoin de surveillance et ils guérissent spontanément. Les hématomes de taille moyenne peuvent être drainés par un cathéter mis en place par trépanation. Les plus volumineux avec des symptômes importants ont besoin d'une chirurgie pour ligaturer des vaisseaux responsables, drainage et nettoyage des caillots sanguins[17] - [18]. Il existe cependant un risque de récidive pouvant atteindre 10 à 20%[19].
Les corticoïdes, en plus de la chirurgie, ne semblent pas améliorer le pronostic[20].
Dans certains cas, selon l'état du patient, l'âge, et le risque anesthésique, seule une surveillance clinique sera proposée.
Notes et références
- Haute autorité de la santé, rapporté par le ministère des solidarité (France), « Syndrome du bébé secoué : une maltraitance qui peut être mortelle » (consulté le )
- Bébé secoué : une forme mal connue de maltraitance aux conséquences irréparables
- UCLA Neurosurgery accédé le 14-11-2012.
- (es) MedlinePlus, « Hematoma subdural », Enciclopedia médica en español, (consulté le )
- (en) Andrew L. Wagner, « Imaging in Subdural Hematoma », Medscape, (lire en ligne, consulté le )
- Vinas F.C. and Pilitsis J. 2006. Penetrating Head Trauma. Emedicine.com.
- Dawodu S. 2004. "Traumatic brain injury: Definition, epidemiology, pathophysiology" Emedicine.com. acesso a 14-11-2012
- Downie A. 2001. "Tutorial: CT in head trauma", accès le 14-11-2012
- (en) Kushner D, « Mild Traumatic Brain Injury: Toward Understanding Manifestations and Treatment », Archives of Internal Medicine, vol. 158, no 15, , p. 1617–1624 (PMID 9701095, DOI 10.1001/archinte.158.15.1617, lire en ligne)
- (en) « Subdural hematoma : MedlinePlus Medical Encyclopedia », Nlm.nih.gov, (consulté le )
- Sanders MJ and McKenna K. 2001. Mosby’s Paramedic Textbook, 2nd revised Ed. Chapter 22, "Head and facial trauma." Mosby.
- (en) University of Vermont College of Medicine. « Neuropathology: Trauma to the CNS » consulté le 15 novembre 2012.
- Edlmann E, Giorgi-Coll S, Whitfield PC, Carpenter KLH, Hutchinson PJ, Pathophysiology of chronic subdural haematoma: inflammation, angiogenesis and implications for pharmacotherapy, J Neuroinflammation, 2017;14:108-108
- (en) Mori K, Yamamoto T, Horinaka N, Maeda M, « Arachnoid cyst is a risk factor for chronic subdural hematoma in juveniles: twelve cases of chronic subdural hematoma associated with arachnoid cyst », J. Neurotrauma, vol. 19, no 9, , p. 1017–27 (PMID 12482115, DOI 10.1089/089771502760341938)
- McCaffrey P. 2001. "The neuroscience on the web series: CMSD 336 neuropathologies of language and cognition." California State University, Chico. Retrieved on 7 août 2007.
- (en) Graham DI and Gennareli TA. Chapter 5, « Pathology of brain damage after head injury » in: Cooper P and Golfinos G. 2000. Head Injury, 4th Ed. Morgan Hill, New York.
- (en) Koivisto T, Jääskeläinen JE, « Chronic subdural haematoma—to drain or not to drain? », Lancet, vol. 374, no 9695, , p. 1040–1041 (DOI 10.1016/S0140-6736(09)61682-2)
- (en) Santarius T, Kirkpatrick PJ, Dharmendra G et al., « Use of drains versus no drains after burr-hole evacuation of chronic subdural haematoma: a randomised controlled trial », Lancet, vol. 374, no 9695, , p. 1067–1073 (DOI 10.1016/S0140-6736(09)61115-6)
- Kolias AG, Chari A, Santarius T, Hutchinson PJ, Chronic subdural haematoma: modern management and emerging therapies, Nat Rev Neurol, 2014;10:570-578.
- Hutchinson PJ, Edlmann E, Bulters D et al. Trial of dexamethasone for chronic subdural hematoma, N Engl J Med, 2020;383:2616-2627