Hyène tachetée
Crocuta crocuta
.jpg.webp)
Répartition géographique
La Hyène tachetée (Crocuta crocuta) est la plus grande des hyènes et est originaire d'Afrique subsaharienne. L’espèce est la seule représentante vivante appartenant au genre Crocuta. Elle est classée comme préoccupation mineure par l'UICN, pour autant les hyènes ont connu une spectaculaire régression de leur nombre ainsi que de leur aire de répartition, due notamment au braconnage et à la réduction de leur habitat, tout au long du XXe siècle. En 2014, leur population était estimée entre 27 000 et 47 000 individus. La hyène tachetée se distingue facilement des autres espèces de hyènes par ses oreilles courtes et rondes, son pelage tacheté et la présence d'un pseudo-pénis chez les femelles.
La hyène tachetée est l'espèce la plus sociable du règne des carnivores avec de larges groupes d'individus et des comportements sociaux complexes[1]. Son organisation sociale est différente de celle de tout autre carnivore et ressemble davantage à celle des primates cercopithèques (babouins et macaques) en ce qui concerne la taille du groupe, la structure hiérarchique et la fréquence des interactions sociales entre parents et membres du clan non apparenté[2].
La hyène tachetée est un animal très performant, étant le grand carnivore le plus commun en Afrique. Son succès est dû en partie à sa capacité d'adaptation et à son opportunisme ; c'est avant tout un chasseur, mais c'est aussi un charognard souvent par cleptoparasitisme, capable de manger et de digérer les os, de la peau et les restes animaux[3]. Sur le plan fonctionnel, la hyène tachetée est celle qui utilise le plus efficacement la matière animale de tous les carnivores africains. La hyène tachetée présente une plus grande plasticité dans son comportement de chasse et de recherche de nourriture que les autres carnivores africains[4].
La hyène tachetée a une longue histoire d'interaction avec I'homme ; des représentations de I'espèce existent depuis le Paléolithique supérieur, avec des sculptures et des peintures des grottes de Lascaux et Chauvet[5]. Cette espèce a une réputation largement négative tant dans la culture occidentale que dans le folklore africain[6]. En Occident, l'espèce est surtout considérée comme laide et lâche, tandis que dans la culture africaine, elle est considérée comme avide, gloutonne, stupide, mais puissante et potentiellement dangereuse.
Étymologie
Le nom scientifique de la hyène tachetée, Crocuta, vient du mot grec Krokottas (Κροκόττας) qui à l'origine désignait le chacal doré. Cela est dû au fait que les premières observations de la hyène la décrivaient comme un croisement du loup et du chien africain en Éthiopie [7]. De l'Antiquité classique jusqu'à la Renaissance, la hyène tachetée et la hyène rayée étaient souvent considérées comme faisant partie de la même espèce. Hiob Ludolf dans son livre Historia aethiopica a été le premier à clairement distinguer le genre Crocuta de la famille Hyaena selon leurs différences physiques mais aussi géographiques. La nature exacte de la taxonomie de la famille Hyaena est restée ambiguë durant longtemps, avec notamment les nombreux voyageurs européens parlant de la hyène tachetée comme un loup.
Les premières descriptions détaillées de la hyène tachetée par les Européens proviennent de Willem Bosman et Peter Kolb (1675-1726). Bosman, un commerçant hollandais qui travailla pour la Compagnie hollandaise des Antilles sur la Côte d'Or (aujourd'hui Ghana) de 1688-1701, a écrit de "Jakhals, de Boshond" (chacals ou chiens des bois) dont la description physique correspond à la hyène tachetée. Kolb, un mathématicien et astronome allemand qui a travaillé pour la Compagnie hollandaise des Indes orientales au Cap de Bonne Espérance de 1705 à 1713, a décrit la hyène tachetée en détail, mais l'a appelée « loup tigre », car les colons d'Afrique australe ne connaissaient pas les hyènes et les appelaient donc « loups »[8].
Leurs descriptions sont passées largement inaperçues jusqu'en 1771, lorsque le naturaliste gallois Thomas Pennant (1726-1798), dans son Synopsis of Quadrupeds, a utilisé les descriptions, ainsi que son expérience personnelle avec un spécimen captif, comme base pour différencier systématiquement la hyène tachetée de la hyène rayée. La description donnée par Pennant était suffisamment précise pour être incluse par Johann Christian Erxleben dans son Systema regni animalis en traduisant simplement le texte de Pennant en latin. Crocuta a finalement été reconnu comme un genre distinct de Hyaena en 1828[8].
Taxonomie, origine et évolution
Contrairement à la hyène rayée, pour laquelle un certain nombre de sous-espèces ont été proposées en raison de sa vaste aire de répartition moderne, la hyène tachetée est une espèce véritablement variable, tant dans le temps que dans l'espace [9]. Son aire de répartition couvrait autrefois presque toute l'Afrique et l'Eurasie[10], de la péninsule ibérique à l'Oural, où elle est restée pendant au moins un million d'années [11]. Des restes ont également été trouvés en Extrême-Orient russe, et il a été théorisé que la présence d’hyènes aurait pu retarder la colonisation de l’Amérique du Nord[12]. Les causes de l'extinction de l'espèce en Eurasie sont encore largement inconnues[11]. En Europe occidentale au moins, l'extinction de l'hyène tachetée pourrait coïncider avec un déclin des prairies il y a 12 500 ans[13]. Bien que les hyènes tachetées soient des animaux polyvalents à de nombreux égards, certaines propriétés de l’espèce semblent moins souples, telles que son affinité pour les habitats ouverts et les basses altitudes[14]. L'Europe aurait connu une perte massive d'habitats de basse altitude, favorisés par les hyènes tachetées, et une augmentation de forêts mixtes. Les hyènes tachetées, dans ces circonstances, auraient été supplantées par les loups et les humains, qui vivaient aussi bien dans les forêts que dans les terres découvertes et dans les hautes terres que dans les basses terres[15]. Les populations d'hyènes tachetées auraient commencé à décliner il y a environ 20 000 ans[16], avant de disparaître complètement de l'Europe occidentale.
L'espèce présentait un degré élevé de variation géographique et morphologique, ce qui a conduit à un ensemble étendu d'attributs spécifiques et sous-spécifiques[17]. Il a été démontré que la variation observée chez les hyènes tachetées était liée à la forte corrélation entre la taille du corps et la température[18]. En 1939, le biologiste L. Harrison Matthews a démontré en comparant une vaste sélection de crânes venant de Tanzanie que les variations observées chez les sous-espèces pouvaient également se retrouver dans une seule population, les seuls caractères distingués étant le pelage (qui est soumis à un degré élevé de variation individuelle) et la taille (qui est soumise à la règle de Bergmann) [19]. Pendant des décennies, de nombreuses nouvelles espèces et sous-espèces ont été nommées et sont maintenant connues comme synonymes des quatre espèces d'hyènes existantes[9]. Il a été progressivement accepté que toutes les variations trouvées chez les hyènes tachetées pourraient être incluses dans une seule espèce[20]. Lorsque les fossiles sont pris en compte, les espèces présentent des variations encore plus grandes qu’elles ne le sont à l’époque moderne, avec des preuves irréfutables de l'existence de plus d’une espèce dans le genre Crocuta[9].
Björn Kurtén et Camille Arambourg ont tous deux proposé une origine asiatique pour l'espèce ; Kurtén a concentré ses arguments sur le taxon plio-pléistocène Crocuta sivalensis des Siwaliks[21], une opinion défendue par Arambourg, qui a néanmoins cité la possibilité d'une origine indoéthiopienne. Cette position a été contestée par Ficarelli et Torre, qui ont trouvé la présence de la hyène tachetée au Pléistocène inférieur, un âge similaire à celui du C. sivalensis asiatique[22]. Les études sur la distribution phylogéographique des haplotypes d'ADNmt indiquent trois événements migratoires majeur d'Afrique vers l'Eurasie, mais ni la topologie de l'arbre phylogénétique ni les fossiles ne permettent d'exclure une origine asiatique [10]. La première migration des hyènes tachetées d'Afrique vers l'Eurasie a commencé il y a moins de 3,5 millions d'années, très probablement à partir de la région où les premiers fossiles de hyènes tachetées ont été découverts, atteignant l'Asie orientale et très probablement aussi le Pakistan. La deuxième migration des hyènes tachetées s'est produite il y a moins de 1,3 à 1,5 million d'années et a entraîné la première arrivée des hyènes en Europe. Cela a également conduit à une séparation des hyènes tachetées africaines en une population du sud et une population du nord. La troisième migration de la hyène a eu lieu il y a 0,36 million d'années, à partir de la population d'Afrique du Nord jusqu'en Europe et en Asie. Contrairement à d'autres carnivores africains, à l'exception du léopard, rien n'indique que les hyènes tachetées aient subi un goulet d'étranglement génétique pendant le pléistocène[23].
Les ancêtres du genre Crocuta ont divergé de la famille Hyaena (hyènes rayées et brunes) il y a 10 millions d'années[10]. Les ancêtres de la hyène tachetée ont probablement développé des comportements sociaux en réponse à la pression accrue des autres prédateurs, et les ont forcés à opérer en équipe. Au cours de leur évolution, les hyènes tachetées ont développé des carnassières aiguës derrière leurs prémolaires écrasantes, ce qui rendait l'attente de la mort de leur proie inutile, comme c'est le cas des hyènes brunes et rayées, et elles sont donc devenues des chasseurs en meute et aussi des charognards[24]. Elles ont commencé à former des territoires de plus en plus vastes, rendus nécessaires par le fait que leurs proies étaient souvent migratrices et que de longues poursuites sur un petit territoire les auraient amenés à empiéter sur le territoire d'un autre clan[24]. L'apparition de l'espèce en Europe et en Chine pendant la période du cromérien coïncide avec le déclin et éventuellement l'extinction de Pachycrocuta brevirostris. Aucune preuve n'ayant été trouvé montrant que le changement environnemental soit responsable de sa disparition, il est probable que Pachycrocuta brevirostris a disparu à cause de la compétition avec la hyène tachetée[25].
Description
Anatomie
Bien que les hyènes tachetées semblent anatomiquement plus proches des Felidae, elles ressemblent beaucoup plus à des chiens qu'à des chats[26]. La hyène tachetée a un cou et des membres antérieurs forts et bien développés, mais des membres postérieurs relativement peu développés. La croupe est arrondie plutôt qu'anguleuse, ce qui empêche les attaques venant de l'arrière[3]. La tête est large et plate avec un museau émoussé et un large rhinarium. Contrairement à la hyène rayée, les oreilles de la hyène tachetée sont arrondies plutôt que pointues. Chaque patte a quatre doigts, palmés et armés de courtes griffes, solides et émoussées. La queue est relativement courte, mesurant 300-350 mm de long. Mâles et femelles ont une paire de glandes anales qui s'ouvrent dans le rectum juste à l'intérieur de l'ouverture anale[19]. Ces glandes produisent une sécrétion blanche et crémeuse qui se colle sur les tiges d'herbe en retournant le rectum[3]. L'odeur de cette sécrétion est très forte, sentant le savon bon marché bouillant ou la brûlure, et peut être détectée par l'homme plusieurs mètres sous le vent[3]. La hyène tachetée possède un cœur proportionnellement large, constituant près de 1% de son poids corporel et lui donnant ainsi une grande endurance lors des poursuites de chasse. Les populations eurasiennes aujourd'hui éteintes se distinguaient des populations africaines modernes par leurs extrémités distales plus courtes et leurs humérus et fémur plus longs[27].

Le crâne de la hyène tachetée diffère de celui de la hyène rayée par sa taille beaucoup plus grande et sa crête sagittale plus étroite. Pour sa taille, la hyène tachetée possède l'un des crânes les plus puissants de la Carnivora[26]. Sa denture est à double usage, à l'inverse de celle des autres espèces modernes d'hyènes, qui sont pour la plupart des charognards ; les prémolaires supérieure et inférieure sont des broyeurs d'os, avec un troisième cône qui tient les os en saillie par la quatrième prémolaire inférieure. La hyène tachetée a aussi ses carnassières situés derrière ses prémolaires de broyage d'os, dont la position lui permet de broyer l'os avec ses prémolaires sans émousser les carnassières[24]. Combinées à de grands muscles au niveau de la mâchoire et une voûte spéciale pour protéger le crâne, ces caractéristiques lui donnent une puissante mâchoire qui peut exercer une pression de 80 kgf/cm2[24] soit 40% de force en plus qu'un léopard. Des hyènes ont été observées en train de fendre des os des girafes mesurant 7 cm de diamètre[28]. On estime qu'une hyène tachetée de 63,1 kg a une force d'occlusion de 565,7 newtons à l'extrémité canine et de 985,5 newtons à l'éocône carnassial[29]. Dans une étude un individu a exercé une force de 4 500 newtons sur les instruments de mesure[30].
Dimensions

La hyène tachetée est le plus gros membre existant des Hyaenidae[9]. Le dimorphisme sexuel au niveau de la taille de l'hyène tachetée a été décrit pour la première fois par Matthews en 1939. Depuis lors, les scientifiques se sont opposés sur le fait que les femelles sont plus grosses que les mâles[31]. Des études récentes ont montré que le dimorphisme sexuel est assez faible et n’est pas détecté pour certains traits morphologiques tels que la longueur de l’arrière-pied, la longueur de l’avant-pied ou la longueur de la jambe inférieure[31]. Les femelles adultes sont moins de 3% plus longues, moins de 1% plus grandes et environ 10% plus lourdes que les mâles adultes[32]. Au Maasai Mara, les femelles adultes mesurent 131,4 cm ± 1,2 cm de long, ont une hauteur d'épaules de 82,0 cm ± 0,54 cm et pèsent 55,6 kg ± 2,0. Les mâles adultes mesurent 127,2 ± 1,1 cm de long, ont une hauteur d'épaule de 81,7 ± 0,4 cm et pèsent 49,0 ± 1,3 kg[31]. Au Ngorongoro, les femelles adultes pèsent 56,68 ± 6,24 kg et les mâles 51,65 ± 3,38 kg[32]. En Zambie, les hyènes tachetées mâles pesaient en moyenne 67,6 kg et 69,2 kg pour les femelles[33]. Des poids exceptionnellement grands de 81,7 kg [24] et 90 kg ont été enregistrés [4]. On a estimé que les membres adultes des populations eurasiennes, aujourd'hui disparues, pesaient jusqu'à 102 kg[34]
Fourrure
La couleur de la fourrure varie beaucoup et change avec l'âge[3]. Les petits naissent avec des poils noirs et doux [35] et commencent à perdre leur pelage noir pour développer le pelage tacheté de couleur plus claire des adultes à l'âge de 2 à 3 mois. La couleur de base des adultes est un brun grisâtre ou gris jaunâtre pâle sur lequel se superpose un motif irrégulier de taches arrondies sur le dos et l'arrière-train[26]. Les taches, qui sont de distinction variable, peuvent être rougeâtres, brun foncé ou presque noirâtres. Leur taille varie, même au sein du même individu, mais elles ont généralement un diamètre de 20 mm. Un ensemble de bandes à peine distinctes remplace les taches sur le dos et les côtés du cou. Une large bande médiale est présente à l'arrière du cou et se prolonge en une crête tournée vers l'avant. La crête est principalement de couleur brun rougeâtre. La calotte et la partie supérieure du visage sont brunâtres, sauf une bande blanche au-dessus des yeux, tandis que le devant des yeux, la zone autour du rhinarium, les lèvres et la partie arrière du menton sont tous noirâtres. Les membres sont tachetés, la couleur des pieds varie du brun clair au noirâtre. La fourrure est relativement clairsemée et se compose de deux types de poils : une sous-fourrure moyennement fine (mesurant de 15 à 20 mm) et de longs poils épais (de 30 à 40 mm)[3]. L'art rupestre paléolithique européen illustrant l'espèce indique que les populations eurasiennes ont conservé les taches de leurs homologues africains modernes[5].
Appareil génital féminin
La hyène tachetée est remarquable pour la structure et l'apparence des organes génitaux féminins, qui ressemblent beaucoup à ceux des mâles :
- la femelle ne possède pas de vagin externe (pas d'ouverture vaginale) car les lèvres sont fusionnées pour former un pseudo-scrotum ;
- le clitoris est en forme de pénis (on l'appelle pseudo-pénis), il est capable d'érection[36] et, cas unique parmi les mammifères, il sert à la miction, à la copulation et à la mise-bas[37] : le pseudo-pénis est traversé jusqu'à son extrémité par un canal urogénital central par lequel la femelle urine, copule et donne naissance[3] - [38] ; s'il n'est pas en érection, il interdit toute copulation[39].
Chez une femelle non sexuellement mature, les organes sexuels ne peuvent être distingués de l'extérieur de ceux d'un mâle[26]. Chez une femelle mature, le pseudo-pénis se distingue du pénis des mâles par sa longueur légèrement plus faible, son épaisseur plus grande et son gland plus arrondi[40] - [41]. Chez le mâle et la femelle, la base du gland est couverte d'épines péniennes[42]. Lorsqu'il est flasque, le pseudo-pénis se rétracte dans l'abdomen, et seul le prépuce est visible. Deux gros mamelons abdominaux sont présents chez les femelles en lactation, ainsi que deux petits mamelons non fonctionnels situés un peu en arrière de ceux-ci [26]. Après la mise bas, le pseudo-pénis est étiré et perd beaucoup de ses aspects d'origine ; il devient un prépuce à paroi lâche et réduite avec un orifice élargi et des lèvres fendues[26].
La formation du pseudo-pénis semble largement indépendante des androgènes, puisque le pseudo-pénis apparaît chez le fœtus féminin avant la différenciation de l'ovaire fœtal et de la glande surrénale[41].
Comportement
Comportement social
Les sociétés de hyènes tachetées sont plus complexes que celles des autres mammifères carnivores et ressemblent particulièrement à celles des primates cercopithèques en ce qui concerne la taille du groupe, la structure, la compétition et la coopération [43] - [2] - [1]. Ce sont des animaux sociaux qui vivent dans de grandes communautés (appelées "clans") pouvant compter jusqu'à 130 individus[32]. La taille du groupe varie géographiquement en fonction de l'abondance des proies[44] ; dans le Serengeti, où les proies sont plus rares car migratrices, les clans sont plus petits que ceux du cratère de Ngorongoro, où la proie est beaucoup plus abondante et essentiellement sédentaire[3]. Les clans de hyènes tachetées sont des sociétés dites de fission-fusion[45] dans lesquelles les membres du clan passent leur temps seuls ou en sous-groupes chasser ou patrouiller le territoire, ce qui signifie que la taille et la composition du clan peuvent varier[2] ; Les clans sont donc moins étroitement liés que ceux des lycaons [3]. Ils ne se rencontrent qu'en grand nombre lors de la chasse de grosse proie, dans la tanière communale ou lorsque les membres du clan se rassemblent pour défendre leur territoire[46] - [47].
Les clans sont structurés selon une hiérarchie de dominance linéaire stricte et stable. Le noyau stable de tout clan est composé de un à plusieurs groupes matrilinéaires apparentés contenant plusieurs femelles adultes et leurs progénitures [48] - [1]. En outre, chaque clan comprend également plusieurs mâles adultes immigrants. La hiérarchie des hyènes tachetées est népotique[49] - [44]; les fils et les filles des femelles dominantes apprennent à devancer les membres du clan subordonnés à leur mère durant leur développement. À l'âge de quelques semaines, ils commencent à approcher activement les autres membres du clan. Lorsqu'un membre du clan est subordonné à sa mère, celle-ci soutient son petit et l’aide à dominer l'autre membre du clan; lorsqu'un individu domine la mère, celle-ci manifeste un comportement d'évitement ou de soumission [50]. Les rangs dans la société hyène ne sont pas corrélés avec les attributs intrinsèques (taille, sexe, force); le pouvoir dans la société de l'hyène réside dans les individus ayant le meilleur réseau d'alliés [2]. Les relations de domination dans la société de hyène sont le résultat de disparités dans le soutien social plutôt que de différences dans les caractéristiques physiques telles que la force ou l'agressivité [32]. Les individus avec un meilleur soutien social potentiel dominent toujours l'adversaire lors d'une rencontre entre deux individus, quels que soient leur taille, leur sexe ou leur force.
Les femelles restent généralement dans leur clan natal, alors que les mâles se dispersent généralement à l'âge de 3 ans et demi [51] - [52] - [53]. Les mâles immigrants rejoignent un nouveau clan au bas de la hiérarchie sociale masculine et restent dans une file d'attente dans l'attente d'améliorer leur statut social[54] - [49]. De ce fait, les femelles et les mâles natifs vont dominer les mâles immigrants dans le nouveau clan dans la mesure où ils perdent leur soutien social potentiel lors de la dispersion[32]. Les hyènes de haut rang maintiennent leur position par l'agression dirigée contre les membres de clan de rang inférieur [46].
Comme les primates cercopithèques, les hyènes tachetées utilisent de multiples modalités sensorielles, reconnaissent des individus différents, sont conscientes que certains membres du clan peuvent être plus fiables que d'autres, reconnaissent les relations de parenté et de rang entre eux, et utilisent ce savoir de manière adaptative lors de la prise de décision sociale[50]. Parmi les hyènes, les membres apparentés passent plus de temps ensemble que les non-apparentés, et les comportements d'affiliation envers les apparentés sont plus fréquents qu'envers les non-apparentés[55] - [2]. Bien que chaque hyène tachetée ne s'occupe que de ses propres jeunes, et que les mâles ne participent pas à l'élevage de leurs petits[49], les observations comportementales suggèrent que les petits peuvent être en mesure d'identifier des parents aussi éloignés que des grands-tantes. De plus, les mâles s'associent plus étroitement à leurs propres filles qu'avec des petits sans lien de parenté, et ces derniers privilégient leurs pères en agissant de manière moins agressive à leur égard[44]. Cependant, les petits s'associent plus étroitement aux demi-frères et sœurs maternels qu'aux demi-frères et sœurs paternels, ce qui suggère un mécanisme basé sur l'association liée à une correspondance physique dans la reconnaissance de la parenté chez la hyène[55].
L'environnement maternel (fort investissement, lait riche en nutriments pendant une longue période de lactation)[39] a un effet significatif sur la qualité et la condition physique de leur progéniture. Les filles de mères de rang élevé grandissent plus vite, survivent mieux et auront une valeur reproductive supérieure à celles des filles de rang inférieur[56]. Un bon investissement maternel influence également la condition physique des fils. Les fils nés d’une femelles de rang supérieur grandissent plus rapidement, survivent mieux, sont plus susceptibles de se disperser vers les clans offrant les meilleures perspectives de condition physique, commencent à se reproduire plus tôt et ont une valeur reproductive plus élevée que les fils nés d’une femelle de rang inférieur[57].
Les renversements de rangs et les renversements dans les clans d'hyènes tachetées sont très rares[58]. La dynamique à long terme des réseaux sociaux des hyènes tachetées est déterminée par de plusieurs facteurs : environnementaux, individuels et topologiques. Les facteurs environnementaux et saisonniers comprennent l’abondance des proies, la pluie et la compétition avec d’autres espèces ; des facteurs individuels tels que le sexe, le rang social ou la préférence à créer des liens avec les femelles et avec les membres apparentés; et les facteurs topologiques comprennent la tendance à former des triades au sein du clan. En effet, les hyènes ont tendance à s'associer avec des «amis de leurs amis » et à former des groupes[59].
Les hyènes tachetées adultes de rang supérieur ont tendance à avoir une longueur de télomère plus long[60]. La longueur des télomères a été identifiée comme un mécanisme par lequel la forme physique et l'espérance de vie peuvent varier. Les longs télomères augmentent probablement la survie et la durée de vie[61]. Les adultes de haut rang s’assurent un meilleur accès à la nourriture[62] et le stress métabolique chez les adultes de rang inférieur, causé par des problèmes environnementaux, serait corrélé au raccourcissement des télomères[63]. Ainsi, les adultes de haut rang peuvent être en meilleure santé, vivre plus longtemps et se reproduire davantage. Cependant, l'âge n'est pas un facteur prédictif de la longueur des télomères et n'affecte pas fortement la longueur des télomères chez les hyènes adultes[60].
Les mouvements saisonniers des principales espèces de proies des hyènes provoquent une variabilité considérable de l'abondance des proies sur leur territoire[64]. Ainsi, la taille du territoire est très variable, allant de moins de 40 km2 dans le cratère de Ngorongoro[65] à plus de 1 000 km2 dans le Kalahari[47]. Les clans sont défendus au moyen de démonstrations vocales[66], de marques olfactives [67] et de patrouilles de territoires[3]. Les clans marquent leurs territoires en collant une sécrétion de la glande anale sur l'herbe[9] ou en fouillant dans des latrines spéciales situées à la limite de l'aire de répartition des clans[47]. Les hyènes ignorent toutefois les frontières des clans en période de pénurie alimentaire dans le Serengeti, et se rendent dans des zones éloignées jusqu'à 75 km à la recherche d'une proie[46]; 30 km dans le désert du Namib[68] et au Kalahari, la distance moyenne parcourue varie entre 42 et 80 km[47]. Les membres de haut rang d'un clan ont plus de chances de s'introduire sur le territoire d'un autre clan que les membres de bas niveau[56], et les mâles qui se sont dispersés de leur clan d'origine vers un nouveau clan peuvent revenir dans leur clan d'origine et y assumer leur statut social d'origine pendant deux ans[56]. Les hyènes voyageant dans le domaine vital d'un autre clan présentent généralement des postures corporelles soumises, en particulier lors de rencontres avec d'autres hyènes. L'agression est plus fréquente lorsque les hyènes rencontrent des intrus à la recherche de nourriture, ce qui peut dégénérer en combats provoquant de graves dommages physiques[46].
Rencontre, reproduction et développement
La reproduction de la hyène tachetée ne dépend pas de la saison, bien qu'un pic de naissance puisse survenir pendant la saison des pluies dans certaines régions[3]. Les femelles sont polyestrus, avec une période d'œstrus durant deux semaines[19]. Comme de nombreuses espèces de félidés, la hyène tachetée peut avoir plusieurs partenaires et aucun lien de paire durable ne se forme. Les membres des deux sexes peuvent s'accoupler avec plusieurs partenaires pendant plusieurs années[55]. Les mâles manifesteront en général un comportement de soumission à l'approche des femelles en chaleur[3]. Les jeunes femelles (moins de 5 ans) préfèrent généralement les individus plus jeunes ou immigrés qui ont rejoint le clan après leur naissance[52]. Les femelles plus âgées montrent une préférence similaire, avec toutefois une préférence pour les mâles avec qui elles ont eu des relations antérieures longues et amicales[52] - [39]. Les mâles passifs ont tendance à avoir plus de succès à courtiser les femelles que les mâles montrant plus d’agressivité[39]. La copulation chez les hyènes tachetées est une affaire relativement courte[3], qui dure de 4 à 12 minutes[42], et qui ne se produit généralement que la nuit, en l'absence d'autres hyènes. Le processus de reproduction est compliqué, car le pénis du mâle entre et sort du tractus génital de la femelle par son pseudo-pénis plutôt que directement par le vagin, qui est bloqué par le faux scrotum. Ces caractéristiques inhabituelles rendent l'accouplement plus difficile pour le mâle que pour les autres mammifères, tout en garantissant que le viol est physiquement impossible[39]. Une fois que la femelle a rétracté son clitoris, le mâle entre dans la femelle en glissant sous elle, opération facilitée par l'angle ascendant du pénis. Une fois que cela est accompli, une posture typique d'accouplement mammifère est adoptée[42] - [38].
La durée de la gestation est de 110 jours[3]. Aux dernières étapes de la grossesse, les femelles fournissent à leur progéniture en développement des concentrations élevées d'androstènedione ovarienne. Les nouveau-nés ont des poils noirs et brunâtres et pèsent en moyenne 1,5 kg[35]. Unique parmi les mammifères carnivores, ils naissent les yeux ouverts et ont des canines de 6–7 mm de long et des incisives de 4 mm de long[26]. Les petits s'attaquent entre eux peu de temps après la naissance[69], probablement en raison des taux élevés d'androgènes auxquels ils ont été exposés au cours du développement. Cette rivalité entre frères et sœurs est particulièrement présente chez les portées de jumeaux et peut entraîner un « caïnisme », c’est-à-dire la mort du petit affaibli par la famine lorsque la mère ne fournit que très peu de lait pendant une période prolongée. Après le caïnisme, le taux de croissance et les chances de survie à l'âge adulte du frère jumeau dominant sont considérablement augmentés[70]. Les petits dépendent du lait maternel pendant environ les 12 premiers mois de leur vie. Cette longue période de dépendance est susceptible de favoriser la sélection pour une forte rivalité entre petits d'une même fratrie, ce qui peut conduire au caïnisme si les conditions environnementales sont mauvaises (telles que la faible abondance de proies). En effet, les mères doivent chercher leur nourriture sur de longues distances et ne faire téter leurs petits que tous les quelques jours[70], empêchant ainsi la distribution de lait maternel pour soutenir une portée de jumeau[46]. Les jeunes qui atteignent un taux de croissance élevé au cours des six premiers mois ont un taux de survie jusqu'à l'âge de l'indépendance de deux ans, supérieur à celui de ceux dont la croissance est faible[71]. L'établissement de la relation de dominance entre les jumeaux au début de la vie augmente donc les chances de survie d'au moins un petits pendant les périodes de faible abondance de proies[70] - [72]. Dans les zones où les proies sont abondantes toute l'année sur le territoire ou dans les territoires de clans adjacents tels que le cratère de Ngorongoro, les mères peuvent allaiter leur progéniture plus souvent que les mères de Serengeti. Ainsi, les agressions entre frères et sœurs sont moins fréquentes, il n’y a pas ou peu de caïnisme et les femelles peuvent même élever des portées triples[73] - [74]. Les taux élevés d'androgènes et la prédisposition génétique entraînent la masculinisation des organes sexuels féminins externes[75]. Les femelles dominantes transfèrent des taux d'androgènes plus élevés que les mères de rang inférieur, ce qui rend les petits des femelles dominantes plus agressifs et sexuellement actifs que ceux des hyènes de rang inférieur; les petits mâles de rang supérieur tenteront de s’accoupler avec les femelles plus tôt que les mâles de rang inférieur[76].
La portée moyenne est composée de deux petits, trois étant occasionnellement signalés[47] - [70]. Donner naissance est difficile pour les hyènes femelles, car les femelles accouchent par le biais de leur clitoris étroit et les petits sont les plus gros carnivores jeunes par rapport au poids de leur mère[24]. Pendant la mise bas, le clitoris se rompt pour faciliter le passage des jeunes et peut prendre des semaines pour guérir[9].
Les femelles en lactation peuvent transporter de 3 à 4 kg de lait dans leurs mamelons[24] Le lait des hyènes tachetées a la teneur en protéines la plus élevée de tous les carnivores terrestres[9]. Les mères ne régurgitent pas la nourriture pour leurs petits mais elles peuvent rapporter de la nourriture à la tanière[3] où elles allaitent également leurs petits[71]. Les femelles sont très protectrices envers leurs petits et ne toléreront pas que d'autres adultes, en particulier des mâles, s'en approchent. Les hyènes tachetées présentent des comportements d'adultes très tôt dans la vie; on a observé des petits se renifler rituellement et marquer leur espace vital avant l'âge d'un mois. Dans les dix jours qui suivent leur naissance, ils peuvent se déplacer à une vitesse considérable[3]. Ils commencent à avoir des comportements de chasse à l'âge de huit mois et participeront pleinement aux chasses en groupe après leur première année. Les hyènes tachetées atteignent leur maturité sexuelle entre deux et quatre ans[77]. La durée de vie moyenne dans les zoos est de 12 ans[78], avec un maximum de 41 ans[79]. Dans la nature, ils sont connus pour vivre jusqu'à 19 ans[58].
La tanière
La vie sociale du clan tourne autour d'une tanière commune. Celle-ci est généralement volée à d'autres espèces telles que phacochère, l'Oryctérope du Cap ou le renard à oreilles de chauve-souris[47]. Le premier avantage des tanières est protecteur lorsque les petits passent leurs premiers 8 à 12 mois. Mais les tanières ont également d'importantes fonctions sociales en tant que lieu de rencontre où les membres du clan interagissent socialement, ainsi qu'avec les petits, ce qui contribue à leur développement social[80] - [81]. Certains clans peuvent utiliser leur tanières pendant des années, tandis que d'autres peuvent utiliser plusieurs tanières différentes au cours d'une année ou plusieurs sites simultanément[9]. Celles-ci peuvent être séparées de 7 km maximum[82]. Les tanières de hyènes peuvent avoir plus d’une douzaine d’entrées et sont situées pour la plupart sur un terrain plat. Les tunnels ont généralement une section ovale, étant plus larges que haut, et se réduisent d'une largeur d'entrée de ½ à 1 mètre à 25 cm. Dans les régions rocheuses d'Afrique orientale et du Congo, les hyènes tachetées utilisent des grottes comme tanières, tandis que celles du Serengeti utilisent des kopjes comme zones de repos pendant la journée. Les tanières ont de larges zones plates autour de leurs entrées, où les hyènes se déplacent ou s’allongent. En raison de leur taille, les hyènes adultes sont incapables d'utiliser toute l'étendue de leur tanières, car la plupart des tunnels sont creusés par des petits[70]. La structure de la tanière, constituée de petits canaux souterrains, constitue probablement un dispositif anti-prédateur efficace qui protège les petits des prédateurs pendant l’absence de la mère. Les fèces sont généralement déposées à 20 mètres de la tanière, bien que les individus urinent où qu’ils se trouvent. Les tanières sont principalement utilisées par plusieurs femelles à la fois, et il n'est pas rare de voir jusqu'à 20 petits sur un seul site[83]. Les femelles donnent généralement naissance à la tanière commune ou à une tanière de naissance privée. Cette dernière est principalement utilisée par les femelles de statut inférieur pour conserver un accès continu à leurs petits et pour s'assurer qu'elles se familiarisent avec leurs petits avant leur transfert dans la tanière commune [9].
Intelligence
À la différence des autres espèces de hyènes, la hyène tachetée présente un plus gros cortex frontal qui intervient dans la médiation du comportement social. Les études suggèrent fortement une évolution convergente de l'intelligence des hyènes et des primates[44]. Une étude récente a montré que les hyènes vivent dans des groupes sociaux aussi vastes et complexes que ceux des primates cercopithèques. Lorsqu'ils vivent une période précoce d'apprentissage intensif de leur environnement social, la demande de dextérité sociale lors d'interactions compétitives et coopératives n'est pas moins intense que chez les groupes de primates. Enfin, les hyènes semblent être capables de réaliser autant exploits de reconnaissance sociale et de cognition que les primates[2]. Une étude réalisée par des anthropologues de l'évolution a démontré que les hyènes tachetées surpassent les chimpanzés lors des tests coopératifs de résolution de problèmes. Des paires captives de hyènes tachetées ont été invitées à tirer deux cordes à l'unisson pour gagner une récompense en nourriture, en coopérant avec succès et en apprenant rapidement les manœuvres sans formation préalable. Des hyènes expérimentées ont même aidé des camarades de clan inexpérimentés à résoudre le problème. En revanche, les chimpanzés et les autres primates nécessitent souvent une formation approfondie et la coopération entre individus n'est pas toujours aussi facile pour eux[84]. Les colonisateurs néerlandais de l'Afrique du Sud du XIXe siècle ont attesté de l'intelligence des hyènes tachetées, affirmant qu’elles étaient excessivement rusées et sournoises, en particulier après s'être échappées des pièges[85]. Les hyènes tachetées semblent prévoir la chasse de certaines espèces à l'avance et certaines ont été observées se livrant à des activités telles que le marquage des odeurs avant de partir à la chasse aux zèbres, un comportement qui ne se produit pas lorsqu'elles ciblent d'autres espèces de proies[3]. De plus, il a été constaté que les hyènes tachetées adoptaient un comportement trompeur, notamment en émettant des cris d’alarme pendant leur alimentation afin d'effrayer leur ennemi ou d'autres membres du clan et en leur permettant de manger temporairement en paix. De même, les mères émettent des appels d'alarme en essayant d'interrompre les attaques de leurs petits par d'autres hyènes[44].
La chasse
Les hyènes sont connues comme étant des chasseurs qualifiés et environ 25 à 35 % des tentatives de chasse aboutissent à la capture d'une proie ongulée[86] - [47]. Seules, elles se nourrissent de petites proies jusqu'à 75 % du temps. Cependant, dans le Masaï Mara, les grands ongulés requièrent souvent la coopération des membres du clan, ce qui augmente la probabilité de réussite d'environ 20 %[86]. Les hyènes chassant seules des jeunes gnous bleus dans le Serengeti ont un taux de réussite de chasse de seulement 15 %, ce chiffre pouvant atteindre 23 % pour une chasse en duo et jusqu'à 31% pour les groupes de trois ou plus[3]. Lorsqu'elles chassent des proies de taille moyenne à grande, les hyènes tachetées ont tendance à sélectionner certaines catégories d'animaux. Elles choisissent généralement les individus les moins aptes parmi les proies: parmi les populations de gnous et de gazelles, les jeunes animaux sont fréquemment ciblés, tout comme les animaux âgés, bien que cette dernière catégorie ne soit pas aussi importante lors de la chasse aux zèbres, en raison de leur comportement agressif anti-prédateur[3]. Le succès de la chasse varie en fonction de la taille du groupe, des espèces de proie, des tactiques de défense de la proie, de la taille du groupe de proies et de l'écosystème[47]. La hyène tachetée suit ses proies vivantes grâce à sa vue, son audition et odorat. Les carcasses sont détectées par l'odorat et le son des autres prédateurs qui s’en nourrissent. Pendant la journée, elles regardent les vautours descendre sur des carcasses[9]. Leur perception auditive est suffisamment puissante pour détecter le bruit des prédateurs tuant une proie ou se nourrissant de carcasses sur des distances pouvant atteindre 10 km[47]. Contrairement au loup gris, la hyène tachetée se repose davantage sur sa vue que sur son odorat lors de la chasse et ne suit pas les empreintes de sa proie ni ne se déplace en file indienne[87] - [3]. Une petite proie est tuée par une seule morsure alors que les proies plus larges sont mangées vivantes[26].
Les hyènes tachetées chassent généralement le gnou soit individuellement, soit par groupes de deux ou trois. Elles attrapent des gnous adultes généralement après 5 km de courses à une vitesse pouvant atteindre 60 km/h. Les poursuites sont généralement débutées par une hyène et, à l'exception des femelles avec des petits, il y a peu de défense active de la part du troupeau de gnous. Un gnou tentera parfois d'échapper aux hyènes en se jetant à l'eau, même si, dans de tels cas, les hyènes l’attraperont presque toujours[3]. Les zèbres exigent des méthodes de chasse différentes de celles utilisées pour les gnous, en raison de leur habitude de courir en groupes serrés et de la défense agressive des étalons. Les groupes de chasseurs de zèbres typiques sont constitués de 10 à 25 hyènes[3], bien qu'un seul cas d'hyène tuant un zèbre adulte sans aide ait été enregistré[88]. Lors d'une poursuite, les zèbres se déplacent généralement en groupes serrés, les hyènes poursuivant en arrière dans une formation en croissant. Les poursuites sont généralement relativement lentes, avec une vitesse moyenne de 15 à 30 km/h. Un étalon essaiera de se placer entre les hyènes et le troupeau, mais dès qu'un des zèbres est distancé par le reste du troupeau, généralement après une course de 3 km, il est immédiatement attaqué. Bien que les hyènes puissent harceler l'étalon, elles ne se concentrent généralement que sur le troupeau et tentent d'esquiver les assauts de l'étalon. Contrairement aux étalons, les juments réagissent seulement de manière agressive lorsque leurs poulains sont menacés. À la différence des gnous, les zèbres s'abreuvent rarement lorsqu'ils sont poursuivis par des hyènes[3]. Lors de la chasse aux gazelles de Thomson, les hyènes tachetées opèrent généralement seules et s'attaquent principalement aux jeunes faons. Les poursuites contre des gazelles adultes et jeunes peuvent couvrir des distances de 5 km avec une vitesse de 60 km/h. Les gazelles femelles ne défendent pas leurs faons, bien qu'elles puissent tenter de distraire les hyènes en feignant d'être faibles[3].
Écologie
Régime alimentaire
Les hyènes tachetées sont des prédateurs grégaires nécessitant un régime carnivore à base de vertébrés[89]. Pour maintenir leur état, elles ont besoin de 3,8 à 4 kg de viande par jour[90]. Considérées à l'origine comme des charognards, il est maintenant bien connu qu'elles sont des chasseurs actifs et les carcasses ne représentent qu'un tiers de leur alimentation dans le Serengeti[3]. Hans Kruuk, un écologiste africain, a réalisé l'une des premières études démontrant leurs capacités de chasseur. Une étude de 7 ans sur les populations de hyènes a montré que les hyènes tachetées chassent autant que les lions. Cependant, les hyènes tachetées restent à tort identifiées comme charognards, souvent même par des écologistes et des chaînes documentaires sur la faune.
La hyène tachetée est très efficace pour manger sa proie ; elle présente des caractéristiques morphologiques et physiologiques permettant de manger tous les restes osseux ou animaux, et sont équipés de dents spéciales pour écraser les os et elles sont également capables de les digérer complètement[3]. Les hyènes tachetées peuvent digérer tous les composants organiques des os, pas seulement la moelle. Toute matière inorganique est excrétée avec les matières fécales, qui consistent presque entièrement en une poudre blanche avec peu de poils. Ils réagissent plus facilement que les autres carnivores africains au débarquement des vautours et sont plus susceptibles de rester à proximité des lieux où un lion a tué une proie[3].
Proies
Les habitudes alimentaires des hyènes tachetées sont extrêmement variées dans le choix de leurs proies, qui varient considérablement d'un écosystème à l'autre[9]. Leur morphologie et leur opportunisme comportemental leur permettent de capturer tout ce qu’il peut l’être, des lièvres aux girafes[91] - [92]. Ils tuent des herbivores tels que des petites antilopes, moyennes ou grandes, des buffles[93] et d'autres herbivores tels que le zèbre ou le phacochère. Mais comme ils sont opportunistes, des individus ont été enregistrés en train de manger presque tous les mammifères, des poissons et autruches[94], tortues, des petits de rhinocéros noirs[95], des petits d’hippopotames[96], jeunes éléphants d’Afrique[97], des pangolins[94] et des pythons[3] - [98]. Il existe au moins un enregistrement de quatre hyènes tuant un hippopotame adulte dans le parc national Kruger[47]. Les hyènes tachetées peuvent consommer des produits organiques d'origine humaine, tels que des bottes en cuir et des ceintures autour des campings. Jane Goodall a signalé que des hyènes tachetées attaquaient ou jouaient sauvagement avec les équipements extérieurs et intérieurs des voitures, et que l'espèce serait responsable de la consommation de pneus de voiture[26]. Les archives fossiles indiquent que les hyènes tachetées d'Europe, aujourd'hui disparues, se nourrissaient principalement de chevaux de Przewalski, de Megaloceros giganteus, de caribous, de Cerf élaphe, de chevreuils, de daims, de sangliers, de bouquetins, de bisons des steppes, d'aurochs ou encore de rhinocéros laineux. On pense que les hyènes tachetées sont responsables de la désarticulation et de la destruction de certains squelettes d'ours des cavernes. Ces grandes carcasses constituaient une ressource alimentaire optimale pour les hyènes, en particulier à la fin de l'hiver, lorsque la nourriture était rare[99].
Les gnous sont les proies ongulées de taille moyenne les plus couramment consommées au Ngorongoro et au Serengeti, ainsi le zèbre, les gazelles de Thomson et les gazelles de Grant[82] - [100]. Les buffles du Cap sont rarement attaqués en raison de différences de préférences d'habitat, bien que des mâles adultes peuvent parfois être attaqués et tués[93]. Dans le parc national Kruger, le gnou bleu, le zèbre de Burchell, le plus grand koudou et l'impala sont la principale proie de la hyène tachetée. Les carcasses de buffles sont généralement mangées après avoir été tué par des lions[98]. La girafe, l'impala, le gnou et le zèbre sont ses principales sources de nourriture dans la région voisine de Timbavati en Afrique du Sud[101]. Springbok et kudu sont les principales proies du parc national d'Etosha en Namibie et le springbok au Namib[102]. Dans le sud du Kalahari, l'oryx, le gnou et le springbok sont les principales proies[47]. À Chobe, les principales proies de la hyène tachetée sont les zèbres migrateurs et impalas résidents[92]. Au Kenya dans le parc du Masai Mara, 80 % des proies des hyènes sont représentées par les topi et les gazelles de Thomson durant les 4 mois de migration où les gnous et les zèbres sont absents[9]. Le guib harnaché, les suni et les buffles sont les proies prédominantes dans les montagnes Aberdare du Kenya, tandis que la gazelle de Grant, la gazelle de Waller les moutons, les chèvres et les bovins sont les proies les plus chassées du nord du Kenya[103]
En Afrique de l’Ouest, on pense que la hyène tachetée est avant tout un charognard, mais qu’elle attaquerait parfois le stock domestique et les antilopes de taille moyenne dans certaines régions. Au Cameroun, il est courant que les hyènes tachetées se nourrissent de petites antilopes comme le Cobe de Buffon, mais elles peuvent aussi se nourrir de carcasses de Redunca, de bubale roux, de buffles, de girafes, d’éléphants d’Afrique, de topis et d’antilopes roannes. Au Malawi, les hyènes tachetées se nourrissent d'ongulés de taille moyenne à grande, tels que le cobe à croissant et l'impala. Dans la réserve de Selous, en Tanzanie, les hyènes tachetées s'attaquent principalement au gnou, suivies du zèbre, de l'impala, de la girafe et du bubale roux. En Ouganda, on pense que l'espèce s'attaque principalement aux oiseaux et aux reptiles, tandis qu'en Zambie, il s'agit principalement d'un charognard[9].
Une hyène tachetée peut manger jusqu'à 18 kg par repas[101]. La consommation alimentaire quotidienne moyenne dans le cratère du Ngorongoro est estimée à 2 kg/jour[3], 3,8 kg/jour dans le parc national Kruger[98] et 4 kg/jour dans le Namib[90]. Lorsqu'elles se nourrissent d'une carcasse intacte, les hyènes tachetées consomment d'abord la viande autour des flancs et de la région anale, puis ouvrent la cavité abdominale et retirent les organes mous. Une fois que l'estomac, sa paroi et son contenu sont consommés, les hyènes mangent les poumons et les muscles abdominaux et des jambes. Une fois les muscles mangés, la carcasse est désassemblée et les hyènes emportent des morceaux pour manger en paix.
Les hyènes tachetées sont habiles à manger leur proie dans l'eau : on les a vues plonger sous des carcasses flottantes pour se nourrir, puis refaire surface pour avaler [102] Une seule hyène peut prendre moins de deux minutes à manger une jeune gazelle[3] tandis qu'un groupe de 35 hyènes peut complètement consommer un zèbre adulte en moins de 30 minutes[54]. Les hyènes tachetées vivent souvent dans les pays très secs où l'eau est peu abondante. Elles peuvent survivre sans manger ni boire pendant de longues périodes allant jusqu'à plusieurs semaines[9]. Elles ne passent généralement pas plus de 30 secondes à boire[3].
Lions
Dans les régions où les hyènes tachetées et les lions sont sympatriques, les deux espèces occupent la même niche écologique et sont donc en compétition directe l'une avec l'autre[104]. Les habitudes alimentaires des hyènes et des lions sont similaires et les deux espèces ont 58,6 % de leurs espèces de proies en commun[105]. Une étude dans le cratère du Ngorongoro montre que les hyènes ont volé 100 % des proies des lions lorsque les mâles adultes étaient absents de la troupe[100]. Au Kalahari, la hyène tachetée se nourrit de proies tuées par les lions et vice versa, sans qu'aucune espèce n'ait un avantage évident[106]. D'un autre côté, les hyènes perdent jusqu'à 5 % de leurs proies tuées au profit des lions dans le Serengeti et 20 % dans le Ngorongoro[3]. Le résultat de toute interaction compétitive entre ces deux espèces dépend de plusieurs facteurs tels que le nombre de lions et de hyènes présents, la présence ou non de lions mâles adultes et la motivation actuelle des membres des deux espèces[107] - [100]. Les membres de matrilignes de hyène coopèrent fréquemment pour se défendre contre les lions et peuvent causer des blessures graves pouvant parfois entrainer la mort[108].
Les lions ignorent généralement les hyènes tachetées, sauf lorsqu'ils leurs disputent une proie ou s'ils sont harcelés par elles. Il existe une fausse idée courante selon laquelle les hyènes volent les proies des lions, mais le plus souvent, c'est l'inverse[104] - [109]. Les lions tuent les hyènes afin de réduire la compétition alimentaire et, dans certains écosystèmes, les lions sont la principale source de mortalité des hyènes tachetées[110] - [104]. Les lions peuvent rapidement suivre les appels à l'alimentation des hyènes, un fait démontré par des expériences sur le terrain, au cours desquelles les lions s'approchaient à plusieurs reprises chaque fois que les appels enregistrés de l'alimentation des hyènes étaient entendus. Lorsque les lions leur disputent une proie, les hyènes tachetées s'en vont ou attendent patiemment à une distance de 30 à 100 mètres jusqu'à ce que les lions aient fini de manger[111]. Dans certains cas, les hyènes tachetées ont l'audace de se nourrir aux côtés des lions et peuvent parfois les forcer à leur abandonner une proie[3]. Cela arrive surtout la nuit, quand les hyènes ont plus d'assurance.
Les deux espèces peuvent agir agressivement l'une envers l'autre même lorsqu'il n'y a pas de nourriture en jeu[111]. Les lions peuvent charger les hyènes et les mutiler sans raison apparente ; et la prédation des lions peut représenter jusqu'à 71% des morts de hyènes à Etosha. Les hyènes tachetées se sont adaptées à cette pression en s'attaquant fréquemment aux lions qui entrent sur leur territoire[104].
Guépards et léopards
Bien que les guépards et les léopards s'attaquent de préférence à des animaux plus petits que ceux chassés par les hyènes tachetées, les hyènes voleront leurs proies quand l'occasion se présentera. Dans le Serengeti, les guépards perdent 4 % de leur proies à cause des hyènes[112]. Chez le guépard, la survie des petits est fortement affectée par la prédation et notamment celle de la hyène. Plus de 90 % des petits guépards meurent avant d'atteindre l'indépendance, principalement à cause de la prédation[113]. Les guépards adultes peuvent aussi perdre la vie à cause des hyènes[114]. Les guépards sont généralement facilement intimidés par les hyènes et ne résistent guère. Comme ils ont de petites mâchoires et sont frêles, une mère ne peut pas défendre ses petits contre les hyènes. Cependant, elle peut réduire la prédation de ses petits en adaptant son comportement et en adoptant une stratégie d'évitement[115].
Les léopards, en particulier les mâles, peuvent se confronter aux hyènes. Des léopards mâles ont été signalés s'attaquant à des hyènes[116]. Les hyènes sont néanmoins des adversaires dangereux pour les léopards ; il existe au moins un signalement d'un jeune léopard mâle adulte qui serait mort d'une infection septicémique causée par des blessures infligées par une hyène tachetée[117]. Il existe également un cas de deux hyènes tachetées tuant et mangeant un jeune léopard à Timbavati Game Reserve, après la blessure d'une jeune hyène par le léopard[118].
Lycaons
La compétition entre la hyène tachetée et les lycaons est commune. Dans le cratère du Ngorongoro, les hyènes rivalisent avec les lycaons pour leur proies[119]. Dans une étude menée dans le Serengeti, les hyènes étaient présentes à 74 % des 62 tueries de lycaons et ont consommé leur proie à 60 %. Par contre, seulement 5 des 465 proies tuées par des hyènes ont été appropriées par des lycaons[3]. Cette compétition aurait des conséquences sur la population de lycaons du Serengeti autant en nombre et que dans leur répartition[120].
Des hyènes tachetées suivent des lycaons afin de s'approprier leur proies. Elles inspectent généralement les endroits où ils sont passés à la recherche de restes de nourriture. Lors d'une mise à mort par les lycaons, les hyènes solitaires s'approchent prudemment et tentent de voler un morceau de viande sans se faire remarquer, bien qu'elles puissent être attaquées lors de cette tentative[119]. Quand elles opèrent en groupe, les hyènes tachetées ont plus de succès pour voler les proies des lycaons, bien que la tendance de ces derniers à s'entraider leur donne un avantage contre les hyènes tachetées, qui sont rarement à l'unisson. Les cas de lycaons volant les proies de hyènes tachetées sont rares. Bien que les lycaons peuvent facilement repousser les hyènes solitaires, dans l'ensemble, la relation entre les deux espèces est plutôt à l’avantage des hyènes[3], les densités de lycaons étant souvent corrélées négativement aux populations de hyènes[121].
Chacals et loups
Les chacals à chabraques, le chacal à flancs rayés et les loups dorés d'Afrique se nourriront à côté des hyènes, mais ils seront chassés s'ils s'approchent trop près. Les hyènes tachetées suivent parfois les chacals et les loups pendant la saison de la mise bas des gazelles, car ceux-ci sont efficaces pour suivre et attraper les jeunes. Les hyènes ne mangent pas facilement la chair du loup ; quatre hyènes ont mis une demi-heure à manger un loup doré. Dans l'ensemble, ces animaux s'ignorent généralement lorsqu'il n'y a pas de nourriture ou de jeunes en jeu[3].
Autres compétiteurs
Les hyènes tachetées dominent les autres espèces de hyènes là où leurs aires de répartition se chevauchent[10]. Les hyènes brunes rencontrent des hyènes tachetées dans le Kalahari, où les espèces brunes sont plus nombreuses que les tachetées. Les deux espèces se rencontrent généralement sur des carcasses, ce que les hyènes tachetées s‘approprient généralement. Parfois, les hyènes brunes se tiennent debout et lèvent leur crinière tout en émettant des grognements. Cela a généralement pour effet de distraire les hyènes tachetées, ce qui les rend perplexes, bien qu'elles attaquent parfois leurs cousins. Des interactions similaires ont été enregistrées entre les hyènes tachetées et les hyènes rayées du Serengeti[122].
Les hyènes tachetées se tiennent généralement à bonne distance des crocodiles du Nil. Bien qu'elles se précipitent facilement dans l'eau pour attraper leurs proies[3].
Communication
Langage corporel
Les hyènes tachetées ont un ensemble complexe de postures en communication. Elles possèdent un riche répertoire de signaux visuels, acoustiques et olfactifs[2]. Elles utilisent ces signaux pour discriminer les membres du clan des hyènes étrangères afin de reconnaître les autres membres de leurs unités sociales en tant qu’individus et d’obtenir des informations sur l’effet des signaleurs[123]. En présence d'un membre du clan, les hyènes sont attentives aux postures corporelles et aux représentations visuelles des autres individus. En se nourrissant d'une carcasse, elles veillent à la position relative des individus[44]. L'olfaction joue un rôle important dans la vie sociale du clan. Les hyènes ont un sens olfactif aigu et se livrent souvent à des marquages odorants. Chaque clan semble avoir une signature olfactive unique[124] et les hyènes à l'état sauvages marquent les limites de leurs territoires avec des sécrétions provenant de leurs glandes odorantes[108]. Quand elles ont peur, les oreilles sont pliées à plat et sont souvent associées à une mise à nu des dents et à un aplatissement de la crinière. Lorsqu'elle est attaquée par d'autres hyènes ou par des lycaons, la hyène abaisse son arrière-train. Avant et pendant une attaque assertive, la tête est haute, les oreilles bien droites, la bouche fermée, la crinière dressée et l’arrière-train haut. La queue pend habituellement en position neutre, mais elle changera de position en fonction de la situation. Lorsqu'un individu tend à fuir un attaquant, la queue est enroulée sous le ventre. Lors d’une attaque ou lorsqu’elle est excitée, la queue est avancée sur le dos. Une queue dressée n'accompagne pas toujours une rencontre hostile, elle a également été observée lors d'interactions sociales inoffensives. À l'approche d'un animal dominant, les hyènes tachetées subordonnées marchent sur les genoux de leurs pattes antérieures en se soumettant[3]. Les cérémonies de bienvenue entre les membres du clan se composent de deux individus parallèles et faisant face à des directions opposées. Les deux individus lèvent leurs pattes arrières et se lèchent mutuellement la région anogénitale[9]. Au cours de ces cérémonies de salutation, le pénis ou le pseudo-pénis s'érige, tant chez les mâles que chez les femelles. L'érection est généralement un signe de soumission, plutôt que de domination, et est plus fréquente chez les mâles que chez les femelles[125].
Vocalisations
La nature sociale de la hyène tachetée a conduit à l’évolution d’une grande variété de vocalisations[47]. Un système de communication vocale riche peut faciliter les liens sociaux entre les membres du clan parfois proches les uns des autres mais aussi séparés des longues distances[126]. Le répertoire vocal de la hyène tachetée est vaste, avec plus d'une dizaine de vocalisations différentes[47]. La vocalisation la plus connue est le "whoop" qui peut être entendu à des kilomètres et est parmi les sons les plus reconnaissables de l'Afrique. Celle-ci peut être utilisée comme une fonction rassembleuse pour rassembler les membres du clan afin de défendre le territoire, les ressources alimentaires et la tanière communale[9]. Les mâles adultes utilisent cette vocalisation plus souvent que les femelles, et les mâles les plus haut placés dans la hiérarchie consacrent plus d'efforts à la démonstration vocale que les mâles les moins bien classés[127]. Les hyènes sont capables d’identifier d’autres individus sur la base de leurs vocalisations à distance, qui transmettent également des informations sur l’âge et le sexe de l’appelant[128].
Une autre vocalisation bien connue est le rire, qui est un signe de soumission. Ce son est principalement utilisé lorsque les hyènes se nourrissent ensemble[3]. Bien que ce son soit émis lors d'interactions rapprochées entre deux individus ou plus, il est fort et peut être facilement entendus par les autres membres du clan. Dans la nature, le rire est généralement émis lors de compétitions entre dominants et subordonnés, telles que celles qui se produiraient lors du rassemblement autour d'une carcasse[47]. Le rire de le la hyène code potentiellement des informations sur l’identité individuelle, le statut social et l’âge, donnant ainsi aux destinataires des indices pour évaluer la position sociale d’un individu émetteur[129].
Maladies et parasites
Les hyènes tachetées peuvent contracter la brucellose, la peste bovine et l'anaplasmose[130]. Elles sont vulnérables à Trypanosoma congolense, qui se contracte en consommant des herbivores déjà infectés, plutôt que par l'infection directe par les mouches tsé-tsé[3]. Il est connu que les hyènes tachetées adultes du Serengeti possèdent des anticorps contre la rage, l'herpès canin, le brucella canin, le parvovirus canin, le Calicivirus félin, la leptospirose, la Brucella melitensis, la peste bovine et l'anaplasmose[131]. Lors de l'apparation de maladie de Carré de 1993 à 1994, des études moléculaires ont montré que les virus isolés à partir de hyènes et de lions étaient plus proches les uns des autres que du virus de la maladie de Carré canin le plus proche chez le chien. Des preuves de la maladie de Carré chez la hyène tachetée ont également été enregistrées dans le Masaï Mara[132]. Au Kalahari, la rage peut également jouer un rôle important dans la dynamique des populations de l’hyène tachetée[47]). Des cas d'individus tués par la rage ont été signalés en Afrique du Sud[133], en Zambie[134] et au Malawi[135]. Au Serengeti et à Masaï Mara, l'exposition à la rage ne provoque pas de symptômes cliniques ni n'affecte la survie ou la longévité des individus[9]. Les analyses de plusieurs échantillons de salive de hyène ont montré qu'il était peu probable que l'espèce soit un vecteur de la rage, ce qui indiquerait que l'espèce est infectée par d'autres animaux plutôt que par d'autres hyènes tachetées[9]. Des microfilaires de Dipetalonema dracuneuloides ont été enregistrées chez des hyènes dans le nord du Kenya[136]. L'espèce est connue pour posséder au moins trois espèces de cestodes du genre Taenia, dont aucune n'est nocive pour l'homme[9]. Elle transporte également des parasites protozoaires du genre Hepatozoon dans le Serengeti[9], au Kenya[137] et de l'Afrique du Sud[138]. Les hyènes tachetées peuvent agir comme hôtes dans les cycles de vie de divers parasites qui commencent leur vie chez les herbivores; Taenia hyaenae et T. olnogojinae sont présents chez les hyènes dans leur phase adulte. Trichinella spiralis et Trichinella nelsoni[139] se trouvent sous forme de kystes dans les muscles des hyène[3]. Les hyènes tachetées peuvent également être infectées par la bactérie Streptococcus equi ruminatorum. L'infection par ces bactéries peut être non symptomatique, mais certaines souches provoquent des signes cliniques graves, notamment la mort[140]. Une épidémie d'infection à Streptococcus dans le cratère de Ngorongoro a provoqué une réduction à court et à long terme de la croissance de la population[141].
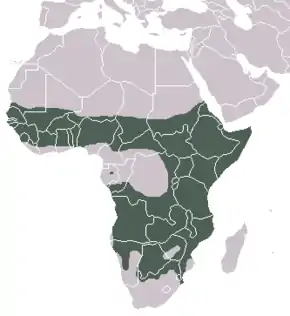
Aire de répartition, habitats et population
Les hyènes tachetées sont relativement largement réparties en Afrique, au sud du Sahara. Leur répartition actuelle est inégale, en particulier en Afrique occidentale et centrale, avec des populations souvent concentrées dans des zones protégées. Des distributions plus continues persistent sur de vastes zones du Tchad, de la République centrafricaine, du Sud-Soudan, de l'Éthiopie, du Kenya, de la Tanzanie, du Botswana, de l'Angola, de la Namibie et de certaines parties de l'Afrique du Sud. Des scientifiques ont rapporté que les hyènes tachetées sont encore largement répandues à Djibouti[142] ainsi qu'en Gambie[143]. Des études à long terme sur l'espèce et des enquêtes récentes ont également confirmé leur présence au Bénin, au Burkina Faso, au Ghana, en Côte d'Ivoire, au Malawi, au Nigéria, en République du Congo, au Sénégal, Zambie et Zimbabwe[144] - [145] - [141] - [146] - [147]. Il est également probable que les hyènes tachetées ont établi une petite population en Érythrée. Les hyènes tachetées peuvent parfois entrer au Gabon en provenance de la République du Congo, mais rien n'indique qu'il y ait une population résidente au Gabon[148] - [145]. Hofer et Mills [149] ont signalé l’extinction de l’espèce en Algérie, où elles auraient pu être observés dans l’Ahaggar et le Tassili d’Ajjer. Il n’existe pas non plus de preuve confirmée de leur présence en Égypte, au Lesotho, au Libéria, en Libye, en Tunisie et au Maroc, et aucun cas récent au Togo.
Des populations viables existent dans plusieurs pays et une estimation provisoire de la population mondiale totale est comprise entre 27 000 et 47 000[150]. Les plus grandes populations connues se trouvent dans l'écosystème de Serengeti en Tanzanie et au Kenya (7 200 à 7 700 dans le secteur tanzanien et 500 à 1 000 dans le secteur au Kenya) et dans le parc national Kruger en Afrique du Sud (1 300 à 3 900). Les densités de population basées sur les recensements systématiques varient considérablement, allant de 0,006 habitants au km² en Namibie à 2,4 individus au km² dans le cratère du Ngorongoro en Tanzanie[9] - [147] - [141]. On trouve de faibles densités de population dans les zones semi-désertiques d'Afrique australe (0,006 à 0,05 individus au km²), telles que le Namib[68] et Etosha Pan[151]. De fortes densités sont observées dans les savanes et certaines forêts ouvertes de Tanzanie et du Kenya, ainsi que dans les forêts de montagne (0,32 à 2,4 individus au km²), telles que la réserve de Selous[152], le parc national Aberdare[103] et le cratère de Ngorongoro[141]. La plupart des populations vivant dans des zones protégées d'Afrique australe et plusieurs populations en Afrique orientale sont considérées comme stables. Il est prouvé que quelques populations ont augmenté au cours des dernières années. En revanche, de nombreuses populations de l'est, du centre et de l'ouest de l'Afrique sont considérées en déclin, même dans les zones protégées, principalement en raison de l'intensification des conflits homme-faune au cours desquels les humains empoisonnent et éliminent les hyènes repérées et en raison du piégeage accidentel[9] - [147].
Les hyènes tachetées sont présentes dans tous les habitats, y compris les habitats semi-désertiques, de savane et de forêts ouvertes, de forêts denses sèches et même de montagne, comme dans les Aberdares, le Mont Kenya et les hauts plateaux éthiopiens, jusqu'à 4 100 m d'altitude[153] - [154]. Elles sont absentes ou présentes à de très faibles densités dans les conditions extrêmes de désert, les altitudes les plus élevées sur les montagnes et les forêts tropicales humides, bien qu'elles puissent faire de profondes incursions dans les zones forestières où les chemins forestiers fournissent un accès[155] - [156]. Dans de nombreuses parties de leur aire de répartition, elles sont étroitement associées aux habitations humaines. Bien que de longues périodes puissent s'écouler entre les moments où elles boivent, les hyènes tachetées dépendent au moins un peu de l'eau. Tilson et Henschel[68] ont par exemple décrit le cas d'un clan qui s'était dispersé après l'assèchement de la seule source d'eau de son aire de répartition.
La hyène tachetée et l'être humain
Préhistoire
La hyène tachetée est représentée dans quelques exemples d'art rupestre du Paléolithique supérieur en France. Une peinture de la grotte de Chauvet représente une hyène dessinée et représentée de profil, avec deux pattes, sa tête et sa partie avant au motif coloré tacheté bien reconnaissable. En raison du profil raide du spécimen, on pense que la peinture était à l'origine destinée à représenter un ours des cavernes, mais qu'elle a été modifiée en hyène. À Lascaux, une peinture rupestre rouge et noire d'une hyène est présente dans la partie de la grotte connue sous le nom de Diverticule axial, et est représentée de profil, avec quatre membres, représentant un animal avec un dos raide. Le corps et le long cou ont des taches, y compris les flancs. Une image d'une grotte d'Ariège montre une figure aux contours incomplets et profondément gravée, représentant une partie d'un cou allongé, passant en douceur dans une partie du membre antérieur de l'animal sur le côté proximal. Sa tête est de profil, avec un museau éventuellement re-gravé. L'oreille est typique de la hyène tachetée, car elle est arrondie. Une image de la grotte du Gabillou en Dordogne montre une figure zoomorphique profondément gravée avec une tête en vue frontale et un cou allongé avec une partie du membre antérieur en profil. Cette figure représente de grands yeux ronds et des oreilles courtes et arrondies qui sont placées loin l'une de l'autre. Elle a une large bouche ridée qui évoque un sourire. Bien que l'on pensait à l'origine qu'il s'agissait d'un hybride zoomorphique, il s'agit probablement d'une hyène tachetée en raison de son museau large et de son long cou[157].
La rareté relative des représentations de la hyène dans l'art rupestre paléolithique a été attribuée, selon la théorie, au rang inférieur de l'animal dans la hiérarchie du culte des animaux ; l'apparence de la hyène tachetée était probablement peu attrayante pour les chasseurs de l'âge de glace, et elle n'était pas recherchée comme proie. De plus, ce n'était pas un rival sérieux pour l'homme comme le lion des cavernes ou l'ours des cavernes, et, à la différence du mammouth ou du rhinocéros laineux, elle n'était pas impressionnante[157].
En Afrique
En Afrique, la hyène tachetée est généralement représentée comme un animal anormal et ambivalent, considéré comme rusé, brutal, nécrophage et dangereux. Elle incarne en outre la puissance physique, la démesure, la laideur, la stupidité, ainsi que la sacralité. Les hyènes tachetées varient dans leurs descriptions mythologiques, selon le groupe ethnique dont proviennent les contes. Il est souvent difficile de savoir si les hyènes tachetées sont les espèces d'hyènes spécifiques figurant dans ces histoires, en particulier en Afrique de l'Ouest, car les hyènes tachetées et les hyènes rayées portent souvent le même nom[158]. Dans les contes ouest-africains, les hyènes tachetées symbolisent l'immoralité, les mauvaises habitudes, le retour aux activités normales et autres traits négatifs et sont parfois présentées comme des mauvais musulmans qui défient l'animisme local existant chez les Beng en Côte d'Ivoire. En Afrique de l'Est, la mythologie Tabwa dépeint la hyène tachetée comme un animal solaire qui a d'abord apporté le soleil pour chauffer la terre froide[158].
Dans la culture des Mbugwe en Tanzanie, la hyène tachetée est liée à la sorcellerie. Selon le folklore Mbugwe, chaque sorcière possède une ou plusieurs hyènes, que l'on appelle "bétail de nuit" et qui portent une marque invisible. On dit que toutes les hyènes appartiennent à des sorcières et que les hyènes purement sauvages n'existent pas. Les hyènes tachetées femelles en lactation seraient traites tous les soirs par leurs propriétaires pour faire du beurre d'hyène, et sont ensuite utilisées comme montures. Lorsqu'une sorcière fait l'acquisition d'une monture hyène, elle la monte sur des terres lointaines afin d'ensorceler les victimes et de rentrer chez elle en toute sécurité avant le matin. Les Mbugwe considèrent que tuer des hyènes est dangereux, car le lien entre la hyène et son propriétaire est très fort, et la sorcière va probablement chercher à se venger. Afin d'éviter ce danger, une hyène tuée a généralement les oreilles, la queue et les pattes avant coupées et enterrées, car ce sont les parties qui sont censées être marquées par la marque des sorcières[159]. Dans la région de Mtwara en Tanzanie, on croit qu'un enfant né la nuit pendant qu'une hyène pleure deviendra probablement un voleur. Dans cette même région, on pense que les fèces d'hyène permettent à un enfant de marcher à un âge précoce, il n'est donc pas rare de voir des enfants avec du fumier d'hyène enveloppé dans leurs vêtements[9].
Les Kaguru de Tanzanie et les Kujamaat du sud du Sénégal considèrent les hyènes comme des hermaphrodites avides. Une tribu africaine mythique, les Bouda, est réputée pour abriter des membres capables de se transformer en hyènes[160]. Un mythe similaire existe à Mansôa, en Guinée-Bissau et sont exécutés si découverts. Le folklore lie la hyène tachetée à l'origine de la mort; dans une histoire, la hyène empêche l'humanité d'atteindre l'immortalité, lui permettant ainsi de continuer à manger les cadavres. Une histoire similaire est présente chez les Meru. Dans leur récit, le dieu suprême Murungu a envoyé une taupe pour informer l'humanité qu'ils renaîtraient après leur mort. Craignant que cela ne la prive de cadavres à manger, la hyène empêche la taupe de transmettre le message. Selon la doctrine de l'Église orthodoxe éthiopienne Tewahedo, les hyènes sont des animaux impurs qui représentent la déviance sexuelle et l'anarchie[161]. L'abbé égyptien Matewos d'Asfoni était associé aux hyènes; une fable raconte comment il a sauvé un petit coincé dans une fosse, et a eu les pieds léchés en reconnaissance par sa mère. Dans le folklore éthiopien, une hyène albinos appelée le "Roi des hyènes" se voit attribuer un grand pouvoir. Certains groupes ethniques en Éthiopie s'associent aux hyènes : les Gurage croient traditionnellement que leurs ancêtres ont migré d'Arabie en Éthiopie en utilisant les hyènes comme monture. Dans la tradition de Dorze, les plus hauts prêtres de Demuṣa ont la capacité de contrôler les hyènes, et les enverront pour punir les pécheurs[162].
Les hyènes tachetées occupent une place importante dans les rituels de certaines cultures africaines. Dans le culte Gelede du peuple Yoruba du Bénin et du sud-ouest du Nigeria, un masque de hyène tacheté est utilisé à l'aube pour marquer la fin de la cérémonie de l'èfè. Comme la hyène tachetée termine habituellement les repas des autres carnivores, l'animal est associé à la conclusion de toutes choses. Dans le culte Korè du peuple Bambara au Mali, la croyance que les hyènes tachetées sont hermaphrodites apparaît comme un intermédiaire idéal dans le domaine rituel. Le rôle du masque hyène tacheté dans leurs rituels est souvent de transformer le néophyte en un être moral complet en intégrant ses principes masculins à la féminité. Le peuple Beng croit qu'en trouvant une hyène fraîchement tuée avec l'anus inversé, il faut la rebrancher, de peur d'être frappé par un rire perpétuel. Ils considèrent également que les fèces d'hyène tachetées sont contaminantes et évacueront un village si une hyène se soulage à l'intérieur des limites du village[158]. À Harar, en Éthiopie, les hyènes tachetées sont régulièrement nourries par les habitants de la ville, qui croient que la présence des hyènes tient les démons à distance et leur associent des propriétés mystiques telles que la bonne nouvelle[163].
Dans la culture occidentale
Les croyances occidentales traditionnelles sur la hyène tachetée remontent à l'Historia animalium d'Aristote, qui décrit l'espèce comme un animal nécrophage, lâche et potentiellement dangereux. Il explique en détail comment la hyène utilise les bruits d'égratignures pour attirer les chiens. Dans Génération des animaux, Aristote critique la croyance erronée que la hyène tachetée est un hermaphrodite (qui provient probablement de la confusion causée par les organes génitaux masculinisés de la femelle), bien que ses descriptions physiques soient plus compatibles avec la hyène rayée. Pline l'Ancien, naturaliste romain du Ier siècle, auteur de l'encyclopédie intitulée Histoire naturelle, soutient la représentation d'Aristote, bien qu'il ait précisé que la hyène peut imiter les voix humaines. Il ajoute que la hyène était tenue en haute estime parmi les mages, et que les parties du corps de cet animal pouvaient guérir différentes maladies, donner une protection et stimuler le désir sexuel[160].
L'auteur du Physiologos, qui a imprégné les contes païens de l'esprit de l'enseignement moral et mystique chrétien, a réactivé le mythe que la hyène est un hermaphrodite. L'auteur a comparé l'espèce à des « hommes à l'esprit double » qui ne sont « ni homme ni femme, c'est-à-dire ni fidèles ni infidèles ». Il ajoute : « Les fils d'Israël sont comme cet animal puisqu'au commencement ils servaient le Dieu vivant, mais plus tard, livrés au plaisir et à la luxure, ils adoraient les idoles ». Les bestiaires du Moyen Âge ont embrassé les descriptions du Physiologus, mais ont approfondi les habitudes nécrophages de l'animal. Ces bestiaires représentent presque invariablement des hyènes se nourrissant de cadavres humains. Ces illustrations étaient en grande partie fondées sur les descriptions données par Aristote et Pline, bien que les animaux n'aient pas de taches ou d'autres marques corporelles, ce qui rend peu probable que les auteurs aient jamais vu des hyènes de leurs propres yeux[160].
Au cours des XVe et XVIe siècles, les voyageurs en Afrique ont fourni d'autres descriptions de l'espèce. Léon l'Africain, diplomate et explorateur d'Afrique du Nord, a repris certains des vieux concepts sur la hyène, mais a ajouté la description de ses jambes et ses pieds comme semblables à ceux des hommes. En 1551, le naturaliste suisse Conrad Gesner a rejeté la croyance de l'hermaphrodisme de la hyène et a émis l'hypothèse qu'il provenait de la confusion autour d'un poisson androgyne portant le même nom. Il ajoute trois autres animaux dans la catégorie des hyènes, dont un quadrupède éthiopien nommé « Crocotta », qui était considéré comme un hybride entre une hyène et une lionne. Sir Thomas Browne, écrivain anglican anglais, s'est également opposé à l'hermaphrodisme supposé de la hyène, déclarant que tous les animaux suivent leur propre « Loi de Coïtion », et qu'un hermaphrodite transgresserait cela. Sir Walter Raleigh, écrivain et explorateur anglais, dans une tentative de rationaliser comment l'arche de Noé aurait pu s'adapter à toutes les espèces animales existantes, a écrit que les hyènes étaient des hybrides entre renards et loups qui ont vu le jour après le grand déluge. Les références aux vocalisations de la hyène tachetée sont mentionnées dans de nombreux exemples contemporains de la littérature anglaise, dont Comme il vous plaira de Shakespeare et Eastward Ho de George Chapman. John Milton, dans son Samson Agonistes, compare l'espèce à Delila[160].
Les historiens naturalistes des XVIIIe et XIXe siècles ont rejeté les histoires d'hermaphrodisme chez les hyènes et reconnu les différences entre les hyènes tachetées et les hyènes rayées. Cependant, ils ont continué à se concentrer sur les habitudes de charognardes de l'espèce, leur potentiel à voler des tombes et leur lâcheté. Au cours du XXe siècle, les stéréotypes occidentaux et africains sur la hyène tachetée ont convergé ; dans Les Vertes Collines d'Afrique d'Ernest Hemingway et Le Roi Lion de Disney, les traits de cupidité et de stupidité comique, courants dans les représentations africaines des hyènes, s'ajoutent à la perception occidentale des hyènes lâches et laides. Après la sortie du Roi Lion, les biologistes spécialistes des hyènes ont protesté contre la représentation de l'animal : un chercheur a même poursuivi les studios Disney pour diffamation[164] et un autre a suggéré le boycott du film[165].
Relation avec les éleveurs
Lorsqu'elle cible le bétail, la hyène tachetée s'attaque principalement aux bovins, aux moutons et aux chèvres[9], bien que les hyènes en Éthiopie ciblent de préférence les ânes[166]. Les rapports sur les dommages au bétail sont souvent non fondés et les hyènes observées en train de manger une carcasse peuvent aussi avoir tué l'animal. Le rythme auquel l'espèce cible le bétail peut dépendre d'un certain nombre de facteurs, notamment les pratiques d'élevage, la disponibilité de proies sauvages et les sources de matière organique associées à l'homme, comme les déchets. Des abattages excédentaires ont été enregistrés dans la province du Cap oriental d'Afrique du Sud. Les attaques contre les stocks tendent à être moins nombreuses dans les zones où le bétail est regroupé dans des clôtures entourées d'épines et où les chiens domestiques sont présents. Une étude réalisée dans le nord du Kenya a révélé que 90 % de tous les cas de prédation du bétail par les hyènes se sont produits dans des zones situées en dehors de la protection des clôtures d'épines[9].
Attaques sur les hommes
Comme la plupart des mammifères prédateurs, la hyène tachetée est plutôt timide en présence de l'homme et reste généralement à distance (jusqu'à 300 mètres). Cependant, cette distance est réduite pendant la nuit, quand on sait que les hyènes suivent les gens de près[3]. Bien que les hyènes tachetées s'attaquaient aux humains dans les temps modernes, de tels incidents sont rares aujourd'hui[167]. Les hyènes tachetées mangeuses d'hommes sont généralement de très gros spécimens ; deux hyènes mangeuses d'hommes, responsables de la mort de 27 personnes à Mlanje, au Malawi, en 1962, pesaient 72 et 77 kg après avoir été abattues. Les victimes des hyènes tachetées sont généralement des femmes, des enfants et des hommes malades ou infirmes[168]. Les attaques surviennent le plus souvent en septembre, lorsque de nombreuses personnes dorment dehors, et les feux de brousse rendent la chasse au gibier sauvage difficile pour les hyènes[167].
En 1903, Hector Duff a décrit des hyènes dans le district de Mzimba en Angonia (Mozambique) attendant à l'aube devant les huttes des gens et les attaquant quand ils ouvraient leurs portes[169]. En 1908-1909 en Ouganda, les hyènes tachetées tuaient régulièrement les gens atteints de la maladie du sommeil pendant qu'ils dormaient dehors dans les camps[168]. Les hyènes tachetées ont une mauvaise réputation au Malawi où elles ont été connues pour attaquer parfois la nuit, particulièrement pendant la période chaude, quand les gens dorment dehors. Des attaques de hyènes ont été largement signalées dans la plaine de Phalombe au Malawi, au nord du mont Michesi. Cinq décès ont été enregistrés en 1956, cinq en 1957 et six en 1958. Un reportage anecdotique du WWF de 2004 indique que 35 personnes ont été tuées par des hyènes tachetées pendant une période de 12 mois au Mozambique, sur une route de 20 km près de la frontière tanzanienne[167].
Bien que les attaques contre les humains vivants soient rares, la hyène tachetée se nourrit facilement des cadavres humains. Dans la tradition des Massaï[9] et des Hadza[170], les cadavres sont laissés en plein air pour que les hyènes tachetées puissent manger. Un cadavre rejeté par les hyènes est considéré comme ayant quelque chose de mal en lui, et susceptible de causer la honte sociale, donc il n'est pas rare que les corps soient couverts de graisse et de sang d'un bœuf abattu[9]. Les hyènes habituées à fouiller les cadavres humains peuvent développer des comportements audacieux envers les êtres vivants ; les attaques de hyènes contre les habitants du Sud-Soudan ont augmenté pendant la deuxième guerre civile soudanaise, lorsque les cadavres humains étaient à leur portée[171].
En zone urbaine
Dans certaines régions d'Afrique, les hyènes tachetées ont commencé à fréquenter les zones métropolitaines, où les groupes sont devenus une menace. On estime que la capitale éthiopienne Addis-Abeba compte jusqu'à un millier d'hyènes résidentes qui survivent en fouillant les décharges et en s'attaquant aux chiens et chats sauvages. Il y a également eu des attaques contre des humains sans abri. En 2013, un petit garçon a été tué par des hyènes après avoir été enlevé à sa mère alors qu'elle campait près de l'hôtel Hilton. Une quarantaine d'animaux auraient été aperçus le long d'une clôture bordant le complexe de l'ambassade britannique. En , un abattage sélectif a été organisé et les tireurs d'élite ont tué dix hyènes qui avaient occupé des terrains vagues près du centre-ville[172].
Chasse et utilisation dans la médecine traditionnelle
La hyène tachetée a été chassée pour ses parties du corps à des fins de médecine traditionnelle[9], d'amusement[160] et de sport, bien que cela soit rare, car l'espèce n'est généralement pas considérée comme attrayante[166]. Il existe des preuves fossiles que les humains du Pléistocène moyen en Europe massacraient et consommaient vraisemblablement les hyènes tachetées[173]. De tels cas sont rares en Afrique moderne, où la plupart des tribus, même celles connues pour manger des viandes inhabituelles, méprisent généralement la chair d'hyène[3].
Plusieurs auteurs lors du Partage de l'Afrique ont attesté que, malgré sa force physique, la hyène tachetée ne présente aucun danger pour les chasseurs lorsqu'elle est capturée ou prise au piège. Souvent, les dépouilleurs autochtones refusaient même de toucher les carcasses d'hyènes, bien que ce ne soit généralement pas un problème, car les peaux d'hyènes n'étaient pas considérées comme attrayantes[168] - [174].
Au Burkina Faso, la queue de la hyène est utilisée à des fins médicinales et magiques. Au Cameroun, en Côte d'Ivoire et au Sénégal, le corps entier des animaux est récolté pour la viande de brousse et les médicaments. Au Malawi et en Tanzanie, les organes génitaux, le bout du nez et la queue sont utilisés en médecine traditionnelle. Au Mozambique, les guérisseurs traditionnels utilisent diverses parties du corps des hyènes tachetées, en particulier les pattes. Les chasseurs oromos subissent généralement une purification rituelle après avoir tué des hyènes[175]. Les chasseurs Kujamaat traitent traditionnellement les hyènes tachetées qu'ils tuent avec le même respect en raison du décès des anciens de la tribu, afin d'éviter les représailles des esprits hyènes agissant au nom de l'animal mort[158].
Pendant les premières années de la colonisation hollandaise en Afrique australe, les hyènes (appelées « loups » par les colons) étaient particulièrement sensibles aux pièges mis en place par l'homme, car leur prédilection pour la charogne et leur manque de prudence vis-à-vis des espaces clos étaient à leur désavantage. Le wolwehok (piège à hyène), construit grossièrement en pierre ou en bois et appâté avec de la viande, était l'une des caractéristiques de nombreuses fermes frontalières. Le piège était muni d'une trappe qui était conçue pour se refermer lorsque l'appât était perturbé. Dans la colonie du Cap, les hyènes tachetées étaient souvent pourchassées en les traquant jusqu'à leur tanière et en leur tirant dessus lorsqu'elles s'échappaient[176]. Une autre méthode de chasse consistait à les piéger dans leur tanière et à les éblouir à la torche, avant de les poignarder au cœur avec un long couteau.
Lorsqu'elles sont pourchassées par des chiens de chasse, les hyènes tachetées attaquent souvent en retour, à moins que les chiens ne soient de races exceptionnellement grandes et puissantes. James Stevenson-Hamilton a écrit que les hyènes tachetées blessées pouvaient être de dangereux adversaires pour les chiens de chasse, enregistrant un incident dans lequel une hyène a réussi à tuer un chien avec une seule morsure au cou sans lui abîmer la peau. Une autre difficulté à tuer les hyènes tachetées en utilisant des chiens est notamment la peau épaisse de l'espèce, qui empêche les chiens d'infliger de graves dommages aux muscles de l'animal[177].
En captivité
Du point de vue de l'élevage, les hyènes sont faciles à élever, car elles ont peu de problèmes de santé et il n'est pas rare que les hyènes en captivité atteignent 15-20 ans. Néanmoins, la hyène tachetée était historiquement peu représentée dans les zoos et était généralement gardée pour remplir des cages vides jusqu'à ce qu'une espèce plus prestigieuse puisse être obtenue. Dans les années suivantes, les animaux considérés comme plus charismatiques se sont vu attribuer des installations plus grandes et de meilleure qualité, tandis que les hyènes étaient souvent reléguées à des expositions de qualité inférieure.
Dans les temps modernes, l'espèce est confrontée à la concurrence spatiale d'animaux plus populaires, en particulier les grands canidés. De plus, de nombreux individus captifs n'ont pas été examinés de près pour confirmer leur sexe, ce qui fait que les couples non reproducteurs sont souvent des individus du même sexe. En conséquence, de nombreuses populations d'hyènes en captivité sont menacées d'extinction[9].
Au cours du XIXe siècle, l'espèce était fréquemment exposée dans les cirques ambulants comme curiosité. Alfred Edmund Brehm, un ornithologue allemand, a écrit que la hyène tachetée est plus difficile à apprivoiser que la hyène rayée, et que la performance des spécimens dans les cirques n'était pas conforme aux normes. Sir John Barrow, un explorateur et administrateur britannique, décrit comment les hyènes tachetées du Sneeuberg étaient entraînées à chasser le gibier, écrivant qu'elles étaient « aussi fidèles et diligentes que les chiens domestiques ordinaires[178]. »
En Tanzanie, les petits peuvent être capturés directement dans leur tanière par le sorcier du village afin d'améliorer leur statut social[9]. Un article de la BBC d' décrit comment un berger vivant dans la petite ville de Qabri Bayah, à environ 50 kilomètres de Jigjiga, en Éthiopie, a réussi à utiliser une hyène tachetée mâle comme chien de garde du bétail, supprimant son désir de partir et de trouver une partenaire en lui donnant des herbes spéciales. Si elles ne sont pas élevées avec des membres adultes de leur espèce, les hyènes tachetées en captivité auront des comportements de marquage olfactif beaucoup plus tard dans la vie que les spécimens sauvages[3].
Bien que facilement domptables, les hyènes tachetées sont extrêmement difficiles à garder en captivité et peuvent être très destructrices ; un spécimen captif, autrement parfaitement apprivoisé, a réussi à déchirer sans effort apparent une planche de 2,5 m de long clouée sur le plancher de son enclos récemment réparé[179]. Au cours des recherches qui ont mené à la composition de sa monographie La hyène tachetée : une étude de la prédation et du comportement social, Hans Kruuk gardait une hyène apprivoisée qu'il appelait Salomon. Kruuk trouvait la compagnie de Salomon si agréable qu'il l'aurait gardée, mais Salomon avait un goût insatiable pour « le fromage au bar du salon touristique et le bacon de la table du gardien en chef du parc », et aucune porte ne pouvait le retenir, alors Salomon a dû vivre ses jours au zoo d'Édimbourg[3].
Galerie
 Hyène tachetée dans la réserve nationale d'Abuk en Gambie.
Hyène tachetée dans la réserve nationale d'Abuk en Gambie. Hyène dans la Réserve nationale du Masai Mara.
Hyène dans la Réserve nationale du Masai Mara. Hyène vue sur le Cratère du Ngorongoro.
Hyène vue sur le Cratère du Ngorongoro. Hyène vue sur le Cratère du Ngorongoro.
Hyène vue sur le Cratère du Ngorongoro._cub_(13780114724).jpg.webp) Jeune hyène (Parc national Kruger, Afrique du Sud).
Jeune hyène (Parc national Kruger, Afrique du Sud)..jpg.webp) Hyène tachetée dans le parc national d'Etosha (Namibie).
Hyène tachetée dans le parc national d'Etosha (Namibie).
Philatélie
Timbre du Burundi de 1971, valeur faciale 5 F, Y&T no 448
Notes et références
- (en) Kay E. Holekamp, Jennifer E. Smith, Christopher C. Strelioff et Russell C. Van Horn, « Society, demography and genetic structure in the spotted hyena: HYENA SOCIETY, DEMOGRAPHY AND GENETICS », Molecular Ecology, vol. 21, no 3, , p. 613–632 (DOI 10.1111/j.1365-294X.2011.05240.x, lire en ligne, consulté le )
- (en) Barbara L. Lundrigan, Sharleen T. Sakai et Kay E. Holekamp, « The Spotted Hyena (Crocuta crocuta) as a Model System for Study of the Evolution of Intelligence », Journal of Mammalogy, vol. 88, no 3, , p. 545–554 (ISSN 0022-2372, DOI 10.1644/06-MAMM-S-361R1.1, lire en ligne, consulté le )
- Hans Kruuk, The spotted hyena: a study of predation and social behavior., University of Chicago Press, 1974, ©1972 (ISBN 0-226-45507-6, 9780226455075 et 0226455084, OCLC 237876936, présentation en ligne)
- Kingdon, Jonathan., East African Mammals : an Atlas of Evolution in Africa v.3A Carnivores (ISBN 978-0-226-43721-7 et 0-226-43721-3, OCLC 50828287, lire en ligne)
- (en) Spassov, N et Stoytchev, T., « The presence of cave hyaena (Crocuta crocuta spelaea) in the Upper Palaeolithic rock art of Europe », Historia Naturalis Bulgarica, , p. 159–166
- Stephen Glickman, « The Spotted Hyena From Aristotle to the Lion King: Reputation is Everything », Social Research, vol. 62, (lire en ligne, consulté le )
- (en) Funk, Holger, Hyaena : On the Naming and Localisation of an Enigmatic Animal, , p. 52–54
- (en) Funk, Holger., Hyaena : on the naming and localisation of an enigmatic animal, Grin-Verl, , 160 p. (ISBN 978-3-640-69784-7 et 3640697847, OCLC 705887919, lire en ligne)
- (en) Mills, M. G. L. et IUCN/SSC Hyaena Specialist Group., Hyaenas : status survey and conservation action plan, Gland (Switzerland), IUCN, , 154 p. (ISBN 2-8317-0442-1, 9782831704425 et 0966187911, OCLC 40467458, lire en ligne).
- Nadin Rohland, Joshua L. Pollack, Doris Nagel et Cédric Beauval, « The population history of extant and extinct hyenas », Molecular Biology and Evolution, vol. 22, no 12, , p. 2435–2443 (ISSN 0737-4038, PMID 16120805, DOI 10.1093/molbev/msi244, lire en ligne, consulté le ).
- Sara Varela, Jorge M. Lobo, Jesús Rodríguez et Persaram Batra, « Were the Late Pleistocene climatic changes responsible for the disappearance of the European spotted hyena populations? Hindcasting a species geographic distribution across time », Quaternary Science Reviews, vol. 29, no 17, , p. 2027–2035 (ISSN 0277-3791, DOI 10.1016/j.quascirev.2010.04.017, lire en ligne, consulté le ).
- (en) Summerill, « Gnawed Bones Tell Tales », ASU, .
- (en) T. Madeyska, « Palaeogeography of European Lowland during the Late Vistulian », Folia Quaternaria, vol. nr 70, , p. 7–30 (ISSN 0015-573X, lire en ligne, consulté le ).
- (en) « Quaternary mammalian extinctions in Northern Eurasia. », sur ResearchGate (consulté le ).
- Mary C. Stiner, « Comparative ecology and taphonomy of spotted hyenas, humans, and wolves in Pleistocene Italy », Revue de Paleobiologie, vol. 23, no 2, , p. 771–785 (ISSN 0253-6730, lire en ligne, consulté le ).
- (en) Anthony J. Stuart, « Mammalian Extinctions in the Late Pleistocene of Northern Eurasia and North America », Biological Reviews, vol. 66, no 4, , p. 453–562 (ISSN 1469-185X, DOI 10.1111/j.1469-185X.1991.tb01149.x, lire en ligne, consulté le ).
- (en) A. Turner, « The interpretation of variation in fossil specimens of spotted hyena crocuta crocuta from sterkfontein valley south africa sites mammalia carnivora », sur Annals of the Transvaal Museum, (consulté le ).
- Werdelin, Lars., The Hyaenidae : taxonomy, systematics and evolution, Universitetsforlaget, (ISBN 82-00-37481-5 et 9788200374817, OCLC 24340587, lire en ligne).
- Matthews Leonard Harrison et Parkes Alan Sterling, « Reproduction in the spotted hyaena, Crocuta crocuta (erxleben) », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 230, no 565, , p. 1–78 (DOI 10.1098/rstb.1939.0004, lire en ligne, consulté le ).
- (en) L. Harrison Matthews, « THE SUBSPECIES AND VARIATION OF THE SPOTTED HYÆNA: 14. The Subspecies and Variation of the Spotted Hysena, Crocuta crocuta Erxl », Proceedings of the Zoological Society of London, vol. B109, no 2, , p. 237–260 (ISSN 1469-7998, DOI 10.1111/j.1096-3642.1939.tb00715.x, lire en ligne, consulté le ).
- (en) Kurtén, Björn., Pleistocene mammals of Europe, New Brunswick (N.J.), AldineTransaction, , 317 p. (ISBN 978-0-202-30953-8, 0202309533 et 9780202309460, OCLC 132681472, lire en ligne).
- Ficcarelli, G., Remarks on the taxonomy of hyaenids, Industrie Grafiche V. Lischi & Figli, (OCLC 416482992, lire en ligne).
- Nadin Rohland, Joshua L. Pollack, Doris Nagel et Cédric Beauval, « The Population History of Extant and Extinct Hyenas », Molecular Biology and Evolution, vol. 22, no 12, , p. 2435–2443 (ISSN 1537-1719 et 0737-4038, DOI 10.1093/molbev/msi244, lire en ligne, consulté le ).
- Macdonald, David W. (David Whyte), The Velvet Claw : A Natural History of the Carnivores (ISBN 978-0-563-20844-0 et 0-563-20844-9, OCLC 27129134, lire en ligne).
- (en) Kurtén, Björn., On evolution and fossil mammals, New York, Columbia University Press, , 301 p. (ISBN 0-231-05868-3 et 9780231058681, OCLC 15018659, lire en ligne).
- Rosevear, D. R., The carnivores of West Africa, British Museum (Natural History), (ISBN 0-565-00723-8 et 9780565007232, OCLC 3053334, lire en ligne)
- Martin Dockner, « Comparison of Crocuta crocuta crocuta and Crocuta crocuta spelaea through computer tomography »,
- JAIME B. TANNER, ELIZABETH R. DUMONT, SHARLEEN T. SAKAI et BARBARA L. LUNDRIGAN, « Of arcs and vaults: the biomechanics of bone-cracking in spotted hyenas (Crocuta crocuta) », Biological Journal of the Linnean Society, vol. 95, no 2, , p. 246–255 (ISSN 0024-4066 et 1095-8312, DOI 10.1111/j.1095-8312.2008.01052.x, lire en ligne, consulté le )
- Per Christiansen et Stephen Wroe, « BITE FORCES AND EVOLUTIONARY ADAPTATIONS TO FEEDING ECOLOGY IN CARNIVORES », Ecology, vol. 88, no 2, , p. 347–358 (ISSN 0012-9658, DOI 10.1890/0012-9658(2007)88[347:bfaeat]2.0.co;2, lire en ligne, consulté le )
- Wendy J. Binder et Blaire Van Valkenburgh, « Development of bite strength and feeding behaviour in juvenile spotted hyenas (Crocuta crocuta) », Journal of Zoology, vol. 252, no 3, , p. 273–283 (DOI 10.1017/S0952836900000017, lire en ligne, consulté le )
- (en) Kay E. Holekamp, Stephen E. Glickman, Mary L. Weldele et Ian Dworkin, « Ontogeny of sexual size dimorphism in the spotted hyena (Crocuta crocuta) », Journal of Mammalogy, vol. 94, no 6, , p. 1298–1310 (ISSN 0022-2372, DOI 10.1644/12-MAMM-A-277.1, lire en ligne, consulté le )
- (en) Colin Vullioud, Eve Davidian, Bettina Wachter et François Rousset, « Social support drives female dominance in the spotted hyaena | », Nature Ecology & Evolution, vol. 3, no 1, , p. 71–76 (ISSN 2397-334X, DOI 10.1038/s41559-018-0718-9, lire en ligne, consulté le )
- (en) Vivian J. Wilson, Weights of Some Mammals from Eastern Zambia, National Museums of Southern Rhodesia, (lire en ligne)
- (en) CARLO MELORO, « Plio-Pleistocene large carnivores from the Italian peninsula: functional morphology and macroecology », Thesis, (lire en ligne)
- (en) George H. Pournelle, « Observations on Birth and Early Development of the Spotted Hyena », Journal of Mammalogy, vol. 46, no 3, , p. 503–503 (ISSN 0022-2372, DOI 10.2307/1377649, lire en ligne, consulté le )
- (en) William J. Hamilton Iii, Ronald L. Tilson et Lawrence G. Frank, « Sexual Monomorphism in Spotted Hyenas, Crocuta crocuta », Ethology, vol. 71, no 1, , p. 63–73 (ISSN 1439-0310, DOI 10.1111/j.1439-0310.1986.tb00570.x, lire en ligne, consulté le ).
- Marine Corniou, « Pourquoi la femelle hyène tachetée a-t-elle un pénis ? », Science & vie, (lire en ligne, consulté le )
- Micaela Szykman, Russell Van Horn, Anne Engh et Erin Boydston, « Courtship and mating in free-living spotted hyenas », Behaviour, vol. 144, no 7, , p. 815–846 (ISSN 0005-7959 et 1568-539X, DOI 10.1163/156853907781476418, lire en ligne, consulté le ).
- (en) M. L. East, T. Burke, K. Wilhelm et C. Greig, « Sexual conflicts in spotted hyenas: male and female mating tactics and their reproductive outcome with respect to age, social status and tenure », Proceedings of the Royal Society of London. Series B: Biological Sciences, vol. 270, no 1521, , p. 1247–1254 (ISSN 1471-2954, PMID 12816637, PMCID PMC1691369, DOI 10.1098/rspb.2003.2363, lire en ligne, consulté le )
- (en) Gerald R. Cunha, Yuzhuo Wang, Ned J. Place et Wenhui Liu, « Urogenital system of the spotted hyena (Crocuta crocuta Erxleben): A functional histological study », Journal of Morphology, vol. 256, no 2, , p. 205–218 (ISSN 0362-2525 et 1097-4687, DOI 10.1002/jmor.10085, lire en ligne, consulté le ).
- Stephen E. Glickman, Gerald R. Cunha, Christine M. Drea et Alan J. Conley, « Mammalian sexual differentiation: lessons from the spotted hyena », Trends in Endocrinology & Metabolism, vol. 17, no 9, , p. 349–356 (ISSN 1043-2760, DOI 10.1016/j.tem.2006.09.005, lire en ligne, consulté le ).
- (en) Richard Estes, The behavior guide to African mammals: including hoofed mammals, carnivores, primates, University of California Press, (ISBN 0-520-05831-3, 9780520058316 et 0520080858, OCLC 19554262, lire en ligne).
- Gittleman, John L., Carnivore Behavior, Ecology, and Evolution, Springer US, (ISBN 978-1-4757-4716-4 et 1475747160, OCLC 851800612, lire en ligne)
- Kay E Holekamp, Sharleen T Sakai et Barbara L Lundrigan, « Social intelligence in the spotted hyena (Crocuta crocuta) », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 362, no 1480, , p. 523–538 (ISSN 0962-8436, PMID 17289649, PMCID PMCPMC2346515, DOI 10.1098/rstb.2006.1993, lire en ligne, consulté le )
- (en) K. E. Holekamp, S. M. Cooper, C. I. Katona et N. A. Berry, « Patterns of Association among Female Spotted Hyenas (Crocuta crocuta) », Journal of Mammalogy, vol. 78, no 1, , p. 55–64 (ISSN 1545-1542 et 0022-2372, DOI 10.2307/1382638, lire en ligne, consulté le )
- (en) Heribert Hofer et Marion L. East, « The commuting system of Serengeti spotted hyaenas: how a predator copes with migratory prey. I. Social organization », Animal Behaviour, vol. 46, no 3, , p. 547–557 (DOI 10.1006/anbe.1993.1222, lire en ligne, consulté le )
- (en) T. K. Fuller, « Mills, M. G. L. 1990. KALAHARI HYAENAS: COMPARATIVE BEHAVIOURAL ECOLOGY OF TWO SPECIES, Unwin Hyman, London, xvi + 304 pp. (ISBN 0-04-445328-0). Price (hardbound), $75.00 », Journal of Mammalogy, vol. 74, no 1, , p. 240–241 (ISSN 1545-1542 et 0022-2372, DOI 10.2307/1381929, lire en ligne, consulté le )
- (en) Laurence G. Frank, « Social organization of the spotted hyaena Crocuta crocuta. II. Dominance and reproduction », Animal Behaviour, vol. 34, no 5, , p. 1510–1527 (DOI 10.1016/S0003-3472(86)80221-4, lire en ligne, consulté le )
- Russell C. Van Horn, Sofia A. Wahaj et Kay E. Holekamp, « Role-Reversed Nepotism Among Cubs and Sires in the Spotted Hyena (Crocuta crocuta) », Ethology, vol. 110, no 5, , p. 413–426 (ISSN 0179-1613 et 1439-0310, DOI 10.1111/j.1439-0310.2004.00984.x, lire en ligne, consulté le )
- (en) Marion L. East, Oliver P. Höner, Bettina Wachter et Kerstin Wilhelm, « Maternal effects on offspring social status in spotted hyenas », Behavioral Ecology, vol. 20, no 3, , p. 478–483 (ISSN 1465-7279 et 1045-2249, DOI 10.1093/beheco/arp020, lire en ligne, consulté le )
- Erin E. Boydston, Karen M. Kapheim, Russell C. Van Horn et Laura Smale, « Sexually dimorphic patterns of space use throughout ontogeny in the spotted hyena ( Crocuta crocuta ) », Journal of Zoology, vol. 267, no 03, , p. 271 (ISSN 0952-8369 et 1469-7998, DOI 10.1017/s0952836905007478, lire en ligne, consulté le )
- (en) O. P. Höner, B. Wachter, M. L. East et W. J. Streich, « Female mate-choice drives the evolution of male-biased dispersal in a social mammal », Nature, vol. 448, no 7155, , p. 798–801 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature06040, lire en ligne, consulté le )
- (en) Eve Davidian, Alexandre Courtiol, Bettina Wachter et Heribert Hofer, « Why do some males choose to breed at home when most other males disperse? », Science Advances, vol. 2, no 3, , e1501236 (ISSN 2375-2548, PMID 27034982, PMCID PMC4803491, DOI 10.1126/sciadv.1501236, lire en ligne, consulté le )
- Laura Smale, Scott Nunes et Kay E. Holekamp, « Sexually Dimorphic Dispersal in Mammals: Patterns, Causes, and Consequences », dans Advances in the Study of Behavior, Elsevier, (ISBN 9780120045266, lire en ligne), p. 181–250
- (en) Sofia A. Wahaj, Russell C. Van Horn, Toni L. Van Horn et Rachel Dreyer, « Kin discrimination in the spotted hyena (Crocuta crocuta): nepotism among siblings », Behavioral Ecology and Sociobiology, vol. 56, no 3, (ISSN 0340-5443 et 1432-0762, DOI 10.1007/s00265-004-0783-8, lire en ligne, consulté le )
- (en) Oliver P. Höner, Bettina Wachter, Heribert Hofer et Kerstin Wilhelm, « The fitness of dispersing spotted hyaena sons is influenced by maternal social status », Nature Communications, vol. 1, no 1, (ISSN 2041-1723, DOI 10.1038/ncomms1059, lire en ligne, consulté le )
- (en) Oliver P. Höner, Bettina Wachter, Heribert Hofer et Kerstin Wilhelm, « The fitness of dispersing spotted hyaena sons is influenced by maternal social status », Nature Communications, vol. 1, no 1, (ISSN 2041-1723, PMID 20975715, PMCID PMC2964455, DOI 10.1038/ncomms1059, lire en ligne, consulté le )
- Christine M. Drea et Laurence G. Frank, « 5. The Social Complexity of Spotted Hyenas », dans Animal Social Complexity, Harvard University Press, (ISBN 9780674419131, DOI 10.4159/harvard.9780674419131.c10, lire en ligne)
- (en) Amiyaal Ilany, Andrew S. Booms et Kay E. Holekamp, « Topological effects of network structure on long-term social network dynamics in a wild mammal », Ecology Letters, vol. 18, no 7, , p. 687–695 (PMID 25975663, PMCID PMC4486283, DOI 10.1111/ele.12447, lire en ligne, consulté le )
- (en) N. Lewin, L. A. Treidel, K. E. Holekamp et N. J. Place, « Socioecological variables predict telomere length in wild spotted hyenas », Biology Letters, vol. 11, no 2, , p. 20140991–20140991 (ISSN 1744-9561 et 1744-957X, DOI 10.1098/rsbl.2014.0991, lire en ligne, consulté le )
- (en) Pat Monaghan et Mark F. Haussmann, « Do telomere dynamics link lifestyle and lifespan? », Trends in Ecology & Evolution, vol. 21, no 1, , p. 47–53 (DOI 10.1016/j.tree.2005.11.007, lire en ligne, consulté le )
- (en) Erin E. Boydston, Karen M. Kapheim, Micaela Szykman et Kay E. Holekamp, « INDIVIDUAL VARIATION IN SPACE USE BY FEMALE SPOTTED HYENAS », Journal of Mammalogy, vol. 84, no 3, , p. 1006–1018 (ISSN 0022-2372 et 1545-1542, DOI 10.1644/BOS-038, lire en ligne, consulté le )
- (en) « (PDF) Telomeres: Linking stress and survival, ecology and evolution », sur ResearchGate (consulté le )
- (en) Dominic D.P. Johnson, Roland Kays, Paul G. Blackwell et David W. Macdonald, « Does the resource dispersion hypothesis explain group living? », Trends in Ecology & Evolution, vol. 17, no 12, , p. 563–570 (DOI 10.1016/S0169-5347(02)02619-8, lire en ligne, consulté le )
- (en) Oliver P. Höner, Bettina Wachter, Marion L. East et Victor A. Runyoro, « The effect of prey abundance and foraging tactics on the population dynamics of a social, territorial carnivore, the spotted hyena », Oikos, vol. 108, no 3, , p. 544–554 (DOI 10.1111/j.0030-1299.2005.13533.x, lire en ligne, consulté le )
- (en) Marion L. East et Heribert Hofer, « Loud calling in a female-dominated mammalian society: I. Structure and composition of whooping bouts of spotted hyaenas, Crocuta crocuta », Animal Behaviour, vol. 42, no 4, , p. 637–649 (DOI 10.1016/S0003-3472(05)80246-5, lire en ligne, consulté le )
- (en) M. L. Gorman et M. G. L. Mills, « Scent marking strategies in hyaenas (Mammalia) », Journal of Zoology, vol. 202, no 4, , p. 535–547 (DOI 10.1111/j.1469-7998.1984.tb05050.x, lire en ligne, consulté le )
- (en) R. L. Tilson et J. R. Henschel, « Spatial arrangement of spotted hyaena groups in a desert environment, Namibia », African Journal of Ecology, vol. 24, no 3, , p. 173–180 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1986.tb00358.x, lire en ligne, consulté le )
- (en) L. Frank, S. Glickman et P Licht, « Fatal sibling aggression, precocial development, and androgens in neonatal spotted hyenas », Science, vol. 252, no 5006, , p. 702–704 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.2024122, lire en ligne, consulté le )
- (en) Heribert Hofer et Marion L. East, « Siblicide in Serengeti spotted hyenas: a long-term study of maternal input and cub survival », Behavioral Ecology and Sociobiology, vol. 62, no 3, , p. 341–351 (ISSN 0340-5443 et 1432-0762, DOI 10.1007/s00265-007-0421-3, lire en ligne, consulté le )
- (en) Heribert Hofer et Marion L. East, « Behavioral processes and costs of co-existence in female spotted hyenas: a life history perspective », Evolutionary Ecology, vol. 17, no 4, , p. 315–331 (ISSN 0269-7653 et 1573-8477, DOI 10.1023/A:1027352517231, lire en ligne, consulté le )
- (en) S. Benhaiem, H. Hofer, S. Kramer-Schadt et E. Brunner, « Sibling rivalry: training effects, emergence of dominance and incomplete control », Proceedings of the Royal Society B: Biological Sciences, vol. 279, no 1743, , p. 3727–3735 (ISSN 0962-8452 et 1471-2954, DOI 10.1098/rspb.2012.0925, lire en ligne, consulté le )
- Bettina Wachter, Oliver Höner, Marion East et Waltraud Golla, « Low aggression levels and unbiased sex ratios in a prey-rich environment: no evidence of siblicide in Ngorongoro spotted hyenas ( Crocuta crocuta ) », Behavioral Ecology and Sociobiology, vol. 52, no 4, , p. 348–356 (ISSN 0340-5443 et 1432-0762, DOI 10.1007/s00265-002-0522-y, lire en ligne, consulté le )
- (en) « Hyena Project », sur Hyena Project (consulté le )
- (en) Wolfgang Goymann, Marion L. East et Heribert Hofer, « Androgens and the Role of Female “Hyperaggressiveness” in Spotted Hyenas (Crocuta crocuta) », Hormones and Behavior, vol. 39, no 1, , p. 83–92 (DOI 10.1006/hbeh.2000.1634, lire en ligne, consulté le )
- Bjorn Carey | April 26 et 2006 09:00am ET, « The Painful Realities of Hyena Sex », sur Live Science (consulté le )
- S. E. Glickman, L. G. Frank, S. Pavgi et P. Licht, « Hormonal correlates of 'masculinization' in female spotted hyaenas (Crocuta crocuta). 1. Infancy to sexual maturity », Journal of Reproduction and Fertility, vol. 95, no 2, , p. 451–462 (ISSN 0022-4251, PMID 1518001, lire en ligne, consulté le )
- (en) S. S. Flower, « Contributions to our Knowledge of the Duration of Life in Vertebrate Animals.-II. Batrachians. », Proceedings of the Zoological Society of London, vol. 95, no 1, , p. 269–289 (DOI 10.1111/j.1096-3642.1925.tb03350.x, lire en ligne, consulté le )
- (en) « Longevity of mammals in captivity », sur ResearchGate (consulté le )
- (en) Erin E. Boydston, Karen M. Kapheim et Kay E. Holekamp, « Patterns of den occupation by the spotted hyaena (Crocuta crocuta): Den use by the spotted hyaena », African Journal of Ecology, vol. 44, no 1, , p. 77–86 (DOI 10.1111/j.1365-2028.2006.00618.x, lire en ligne, consulté le )
- (en) Paula A. White, « Costs and strategies of communal den use vary by rank for spotted hyaenas, Crocuta crocuta », Animal Behaviour, vol. 73, no 1, , p. 149–156 (DOI 10.1016/j.anbehav.2006.09.001, lire en ligne, consulté le )
- (en) Heribert Hofer et Marion L. East, « The commuting system of Serengeti spotted hyaenas: how a predator copes with migratory prey. II. Intrusion pressure and commuters' space use », Animal Behaviour, vol. 46, no 3, , p. 559–574 (DOI 10.1006/anbe.1993.1223, lire en ligne, consulté le )
- (en) « Territorial Behaviour by a Clan of Spotted Hyaenas Crocuta crocuta | Request PDF », sur ResearchGate (consulté le )
- Live Science Staff | September 28 et 2009 08:56am ET, « Hyenas Surprisingly Good at Cooperative Tasks », sur Live Science (consulté le )
- (en) Moodie, John Wedderburn Dunbar, Ten Years in South Africa, vol. Vol 1, Richard Bentley,
- (en) K. E. Holekamp, L. Smale, R. Berg et S. M. Cooper, « Hunting rates and hunting success in the spotted hyena ( Crocuta crocuta ) », Journal of Zoology, vol. 242, no 1, , p. 1–15 (DOI 10.1111/j.1469-7998.1997.tb02925.x, lire en ligne, consulté le )
- (en) G. C. Sanderson, « Mech, L. David. The Wolves of Isle Royale. Fauna of the National Parks of the United States, Fauna Series 7. U. S. Government Printing Office, Washington, D. C., xiii + 210 pp., illus., 1966. Price, $1.00 (paper) », Journal of Mammalogy, vol. 49, no 1, , p. 167–168 (ISSN 1545-1542 et 0022-2372, DOI 10.2307/1377761, lire en ligne, consulté le )
- Macedo, Regina H. (Regina Helena), 1958-, Behavioral Ecology of Tropical Animals, , 352 p. (ISBN 978-0-12-380895-0, 0123808952 et 9780123808943, OCLC 688998390, lire en ligne)
- C. Carbone, G. M. Mace, S. C. Roberts et D. W. Macdonald, « Energetic constraints on the diet of terrestrial carnivores », Nature, vol. 402, no 6759, , p. 286–288 (ISSN 0028-0836, PMID 10580498, DOI 10.1038/46266, lire en ligne, consulté le )
- (en) J. R. Henschel et R. L. Tilson, « How much does a spotted hyaena eat? Perspective from the Namib Desert », African Journal of Ecology, vol. 26, no 4, , p. 247–255 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1988.tb00977.x, lire en ligne, consulté le )
- S.M. Hirst, « Populations in a Transvaal Lowveld Nature Reserve », Zoologica Africana, vol. 4, no 2, , p. 199–230 (ISSN 0044-5096, DOI 10.1080/00445096.1969.11447372, lire en ligne, consulté le )
- (en) S. M. Cooper, « The hunting behaviour of spotted hyaenas (Crocuta crocuta) in a region containing both sedentary and migratory populations of herbivores », African Journal of Ecology, vol. 28, no 2, , p. 131–141 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1990.tb01145.x, lire en ligne, consulté le )
- (en) Ilaria Silvestre, Ottavio Novelli et Giuseppe Bogliani, « Feeding habits of the spotted hyaena in the Niokolo Koba National Park, Senegal », African Journal of Ecology, vol. 38, no 2, , p. 102–107 (ISSN 0141-6707 et 1365-2028, DOI 10.1046/j.1365-2028.2000.00220.x, lire en ligne, consulté le )
- U. De V. Pienaar, « Predator-prey relationships amongst the larger mammals of the Kruger National Park », Koedoe, vol. 12, no 1, (ISSN 2071-0771 et 0075-6458, DOI 10.4102/koedoe.v12i1.753, lire en ligne, consulté le )
- (en) J. Berger et C. Cunningham, « Active Intervention and Conservation: Africa's Pachyderm Problem », Science, vol. 263, no 5151, , p. 1241–1242 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.263.5151.1241, lire en ligne, consulté le )
- (en) ANTHONY CULLEN, WINDOW ONTO WILDERNESS, East African Publishing House, (ASIN B00GYA3H32, lire en ligne)
- (en) Rennie Montague Bere, The African Elephant, A. Barker, , 96 p.
- (en) J. R. Henschel et J. D. Skinner, « The diet of the spotted hyaenas Crocuta crocuta in Kruger National Park », African Journal of Ecology, vol. 28, no 1, , p. 69–82 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1990.tb01138.x, lire en ligne, consulté le )
- C.G. Diedrich et K. Žák, « Prey deposits and den sites of the Upper Pleistocene hyena Crocuta crocuta spelaea (Goldfuss, 1823) in horizontal and vertical caves of the Bohemian Karst (Czech Republic) », Bulletin of Geosciences, , p. 237–276 (ISSN 1802-8225 et 1214-1119, DOI 10.3140/bull.geosci.2006.04.237, lire en ligne, consulté le )
- (en) Oliver P. Honer, Bettina Wachter, Marion L. East et Heribert Hofer, « The response of spotted hyaenas to long-term changes in prey populations: functional response and interspecific kleptoparasitism », Journal of Animal Ecology, vol. 71, no 2, , p. 236–246 (ISSN 0021-8790 et 1365-2656, DOI 10.1046/j.1365-2656.2002.00596.x, lire en ligne, consulté le )
- (en) Simon K. Bearder, « Feeding habits of spotted hyaenas in a woodland habitat », African Journal of Ecology, vol. 15, no 4, , p. 263–280 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1977.tb00408.x, lire en ligne, consulté le )
- (en) J. D. & Van Aarde Skinner, « The distribution and ecology of the brown hyaena Hyaena brunnea and spotted hyaena Crocuta in the central Namib Desert », sur www.ingentaconnect.com, (consulté le )
- (en) Dada Gottelli et Claudio Sillero-Zubiri, « Feeding ecology of spotted hyaena (Mammalia: Crocuta crocuta) in a mountain forest habitat », sur www.semanticscholar.org, (consulté le )
- (en) Martina Trinkel et Gerald Kastberger, « Competitive interactions between spotted hyenas and lions in the Etosha National Park, Namibia », African Journal of Ecology, vol. 43, no 3, , p. 220–224 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.2005.00574.x, lire en ligne, consulté le )
- (en) M. W. Hayward, « Prey preferences of the spotted hyaena (Crocuta crocuta) and degree of dietary overlap with the lion (Panthera leo) », Journal of Zoology, vol. 270, no 4, , p. 606–614 (ISSN 0952-8369 et 1469-7998, DOI 10.1111/j.1469-7998.2006.00183.x, lire en ligne, consulté le )
- Mills, M. G. L., Kalahari hyenas : comparative behavioral ecology of two species, Chapman & Hall, (ISBN 0-412-53760-5 et 9780412537608, OCLC 30913957, lire en ligne)
- (en) S.M. Cooper, « Optimal hunting group size: the need for lions to defend their kills against loss to spotted hyaenas », African Journal of Ecology, vol. 29, no 2, , p. 130–136 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1991.tb00993.x, lire en ligne, consulté le )
- (en) Erin E. Boydston, Toni Lyn Morelli et Kay E. Holekamp, « Sex Differences in Territorial Behavior Exhibited by the Spotted Hyena (Hyaenidae, Crocuta crocuta) », Ethology, vol. 107, no 5, , p. 369–385 (ISSN 0179-1613 et 1439-0310, DOI 10.1046/j.1439-0310.2001.00672.x, lire en ligne, consulté le )
- (en) H. E. Watts et K. E. Holekamp, « Interspecific competition influences reproduction in spotted hyenas », Journal of Zoology, vol. 276, no 4, , p. 402–410 (DOI 10.1111/j.1469-7998.2008.00506.x, lire en ligne, consulté le )
- (en) Johannes Robert Henschel, The Socio-ecology of a Spotted Hyaena Crocuta Crocuta Clan in the Kruger National Park, Universiteit van Pretoria, (lire en ligne)
- Schaller, George B., The Serengeti lion : a study of predator-prey relations, , 480 p. (ISBN 978-0-226-73639-6, 0-226-73639-3 et 0226736407, OCLC 500945, lire en ligne)
- (en) George B. Schaller, « Hunting Behaviour of the Cheetah in the Serengeti National Park, Tanzania », African Journal of Ecology, vol. 6, no 1, , p. 95–100 (ISSN 1365-2028, DOI 10.1111/j.1365-2028.1968.tb00906.x, lire en ligne, consulté le )
- (en) M. Karen Laurenson, « High juvenile mortality in cheetahs ( Acinonyx jubatus ) and its consequences for maternal care », Journal of Zoology, vol. 234, no 3, , p. 387–408 (DOI 10.1111/j.1469-7998.1994.tb04855.x, lire en ligne, consulté le )
- « Cheetahs of the Serengeti Plains: Group Living in an Asocial Species by T. M. Caro », African Journal of Ecology, vol. 34, no 2, , p. 234–235 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1996.tb00618.x, lire en ligne, consulté le )
- (en) Sarah M. Durant, « Living with the enemy: avoidance of hyenas and lions by cheetahs in the Serengeti », Behavioral Ecology, vol. 11, no 6, , p. 624–632 (ISSN 1465-7279 et 1045-2249, DOI 10.1093/beheco/11.6.624, lire en ligne, consulté le )
- Scott, Jonathan, 1949-, Leopard, HarperCollins, (ISBN 0-00-714667-1, 9780007146673 et 0007211813, OCLC 52878494, lire en ligne)
- (en) Balme and Hunter, « (PDF) Mortality in a protected leopard population, Phinda Private Game Reserve, South Africa: A population decline », sur ResearchGate, (consulté le )
- (en-US) « Hyenas kill a leopard », sur Africa Geographic, (consulté le )
- Richard D. Estes et John Goddard, « Prey Selection and Hunting Behavior of the African Wild Dog », The Journal of Wildlife Management, vol. 31, no 1, , p. 52 (DOI 10.2307/3798360, lire en ligne, consulté le )
- (en) J. R. Malcolm et Ken Marten, « Natural selection and the communal rearing of pups in African wild dogs (Lycaon pictus) », Behavioral Ecology and Sociobiology, vol. 10, no 1, , p. 1–13 (ISSN 0340-5443 et 1432-0762, DOI 10.1007/BF00296390, lire en ligne, consulté le )
- (en) Creel, Scott, 1962-, The African wild dog : behavior, ecology, and conservation, Princeton (N.J.), Princeton University Press, , 341 p. (ISBN 0-691-01655-0, 9780691016559 et 0691016542, OCLC 47995950, lire en ligne)
- M. G. L Mills, « The comparative behavioural ecology of the Brown Hyaena Hyaena brunnea and the Spotted Hyaena Crocuta crocuta in the Southern Kalahari », Koedoe, vol. 27, no 2, (ISSN 2071-0771 et 0075-6458, DOI 10.4102/koedoe.v27i2.583, lire en ligne, consulté le )
- (en) Johannes R. Henschel et John D. Skinner, « Territorial Behaviour by a Clan of Spotted Hyaenas Crocuta crocuta », Ethology, vol. 88, no 3, , p. 223–235 (DOI 10.1111/j.1439-0310.1991.tb00277.x, lire en ligne, consulté le )
- (en) Heribert Hofer, Marion East, Ina Sämmang et Martin Dehnhard, « Analysis of Volatile Compounds in Scent-Marks of Spotted Hyenas (Crocuta Crocuta) and their Possible Function in Olfactory Communication », dans Chemical Signals in Vertebrates 9, Springer US, (ISBN 9781461351870, DOI 10.1007/978-1-4615-0671-3_18, lire en ligne), p. 141–148
- (en) Francis, Richard C., 1953-, Why men won't ask for directions : the seductions of sociobiology, Princeton (N.J.), Princeton University Press, , 325 p. (ISBN 0-691-05757-5, 9780691057576 et 0691124051, OCLC 51900516, lire en ligne)
- (en) Gabriel Ramos-Fernández, « Vocal Communication in a Fission-Fusion Society: Do Spider Monkeys Stay in Touch With Close Associates? », International Journal of Primatology, vol. 26, no 5, , p. 1077–1092 (ISSN 0164-0291 et 1573-8604, DOI 10.1007/s10764-005-6459-z, lire en ligne, consulté le )
- (en) Marion L. East et Heribert Hofer, « Loud calling in a female-dominated mammalian society: II. Behavioural contexts and functions of whooping of spotted hyaenas, Crocuta crocuta », Animal Behaviour, vol. 42, no 4, , p. 651–669 (DOI 10.1016/S0003-3472(05)80247-7, lire en ligne, consulté le )
- (en) Kay E. Holekamp, Erin E. Boydston, Micaela Szykman et Isla Graham, « Vocal recognition in the spotted hyaena and its possible implications regarding the evolution of intelligence », Animal Behaviour, vol. 58, no 2, , p. 383–395 (DOI 10.1006/anbe.1999.1157, lire en ligne, consulté le )
- (en) Nicolas Mathevon, Aaron Koralek, Mary Weldele et Stephen E Glickman, « What the hyena's laugh tells: Sex, age, dominance and individual signature in the giggling call of Crocuta crocuta », BMC Ecology, vol. 10, no 1, , p. 9 (ISSN 1472-6785, DOI 10.1186/1472-6785-10-9, lire en ligne, consulté le )
- R. Sachs et A. S. Taylor, « Trichinosis in a spotted hyaena (Crocuta crocuta) of the Serengeti », The Veterinary Record, vol. 78, no 20, , p. 704 (ISSN 0042-4900, PMID 5948801, lire en ligne, consulté le )
- Heribert Hofer et Marion East, Serengeti II : Dynamics, Management, and Conservation of an Ecosystem, University of Chicago, , 665 p. (ISBN 978-0-226-76032-2, lire en ligne)
- Kathleen A. Alexander, Pieter W. Kat, Laurence G. Frank et Kay E. Holekamp, « Evidence of Canine Distemper Virus Infection among Free-Ranging Spotted Hyenas (Crocuta crocuta) in the Masai Mara, Kenya », Journal of Zoo and Wildlife Medicine, vol. 26, no 2, , p. 201–206 (ISSN 1042-7260, lire en ligne, consulté le )
- (en) Barnard BJ, « The role played by wildlife in the epizootiology of rabies in South Africa and South-West Africa », Onderstepoort J Vet Res., (lire en ligne)
- (en) D. Röttcher et A. M. Sawchuk, « WILDLIFE RABIES IN ZAMBIA », Journal of Wildlife Diseases, vol. 14, no 4, , p. 513–517 (ISSN 0090-3558, DOI 10.7589/0090-3558-14.4.513, lire en ligne, consulté le )
- (en) R. M. Edelsten, « Epidemiology and control of rabies in Malawi », Tropical Animal Health and Production, vol. 27, no 3, , p. 155–163 (ISSN 0049-4747 et 1573-7438, DOI 10.1007/BF02248961, lire en ligne, consulté le )
- (en) M. J. Reardon et L. K. Lightner, « Dipetalonema dracunculoides in dogs and spotted hyena (Crocuta crocuta) in the Turkana District of Kenya », Proceedings - Helminthological Society of Washington, (ISSN 0018-0130, lire en ligne, consulté le )
- (en) Brenda O. Vidler et David W. Brocklesby, « Some new host records for Hepatozoon species in Kenya », sur undefined, (consulté le )
- (en) R. M. McCully, P. A. Basson, R. D. Bigalke et Valerius De Vos, « Observations on naturally acquired hepatozoonosis of wild carnivores and dogs in the Republic of South Africa », Onderstepoort Journal of Veterinary Research, (ISSN 0030-2465, lire en ligne, consulté le )
- E. Pozio, D. De Meneghi, M. E. Roelke-Parker et G. La Rosa, « Trichinella nelsoni in Carnivores from the Serengeti Ecosystem, Tanzania », The Journal of Parasitology, vol. 83, no 6, , p. 1195 (DOI 10.2307/3284388, lire en ligne, consulté le )
- (en) O Honer, B Wachter, S Speck et G Wibbelt, « Severe Streptococcus infection in spotted hyenas in the Ngorongoro Crater, Tanzania », Veterinary Microbiology, vol. 115, nos 1-3, , p. 223–228 (DOI 10.1016/j.vetmic.2005.12.018, lire en ligne, consulté le )
- (en) Oliver P. Höner, Bettina Wachter, Katja V. Goller et Heribert Hofer, « The impact of a pathogenic bacterium on a social carnivore population: Long-term impact of disease outbreak on a social carnivore population », Journal of Animal Ecology, vol. 81, no 1, , p. 36–46 (DOI 10.1111/j.1365-2656.2011.01873.x, lire en ligne, consulté le )
- (en) Künzel, T., Rayaleh, H.A. and Künzel, S., Status Assessment Survey on Wildlife in Djibouti. Final Report, Zoological Society for the Conservation of Species and Populations (Z.S.C.S.P.) and Office National du Tourisme et de l’Artisanat (O.N.T.A.).,
- Grubb, P., Mammals of Ghana Sierra Leone and the Gambia, Trendrine, , 265 p. (ISBN 0-9512562-4-6 et 9780951256244, OCLC 42792565, lire en ligne)
- Vermeulen, Les carnivores, Gembloux, Presses Agronomiques de Gembloux, , pp. 116-125
- (en) Philipp Henschel, Lauren Coad, Cole Burton et Beatrice Chataigner, « The Lion in West Africa Is Critically Endangered », PLoS ONE, vol. 9, no 1, , e83500 (ISSN 1932-6203, DOI 10.1371/journal.pone.0083500, lire en ligne, consulté le )
- Marion L. East et Heribert Hofer, « Social environments, social tactics and their fitness consequences in complex mammalian societies », dans Social Behaviour, Cambridge University Press, (ISBN 9780511781360, DOI 10.1017/cbo9780511781360.029, lire en ligne), p. 360–390
- (en) Kay E. Holekamp et Stephanie M. Dloniak, « Intraspecific Variation in the Behavioral Ecology of a Tropical Carnivore, the Spotted Hyena », dans Advances in the Study of Behavior, vol. 42, Elsevier, (ISBN 9780123808943, DOI 10.1016/s0065-3454(10)42006-9, lire en ligne), p. 189–229
- (en) Bohm, « Mission report of scientific studies in the National Parks of Gabon », Report to the Secrétariat de la Commission Scientifique sur les Autorisations de Recherche du CENAREST, and to the Secrétariat Exécutif de l'ANPN.,
- (en) Hofer, H. and Mills, M.G.L., « Worldwide distribution of Hyaenas », Status Survey and Conservation Action Plan, IUCN, Gland, Switzerland and Cambridge, UK, , pp. 39-63
- (en) IUCN, « Crocuta crocuta: Bohm, T. & Höner, O.R.: The IUCN Red List of Threatened Species 2015: e.T5674A45194782 », International Union for Conservation of Nature, (DOI 10.2305/iucn.uk.2015-2.rlts.t5674a45194782.en, consulté le )
- (en) W. C. Gasaway, K. T. Mossestad et P. E. Standers, « Food acquisition by spotted hyaenas in Etosha National Park, Namibia: predation versus scavenging », African Journal of Ecology, vol. 29, no 1, , p. 64–75 (ISSN 0141-6707 et 1365-2028, DOI 10.1111/j.1365-2028.1991.tb00821.x, lire en ligne, consulté le )
- (en) Scott Creel et Nancy Marusha Creel, « Limitation of African Wild Dogs by Competition with Larger Carnivores », Conservation Biology, vol. 10, no 2, , p. 526–538 (ISSN 0888-8892 et 1523-1739, DOI 10.1046/j.1523-1739.1996.10020526.x, lire en ligne, consulté le )
- Truman P. Young et Mathew R. Evans, « Alpine vertebrates of mount Kenya, with particular notes on the Rock Hyrax », Journal of The East Africa Natural History Society and National Museum, vol. 82, , p. 55–79 (lire en ligne, consulté le )
- (en) East and Hofer, The Mammals of Africa Crocuta crocuta, vol. Volume V: Carnivores, Pangolins, Equids, Rhinoceroses, Londres, Bloomsbury Publishing, , pp. 560
- (en) J. Decher, « Kingdon, J. 1997. THE KINGDON FIELD GUIDE TO AFRICAN MAMMALS. Academic Press, San Diego, California, xviii + 464 pp. », Journal of Mammalogy, vol. 80, no 2, , p. 692–693 (ISBN 0-12-408355-2, ISSN 1545-1542 et 0022-2372, DOI 10.2307/1383314, lire en ligne, consulté le )
- (en) Philipp Henschel, « Leopards in African Rainforests : Survey and Monitoring Techniques », sur www.semanticscholar.org, (consulté le )
- « Wayback Machine », sur www.nmnhs.com, (version du 15 avril 2012 sur Internet Archive)
- (en) Jurgen W Frembgen, « The Magicality of the HyenaBeliefs and Practices in West and South Asia », Asian Folklore Studies, , p. 331-344 (lire en ligne)
- Middleton, John, 1921-2009, et Winter, E. H. (Edward Henry),, Witchcraft and sorcery in East Africa, , 314 p. (ISBN 978-1-136-55145-1, 113655145X et 9781315018041, OCLC 863157478, lire en ligne)
- Stephen Glickman, « The Spotted Hyena From Aristotle to the Lion King: Reputation is Everything », Social Research, vol. 62, (lire en ligne, consulté le )
- Quin, P. J., Foods and feeding habits of the Pedi : with special reference to identification, classification, preparation and nutritive value of the respective foods, Witwatersrand University Press, (OCLC 638683577, lire en ligne)
- (en) Siegbert Uhlig, Encyclopaedia Aethiopica : He-N, Wiesbaden, Isd, , 1211 p. (ISBN 978-3-447-05607-6, lire en ligne)
- Bierbaum, Bernd., In Ethiopia (ISBN 978-3-8448-7702-1 et 3844877029, OCLC 930709363, lire en ligne)
- (en) James Mcpherson, « The good, the bad and the hyena », The good, the bad and the hyena, (suzieszterhas.com).
- (en) Frank, Laurence D, « Girl Power », African geographic, .
- (en) G. YIRGA, H. BAUER, « Livestock Depredation of the Spotted Hyena (Crocuta crocuta) in Southern Tigray, Northern Ethiopia », Wavback Machine, (version du 16 décembre 2012 sur Internet Archive)
- (en) « Preliminary data on human - carnivore conflict in Niassa National Reserve, Mozambique, particularly fatalities due to lion, spotted hyaena and crocodile », sur ResearchGate (consulté le )
- Theodore Roosevelt, African game trails : an account of the African wanderings of an American hunter-naturalist., Charles Scribner's Sons,, (lire en ligne)
- (en) Knight, John, 1960- et European Association of Social Anthropologists., Natural enemies : people-wildlife conflicts in anthropological perspective, New York, Routledge, , 254 p. (ISBN 0-415-22440-3, 9780415224406 et 0415224411, OCLC 44509232, lire en ligne)
- Marlowe, Frank, 1954-, The Hadza : hunter-gatherers of Tanzania, University of California Press, (ISBN 978-0-520-94544-9, 0520945441 et 1282772716, OCLC 646788649, lire en ligne)
- (en) Copson, Raymond W., Africa's wars and prospects for peace, Armonk (N.Y.)/London (GB), M.E. Sharpe, , 211 p. (ISBN 1-56324-300-8, 9781563243004 et 1563243016, OCLC 28508454, lire en ligne)
- (en-GB) Martin Fletcher, « The urban hyenas that attack rough sleepers », BBC, (lire en ligne, consulté le )
- (en) Antonio Rodríguez Hidalgo, « THE SCAVENGER OR THE SCAVENGED? », Journal of Taphonomy, (lire en ligne)
- (en) Richard Tjader, « The big game of Africa, by Richard Tjader; with many illustrations from photographs by the author. », New York and London, D. Appleton and Company, (lire en ligne, consulté le )
- (en) Siegbert Uhlig et Alessandro Bausi, Encyclopaedia Aethiopica, Wiesbaden, Harrassowitz, 2003-2014, 846 p. (ISBN 3-447-04746-1, 9783447047463 et 3447052384, OCLC 52774892, lire en ligne)
- Beinart, William., The rise of conservation in South Africa : settlers, livestock, and the environment, 1770-1950, Oxford University Press, , 456 p. (ISBN 978-0-19-954122-5, 0199541221 et 9780199261512, OCLC 214305997, lire en ligne)
- Samuel Daniell, John Barrow, William Daniell et William Somerville, Sketches representing the native tribes, animals, and scenery of southern Africa : from drawings made by the late Mr. Samuel Daniell /, Printed by Richard and Arthur Taylor :, (lire en ligne)
- John Barrow, Samuel John Neele, Henry Scott Buccleuch et Russell E. Train Africana Collection (Smithsonian Institution. Libraries) DSI, An account of travels into the interior of southern Africa, in the years 1797 and 1798 : including cursory observations on the geology and geography of the southern part of that continent; the natural history of such objects as occurred in the animal, vegetable, and mineral kingdoms; and sketches of the physical and moral characters of the various tribes of inhabitants surrounding the settlement of the Cape of Good Hope : to which is annexed, a description of the present state, population, and produce of that extensive colony : with a map constructed entirely from actual observations made in the course of the travels, London : Printed by A. Strahan ... for T. Cadell, jun. and W. Davies ..., (lire en ligne)
- Thomas Rymer Jones, The animal creation : a popular introduction to zoology., Society for Promoting Knowledge,, (lire en ligne)
Voir aussi
Références taxinomiques
- (en) Référence Animal Diversity Web : Crocuta crocuta (consulté le )
- (en) Référence Fonds documentaire ARKive : Crocuta crocuta (consulté le )
- (en) Référence BioLib : Crocuta crocuta (Erxleben, 1777)
- (en) Référence Brainmuseum : Crocuta crocuta (consulté le )
- (en) Référence Catalogue of Life : Crocuta crocuta (Erxleben, 1777) (consulté le )
- (fr) Référence INPN : Crocuta crocuta (Erxleben, 1777) (TAXREF) (consulté le )
- (fr+en) Référence ITIS : Crocuta crocuta (Erxleben, 1777) (consulté le )
- (en) Référence Mammal Species of the World (3e éd., 2005) : Crocuta crocuta Erxleben, 1777 (consulté le )
- (en) Référence NCBI : Crocuta crocuta (taxons inclus) (consulté le )
- (en) Référence Paleobiology Database : Crocuta crocuta Erxleben 1777 (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- (en) Référence UICN : espèce Crocuta crocuta (Erxleben, 1777) (consulté le )
Liens externes
- (en) « Ngorongoro Hyena Project » (consulté le )
