Protoxyde d'azote
Le protoxyde d'azote, ou monoxyde de diazote, oxyde nitreux, hémioxyde d'azote ou gaz hilarant, est un composé chimique de formule N2O.
| Protoxyde d'azote | |
 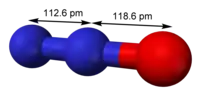 Structure du protoxyde d'azote. |
|
| Identification | |
|---|---|
| Nom UICPA | protoxyde d'azote |
| Synonymes |
oxyde nitreux |
| No CAS | |
| No ECHA | 100.030.017 |
| No CE | 233-032-0 |
| No RTECS | QX1350000 |
| Code ATC | N01 |
| PubChem | |
| ChEBI | 17045 |
| No E | E942 |
| FEMA | 2779 |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé liquéfié incolore, d'odeur caractéristique[2]. |
| Propriétés chimiques | |
| Formule | N2O [Isomères] |
| Masse molaire[3] | 44,012 8 ± 0,000 7 g/mol N 63,65 %, O 36,35 %, |
| Moment dipolaire | 0,160 83 D[4] |
| Propriétés physiques | |
| T° fusion | −90,8 °C[2] |
| T° ébullition | −88,5 °C[2] Décomposition à 300 °C |
| Solubilité | 1,5 g l−1 (eau, 15 °C)[2]. Soluble aussi dans l'acide sulfurique, l'éthanol, l'éther, les huiles. |
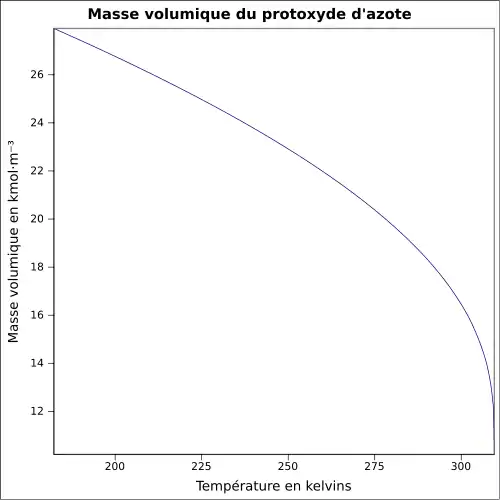
| Masse volumique | 1,23 g cm−3 (liquide, −89 °C)[2] 0,001 80 g cm−3 (gaz, 25 °C)[5] |
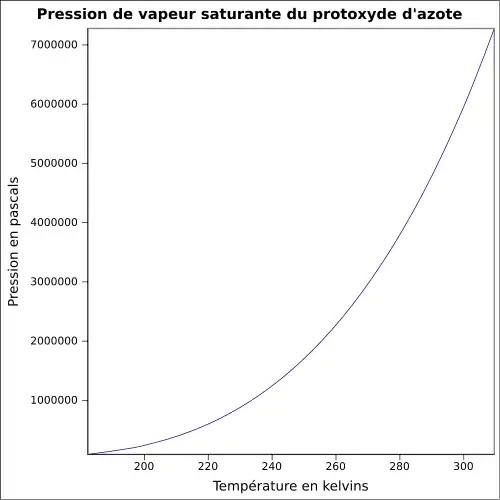
| Pression de vapeur saturante | 51,7 bar à 21 °C
|
| Point critique | 72,7 bar, 36,55 °C[7] |
| Vitesse du son | 263 m s−1 (0 °C, 1 atm)[8] |
| Thermochimie | |
| S0gaz, 1 bar | 219,96 J mol−1 K−1 |
| ΔfH0gaz | 82,05 kJ mol−1 |
| ΔvapH° | 16,53 kJ mol−1 (1 atm, −88,48 °C)[9] |
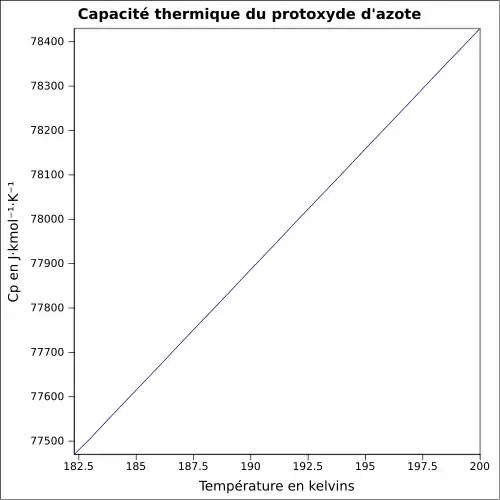
| Cp | |
| PCS | 82,1 kJ mol−1 (25 °C, gaz)[10] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,886 eV (gaz)[11] |
| Précautions | |
| SGH[12] | |
   Danger |
|
| SIMDUT[13] | |
   A, C, D2A, |
|
| NFPA 704 | |
| Transport[12] | |
| Inhalation | Asphyxiant si inhalé pur |
| Peau | Toxique si cryogénique ou compressé |
| Yeux | Toxique si cryogénique ou compressé |
| Données pharmacocinétiques | |
| CAM | 105 %vol |
| Métabolisme | Nul |
| Considérations thérapeutiques | |
| Classe thérapeutique | Anesthésique général, analgésique |
| Voie d’administration | Inhalatoire |
| Caractère psychotrope | |
| Catégorie | Hallucinogène dissociatif |
| Mode de consommation |
Inhalatoire |
| Autres dénominations |
Gaz hilarant |
| Risque de dépendance | Élevé |
| Unités du SI et CNTP, sauf indication contraire. | |
Ce gaz incolore a une odeur et un goût légèrement sucrés. Il est utilisé en anesthésie, en chirurgie, en odontologie, en pédiatrie comme adjuvant (en mélange équimolaire avec de l'oxygène) pour ses propriétés anesthésiques et antalgiques. Il est dit « gaz hilarant » car euphorisant à l'inhalation, d'où son usage comme drogue récréative hallucinogène[14] - [15]. Comme comburant, il accroît la puissance des moteurs en compétition automobile. Avec l'acétylène H-C≡C-H, il est utilisé dans certains appareils d'analyse (spectrométrie d'absorption atomique[16]).
Ses émissions sont d'origine naturelle et humaine (plus de 20 % d'augmentation dans l'air depuis l'époque pré-industrielle). Présent à l'état de traces dans l'air sec (330 parties par milliard[5]), c'est un puissant gaz à effet de serre (298 fois plus puissant que le CO2) et il est devenu le 1er contributeur à la destruction de la couche d'ozone[17]. Des analyses américaines publiées en 2021 (commandées par le président Joe Biden) concluent que son coût social a été sous-estimé, car ne tenant pas compte de l'appauvrissement de la couche d'ozone stratosphérique, effet qui à lui seul pourrait augmenter de 20 % sa valeur de nuisibilité sociale. Selon la même étude, ses liens avec d'autres effets de la pollution azotée pourraient rendre son « atténuation encore plus impérieuse » dans l'atmosphère[18].
Production et synthèse
Le protoxyde d'azote est préparé par décomposition du nitrate d'ammonium fondu entre 250 °C et 260 °C selon l'équation de réaction suivante[19] :
Il se forme toujours 1 à 2 % de l'azote N2 et du monoxyde d'azote NO. Ce dernier est éliminé par passage dans du sulfate de fer(II). Le nitrate d'ammonium utilisé doit être exempt d'ions chlorures Cl− qui catalysent la formation de N2. Cependant, le chauffage de solutions de nitrate d'ammonium dans l'acide nitrique ou dans l'acide sulfurique conduit à du protoxyde d'azote pur, même en présence de petites quantités d'ions chlorures.
Propriétés chimiques
Très stable dans l'atmosphère, très peu soluble dans l'eau, il est hautement soluble dans les huiles et dans les corps gras.
Réactivité
Ce gaz ne réagit pas à température ambiante avec les dihalogènes (Cl2, Br2 ou I2), ni avec les métaux alcalins (Li, Na, K).
Il peut néanmoins se fixer sur certains cations métalliques en tant que ligand et forme des complexes comme [Ru(NH3)5(N2O)]2+.
Il peut aussi oxyder des métaux de transition à basse valence dans les complexes.
Il n'est pas modifié par l'ozone O3, mais contribue à la dégradation de l'ozone stratosphérique (couche d'ozone protectrice de la biosphère contre les UV solaires).
À haute température, il se décompose en azote et oxygène :
Il réagit avec de nombreux composés organiques et il dope les combustions grâce à son fort pouvoir oxydant[2].
Il a ainsi servi de comburant pour doper les moteurs d'avions de chasse à haute altitude durant la seconde guerre mondiale et ceux de voitures de compétition (tuning automobile et dragsters). Il peut aussi occasionner de violentes explosions accidentelles et de gros dégâts dans les fours d'incinérateur de déchets municipaux quand des cartouches de grande capacité de gaz euphorisant y aboutissent malencontreusement.
Historique


En 1772, Joseph Priestley découvre le protoxyde d'azote[20] et le décrit dans Experiments and Observations on Different Kinds of Air.
En 1798, Humphry Davy découvre entre autres ses propriétés euphorisantes. Le protoxyde d'azote est utilisé dès la fin du XVIIIe siècle comme « gaz hilarant » dans les foires.
En 1844, le dentiste Horace Wells découvre ses effets anesthésiants, qu'il expérimente sur lui-même. Malheureusement, impatient de faire connaître sa découverte, Wells se lance sans expérimentation approfondie préalable, dans des démonstrations devant un public médical à Hartford (Connecticut) et à Harvard, qui sont des échecs retentissants. Dépité, Wells abandonne définitivement la dentisterie. Il faudra attendre les recherches et démonstrations réussies de William Thomas Green Morton avec l'éther (octobre et novembre 1846 à Boston) pour que l'anesthésie soit utilisée par les chirurgiens, ce qui a permis à la chirurgie de faire un bond en avant (la douleur était l'une des deux grandes limites de la chirurgie, avec l'infection). Le protoxyde d'azote est remis à l'honneur par un dénommé Colton, montreur de spectacles au gaz hilarant, qui, associé au dentiste J.H. Smith, installent une clinique à New York puis exportent leur procédé en Europe.
En 1961, des médecins anglais l’utilisent pour la première fois en obstétrique où il atténue la douleur et a un rôle d'anxiolyse.
Dans les années 1980, son usage est grandement amélioré par l'association avec de l’oxygène car le premier risque à son utilisation reste l'asphyxie par manque d'oxygène. La médecine l'utilise donc en mélange équimolaire avec de l'oxygène (MEOPA). Le protoxyde d'azote remplace alors progressivement l’éther et le chloroforme en obstétrique[21].
En 1998, il reçoit un statut de médicament antalgique.
En , il obtient en France l'autorisation de mise sur le marché (AMM), alors qu'il est déjà régulièrement utilisé sous cette forme durant le XXe siècle. Auparavant, il était distribué (hors de la classification médicament comme les autres gaz médicaux) dans la majorité des blocs opératoires et a constitué l'un des agents de l'anesthésie générale durant le XXe siècle ; sa faible puissance anesthésique restreignant son usage à des actes assez peu douloureux, et au rôle d'adjuvant de médicaments plus puissants dont il permet de réduire les doses en diminuant certains effets indésirables.
Fin 2009, en France, l’Afssaps modifie la réglementation afin que le MEOPA puisse être utilisé hors des établissements hospitaliers[22], régularisant la situation de ceux qui l'utilisaient (en France au moins depuis 1996 « à domicile » chez des patients adultes sidéens pour soulager la douleur d'ulcérations cutanées associées au syndrome de Kaposi et chez certains malades âgés porteurs d’ulcères cutanés ou d’escarres rendus trop somnolents par un traitement antérieur, ou sporadiquement en pédiatrie à domicile, pour soulager des douleurs majeures quand les produits morphiniques ne suffisaient plus chez des enfants en soins palliatifs[22]. Il était en outre utilisé ponctuellement par des médecins, par exemple en dermatologie ou en ORL au domicile de patients adultes, puis très régulièrement chez les enfants (annexe 2) sans remboursement par la Sécurité sociale car ce moyen antalgique était hors nomenclature).
Des médecins signalent que « la reproductibilité de l'effet n’est pas complète, avec un manque d’efficacité chez certains » ; les principaux effets indésirables sont des nausées et vomissements, « généralement réversibles en quelques minutes à l’arrêt du traitement »[23] (un groupe d'experts[24] réunis par l'Afssaps considère dans son rapport[25] que « Le MEOPA ne permet pas de couvrir tous les actes et soins douloureux. Selon les indications, l’âge de l’enfant et l’expérience de l’équipe, 10 à 30 % d’échecs sont observés. Les enfants de moins de deux ans ont des effets beaucoup moins marqués »[23]).
L’Afssaps précise que
« tout mésusage ou abus doit être prévenu. Dans ce contexte, un reclassement dans la catégorie des médicaments réservés à l’usage professionnel a été retenu ; ce mélange gazeux ne peut donc être distribué qu’aux professionnels de santé concernés et non directement aux patients[21]. La modification des conditions de prescription et de délivrance a entraîné la révision complète des RCP des spécialités concernées. En outre, compte-tenu de l’ensemble des risques liés à l’utilisation des spécialités à base de MEOPA, l’Afssaps conditionne leur mise à disposition en dehors des établissements de santé à la mise en application d’un plan de gestion des risques (PGR) national commun. Il repose sur un engagement des laboratoires à la mise en place des mesures de gestion et de minimisation des risques suivantes[21] :
- la réalisation d’une surveillance de pharmacovigilance et de pharmacodépendance renforcée[26] avec
- l’incitation des professionnels de santé à notifier les effets indésirables, les cas d’abus, de pharmaco dépendance, d’usage détourné et de mésusages liés à l’utilisation du MEOPA ;
- pendant les deux premières années, la transmission semestrielle à l’Afssaps des rapports périodiques actualisés de Pharmacovigilance accompagnés de la synthèse française des cas rapportés, du bilan des consommations et des conditions d’utilisation du produit ;
- la sécurisation et la traçabilité de la distribution et de la récupération, avec notamment la vérification à la commande de la qualité et de la formation du demandeur ;
- la sécurisation et traçabilité de l’utilisation : volumes des bouteilles limité à cinq litres et sécurisation des bouteilles ;
- la réalisation d’un plan de formation des professionnels : médecins, pharmaciens et personnel soignant ;
- la mise à disposition d’un document d’information destiné aux patients (en cas de stockage à domicile.). »
L'année suivante (2010), la réserve hospitalière s'ouvre à la dentisterie. L’Afssaps lance un suivi national de pharmacovigilance et de pharmacodépendance du N2O ; en particulier, les vols de N2O doivent lui être déclarés[21].
En 2001 (en France), les indications en hospitalisation au domicile pédiatrique ont intégré les trois cas suivants :
- actes médicaux invasifs et répétés, insuffisamment calmés par d’autres moyens antalgiques faibles (Emla, antalgiques palier 1) tels que des injections intramusculaires pour une chimiothérapie, la réfection de pansements sur peau lésée[21] ;
- soins médicaux jugés normalement peu douloureux par les médecins, mais source d’angoisse ou d’anxiété marqués pour un enfant particulier (tels que des pansements de cathéter veineux central, des prélèvements sanguins veineux périphériques itératifs)[21] ;
- soins réitérés durant des mois devenant source de difficultés marquées d’acceptation[21].
Sources
Selon l'OMM (2017), ses émissions sont d'origine naturelle pour environ 60 % et humaine pour environ 40 %[27] alors qu'une estimation antérieure (2009) concluait à 30 % d'origine humaine[28].
Sources naturelles
Certains micro-organismes du sol et des océans en sont les principales sources naturelles mais il est également produit par la combustion de matières organiques et de combustibles fossiles, l’industrie ou les stations d'épuration des eaux usées[29], etc. Sa production dans les sols et dans l'air à partir des sols est fortement augmentée par la fertilisation azotée (usage des engrais, y compris d'origine « organique » naturelle, et amendements azotés)[30]. Une partie des émissions des sols cultivés ou prairiaux ayant fait l'objet d'épandages de fumiers et lisiers, de boues d'épuration ou de certains engrais est ainsi d'origine humaine[31].
Les bactéries vivant dans certaines fourmilières en sont une source importante ; les gaz exhalés par vingt-deux nids de fourmis coupeuses de feuilles (du sud-ouest du Costa Rica) a montré qu'en contexte humide et pauvre en oxygène, ces bactéries produisent des quantités très importantes de méthane et d'oxyde nitreux[32]. Ces grandeurs sont comparables à celles observées dans les stations d'épuration d'eaux usées et des fosses à lisier[32]. Ces fourmis contribuent néanmoins aussi aux fonctions de puits de carbone du sol ; le bilan de leurs effets globaux sur le climat n'est pas encore évalué, faute de données suffisantes[32], mais cette production explique pourquoi les études précédentes avaient mesuré des niveaux très variables de méthane et d’oxyde nitreux dans les forêts et régions où ces fourmis construisent leurs nids souterrains[32].
Sources humaines
Un tiers du N2O de l'atmosphère provient de l'épandage de lisier et d'engrais azotés[33] - [34]. Une autre contribution importante est la synthèse d'acide adipique, HO2C(CH2)4CO2H, un précurseur de nombreux polymères de nylon et qui dégage un N2O pour chaque molécule d'acide adipique[35] - [36]. En France, l’agriculture contribue à hauteur de 86 % aux émissions de N2O provenant essentiellement de la transformation des produits azotés (engrais, fumier, lisier, résidus de récolte) épandus sur les terres agricoles. Une petite partie des émissions provient de la pollution routière, en particulier des véhicules équipés de pots catalytiques et de quelques procédés industriels[37] - [38].
Contribution à l'effet de serre
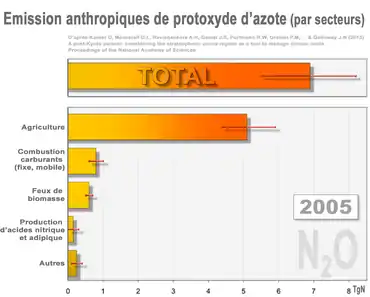
Les sources de moindre importance (ex. : eaux usées et aquaculture) figurent dans la barre du bas intitulée « Autres ». Les barres rouges correspondent aux marges d'erreur (rouge)[39]. En 2005, le total (dominé par les émissions agricoles) correspond à 30-40 % environ de tout le N2O introduit annuellement par l'humain dans l'atmosphère.
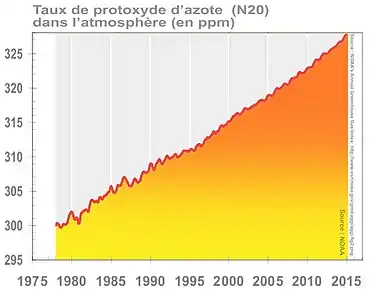
Ce gaz est stable (121 ans de durée de vie moyenne dans l'atmosphère[40]), à effet de serre et destructeur de la couche d'ozone ; avec 329 ppb en 2016, soit +22 % par rapport au niveau préindustriel, il est responsable de 6 % au forçage radiatif induit par les gaz à effet de serre persistants.
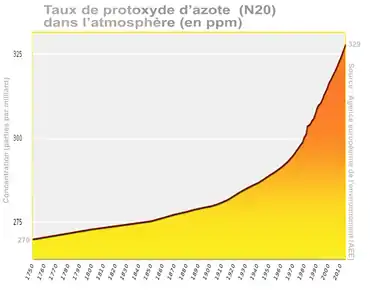




Le protoxyde d'azote est aussi un puissant gaz à effet de serre[42]. Sa teneur augmente dans l'air au moins depuis le milieu du XVIIIe siècle avec une accélération au début du XXe siècle et une forte accélération depuis les années 1970[43].
Selon le GIEC[44], son potentiel de réchauffement global à cent ans est égal à 298, c'est-à-dire qu'il contribue 298 fois plus au réchauffement climatique qu'une même masse de CO2 émise en même temps pendant les cent ans qui suivent leur émission.
En 2009, dans un article de la revue Science intitulé « Protoxyde d'azote : pas de quoi rire »[45], Donald J. Wuebbles (Département Atmospheric Sciences, School of Earth, Society, and Environment de l'université de l'Illinois) s'étonne qu'en dépit de son importance reconnue depuis longtemps comme gaz à effet de serre et destructeur de la couche d'ozone, l'oxyde nitreux semble parfois encore rester le gaz oublié dans les questions de protection de l'atmosphère, du climat ou de la couche d'ozone. On continue à principalement se concentrer sur les émissions de dioxyde de carbone (CO2) et de méthane (CH4) provenant notamment des combustibles fossiles en oubliant que « les changements futurs du climat et de la répartition de l'ozone stratosphérique dépendent des émissions et de la concentration changeante de N2O dans l'atmosphère […] l'oxyde nitreux mérite beaucoup plus d'attention et de considération pour une action politique visant à contrôler les futures émissions anthropiques »[45].
Sa concentration dans l'atmosphère terrestre a atteint 329 ppb en 2016, soit +22 % par rapport au niveau préindustriel, contribuant pour 6 % au forçage radiatif induit par les gaz à effet de serre persistants (voir graphique ci-contre)[27].
Contribution à la destruction de la couche d'ozone
Le protoxyde d’azote (N2O) en excès contribue à la destruction de la couche d'ozone, en interaction avec d'autres gaz[46]. Il est considéré comme ayant une longue durée de vie dans la haute atmosphère (comme le CO2 et le méthane responsable en excès, à l’effet de serre[47]. Or, le réchauffement peut exacerber le trou de la couche d'ozone et inversement[47]).
Dès le début des années 1970, des météorologues et scientifiques s'inquiètent de l'augmentation du taux de N2O dans la haute atmosphère[48], mais il n'a pas été inclus dans le Protocole de Montréal. Au début du XXIe siècle, à la suite du recul des émissions des gaz soumis au Protocole de Montréal, le N2O devient le premier ennemi de la couche d'ozone[17] - [28] - [39]. Le GIEC prévoit qu'il devrait continuer à s'accumuler dans l'atmosphère[47], tendance confirmée par un article publié près de dix ans plus tard, en 2018 dans Science, et il devrait le rester durant tout le XXIe siècle[28] car la part de protéines animales dans l'alimentation humaine ne cesse de croître, associée à une production de fumier et de soja également source croissante d'oxyde nitreux. Selon un article de la revue Nature Geoscience, le lisier et le fumier libèrent ainsi dans l'air 2 % environ de l'azote qu'ils contenaient et les engrais azotés 2,5 % ; ces deux sources introduisent dans l'atmosphère 2,8 Mt de N2O pour les lisiers et 2,2 Mt pour les engrais synthétiques (dont la production et le transport et l'épandage produisent aussi par ailleurs du CO2 qui aggrave l'effet de serre. L'industrie rejette bien moins de N2O (0,8 Mt/an environ) et la combustion de la biomasse (0,5 Mt/an). De 1860 à 2005, le taux de N2O dans l'air serait passé de 270 à 319 ppb (parties par milliard, un taux de croissance assez comparable à celui du CO2).
Diverses stratégies d'atténuation des émissions de N2O sont possibles, dont en agriculture, où des changements techniques et de comportements pourraient considérablement réduire les émissions de N2O (et d'autres formes d'azote réactif), mais elles sont peu soutenues par l'industrie et les États[39]. Les parties signataires du régime de l'ozone qui doivent appliquer la Convention de Vienne (1985) au travers de son Protocole de Montréal de 1987 pourraient aussi prendre des mesures pour gérer le N2O à l'avenir[39]. En 2017, par un amendement au protocole, elles ont intégré les HFC mais n'évoquent toujours pas le N2O. Des voies réglementaires claires permettraient pourtant de l'inclure dans le régime de protection de la couche d'ozone en partageant l'autorité sur le N2O avec les traités internationaux (actuels et futurs) sur le climat. Selon Kanter et al. (2012), ce serait un moyen supplémentaire et précieux dans la gouvernance et diplomatie du développement durable[39].
Polluant de l'air intérieur
Dans certains contextes (certains locaux industriels, salle d'opération dans les hôpitaux, usage « récréatif » dans des locaux ou habitacles mal aérés), il est un polluant de l'air intérieur[49].
Utilisations
Il est utilisé dans le cadre d'anesthésies locales, généralement lors d'opérations hors hôpitaux (cas d'urgence) ou en cas de contre-indications.
Ce gaz est aussi prisé de certaines soirées où ses effets sont détournés pour provoquer chez l'inhaleur des sensations de fous rires incontrôlés.
Usage médical
Le protoxyde d'azote exerce un effet antalgique (apaise la douleur) et potentialise (augmente) l'effet des médicaments anesthésiques administrés en même temps. On l'utilise donc :
- en anesthésie, comme composante courante de l'anesthésie générale combinée, en association avec des anesthésiques injectables (hypnotiques, morphiniques, curares) ou inhalés ;
- en médecine d'urgence (réductions de fractures ou luxations), pédiatrie ou en salle d'accouchement, sous forme de mélange équimoléculaire avec du dioxygène (MEOPA) ;
- pour la pratique de gestes douloureux (MEOPA), en particulier chez l'enfant : prélèvement sanguin difficile, myélogramme, ponction lombaire, etc. Il a ici l'avantage d'induire souvent une amnésie du geste, utile quand celui-ci doit être répété. Pour une efficacité accrue, le protoxyde d'azote est ici associé à la prise préventive d'antalgiques, de type morphinique le plus souvent.
Le protoxyde d'azote (MEOPA) est classé dans la liste modèle des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[50], mais il fait en milieu hospitalier « l’objet d’un suivi renforcé de pharmacovigilance et d’addictovigilance »[26].
Mécanisme d'action
Le mécanisme pharmacologique d’action du N2O en médecine n'est pas encore complètement compris.
Le N2O interfère avec des voies de signalisation en modulant directement une large gamme de canaux ioniques commandés par des ligands (récepteurs ionotropes), ce qui jouerait un rôle majeur dans bon nombre de ses effets. Il bloque modérément les canaux du récepteur nicotinique de l'acétylcholine contenant les sous-unités NMDA et la sous-unité β2 (dite « CHRNB2 » pour neuronal acetylcholine receptor subunit beta-2). Il inhibe faiblement les récepteurs AMPA, et kaïnate, GABAA-rho (anciennement nommé « récepteur GABAC ») et le récepteur 5-HT3. Et il potentialise légèrement les récepteurs GABAA et glycine[51] - [52].
Il active le domaine K+ (canal potassique) à deux pores[53].
Bien que le N2O affecte (très rapidement) de nombreux canaux ioniques, ses effets anesthésiques, hallucinogènes et euphorisants sont probablement principalement ou totalement induits par une inhibition des courants médiés par les récepteurs NMDA[51] - [54].
Outre ses effets sur les canaux ioniques, le N2O pourrait agir en « mimant » l'oxyde nitrique (NO) dans le système nerveux central ; ceci pourrait expliquer une partie au moins de son caractère analgésique et anxiolytique[54] (remarque : l'oxyde nitreux est trente à quarante fois plus soluble que l'azote).
Les effets de l'inhalation de doses sous-anesthésiques d'oxyde nitreux varient selon plusieurs facteurs, et avec des différences individuelles[55] - [56], cependant selon Jay (2008), il est reconnu pour induire les états et sensations suivants[57] :
- intoxication ;
- euphorie/dysphorie ;
- désorientation spatiale ;
- désorientation temporelle ;
- réduction de la douleur.
Après inhalation de N2O, une minorité de personnes présenteront également des vocalisations incontrôlées et des spasmes musculaires. Ces effets disparaissent généralement quelques minutes après l'élimination de la source d'oxyde nitreux[57].
Effet euphorisant
Chez le rat de laboratoire, le N2O stimule la voie méso-limbique de récompense, en induisant la libération de dopamine et en activant dans le cerveau les neurones dopaminergiques de l'aire tegmentale ventrale et du noyau accumbens, vraisemblablement par antagonisation des récepteurs NMDA localisés dans le système[58] - [59] - [60] - [61]. Cette action expliquerait les effets euphorisants du N2O et semble aussi notamment augmenter ses propriétés analgésiques[58] - [59] - [60] - [61].
Il est remarquable cependant que chez la souris de laboratoire, le N2O bloque la libération de dopamine induite par les transporteurs liés aux amphétamines dans le noyau accumbens et qu’il bloque l’addiction, supprime le conditionnement pavlovien de type PPC (Préférence de place conditionnée/Conditioned place preference) induit par la cocaïne ou la morphine, sans produire d’effet de renforcement ni d'aversion[62] - [63].
Les effets du N2O sur le PPC chez les rats sont plus complexes et « mélangés », consistant en un renforcement, une aversion et aucun changement[64].
En revanche, le N2O est un facteur de renforcement positif chez le singe-écureuil[65]. Et il est bien connu pour être addictif chez l'humain[66].
Ces divergences de réponse selon l’espèce à N2O sont mal comprises : elles pourraient refléter de réelles variation entre espèces proches, voire au sein d’une espèce (ou refléter des différences méthodologiques entre études ?)[63]. Des études cliniques humaines ont conclu que N2O induit chez l’humain des réponses mixtes, similaires à celles décrites chez les rats, reflétant une variabilité subjective qui semble élevée[67] - [68].
Effet anxiolytique
Les tests comportementaux d'anxiété montrent qu’une faible dose de N2O est efficacement anxiolytique. Cet effet « anti-anxiété » a été associé à une activité accrue des récepteurs GABAA, car il est partiellement inversé par les antagonistes de ces récepteurs.
Inversement, les animaux qui ont développé une tolérance aux effets anxiolytiques des benzodiazépines sont alors aussi partiellement tolérants au N2O[69]
Des études cliniques ont montré qu’un humain recevant 30 % de N2O dans l’air inhalé, les antagonistes des récepteurs aux benzodiazépines (GABAA) réduisent le nombre de rapports subjectifs de sensation de « sensations fortes », sans toutefois altérer les performances psychomotrices[70].
Effets analgésiques
Ces effets semblent liés à l'interaction entre le « système opioïde endogène » et le « système noradrénergique descendant ». En effet :
- quand des animaux reçoivent de la morphine de façon chronique, ils développent une tolérance à ses effets antidouleur, et ils se montrent alors également tolérants aux effets analgésiques du N2O[71] ;
- l'administration d'anticorps qui lient et bloquent l'activité de certains opioïdes endogènes (mais non la β-endorphine) bloque également les effets antinociceptifs (antidouleur) du N2O[72] ;
- les médicaments qui inhibent la dégradation des opioïdes endogènes potentialisent également les effets antinociceptifs du N2O[72] ;
- plusieurs expériences ont montré que les médicaments antagonistes des récepteurs opioïdes appliqués directement au cerveau bloquent les effets antinociceptifs du N2O, mais que ces mêmes médicaments n’ont aucun effet s’ils sont injectés dans la moelle épinière. À l'inverse, les antagonistes des récepteurs α2-adrénergiques (adrénorécepteurs) suppriment les effets de réduction de la douleur induits par le N2O s’ils sont administrés directement dans la moelle épinière, mais pas lorsqu'ils sont appliqués directement au cerveau[73].
- les souris ou les animaux « knock-out » pour l'α2B-adrénocepteurs (ou « récepteur adrénergique alpha-2B ») ne produisant pas de noradrénaline sont rendus presque complètement résistants aux effets antinociceptifs du N2O[74].
Apparemment, la libération d'opioïdes endogènes induite par le N2O provoque la désinhibition des neurones noradrénergiques du tronc cérébral, laquelle libère de la noradrénaline dans la moelle épinière et inhibe le signal de douleur[75]. En 2019, la manière dont le N2O provoque la libération de peptides opioïdes endogènes n’est pas encore comprise. Les progrès de la neurophysiologie et de la cartographie du cerveau et de ses fonctions sensorimotrices, cognitives et langagières pourraient à l’avenir permettre de mieux comprendre ces phénomènes (pour les effets « hilarants » du N2O y compris).
Principe
Du fait de sa teneur en oxygène plus élevée que l'air, le protoxyde d'azote est parfois utilisé comme appoint ou en substitution à ce dernier dans les moteurs à combustion interne[76]. Il permet d'augmenter la charge comburant/carburant dans le cylindre, de favoriser la combustion, et ainsi d'augmenter fortement la puissance du moteur (de 30 % à 100 % environ). C'est le moteur à protoxyde d'azote.
Aviation
L'injection de protoxyde d'azote est utilisée durant la Seconde Guerre mondiale dans certains avions de combat allemands. Un dispositif, nommé « GM-1 », visait à compenser la diminution du dioxygène de l'air en altitude (gaz prélevé dans l'air, utilisé comme comburant par les moteurs à pistons), ce qui avait comme conséquence de réduire le niveau de comburant dans le moteur par rapport au carburant, et entraînait ainsi la baisse de la puissance délivrée par le moteur ainsi que l'augmentation de la consommation[77]. L'injection de protoxyde d'azote visait donc à pallier le manque de comburant dans le moteur de manière à permettre à celui-ci de fonctionner à haute altitude avec un rendement identique à celui de basse ou de moyenne altitude. Le pilote disposait ainsi d'une réserve de puissance qu'il pouvait utiliser jusqu'à l'épuisement de la bonbonne contenant le protoxyde d'azote sous forme liquide, soit une dizaine de minutes.
À l'époque, ces systèmes étaient mal maîtrisés et requéraient une grande précaution d'emploi, surtout pour les moteurs compliqués des appareils allemands. Un pilote souhaitant utiliser le GM-1 devait le faire à une altitude où l'air était déjà raréfié (à partir d'environ 6 000 m d'altitude) et devait réduire les gaz avant de relancer ceux-ci une fois le dispositif mis en route, sous peine de casser le moteur ou, pire, de faire exploser l'avion.
Compétition automobile
Plus tard, et à l'instar des autres procédés de suralimentation tels que le compresseur et le turbo, le principe de l'injection de protoxyde d'azote fut repris en compétition automobile, puis par le particulier puisque l'on trouve sur le marché des kits NOS (nitrous oxide systems) que l'on peut adapter sur à peu près n'importe quelle automobile. Bien que ces kits soient très prisés des amateurs de tuning automobile, leur installation sur des véhicules de série reste illégale dans de nombreux pays. L'utilisation en France reste autorisée du moment que la vanne de sécurité (obligatoire) de la bonbonne est verrouillée et qu'il n'en est pas fait usage lorsque le véhicule équipé circule sur une voie publique ; cependant les assurances sont en droit de refuser de prendre en charge de tels véhicules. La présence d'un kit nitro lors d'un accident provoque une augmentation significative des risques. En cas de choc, de changement de température, d'usures, de l'utilisation d'un kit de mauvaise qualité, ou du non renouvellement des connexions et changement de bouteille conformément aux normes régissant les conditions générales liées au gaz, que l'installation du kit ne soit pas faite pas un professionnel habitué à ces systèmes, il y a un risque de fuites de gaz ou d'explosion des contenants et de leur conséquence (fuite : risque d'incendie augmenté, incendie spontané (auto-ignition, réaction chimique dangereuse), brûlures par le froid, asphyxie, perte de connaissance, dégradation/dégradation des pièces mécaniques de la voiture. Dans le cas où il y aurait une rupture des bouteilles de nitro, s'ajoute au risque lié aux fuites de gaz, les risques explosion du véhicule, la déflagration/explosion étant démultipliée par rapport à une déflagration sans kit nitro. Le carburant (essence, diesel, etc.) brûle et détonne plus rapidement, la température des flammes est environ deux fois plus élevée.
Usage comme drogue dite « récréative »
Le protoxyde d'azote, légalement vendu dans les commerces de proximité — théoriquement pour des siphons à chantilly — conditionné en bonbonnes ou cartouches d'acier de forme ovale, est, depuis 2000 au moins, détourné à titre récréatif pour ses propriétés psychodysleptiques[78].
Selon Garbaz, la toxicomanie au protoxyde d’azote est restée longtemps (bien que dès le XVIIIe siècle, il avait des fêtes souvent organisées aux domiciles et par de riches bourgeois (l'obtention du gaz se faisait par réaction chimique directement sur place) dont le but principal était l'inhalation du protoxyde d'azote) rare, ne touchant d'abord que des employés du monde hospitalier ou médical, puis un nombre croissant de jeunes adultes et adolescents, voire d'enfants. En s’étendant ainsi au grand public (via la grande disponibilité de cartouches à bas prix), « elle expose à la survenue d’accidents et d’effets indésirables non connus »[79]. Ce détournement du protoxyde d'azote est avéré aux États-Unis et au Royaume-Uni depuis le début des années 1980 et en France depuis 1996/1998 (premiers cas signalés par le centre antipoison de Marseille), dans les milieux étudiant notamment[20]. Il est souvent partagé ou vendu à l'occasion de soirées techno, ou dans les free parties, les technivals, les soirées trance, etc.[80].
S'il est pris seul et épisodiquement, le protoxyde d’azote ne représente pas un risque d'addiction : le N2O fait rire (même si en réalité, bien que surnommé « gaz hilarant », il induit moins souvent le rire que les boissons alcoolisées ou le cannabis), son effet est de relativement courte durée et certaines personnes ne ressentent peu ou pas d'effets anesthésiants, ni d'effet agréable, et il n'induit généralement pas de dépendance. Ce n'est cependant pas un produit anodin. Il peut induire des lésions irréversibles ou des pathologies graves telles qu'une forme d'anémie particulière, d'atteintes neurologiques (poly-neuropathies, d'ataxies, c'est-à-dire troubles de l'équilibre, problèmes de coordination motrice), note William Lowenstein, spécialiste en médecine interne et addictologie, président de SOS Addictions[80]. Et selon les statistiques anglaises collectées par un rapport de l'université de Londres (cité par le quotidien The Independent), en six ans, de 2006 à 2012, dix-sept jeunes Britanniques sont morts après avoir consommé du gaz hilarant, dont six par asphyxie (hypoxie)[80].
Le protoxyde d'azote semble faire l'objet de modes ; en France, un premier pic de consommation est apparu vers l'an 2000[80] et un regain constaté en 2017-2018, notamment dans les régions proches du Royaume-Uni[81]. Il est le plus souvent inhalé par la bouche via des ballons gonflables de caoutchouc ou des préservatifs gonflés de gaz (vendus à l'unité), selon un rapport français de 2007 commandé par la direction générale de la Santé[82]. Le conditionnement en ballons permet d'éviter des gelures et des embolies pulmonaires ou cérébrales causées par le froid dues à la détente du gaz s'il est « directement aspiré à la cartouche », tels une bombe de gaz dépoussiérant ou un siphon à chantilly, note Drogues info service, qui ajoute que « les effets fugaces du protoxyde d'azote incitent parfois l'usager à des inhalations répétées pouvant conduire à la mort par asphyxie »[80].
« Contrairement aux autres drogues, il n’y a pas de dépendance au protoxyde d’azote », indique Drogues info service.
Les cas de dépendance sont exceptionnels. Les personnes atteintes d'une réelle dépendance (au sens pharmacologique) au protoxyde d'azote, présentent souvent initialement une maladie qui n'est pas soulagée par les traitements habituels et dans ces situations le N2O présente davantage de bénéfices que de risques (cancer en phase terminale chez l'enfant, lésions et ulcérations chroniques chez des patients âgés ou chez des personnes victimes du HIV ou encore, lors de syndromes douloureux chroniques).
Dans de rares cas où la dépendance débute à la suite de la consommation dite « récréative », les consommateurs se retrouvent rapidement dans une situation d'isolement social qui s'accompagne bien souvent de difficultés économiques, sources de malnutrition (carences).
« Même si cela peut faire peur, il faut relativiser. Le gaz hilarant n’est qu’une petite mode, chez les jeunes, dans une recherche d’ivresse qui est intemporelle », selon William Lowenstein.
En France
En 2011, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) a mis en garde contre l'usage récréatif des substances volatiles en général et du protoxyde d'azote notamment (5,5 % d'entre eux disaient l'avoir déjà expérimenté en 2011)[80].
En 2014, Drogues info service avait reçu très peu de demandes d'aide ou d'information (quinze demandes sur 44 000 appels)[80].
À la suite d'une forte recrudescence en 2017, 2018 et 2019 dans le Nord[83] - [84], puis en Île-de-France[85] et au reste du territoire[86] - [87], une proposition de loi[88] tendant à protéger les mineurs des usages dangereux du protoxyde d'azote est adoptée à l'unanimité le 11 décembre 2019 au Sénat[89]. La mesure phare est l’interdiction de la vente aux mineurs, y compris sur les sites de commerce en ligne. Le texte propose aussi de pénaliser l’incitation d’un mineur à faire un usage détourné d’un produit de consommation courante pour en obtenir des effets psychoactifs. Il prévoit encore d’accompagner la politique de prévention menée à l’école. Le texte devrait être soumis à l’Assemblée nationale en 2020.
Par le biais d'un arrêté, la commune de Toulouse interdit, le , l'usage récréatif des gaz hilarants sur le domaine public et la vente aux mineurs[90].
Nuisances et dégâts occasionnés aux incinérateurs municipaux

Les cartouches de N2O abandonnées dans la nature et dans les rues constituent une source de nuisances et de pollution non négligeable. En Belgique, rien qu'en trois semaines au mois de janvier 2023, Bruxelles propreté en a récolté plus de deux tonnes le long des voiries régionales auxquelles il convient également d'ajouter les collectes communales et celles des déchets ménagers habituels[91]. On les trouvent surtout aux abords des bars et des dancings.
Les cartouches de grande capacité non complètement vidées, si elles sont collectées et incinérées, donnent lieu à de violentes explosions endommageant sérieusement les fours des incinérateurs de déchets ménagers[92]. Les barreaux des grilles des fours se brisent et les cendres s'agglomèrent dans l'espace de réception situé en dessous des grilles, ce qui bouche les systèmes d'évacuation des cendres (cendres de plancher (en))[93] - [94]. C'est ainsi que de nombreux incinérateurs doivent fréquemment mettre à l'arrêt certains de leurs fours afin de pouvoir réparer les dégâts souvent considérables. Les agences responsables de la propreté publique et du traitement des déchets ménagers sont obligées de trier attentivement les poubelles situées sur la voie publique afin de protéger les fours des incinérateurs et de limiter leur indisponibilité liée au temps nécessaire à la réparation des dégâts causés par ces explosions. Le problème affecte également de nombreuses municipalités en France[93] - [94].
Autres usages
Le protoxyde d'azote est utilisé comme gaz propulseur, notamment dans les bonbonnes de crème chantilly. Il est également utilisé dans les bombes d'air sec pour l'électronique et les ordinateurs. Son code européen est le E942[95].
Dissous dans l'eau, le protoxyde d'azote a un goût sucré[96].
Il a été utilisé pour la conservation de la viande.
Toxicologie
Les effets d'une exposition chronique à de faibles doses sont mal connus, mais ont été étudiés pour certains métiers exposés (anesthésistes en salles de chirurgie, par exemple[97]).
À forte dose, il provoque des effets neurologiques (polynévrite avec spasticité) et une anémie macrocytaire, avec réduction du taux de vitamine B12 circulante. Smith, dans une revue des risques sanitaires chez le personnel hospitalier, rappelle qu'il s'agit d'un poison mitotique, qui a été rendu responsable de tumeurs du système lymphoïde et du système réticulo-endothélial chez le personnel intervenant en salle d'opération (avec échanges entre chromatides sœurs selon Saras et al. 1992, Eroglu et al.) chez lequel on a décrit diverses atteintes cytogénétiques (problèmes également posés par l'exposition à d'autres anesthésiques).
Le protoxyde d'azote à haute concentration peut tuer par asphyxie (due à un manque d'oxygène) ; le mélange anesthésique contient toujours au moins 21 % d'oxygène (soit la proportion d'oxygène de l'air ambiant, et jusqu'à 50 % dans le cas du MEOPA).
L'usage détourné et prolongé de protoxyde d'azote présente, outre des risques d'asphyxie, des risques de complications médicales pour le nouveau-né en cas d'usage durant une grossesse[98].
Effets et conséquences, toxicité
Les effets de court terme sont rapides et fugaces. Ils commencent de quinze à trente secondes après l'absorption et se terminent au bout de deux à trois minutes.
À forte dose, le protoxyde d'azote devient narcotique avec, comme effets possibles :
- euphorie, sensation de bien-être et fous rires ;
- désinhibition ;
- effet de flottement ;
- distorsions visuelles et auditives ;
- sensation d'alourdissement des membres ;
- modification de la voix, qui devient très grave (effet inverse de l'hélium) ;
- pertes de mémoire ;
- spasmes ;
- hypersalivation.
Effets de doses importantes à court terme
- nausées, vomissements
- hypoxie
- vertiges
- risques de brûlures irréversibles causées par le froid si le gaz est inhalé ou mis en bouche au moment de sa décompression et de sa détente adiabatique
- hallucinations[99]
Effets de doses importantes ou répétées à long terme
Les effets toxiques ou indésirables connus à long terme d'une exposition répétée au protoxyde d’azote sont de plusieurs ordres : hématologiques, neurologiques (cf. démyélinisation), psychiatriques et tératogènes[79].
Les professionnels ne sont pas les seuls concernés. Un usage récréatif intense et/ou régulier du protoxyde d'azote peut provoquer des symptômes et maladies que les médecins ne sont pas accoutumés à suspecter ou diagnostiquer :
- une carence en vitamine B12 (cobalamine)[100] car le N2O oxyde les ions cobalt de cet oligoélément essentiel[101] - [102] ;
- une réduction du taux de vitamine B12 circulante[103] par inhibition de la méthionine synthase hépatique[104], entraînant chez les gros consommateurs de N2O des neuropathies (troubles neurologiques) telles que des tremblements ou des difficultés à coordonner ses mouvements ;
- des complications neurologiques sont possibles et méconnues (même des médecins[102]), dont atteintes de la moelle osseuse et de la moelle épinière se traduisant par une faiblesse symétrique et progressive des membres inférieurs, des troubles de l’équilibre et une difficulté croissante à marcher, soulignée par plusieurs études récentes[105] - [106] - [107] - [108] - [109] chez des personnes habitués à inhaler de fortes doses de N2O. C'est le déficit en vitamine B12 qui entraîne la neurotoxicité du N2O à forte dose ou en cas d'usage récréatif chronique[110] : une démyélinisation des fibres nerveuses, ce qui finit par interrompre la transmission nerveuse (en l'absence de B12, le recyclage de l’homocystéine en méthionine est interrompu, empêchant la méthylation des protéines de la gaine de myéline, ce qui entraine une démyélinisation)[1]. Une sclérose de la moelle se combine à une atteinte dégénérative de la moelle épinière (visibles sur l'imagerie par résonance magnétique (IRM), où une coupe sagittale montre comme conséquence d'une dégénérescence subaiguë de la moelle un hypersignal en séquence pondérée T2 localisé préférentiellement au niveau des cordons postérieurs de la moelle cervicale ou dorsale[1]). Cette démyélinisation dégrade la sensibilité profonde[1]. En , à Londres des urgentistes et neurologues de divers hôpitaux ont rapporté dix cas de « sclérose combinée de la moelle » (SCM) chez des jeunes de 17 à 26 ans dont la plupart ne consommaient pas d’autres drogues (et pas d'alcool)[1] - [111]. La concentration sanguine en vitamine B12 peut être normale, mais la vitamine non fonctionnelle. Une augmentation anormale du taux d'acide méthylmalonique (AMM) et d’homocystéine peuvent alors orienter le diagnostic[1] ;
- la supplémentation rapide en vitamine B12 inverse la dégénérescence, mais la récupération neurologique peut être incomplète, surtout si la personne continue à inhaler du N2O[112] ;
- un pneumothorax. Les cas liés au protoxyde d'azote ont d'abord été décrits en tant qu'accidents d’anesthésie ou de cœlioscopie (diffusion du N2O dans la cavité péritonéale, puis vers la cavité pleurale)[79]. L'inhalation de N2O peut révéler un pneumothorax asymptomatique et l'aggraver (« Les conséquences peuvent être dramatiques lors de son utilisation frauduleuse en milieu extra-hospitalier par méconnaissance de ses effets secondaires ») ;
- une anémie, dite mégaloblastique, car associée à des globules rouges anormalement grands[1] ;
- une dépendance psychologique.
Notes et références
- Marc Gozlan, « Le protoxyde d’azote, un gaz hilarant qui ne fait pas du tout rire les médecins », Réalités biomédicales, 28 décembre 2018, Le Monde (consulté le 8 juillet 2019).
- OXYDE NITREUX, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- Fiche renseignement, Gas Encyclopedia, Air liquide.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- (en) « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- « Oxyde nitreux » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- Clément Gérome, Agnès Cadet-Taïrou, Michel Gandilhon, Maitena Milhet, Magali Martinez et Thomas Néfau, « Substances psychoactives, usagers et marchés : les tendances récentes (2017-2018) », Tendances, OFDT, Observatoire français des drogues et des toxicomanies, no 129, (lire en ligne).
- Lose S, CedrAgir/TREND, Tendances récentes et nouvelles drogues, décembre 2018 (OFDT, Observatoire français des drogues et des toxicomanies)
- Futura, « Définition | Spectrométrie d'absorption - SAA | Futura Sciences », sur Futura (consulté le ).
- Randeniya, L. K., Vohralik, P. F. et Plumb, I. C. (2002), Stratospheric ozone depletion at northern mid latitudes in the 21st century: The importance of future concentrations of greenhouse gases nitrous oxide and methane. Geophysical research letters, 29(4).
- (en) David R. Kanter, Claudia Wagner-Riddle, Peter M. Groffman et Eric A. Davidson, « Improving the social cost of nitrous oxide », Nature Climate Change, vol. 11, no 12, , p. 1008–1010 (ISSN 1758-678X et 1758-6798, DOI 10.1038/s41558-021-01226-z, lire en ligne, consulté le ).
- (en) Cotton F. A. et Wilkinson G. (1972), Advanced Inorganic Chemistry, a comprehensive text, 3e éd., Interscience Publishers, John Wiley & Sons, p. 355.
- Denis Richard, Jean-Louis Senon et Marc Valleur, Dictionnaire des drogues et des dépendances, Paris, Larousse, , 626 p. (ISBN 2-03-505431-1).
- Dr Daniel Annequin, « Un an après la sortie du MEOPA de la réserve hospitalière. État des lieux » [PDF], Unité fonctionnelle de lutte contre la douleur, hôpital d’enfants Armand-Trousseau de Paris, Centre national de ressources de lutte contre la douleur (consulté le 28 octobre 2018).
- « Annexe 1 : Rectificatif d’AMM en date du » [PDF], Centre national de ressources de lutte contre la douleur.
- « Annexe 3 : Recommandations AFSSAPS concernant le MEOPA () » [PDF], Centre national de ressources de lutte contre la douleur.
- Groupe présidé par le Dr Annequin, avec le Pr Corinne Lejus, les Dr Barbara Tourniaire, Elisabeth Fournier Charrière, Nada Sabourdin qui ont coordonné les sous-groupes de travail ; le Dr Nathalie Dumarcet de l'Afssaps assurant la coordination générale. L’Association Pediadol (pediadol.org) a contribué à la facilitation logistique de ces recommandations.
- « http://www.afssaps.fr/var/afssaps_site/storage/original/application/7b8bf3b0175d7c1ef72e65079ac4e56 e.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur afssaps.fr.
- Caroline Victorri-Vigneau (2017), Pharmacologie clinique – Pratiques d’utilisation du MEOPA dans un CHU : quelle conformité ? (MEOPA use practices in a university hospital: Which conformity?), Therapies, vol. 72, no 6, décembre 2017, p. 659-663, DOI 10.1016/j.therap.2017.04.003.
- « Montée en flèche des concentrations de gaz à effet de serre : nouveau record », sur OMMM, (consulté le ).
- (en) Ravishankara A.R, Daniel J.S et Portmann R.W (2009), Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century [PDF], Science, 326(5949), 123-125.
- G. Tallec, Émissions d’oxyde nitreux lors du traitement de l’azote en station d’épuration (thèse de doctorat), Marne-la-Vallée, ENPC, , agglomération parisienne.
- (en) P.J. Crutzen et D.H. Ehhalt, « Effects of nitrogen fertilizers and combustion on the stratospheric ozone layer », Ambio, , p. 112-117.
- (en) Roberto André Grave, Rodrigo da Silveira Nicoloso, Paulo Cezar Cassol, Marcio Luis Busi da Silva, Melissa Paola Mezzari, Celso Aita et Camila Rosan Wuaden, « Determining the effects of tillage and nitrogen sources on soil N2O emission », Soil and Tillage Research, no 175, (DOI 10.1016/j.still.2017.08.011, lire en ligne).
- (en) S. Perkins, « Leafcutter ant ‘compost piles’ produce potent greenhouse gases », .
- (en) R. L. Thompson, L. Lassaletta, P. K. Patra et C. Wilson, « Acceleration of global N 2 O emissions seen from two decades of atmospheric inversion », Nature Climate Change, vol. 9, no 12, , p. 993–998 (ISSN 1758-6798, DOI 10.1038/s41558-019-0613-7, lire en ligne, consulté le ).
- « La tendance à la hausse se poursuit : les concentrations de gaz à effet de serre dans l’atmosphère ont atteint de nouveaux sommets en 2018 », sur Organisation météorologique mondiale, (consulté le ).
- (en) V. N. Parmon, G. I. Panov, A. Uriarte et A. S. Noskov, « Nitrous oxide in oxidation chemistry and catalysis application and production », Elsevier, vol. 100, , p. 115-131 (DOI 10.1016/j.cattod.2004.12.012).
- « Overview of Greenhouse Gases – Nitrous Oxide », US EPA (consulté le ), Page 164 (document header listing).
- « Protoxyde d'azote - N2O », sur citepa.org, (consulté le ).
- « Le protoxyde d’azote, un gaz à effet de serre qui ne fait rire personne », sur inra.fr, (consulté le ).
- (en) Kanter D., Mauzerall D.L., Ravishankara A.R., Daniel J.S., Portmann R.W., Grabiel P.M., … et Galloway J.N. (2012), A post-Kyoto partner: considering the stratospheric ozone regime as a tool to manage nitrous oxide [PDF], Proceedings of the National Academy of Sciences, 201222231
- Appendix 8.A [PDF], Intergovernmental Panel on Climate Change Fifth Assessment Report, p. 731.
- Agence européenne de l'environnement et AGAGE, Trends in atmospheric concentrations of CO2, CH4 and N2O, 20 mars 2019 (consulté le 7 juillet 2019).
- Ravishankara A.R., Daniel J.S. et Portmann R.W. (2009), Nitrous Oxide (N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century, Science, 326 (5949): 123–5, Bibcode : 2009Sci…326..123R, DOI 10.1126/science.1176985, .
- Data, l'Agence européenne de l'environnement (consulté le 25 mai 2019)
- (en) Direct Global Warming Potentials p. 212
- Wuebbles D.J. (2009), Nitrous oxide: no laughing matter, Science, 326, 5949, p. 56-57.
- (en) Portmann R.W, Daniel J.S. et Ravishankara A.R. (2012), Stratospheric ozone depletion due to nitrous oxide: influences of other gases, Phil. Trans. R. Soc. B, 367 (1593), 1256-1264.
- (en) Menon S., Denman K.L., Brasseur G., Chidthaisong A., Ciais P., Cox P. M., … et Jacob D. (2007), Couplings between changes in the climate system and biogeochemistry (no LBNL-464E), Lawrence Berkeley National Lab. (LBNL), Berkeley, CA (États-Unis)
- (en) Crutzen P.J. (1970), The influence of nitrogen oxides on the atmospheric ozone content [PDF], Quarterly Journal of the Royal Meteorological Society, 96(408), 320-325.
- Chapuis, C., Guerquin, L. et Albaladejo, P. (2016), Les médicaments utilisés en anesthésie sont-ils vraiment des polluants majeurs ?, Le Praticien en anesthésie réanimation, 20(4), 184-187
- WHO Model List of Essential Medicines, 18th list, avril 2013.
- Yamakura T. et Harris R.A., « Effects of gaseous anaesthetics nitrous oxide and xenon on ligand-gated ion channels. Comparison with isoflurane and ethanol », Anesthesiology, vol. 93, no 4, , p. 1095–101 (PMID 11020766, DOI 10.1097/00000542-200010000-00034).
- Mennerick S., Jevtovic-Todorovic V., Todorovic S.M., Shen W., Olney J.W. et Zorumski C.F., « Effect of nitrous oxide on excitatory and inhibitory synaptic transmission in hippocampal cultures », Journal of Neuroscience, vol. 18, no 23, , p. 9716–26 (PMID 9822732, DOI 10.1523/JNEUROSCI.18-23-09716.1998).
- Gruss M., Bushell T.J., Bright D.P., Lieb W.R., Mathie A. et Franks N.P., « Two-pore-domain K+ channels are a novel target for the anesthetic gases xenon, nitrous oxide, and cyclopropane », Molecular Pharmacology, vol. 65, no 2, , p. 443–52 (PMID 14742687, DOI 10.1124/mol.65.2.443).
- Emmanouil D.E. et Quock R.M., « Advances in Understanding the Actions of Nitrous Oxide », Anesthesia Progress, vol. 54, no 1, , p. 9–18 (PMID 17352529, PMCID 1821130, DOI 10.2344/0003-3006(2007)54[9:AIUTAO]2.0.CO;2).
- Roland M. Atkinson, J. DeWayne Green, Dennis E. Chenoweth et Judith Holmes Atkinson, « Subjective Effects of Nitrous Oxide: Cognitive, Emotional, Perceptual and Transcendental Experiences », Journal of Psychedelic Drugs, vol. 11, no 4, , p. 317–330 (DOI 10.1080/02791072.1979.10471415).
- Diana J. Walker et James P. Zacny, « Within- and between-subject variability in the reinforcing and subjective effects of nitrous oxide in healthy volunteers », Drug and Alcohol Dependence, vol. 64, no 1, , p. 85–96 (PMID 11470344, DOI 10.1016/s0376-8716(00)00234-9).
- Jay M., « Nitrous oxide: recreational use, regulation and harm reduction », Drugs and Alcohol Today, vol. 8, no 3, , p. 22–25 (DOI 10.1108/17459265200800022).
- S. Sakamoto, S. Nakao, M. Masuzawa, Takefumi Inada, Mervyn Maze, Nicholas P. Franks et Koh Shingu, « The differential effects of nitrous oxide and xenon on extracellular dopamine levels in the rat nucleus accumbens: a microdialysis study », Anesthesia and Analgesia, vol. 103, no 6, , p. 1459–63 (PMID 17122223, DOI 10.1213/01.ane.0000247792.03959.f1, CiteSeerx 10.1.1.317.6613).
- Benturquia N., Le Marec T., Scherrmann J.M. et Noble F., « Effects of nitrous oxide on dopamine release in the rat nucleus accumbens and expectation of reward », Neuroscience, vol. 155, no 2, , p. 341–4 (PMID 18571333, DOI 10.1016/j.neuroscience.2008.05.015).
- Lichtigfeld F.J. et Gillman M.A., « Role of dopamine mesolimbic system in opioid action of psychotropic analgesic nitrous oxide in alcohol and drug withdrawal », Clinical Neuropharmacology, vol. 19, no 3, , p. 246–51 (PMID 8726543, DOI 10.1097/00002826-199619030-00006).
- Koyanagi S., Himukashi S., Mukaida K., Shichino T. et Fukuda K., « Dopamine D2-like receptor in the nucleus accumbens is involved in the antinociceptive effect of nitrous oxide », Anesthesia and Analgesia, vol. 106, no 6, , p. 1904–9 (PMID 18499630, DOI 10.1213/ane.0b013e318172b15b, CiteSeerx 10.1.1.327.9838).
- David H.N., Ansseau M., Lemaire M. et Abraini J.H., « Nitrous oxide and xenon prevent amphetamine-induced carrier-mediated dopamine release in a memantine-like fashion and protect against behavioral sensitization », Biological Psychiatry, vol. 60, no 1, , p. 49–57 (PMID 16427030, DOI 10.1016/j.biopsych.2005.10.007).
- N. Benturquia, S. Le Guen, C. Canestrelli, V. Lagente, G. Apiou, B.P. Roques et F. Noble, « Specific blockade of morphine- and cocaine-induced reinforcing effects in conditioned place preference by nitrous oxide in mice », Neuroscience, vol. 149, no 3, , p. 477–86 (PMID 17905521, DOI 10.1016/j.neuroscience.2007.08.003, lire en ligne).
- Ramsay D.S., Watson C.H., Leroux B.G., Prall C.W. et Kaiyala K.J., « Conditioned place aversion and self-administration of nitrous oxide in rats », Pharmacology Biochemistry and Behavior, vol. 74, no 3, , p. 623–33 (PMID 12543228, DOI 10.1016/S0091-3057(02)01048-1).
- Wood R.W., Grubman J. et Weiss B., « Nitrous oxide self-administration by the squirrel monkey », The Journal of Pharmacology and Experimental Therapeutics, vol. 202, no 3, , p. 491–9 (PMID 408480).
- Zacny J.P. et Galinkin J.L., « Psychotropic drugs used in anesthesia practice: abuse liability and epidemiology of abuse », Anesthesiology, vol. 90, no 1, , p. 269–88 (PMID 9915336, DOI 10.1097/00000542-199901000-00033).
- Dohrn C.S., Lichtor J.L., Coalson D.W., Uitvlugt A., de Wit H. et Zacny J.P., « Reinforcing effects of extended inhalation of nitrous oxide in humans », Drug and Alcohol Dependence, vol. 31, no 3, , p. 265–80 (PMID 8462415, DOI 10.1016/0376-8716(93)90009-F).
- Walker D.J. et Zacny J.P., « Within- and between-subject variability in the reinforcing and subjective effects of nitrous oxide in healthy volunteers », Drug and Alcohol Dependence, vol. 64, no 1, , p. 85–96 (PMID 11470344, DOI 10.1016/S0376-8716(00)00234-9).
- Emmanouil DE, Johnson CH, Quock RM, « Nitrous oxide anxiolytic effect in mice in the elevated plus maze: mediation by benzodiazepine receptors », Psychopharmacology, vol. 115, nos 1–2, , p. 167–72 (PMID 7862891, DOI 10.1007/BF02244768).
- Zacny JP, Yajnik S, Coalson D, Lichtor JL, Apfelbaum JL, Rupani G, Young C, Thapar P, Klafta J, « Flumazenil may attenuate some subjective effects of nitrous oxide in humans: a preliminary report », Pharmacology Biochemistry and Behavior, vol. 51, no 4, , p. 815–9 (PMID 7675863, DOI 10.1016/0091-3057(95)00039-Y).
- Berkowitz BA, Finck AD, Hynes MD, Ngai SH, « Tolerance to nitrous oxide analgesia in rats and mice », Anesthesiology, vol. 51, no 4, , p. 309–12 (PMID 484891, DOI 10.1097/00000542-197910000-00006).
- Branda EM, Ramza JT, Cahill FJ, Tseng LF, Quock RM, « Role of brain dynorphin in nitrous oxide antinociception in mice », Pharmacology Biochemistry and Behavior, vol. 65, no 2, , p. 217–21 (PMID 10672972, DOI 10.1016/S0091-3057(99)00202-6).
- Guo TZ, Davies MF, Kingery WS, Patterson AJ, Limbird LE, Maze M, « Nitrous oxide produces antinociceptive response via alpha2B and/or alpha2C adrenoceptor subtypes in mice », Anesthesiology, vol. 90, no 2, , p. 470–6 (PMID 9952154, DOI 10.1097/00000542-199902000-00022).
- Sawamura S, Kingery WS, Davies MF, Agashe GS, Clark JD, Koblika BK, Hashimoto T et Maze M, « Antinociceptive action of nitrous oxide is mediated by stimulation of noradrenergic neurons in the brainstem and activation of [alpha]2B adrenoceptors », J. Neurosci., vol. 20, no 24, , p. 9242–51 (PMID 11125002, DOI 10.1523/JNEUROSCI.20-24-09242.2000).
- Maze M. et Fujinaga M., « Recent advances in understanding the actions and toxicity of nitrous oxide », Anaesthesia, vol. 55, no 4, , p. 311–4 (PMID 10781114, DOI 10.1046/j.1365-2044.2000.01463.x).
- « Le protoxyde d'azote (Nitrous oxyde) », sur Mecamotors.
- « Fuels & Fluids Used By Germany: GM-1 », sur Luftwaffe Ressource Center.
- Claire BOUTRON, Monique MATHIEU-NOLF, Nicolas PETY, Marc DEVEAUX, « Utilisations détournées du protoxyde d'azote », Annales de Toxicologie Analytique, vol. XII, no 3, (lire en ligne)
- Garbaz L, Mispelaere D, Boutemy M et Jounieaux V., Pneumothorax et inhalation volontaire de protoxyde d’azote, Rev. Mal. Respir., mai 2007, 24(5):622-4.
- Lise Loumé (2015), « Un Britannique de 18 ans meurt après avoir inhalé du gaz hilarant », Science et Avenir, 29 juillet 2015.
- Valentine Leroy, « Drogues récréatives : le protoxyde d’azote ne fait plus rire », sur illicit-trade.com, 22 octobre 2019.
- Luc de Haro, Jocelyne Arditti et Catherine Messina-Gourlot, Comité de coordination de toxicovigilance, Déviation d’utilisation du protoxyde d’azote (rapport), direction générale de la Santé, , 12 p. (lire en ligne [PDF]).
- Agathe Peplinski, « «Gaz hilarant»: plusieurs villes s’inquiètent face au protoxyde d’azote », Le Figaro, (lire en ligne).
- Cécile Bidault, « « Gaz hilarant » : les cas graves liés à la consommation de protoxyde d'azote se multiplient dans le Nord », France Bleu Nord, (lire en ligne).
- « Drogue : le gaz hilarant fait des ravages », L'Express, (lire en ligne).
- Sarah Finger, « Montpellier : le succès stupéfiant du gaz hilarant », Libération, (lire en ligne).
- Elsa Mari, « Alerte au protoxyde d’azote, drogue du fou rire », Le Parisien, (lire en ligne).
- Senat, « Usages dangereux du protoxyde d'azote ».
- « « Gaz hilarant » : les sénateurs votent l’interdiction de la vente aux mineurs », Ouest France, (lire en ligne).
- « Il rend les gens marteaux et pollue, Toulouse interdit le « gaz hilarant » », sur 20minutes.fr (consulté le ).
- Belga, « Près de 2 tonnes de cartouches de protoxyde d’azote collectées par Bruxelles Propreté en 3 semaines », sur lavenir.net, (consulté le )
- Belga, « Les cartouches et bouteilles de protoxyde d'azote endommagent les incinérateurs », sur RTBF, (consulté le )
- ARIA, « Explosion dans le four d'un incinérateur de déchets non dangereux », sur ARIA, la référence du retour d'expérience sur accidents technologiques, (consulté le )
- BFM Business, « Quand le gaz hilarant explose dans les usines d’incinération de déchets », sur BFM Business, (consulté le )
- Parlement européen et Conseil de l'Europe, « La directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », Journal officiel, no L 61, (résumé, lire en ligne).
- Cutayar J et Pean J.L (2007), Utilisation du protoxyde d'azote (N2O) ou d'un mélange de gaz comportant du protoxyde d'azote comme agent édulcorant de produits agroalimentaires, World Patent WO/2007/090939
- Robert R. Lauwerys, Vincent Haufroid et Perrine Hoet, Toxicologie industrielle et intoxications professionnelles (extrait)
- Protoxyde d'azote, brochure éditée et distribuée par l'Association Spiritek en partenariat avec les villes de Lille et de Tourcoing, la communauté urbaine Lille-Métropole et le conseil général du département Nord.
- « Le protoxyde d’azote, un gaz hilarant qui ne fait pas du tout rire les médecins », sur lemonde.fr, 28 décembre 2018 (consulté le 25 avril 2019)
- (en) Michel Hautefeuille et Dan Véléa, Les drogues de synthèse, Presses universitaires de France, coll. « Que sais-je ? » (no 3625), , 127 p. (ISBN 978-2-13-052059-7, OCLC 300468465).
- Jordan J.T., Weiser J. et Van Ness P.C., Unrecognized cobalamin deficiency, nitrous oxide, and reversible subacute combined degeneration, Neurol. Clin. Pract., août 2014, 4(4):358-361, DOI 10.1212/CPJ.000000000000001.
- Chaugny C., Simon J., Collin-Masson H., De Beauchêne M., Cabral D., Fagniez O. et Veyssier-Belot C., Carence en vitamine B12 par toxicité du protoxyde d’azote : une cause méconnue de sclérose combinée de la moelle, Rev. Med. Interne, mai 2014, 35(5):328-32, DOI 10.1016/j.revmed.2013.04.018.
- (en) Michael A. Miller, Vicky Martinez, Richard McCarthy et Manish M. Patel, « Nitrous oxide whippit abuse presenting as clinical B12 deficiency and ataxia », American Journal of Emergency Medicine, vol. 22, no 2, mars 2004 (lire en ligne).
- Deacon R., Lumb M., Perry J. et al., Inactivation of methionine synthase by nitrous oxide, Eur. J. Biochem, 1980, 104:419–423
- Kwon YJ, Rho JH, Hwang J et Baek SH, Unhappy End of « Happy Balloons »: Subacute Combined Degeneration Caused by Nitrous Oxide Gas, J. Clin. Neurol., 26 octobre 2018.
- Egan W, Steinberg E et Rose J, Vitamin B12 deficiency-induced neuropathy secondary to prolonged recreational use of nitrous oxide, Am. J. Emerg. Med., septembre 2018, 36(9):1717.e1-1717.e2, DOI 10.1016/j.ajem.2018.05.029 (résumé)
- Antonucci MU, Subacute Combined Degeneration from Recreational Nitrous Oxide Inhalation, J. Emerg. Med., mai 2018, 54(5):e105-e107, DOI 10.1016/j.jemermed.2018.01.045.
- Keddie S, Adams A, Kelso ARC, Turner B, Schmierer K, Gnanapavan S, Malaspina A, Giovannoni G, Basnett I et Noyce AJ, No laughing matter: subacute degeneration of the spinal cord due to nitrous oxide inhalation, J. Neurol., mai 2018, 265(5):1089-1095, DOI 10.1007/s00415-018-8801-3.
- Buizert A, Sharma R et Koppen H, When the Laughing Stops: Subacute Combined Spinal Cord Degeneration Caused by Laughing Gas Use, J. Addict. Med., mai-juin 2017, 11(3):235-236, DOI 10.1097/ADM.0000000000000295 (résumé)
- Johnson K, Mikhail P, Kim MG, Bosco A et Huynh W, Recreational nitrous oxide-associated neurotoxicity, J. Neurol. Neurosurg. Psychiatry, août 2018, 89(8):897-898, DOI 10.1136/jnnp-2017-317768 (résumé)
- Chaugny, C., Simon, J., Collin-Masson, H., De Beauchêne, M., Cabral, D., Fagniez, O. et Veyssier-Belot, C. (2014), Carence en vitamine B12 par toxicité du protoxyde d’azote: une cause méconnue de sclérose combinée de la moelle. La Revue de Médecine Interne, 35(5), 328-332.
- Morris N, Lynch K et Greenberg SA (2015), Severe motor neuropathy or neuronopathy due to nitrous oxide toxicity after correction of vitamin B12 deficiency, Muscle Nerve, avril, 51(4):614-6, DOI 10.1002/mus.24482.
Voir aussi
Bibliographie
- Saito, R., Patra, P.K., Deutscher, N., Wunch, D., Ishijima, K., Sherlock, V., Blumenstock, T., Dohe, S., Griffith, D., Hase, F., Heikkinen, P., Kyrö, E., Macatangay, R., Mendonca, J., Messerschmidt, J., Morino, I., Notholt, J., Rettinger, M., Strong, K., Sussmann, R. et Warneke, T. (2012), Technical Note: Latitude-time variations of atmospheric column-average dry air mole fractions of CO2, CH4 and N2O, Atmos. Chem. Phys., 12, 7767-7777, DOI 10.5194/acp-12-7767-2012.
- Schilt A. et al. (2010), Atmospheric nitrous oxide during the last 140,000 years, Earth Planet. Sci. Lett., 300, 33–43.
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) Medical Subject Headings
- (en) National Drug File
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Fiche renseignement, Gas Encyclopedia, Air liquide.
- Fiche internationale de sécurité du protoxyde d'azote [PDF] sur le site de l'INRS.
- Fiche protoxyde d'azote sur le site de l'Ademe.
- Fiche protoxyde d'azote sur le site de l'INRA.
- (en) Nitrous Oxide [PDF] sur NIOSH Resources.
- Fiche protoxyde d'azote sur le site de Drogues info service.