Cotylorhynchus
Cotylorhynchus est un genre éteint de synapsides Caseidae herbivore ayant vécu à la fin du Permien inférieur (Kungurien) et possiblement au début du Permien moyen (Roadien) dans ce qui est aujourd’hui le Texas et l’Oklahoma aux États-Unis. Le grand nombre de spécimens découverts fait de lui le caséidé le mieux connu. Comme tous les grands caséidés herbivores, Cotylorhynchus avait un museau court incliné vers l’avant et pourvu de très grandes narines externes. La tête était très petite comparée à la taille du corps. Ce dernier était massif, en forme de tonneau, et terminé par une queue allongée. Les membres étaient courts et robustes. Les mains et les pieds avaient des doigts courts et larges aux griffes puissantes. Le corps en forme de tonneau devait abriter des intestins volumineux suggérant que l’animal devait se nourrir d’une grande quantité de végétaux à faible valeur nutritive. Un mode de vie semi-aquatique chez Cotylorhynchus et d’autres grands caséidés a été proposé par divers auteurs sur la base de la structure spongieuse (ostéoporotique) de son squelette postcrânien. Une théorie contestée par d’autres chercheurs à partir de données paléontologiques et taphonomiques combinées à l’absence chez cet animal d’adaptations morphologiques à un mode vie aquatique. Le genre Cotylorhynchus est représenté par trois espèces dont la plus grande pouvait atteindre 6 m de longueur. Cependant, une étude publiée en 2022 suggère que le genre pourrait être paraphylétique, deux des trois espèces appartenant peut-être à un ou des genres distincts.

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Synapsida |
| Clade | † Caseasauria |
| Famille | † Caseidae |
Espèces de rang inférieur
Étymologie
Le nom de genre Cotylorhynchus vient du Grec kotyle, coupe, creux, et de rhynchos, bec, ou museau. Le genre a été nommé ainsi en raison de l'ouverture nasale qui est entourée d'une surface osseuse déprimée en forme de coupe[1].
Description
_2.jpg.webp)
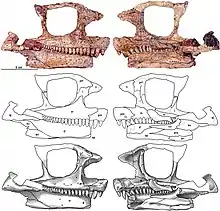
Le crâne de Cotylorhynchus montre la morphologie typique des caséidés avec un museau incliné vers l’avant, de très grandes narines externes, un toit crânien orné de nombreuses petites dépressions, et un très grand foramen pinéal. Ce dernier est plus large que long comme chez Ennatosaurus et diffère ainsi de celui d’Euromycter qui est subcirculaire[2]. Le nombre de dents des mâchoires supérieure et inférieure varie de 16 à 20. Sur la mâchoire supérieure, les dents antérieures sont longues et minces alors que celles qui suive décroient en taille postérieurement et sont légèrement spatulées. Toutes les dents marginales ont leur extrémité distale légèrement incliné vers l’intérieur de la bouche et leur couronne portent chacune trois petites cuspides disposées longitudinalement. Ces dents montrent également un élargissement de la partie centrale de la couronne[3]. Sur la mâchoire inférieure, les dents antérieures, possiblement non denticulées d’après Olson, sont plus courtes et sont légèrement inclinées vers l’avant. Les dents suivantes sont similaires à celles de la mâchoire supérieure.
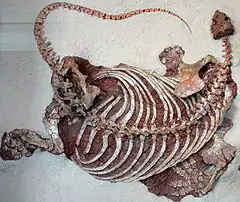
Le squelette postcranien est massif. Les côtes sont très longues, lourdes et incurvées pour former un corps bulbeux. Les côtes sont présentes sur toutes les vertèbres pré-sacrées et les premières vertèbres caudales. Les cinq côtes présacrées postérieures sont fusionnées aux apophyses transverses des vertèbres. Le sacrum contient trois vertèbres. Les épines neurales des vertèbres des plus gros spécimens deviennent proportionnellement plus hautes, en particulier dans la région pelvienne. Les membres sont courts et robustes. Le fémur est caractérisé par son extrémité proximale ayant un large plateau marqué par une marge surplombant légèrement la surface dorsale du fémur. Les mains et les pieds sont larges et courts, et se terminent par des phalanges unguéales fortes, acérées, et recourbées qui devaient soutenir des griffes puissantes. Les cicatrices musculaires et tendineuses sont largement développées[3].
Espèces
Le genre Cotylorhynchus contient trois espèces qui diffèrent par leurs tailles et leurs proportions : C. romeri (l’espèce type), C. hancocki, et C. bransoni. Chez C. romeri il existe deux groupes de taille correspondant peut être à un dimorphisme sexuel. Il n'y a pas de chevauchement de taille entre les adultes de C. romeri et C. hancocki, mais les plus gros spécimens de C. bransoni ont à peu près les mêmes dimensions que les petits spécimens de C. romeri[3]. En 2022, Ralf Werneburg et des collègues ont suggéré que les espèces C. hancocki et C. bransoni pourraient ne pas appartenir au genre Cotylorhynchus. Ces auteurs considèrent qu’une révision détaillée de ces deux taxons est nécessaire pour clarifier leur statut[4].
Cotylorhynchus romeri
L’espèce type Cotylorhynchus romeri est l’espèce la mieux connue du genre. Elle fut érigée en 1937 par John Willis Stovall à partir de l’holotype OMNH 00637, composé du côté droit d'un crâne, une interclavicule incomplète, et une paire de mains droite et gauche, trouvés dans les mudstones rouges de la partie inférieure de la formation de Hennessey, près de la localité de Navina, dans le Comté de Logan, Oklahoma[1] - [3]. Le nom de l’espèce honore le paléontologue Américain Alfred Sherwood Romer[1]. Peu après la découverte de l’holotype, de très nombreux spécimens furent découverts dans une vingtaine de sites entourant la ville de Norman, dans le Comté de Cleveland, toujours dans la formation de Hennessey. Plusieurs squelettes assez complets et de nombreux autres plus fragmentaires, totalisent environ 40 individus[3]. Les spécimens des deux régions sont plus ou moins contemporains et ne sont connus que dans un intervalle stratigraphique de 30 m d’épaisseur. À Navina, l’holotype provient d’un niveau situé environ 60 m au-dessus de la base de la formation de Hennessey. Les nombreux exemplaires de la région de Norman ont été trouvés dans plusieurs couches situées entre 45 et 76 m au-dessus de la base de la formation[3]. L’holotype de C. romeri possède 20 dents sur les mâchoires supérieures (3 sur le prémaxillaire et 17 sur le maxillaire) et 19 dents sur les mâchoires inférieures. Les C. romeri de la région de Norman montrent un nombre de dents plus réduit. Quatre crânes où le comptage des dents était possible possèdent 15 ou 16 dents sur les mâchoires supérieures (3 sur le prémaxillaire et jusqu’à 13 sur le maxillaire). Certains auteurs ont ainsi envisagé que l’holotype de C. romeri et les spécimens référés de Norman représentaient deux espèces différentes. Cependant, le manque d’échantillons de la localité type (l’holotype de C. romeri y étant le seul fossile connu) et le nombre de dents étant la seule différence avec les spécimens de Norman, il fut décidé de maintenir tous ces spécimens dans la même espèce[1] - [3].
C. romeri est une espèce de grande taille pouvant dépasser 3,60 m de longueur et peser 330 kg selon Romer et Price[5] ou 4,50 m de longueur selon Stoval et des collègues[6]. Robert Reisz et des collègues ont identifié chez cette espèce plusieurs autapomorphies crâniennes. C. romeri se distinguerait par des postpariétaux transversalement larges qui entrent en contact avec les supratemporaux latéralement, un grand supratemporal qui limite le contact entre le pariétal et le postorbitaire, un stapes doté d’une courte diaphyse distale massive et d’un processus ventral qui s’appuie contre la branche carré du ptérygoïde, des vomers portant trois grandes dents le long du bord médial de l’os, la présence de dents sur le parasphénoïde, et un surangulaire recouvrant la pointe postéro-dorsale du dentaire et l’exclut de l’éminence coronoïde. Cependant, Reisz et des collègues soulignent le fait que ces autapomorphies sont ambiguës car elles reposent, à quelques exceptions près (quelques os du palais), sur des parties du crâne encore inconnues chez les autres espèces du genre limitant ainsi les comparaisons[2].
_1.jpg.webp)
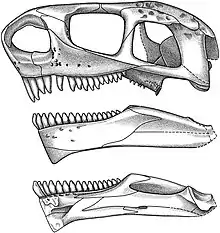
Comme chez les deux autres espèces de Cotylorhynchus, la denture se compose de dents tricuspides. Toutefois, C. romeri est l’espèce où les cuspides sont le moins développées[3]. D’après Everett Claire Olson, les dents prémaxillaires ne portaient pas de cuspides[3]. Ces dernières ont toutefois été signalées sur les dents prémaxillaires par Robert Reisz et des collègues[2]. Toutes les dents marginales ont leur extrémité distale recourbée lingualement. De nombreuses dents sont également présentes sur plusieurs os du palais. Une courte rangé de trois grandes dents légèrement recourbées sont présentes sur chaque vomers. Elles sont plus hautes que toutes les autres dents du palais. Les palatins portent 10 dents subconiques situées sur une région de l’os légèrement épaissie adjacente à la partie médiane de la suture partagée avec le ptérygoïde. Ce dernier, de forme triangulaire, porte de nombreuses dents réparties en quatre groupes distincts : une rangée médiale bordant la vacuité interptérygoïde, un groupe de dents plus petites qui contribue au groupe de dents ptérygo-palatines, un amas postérolatéral de très petites dents sur la branche transversale du ptérygoïde, et derrière cet amas une rangée de grandes dents qui borde la marge postérieure de la branche transversale et s'étend médialement à la région basicrânienne[2]. D’une manière générale, le ptérygoïde porte des dents plus nombreuses, plus petites et plus fines que celles présentes sur le ptérygoïde de C. bransoni[3]. Quelques dents sont également présentes sur le parasphénoïde. Plusieurs dents du palais ont leur extrémité bien conservée qui montre la même morphologie distale que les dents marginales avec trois petites cuspides. Sur la mandibule, le dentaire porte entre 16 et 19 dents, lesquelles présentent la même morphologie que les dents de la mâchoire supérieure. Chez C. romeri, la rangé dentaire ne montre pas d’espaces pour les dents de remplacement ce qui pourrait être lié à des taux réduits de remplacement des dents et une longévité accrue des dents fonctionnelles[2].
La colonne vertébrale comprend 25 ou 26 vertèbres présacrées, 3 vertèbres sacrales et environ 55 vertèbres caudales[6]. C. romeri se distingue par ses postzygapophyses largement espacées sur les vertèbres dorsales, alors que chez C. hancocki et C. bransoni, elles se contactent généralement le long de la ligne médiane[7]. Les membres, relativement courts, étaient plus robustes que ceux de C. bransoni mais moins massifs que ceux de C. hancoki[8]. Les mains et les pieds montrent une formule phalangienne[N 1] de 2-2-3-3-2[6] - [3]. Les squelettes de la région de Norman montrent deux groupes de tailles au sein des spécimens adultes. L’un de ces groupes est composé d’individus environ 20 % plus petits que ceux de l’autre groupe. Cette différence de taille fut interprétée comme une possible différentiation spécifique ou plus probablement comme l’expression d’un dimorphisme sexuel[6] - [3].
Cotylorhynchus hancocki

Cotylorhynchus hancocki fut nommé en 1953 par Everett C. Olson et James R. Beerbower, à partir d’un humérus droit et d’une extrémité proximale de tibia (constituant l’holotype FMNH UR 154) découverts dans la partie supérieure de la formation de San Angelo, près de la Pease River, dans le Comté de Hardeman au Texas[9]. L’espèce porte le nom de J. Hancock grâce auquel l'exploration d'une grande partie de la localité de Pease River fut possible[9]. Par la suite, plus d’une soixantaine de spécimens, allant de l’os isolé au squelette presque complet, furent découverts dans plusieurs gisements du Comté de Knox, la majorité provenant toutefois de la carrière de Kahn. Ce site a livré les spécimens les plus complets de l’espèce tels FMNH UR 581, un squelette presque complet auquel ne manque que le crâne, quelques vertèbres cervicales, un scapulo-coracoïde et certains os des membres ; FMNH UR 622, un squelette partiel composé d’une partie de la boîte crânienne et du palais, diverses vertèbres, des côtes, des os des membres, une clavicule, et des os du pied ; et FMNH UR 703, une partie du squelette d'un très grand individu incluant des vertèbres dorsales, lombaires, sacrales, et caudales, le bassin, un fémur, un radius, un ulna, et des côtes. D’autres spécimens notables incluent plusieurs os crâniens isolés. Tous les os crâniens connus chez cette espèce proviennent de la carrière de Kahn[10] - [3].
Avec une taille pouvant dépasser les 6 m de longueur et un poids de plus de 500 kg[3], C. hancocki est de très loin la plus grande espèce du genre, et est l’un des plus grands caséidés connus avec le genre Alierasaurus[11] - [12] - [13] - [14]. Ses dimensions font également de lui l’un des plus grands synapsides non-mammalien. On ne connaît pas de crâne complet de C. hancocki. Les divers éléments connus (maxillaires, dentaires, boîte crânienne, os du palais), indique un crâne similaire à celui de C. romeri en légèrement plus grand. La denture supérieure n’est pas connue en totalité. Plusieurs mandibules isolées montrent que la denture inférieure comptait jusqu’à 18 dents légèrement spatulées et tricuspides. Les cuspides des dents supérieures étaient moins fortes que celles des dents inférieures. Les cuspides dentaires de C. hancocki sont plus prononcées que celles de C. romeri mais moins développées que celles de C. bransoni[10] - [3].
Le squelette postcrânien se distingue par la morphologie et les proportions des membres, des vertèbres, et du bassin. Le scapulo-coracoïde est caractérisé par la présence d’un foramen supraglénoïdien sur la lame scapulaire. Un tel foramen est absent chez les deux autres espèces de Cotylorhynchus et chez les caséidés en général[7] mais est présent chez le genre Lalieudorhynchus[4]. La scapula possède une marge antéromédiane bombée en forme de processus comme chez Lalieudorhynchus[4]. L’humérus possède un épicondyle plat, très large et mince, et un foramen entepicondylien complètement fermé[10]. La colonne vertébrale la plus complète est celle du spécimen FMNH UR 581 dans laquelle il y a dix-sept vertèbres présacrées et trente-neuf vertèbres caudales en articulation[10]. Une caractéristique liée à la très grande taille de cette espèce est la présence d’un hyposphene proéminent sur les postzygapophyses des vertèbres dorsales[7], un caractère partagé avec Lalieudorhynchus[4]. Cette articulation intervertébrale supplémentaire renforçait et stabilisait davantage la colonne vertébrale pour soutenir le poids important de l’animal. L’épine neurale de la première vertèbre caudale et de la première vertèbre sacrée est très allongée dorsalement comme chez Lalieudorhynchus[4]. Les os des membres sont très robustes. Le fémur notamment est très massif avec une diaphyse relativement courte et un trochanter interne très développé[10] - [8], un autre caractère partagé avec Lalieudorhynchus[4]. L’os dans son ensemble est proportionnellement plus court et plus large que le fémur des deux autres espèces de Cotylorhynchus[8]. Le bassin est caractérisé par une projection antérolatérale du pubis nettement plus grande que chez C. romeri, et un sacrum présentant une très grande côte sacrale antérieure, tandis que les deuxième et troisième côtes sacrales sont petites et moins spécialisées[10]. Un pied incomplet est conservé chez FMNH UR 581. L’astragale de C. hancocki diffère de celui des deux autres espèces de Cotylorhynchus et ressemble à celui de Lalieudorhynchus en étant presque aussi large que long[4]. Le doigt IV est complet et compte trois éléments. La position des éléments conservés des doigts II et III suggère une formule phalangienne de ?-2-2-3-?[10] - [15].
Cotylorhynchus bransoni
Cotylorhynchus bransoni fut nommée en 1962 par Everett C. Olson et Herbert Barghusen à partir de nombreux ossements trouvés dans la carrière d’Oméga, dans le Comté de Kingfisher en Oklahoma. Ses restes furent initialement décrits comme provenant de la partie centrale de la formation de Flowerpot[15]. Plus tard, Olson a corrigé cette attribution en précisant que ces restes appartiennent à une langue de la formation de Chickasha (Groupe d’El Reno) dont les dépôts s’imbriquent par endroit avec ceux des formations de Flowerpot, de Blaine, et de Dog Creek[16] - [3]. Le nom de l’espèce honore le Dr. Carl C. Branson qui, à l’époque de la description de l’espèce, était le directeur de l’Oklahoma Geological Survey, et qui a soutenu le programme de recherche sur la faune de la formation de Chickasha[15]. L’holotype FMNH UR 835, se compose du côté gauche du bassin, d’un fémur gauche, et plusieurs côtes sacrales partielles. D’autres spécimens sont représentés par FMNH UR 836, un tibia et une fibula droit, des tarses, des métatarses, et des phalanges sauf les unguéales ; FMNH UR 837, un radius et l’ulna gauche, et une partie du carpe ; FMNH UR 838, un astragale gauche aplati ; FMNH UR 839, un tibia gauche immature ; FMNH UR 840, une fibula gauche mal conservé d’un individu immature ; FMNH UR 841, un fragment de maxillaire gauche avec deux dents ; FMNH UR 842, deux fragments de phalanges unguéales ; et FMNH UR 843, une phalange unguéale[15]. D’autres fouilles effectuées dans la carrière d’Oméga ont permis de découvrir de nombreux ossements supplémentaires, dont plusieurs éléments inédits du squelette. Ce matériel additionnel inclut FMNH UR 905, un pied partiel; FMNH UR 910, des côtes cervicales; FMNH UR 912, une clavicule; FMNH UR 913, un chevron; FMNH UR 915, une série de vertèbres; FMNH UR 918 et 919, deux scapulo-coracoïdes; FMNH UR 923, des vertèbres sacrées; FMNH UR 929, un ptérygoïde; et FMNH UR 937, des vertèbres caudales[16] - [3]. Enfin, trois sites de la région d’Hitchcock, dans le comté de Blaine, ont fourni les spécimens FMNH UR 972, des vertèbres caudales; FMNH UR 982, 4 vertèbres dorsales; FMNH UR 983, des vertèbres dorsales; FMNH UR 984, un humérus incomplet; et FMNH UR 988, une partie du bassin et un pied complet et articulé encore associé à une partie du tibia et de la fibula[16] - [3].
C. bransoni est la plus petite espèce connue du genre Cotylorhynchus, avec ses plus gros représentant de taille comparable aux plus petits individus de C. romeri[3]. Le crâne est très mal connu et n’est représenté que par deux os dentifères : un fragment de maxillaire et un ptérygoïde. Les dents présentes sur ces éléments distinguent C. bransoni des deux autres espèces du genre. Les deux dents tricuspides préservées sur le maxillaire montrent des cuspides plus développées que celles observées chez C. romeri et C. hancocki. Le ptérygoïde porte des dents moins nombreuses, plus grandes et plus robustes que celles présentes sur le ptérygoïde de C. romeri[10] - [3].
Le scapulo-coracoïde possède une lame scapulaire proportionnellement moins large que chez les deux autres espèces. La cavité glénoïde est un peu plus longue proportionnellement à sa largeur que chez les deux autres espèces, et la partie antérieure de la plaque coracoïde est moins étendue en avant[3]. Le radius et l’ulna sont relativement minces et courts. Le bassin est caractérisé par le fort développement de l’ilion, qui s’élève en lame au-dessus de l’acetabulum. Le fémur est gracile avec une diaphyse élancée et un quatrième trochanter se trouvant loin sur la diaphyse. Les condyles distaux sont largement espacés. L’astragale est caractérisé par la présence d’un très gros foramen, absent chez les deux autres espèces[10] - [3]. Olson & Barghusen pensaient que la formule phalangienne du pied de C. bransoni était 2-2-2-3-2, soit une formule plus réduite que celle des deux autres espèces de Cotylorhynchus[15] - [3]. Toutefois, Romano et Nicosia ont montré en 2015 que le doigt III comptait bien trois phalanges et non deux comme le croyait Olson et Barghusen. Ainsi, la formule phalangienne du pied de C. bransoni était 2-2-3-3-2 comme chez C. romeri et probablement aussi chez C. hancocki[7].
Répartition stratigraphique
Aucune datation radiométrique n’est disponible pour les formations géologiques contenant des fossiles de Cotylorhynchus. L’espèce la plus ancienne est C. romeri de la formation de Hennessey en Oklahoma. Cette formation est considérée comme contemporaine de la partie supérieure du Groupe de Clear Fork (formation de Choza) du Texas[17]. Des faunes d’ammonoïdes trouvées dans des strates marines présentes à la base et au sommet du Groupe de Clear Fork indiquent que les trois formations qui le composent (Arroyo, Vale, et Choza) sont entièrement incluses dans l’étage Kungurien[18] - [19].
Les deux autres espèces de Cotylorhynchus sont plus récentes et proviennent des formations de San Angelo et de Chickasha. L’estimation de l’âge géologique de ces deux formations a fait l’objet de nombreuses interprétations, celles-ci leur attribuant alternativement un âge Cisuralien terminal (Kungurien) et/ou Guadalupien basal (Roadien)[20].
Au Texas, l’espèce Cotylorhynchus hancocki provient de la formation de San Angelo. Cette formation surmonte le Groupe de Clear Fork et est recouverte par la formation de Blaine. D’après Spencer G. Lucas et d’autres auteurs, des fusulines trouvées dans une intercalation marine de la formation de San Angelo, ainsi que des ammonoïdes présentes à la base de la formation de Blaine sus-jacente, indiquaient un âge Kungurien. De plus, selon ces auteurs, la base de la formation de San Andres, située plus à l’ouest et considérée comme un équivalent latéral de la formation de Blaine, se trouve dans la zone de conodontes de Neostreptognathodus prayi, la seconde des trois biozones de conodontes du Kungurien. La base de la formation de Blaine appartiendrait donc à cette biozone du Kungurien, ce qui suggère que la formation de San Angelo sous-jacente et C. hancocki seraient légèrement plus anciens que la zone de conodonte à N. prayi avec un âge Kungurien inférieur[18] - [21] - [19]. Cependant, Michel Laurin et Robert W. Hook ont fait valoir que l’intercalation marine à fusulines citée plus haut n’appartient pas à la formation de San Angelo dans laquelle elle fut incluse par erreur, et ne peut pas être utilisée pour dater cette dernière. Le nom de formation de San Angelo a été incorrectement appliqué à une grande variété de roches dans divers bassins sédimentaires situés dans l’ouest du Texas, alors que la Formation de San Angelo est limitée au plateau oriental et est exclusivement continentale et dépourvue de fossiles marins[20]. Par ailleurs, la révision taxonomique des ammonoïdes de la base de la formation de Blaine indique un âge Roadien plutôt que Kungurien[N 2] - [20]. La formation de San Angelo a quant à elle livré une flore fossile dominée par les conifères voltziens, un assemblage plutôt caractéristique du Guadalupien et du Lopingien. Ainsi, selon Laurin et Hook la formation de San Angelo pourrait dater du Kungurien terminal ou du Roadien basal, ou plus probablement pourrait chevaucher la limite Kungurien/Roadien[20].
C. bransoni est l’espèce la plus récente du genre et provient de la formation de Chickasha en Oklahoma. Cette formation fut longtemps considérée comme contemporaine de la formation de San Angelo. Cependant, Laurin et Hook ont démontré que la formation de Chickasha est légèrement plus récente car elle est intercalée dans la partie centrale de la formation de Flowerpot, laquelle recouvre la formation du grès de Duncan qui est en fait l’équivalent latéral de la formation de San Angelo en Oklahoma[20]. Des données magnétostratigraphiques suggèrent que la formation de Chickasha date probablement du Roadien inférieur[20]. Un âge Roadien fut également suggéré sur la base de la présence dans la faune de Chickasha du parareptile Nycteroleteridae Macroleter, un genre qui n’était connu que dans le Permien moyen de Russie d’Europe[22] - [23]. Toutefois, Sigi Maho et des collègues ont mis en avant le fait que plusieurs genres de tétrapodes du Permien avaient une large distribution temporelle, tels Dimetrodon et Diplocaulus, et que la présence du genre Macroleter à la fois en Russie et en Oklahoma (représenté par des espèces différentes) ne garantissait pas un âge Permien moyen pour la formation de Chickasha[24]. Les mêmes auteurs soulignent également l’exemple du Varanopidae Mesenosaurus, lequel est présent à la fois dans le Permien moyen de Russie et par une espèce distincte en Oklahoma dans des terrains datés radiométriquement du milieu du Permien inférieur (Artinskien)[24]. De plus, de probables empreintes de pas de Nycteroleteridae, nommées Pachypes ollieri, provenant de roches cisuraliennes d'Europe et d'Amérique du Nord et du Guadalupien d'Europe, montrent que la distribution stratigraphique des Nycteroleteridae ne se limitait pas au Permien moyen et supérieur mais incluait également le Permien inférieur[25]. Les occurrences cisuraliennes de P. ollieri proviennent des formations d’Hermit (Arizona), de Rabéjac (France) et de Peranera (Espagne) toutes d’âge Artinskien, et également de la formation de San Angelo[25]. Ainsi, dans l’état actuel des connaissances, l’âge de la formation de Chickasha peut difficilement être évaluée à partir de la faune qu’elle contient. Cependant, la position stratigraphique de la formation de Chickasha comparée à celle de la formation de San Angelo, et son probable âge Roadien inférieur inféré par la magnétostratigraphie, indiquent que la faune de Chickasha représente l’assemblage faunique le plus récent du Permien d’Amérique du Nord.
Paléoenvironnements
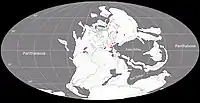
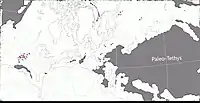
Au Permien, la plupart des terres émergées étaient réunies en un seul supercontinent, la Pangée. Celui-ci avait alors grossièrement la forme d’un C : ses parties nord (la Laurasia) et sud (le Gondwana) étaient reliés à l'ouest mais séparés à l'est par une très vaste baie océanique - la mer de Téthys[26]. Un long chapelet de microcontinents, regroupés sous le nom de Cimmérie, divisait la Téthys en deux : la Paleo-Tethys au nord, et la Neo-Tethys au sud[27]. Les formations de Hennessey, de San Angelo, et de Chickasha correspondent principalement à des sédiments fluviatiles et/ou éoliens déposés dans une vaste plaine deltaïque parsemée de lacs et de lagunes. Cette plaine côtière était bordée à l’ouest par une mer qui occupait ce qui est maintenant le Golfe du Mexique et la partie la plus méridionale de l'Amérique du Nord. Les cours d’eau alimentant le delta se dirigeaient depuis des reliefs modestes situés plus à l’est et correspondant aux soulèvements ancestraux des montagnes Ouachita, Arbuckle et Wichita. Le climat était subtropical avec des pluies modérées et saisonnières. Il existait une mousson d’été ainsi qu’une saison sèche hivernale. La mousson était relativement faible en raison de la taille limitée de la mer et du faible différentiel entre les températures d’été et d’hiver. La présence d’évaporites indique une aridité importante interrompue par des inondations saisonnières[9] - [10] - [17] - [28] - [29] - [30] - [19].
Formation de Hennessey
Everett C. Olson pensait que la formation de Hennessey était représentée par plusieurs faciès sédimentaires correspondant à plusieurs types d’environnements. Selon lui, une partie de la formation se serait déposée dans un milieu franchement marin tandis que d’autres parties représenteraient des dépôts côtiers et continentaux. Le faciès continental est surtout composé de mudstones rouges, accompagné localement de lentilles et de bancs de grès et de siltites interprétés comme des dépôts fluviaux et de plaines inondables[17]. Cependant, des analyses de faciès détaillées ont révélé par la suite que ces roches avaient plus probablement une origine éolienne, correspondant à des limons, argiles, et sables déposés sous forme de loess et parfois piégés dans des vasières plus ou moins salines, des lacs salés peu profonds, ou des cours d’eau éphémères de type oued[30]. Les fossiles de Cotylorhynchus romeri ne se rencontre que dans les mudstones rouges. Cette espèce se présente en partie sous forme de squelettes quasi complets mais également sous forme de squelettes disloqués et de segments articulés de squelettes. D’après la position des squelettes articulés, Stovall et des collègues estimaient que les animaux s’étaient probablement enlisés dans des marais où ils furent ensevelis. Les squelettes disloqués ou partiellement articulés indiquent également que d’autres spécimens ont subi un certain transport avant leur enfouissement[17]. D’après Markus Lambertz et des collègues, il est également possible que les animaux se soient embourbés lors de l’assèchement du point d’eau dans lequel ils vivaient, dans l’hypothèse d’un mode de vie semi-aquatique chez Cotylorhynchus[31]. Mis à part C. romeri, les autres vertébrés connus dans la formation de Hennessey sont les captorhinidés Captorhinikos chozaensis[32] et Rhodotheratus parvus[33], le dipneuste Gnathorhiza[17] - [2] et les amphibiens Diplocaulus, Brachydectes[34] - [35], Rhynchonkos, Aletrimyti, et Dvellacanus[36]. Gnathorhiza et Brachydectes étaient capables d’estiver dans des terriers lors des périodes prolongées d’aridités[17]. De rares pistes de vertébrés ont été attribué aux ichnogenres Amphisauropus et Dromopus, considérés respectivement comme des empreintes d’amphibiens seymouriamorphes et de reptiles araeoscelides[37]. Les pistes d’Amphisauropus de la formation de Hennessey ont toutefois été reclassé dans l’ichnogenre Hyloidichnus[38] lequel correspond à des empreintes de pas d’eureptiles captorhinidés[39] - [40].
Formation de San Angelo
La formation de San Angelo est composée à sa base de grès dur, vert, gris et bruns, et de conglomérats fins, non fossilifères. La partie centrale de la formation est principalement constituée de mudstones rouges interprétés comme des boues argileuses et limoneuses déposées dans les plaines côtières lors d’épisodes d’inondations périodiques. Ces mudstones rouges sont intercalés d’un mince niveau de grès vert, de mudstones sableux, et d’évaporites. Ceux-ci correspondraient à un empiètement mineur et de courte durée des estuaires, des lagunes, et des mers très peu profondes sur la partie terrestre du delta. Les caséidés Angelosaurus dolani et Caseoides sanangeloensis sont présents dans les mudstones rouges de cette partie de la formation[N 3]. La partie supérieure de la formation de San Angelo est caractérisée par la prépondérance des sédiments grossiers tels que grès et conglomérats, mais incluant aussi à sa base des mudstones sableux et à son sommet des mudstones rouges purs. D’après Olson, ces sédiments furent déposés par des rivières plus larges et aux courants plus puissants que celles de la partie centrale de la formation[10]. Cependant, en Oklahoma, les strates équivalentes à la formation de San Angelo, qui étaient elles aussi considérées comme des dépôts fluviaux-deltaïques et fluviaux côtiers, ont été réinterprété comme étant d’origine éolienne[41]. La partie supérieure non sommitale de la formation de San Angelo est caractérisée par l’absence du caséidé Angelosaurus et l’abondance de Cotylorhynchus hanckoki. Ce dernier est représenté le plus souvent par un seul individu dans chaque gisement, à l’exception de la carrière de Kahn. Ce site a livré de nombreux spécimens répartis dans plusieurs niveaux stratigraphiques. Le niveau le plus riche, composé de mudstones sableux verts, parfois bruns, a fourni les restes d’au moins 15 individus. Plusieurs étaient partiellement articulés alors que d’autres étaient représentés par des os isolés. Après leur transport sur le site, certains os sont restés exposés à la surface un certain temps comme l’indique la présence, sur certains d’entre eux, d’une fine couche de limon bien différente du reste de la roche encaissante. Plusieurs ossements indiquent que certaines carcasses furent dévorées sur place. La taphonomie du site indique donc que les cadavres de C. hancocki furent transportés lors d’un épisode d’inondation, déposés au fur et à mesure que les eaux se retiraient, soumis à l’action des prédateurs et des charognards, puis enterrés ultérieurement peut-être lors d’une nouvelle crue. Un processus qui se serait répété plusieurs fois. De grandes masses de végétation ont également été transportées et se trouvent en association directe avec les vertébrés[10]. Tout au sommet de la formation de San Angelo, les mudstones rouges sont à nouveau le faciès sédimentaire dominant. Le genre Angelosaurus est à nouveau présent (avec l’espèce A. greeni), accompagné par le caséidé Caseoides cf. agilis[9] - [10] - [3]. Ainsi, la faune de la partie supérieure de la formation de San Angelo comprend, entre autres[N 4], les caséidés Caseopsis agilis et Angelosaurus greeni, le sphénacodontidé Dimetrodon angelensis, les captorhinidés Rothianiscus multidonta, et Kahneria seltina, et le dvinosaure Tupilakosauridae Slaugenhopia[9] - [10]. Quelques pistes de tétrapodes indiquent également la présence de paréiasauromorpha nycteroleteridés (ichnotaxon Pachypes ollieri)[25], dont un squelette partiel est connu dans les dépôts légèrement plus récents de la formation de Chickasha[22] - [25]. Une flore inhabituelle a été retrouvée dans les chenaux de la partie supérieure de la formation de San Angelo. Elle est dominée par les gymnospermes et est remarquable par sa composition unique incluant à la fois des taxons typiques du Permien inférieur tels Walchia ou Culmitzschia mais aussi des formes qui n’étaient jusque-là connus que dans le Permien moyen ou supérieur comme diverses espèces d’Ulmannia, Pseudovoltzia liebeana, et le taxon d’affinité incertaine Taeniopteris eckardtii, ou dans les strates du Mésozoïque comme la bennettitale Podozamites et le cycadidé putatif Dioonitocarpidium. Le reste de la flore est représentée par le ginkgoale Dicranophyllum, la cordaitale Cordaites, et l’équisetale cf. Neocalamites[42] - [43].
Formation de Chickasha
La formation de Chickasha correspond à la partie centrale de la formation de Flowerpot dans laquelle elle s’intercale localement. Les sédiments qui la composent sont variés et comportent des shales rouges, des grès, des mudstones, des conglomérats, et des évaporites, déposés dans les plaines inondables et les chenaux bordant la mer et les lagunes côtières. Dans la carrière d’Oméga, tous les fossiles proviennent de grès, de mudstones et de conglomérats durs et siliceux, disposés en lentilles. Ils correspondent à des dépôts d’un ancien chenal d’environ 1,50 m d’épaisseur et 4,6 m de largeur où se sont accumulés les squelettes de Cotylorhynchus bransoni, mais aussi ceux d’un second caséidé, Angelosaurus romeri, et ceux du captorhinidé Rothianiscus robustus[15] - [16] - [20]. Ailleurs dans cette formation sont connus le Xenacanthiforme Orthacanthus, le Nectridea Diplocaulus[20], le temnospondyle Dissorophidae Nooxobeia[44], le pareiasauromorpha Nycteroleteridae Macroleter[22] - [23], et les varanopidés Varanodon et Watongia[16] - [45]
Paléobiologie
Régime alimentaire
La cage thoracique très développée et en forme de tonneau indique la présence d’un système digestif massif adapté à l’ingestion d’une grande quantité de plantes à faible valeur nutritive. La denture de Cotylorhynchus montre également que celui-ci était clairement herbivore. Les dents de devant, plus longues et légèrement recourbées, servaient probablement à rassembler la végétation dans la bouche. Les dents marginales étaient bien adaptées pour trancher et couper la végétation. L’appareil hyoïde retrouvé chez d’autres caséidés (Euromycter et Ennatosaurus), indique l’existence d’une langue massive relativement mobile qui devait travailler de concert avec les dents palatines lors de la déglutition[3] - [2]. La langue devait presser les morceaux de plantes contre le palais afin de perforer la nourriture avec les grandes dents palatines, une action qui peut avoir servi à améliorer la fermentation cellulolytique des aliments dans l'intestin[2]. Le faible nombre de cuspides (trois) sur les dents de Cotylorhynchus indique que ce genre était adapté à un type de fourrage (ou gamme de fourrage) différent de celui des autres genres de caséidés herbivores ayant un plus grand nombre de cuspides (Angelosaurus, Euromycter et Ennatosaurus ayant respectivement 5, 5 à 8, et 5 à 7 cuspides)[2].
Mode de vie terrestre vs semi-aquatique
Cotylorhynchus et les caséidés en général sont habituellement considérés comme des animaux principalement terrestres. Olson notamment considérait que le degré d’ossification du squelette, les pieds et les mains relativement courts, les griffes massives, les membres aux muscles extenseurs très puissants, et le sacrum solide, suggéraient fortement un mode de vie terrestre. Olson n’excluait pas que les caséidés aient passé quelque temps dans l’eau, mais il considérait que ces animaux devaient évoluer le plus souvent sur la terre ferme[3]. Il a été suggéré que les membres antérieurs très puissants, avec des muscles extenseurs forts et très tendineux, ainsi que des griffes très massives, pouvaient servir à déterrer des racines ou des turbercules[3]. Toutefois, le cou très court impliquait une faible amplitude de mouvements verticaux de la tête qui interdisait à l’animal de se nourrir au ras du sol[31]. Une autre hypothèse suggère que Cotylorhynchus aurait pu se servir de ses puissants membres antérieurs pour rabattre vers lui de grandes plantes qu’il aurait arrachées avec ses griffes puissantes[3]. D’autres hypothèses suggèrent que Cotylorhynchus se servaient de ses membres aux griffes puissantes comme moyen de défense contre les prédateurs, ou lors d’activités intra spécifiques liés notamment à la reproduction. Un élément intéressant à ce sujet est que presque tous les spécimens de C. hancocki présentent une à dix fractures costales guéries au cours de la vie de l’animal[10] - [3]. Enfin, pour certains auteurs, Cotylorhynchus était un animal semi-aquatique qui se servait de ses mains aux larges griffes comme des pagaies, lesquelles pouvaient également être utilisées pour manipuler les plantes dont il se nourrissait[31].
En effet, en 2016, Markus Lambertz et des collègues remirent en cause le mode de vie terrestre des grands caséidés comme Cotylorhynchus. Ces auteurs ont montré que la microstructure osseuse de l’humérus, du fémur, et des côtes de spécimens adultes et immatures de Cotylorhynchus ressemblait davantage à celle d’animaux aquatiques plutôt qu’à celle d’animaux terrestres, avec un os à la structure très spongieuse, au cortex extrêmement fin, et à l’absence de canal médullaire distinct. Selon ces auteurs, cette faible densité osseuse aurait été un handicap pour des animaux pesant plusieurs centaines de kilos au mode de vie strictement terrestre. Lambertz et al. ont également estimé que les articulations entre les vertèbres et les côtes dorsales ne permettaient que de faibles amplitudes de mouvement de la cage thoracique, limitant ainsi la ventilation costale. Pour pallier cela, ils ont proposé qu'un proto-diaphragme devait être présent pour faciliter la respiration, en particulier dans un milieu aquatique. Ces auteurs estiment également que les paléoclimats arides auxquels correspondent les gisements fossilifères à caséidés ne sont pas incompatibles avec un mode de vie aquatique de ces animaux. Ces paléoenvironnements incluaient en fait un nombre non négligeable de plans d’eau (cours d’eau, lacs et lagunes). Les conditions arides auraient pu être la raison pour laquelle les animaux se seraient parfois rassemblés et seraient finalement morts. De plus, les environnements arides présentent une faible densité de plantes, ce qui exigerait encore plus d'efforts locomoteurs pour satisfaire les demandes énergétiques de ces animaux. Ainsi pour Lambertz et al., les grands caséidés comme Cotylorhynchus étaient des animaux principalement aquatiques qui ne devaient s’aventurer sur terre qu’à des fins de reproduction ou de thermorégulation[31].
Cette hypothèse est toutefois contestée par Kenneth Angielczyk et Christian Kammerer ainsi que par Robert Reisz et des collègues à partir de données paléontologiques et taphonomiques combinées à l’absence chez ces grands caséidés d’adaptations morphologiques à un mode vie aquatique. Selon Angielczyk et Kammerer, la faible densité osseuse des caséidés identifiée par Lambertz et al. ne ressemble pas à celle d’animaux semi-aquatiques, lesquels tendent à avoir un squelette plus fortement ossifié pour assurer un contrôle passif de la flottabilité et une stabilité accrue contre l'action du courant et des vagues. La microstructure osseuse de Cotylorhynchus ressemble davantage à ce qui est observé chez les animaux vivant en haute mer, comme les cétacés et les pinnipèdes, qui mettent l'accent sur une maniabilité élevée, une accélération rapide et un contrôle hydrodynamique de la flottabilité. Toutefois, la morphologie des caséidés était totalement incompatible avec un mode de vie pélagique. Ainsi, en raison de ces données inhabituelles, Angielczyk et Kammerer considèrent que les éléments disponibles sont encore insuffisants pour remettre en question le mode de vie terrestre plus largement supposé des caséidés[46]. D’après Reisz et des collègues la présence de nombreux squelettes de l’amphibien Brachydectes conservés en estivation et du dipneuste Gnathorhiza, un autre estivateur bien connu, combiné à l’absence de vertébrés obligatoirement aquatiques suggèrent fortement que la faune de Hennessey vivait dans un habitat sec périodiquement ponctué de moussons. Conjugué au fait que Cotylorhynchus ne montre aucune adaptation morphologique à un mode de vie aquatique, ces auteurs le considèrent comme un animal terrestre qui a dû endurer les pluies de mousson, certains individus succombant occasionnellement à des inondations majeures[2].
En 2022, Werneburg et des collègues ont proposé un mode de vie semi-aquatique un peu différent, dans lequel les grands caséidés comme Lalieudorhynchus (dont la texture osseuse est encore plus ostéoporotique que celle de Cotylorhynchus) seraient des équivalents écologiques des hippopotames actuels, passant une partie de leur temps dans l’eau (en étant des marcheurs subaquatiques plutôt que des animaux nageurs) mais venant sur terre pour se nourrir[4].
Phylogénie
Toutes les études phylogénétiques des caséidés considèrent Cotylorhynchus comme un taxon proche des genres Ennatosaurus et Angelosaurus. Dans la première analyse phylogénétique des caséidés publiée en 2008, l’espèce Cotylorhynchus romeri est récupérée comme le groupe frère de Angelosaurus dolani[47].
Ci-dessous le premier cladogramme des Caseidae publié par Maddin et al. en 2008[47].
| Caseasauria |
| ||||||||||||||||||||||||||||||||||||
Une autre analyse phylogénitique réalisée en 2012 par Benson identifie Cotylorhynchus romeri comme le groupe frère des deux espèces C. Hancocki et C. bransoni[48].
Ci-dessous, le cladogramme des Caseasauria publié par Benson en 2012[48].
| Caseasauria |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En 2015, Romano et Nicosia ont publié la première étude cladistique incluant presque tous les Caseidae, à l’exception de taxons très fragmentaires comme Alierasaurus ronchii et Angelosaurus greeni. Dans cette analyse, les trois espèces de Cotylorhynchus forme un clade avec le genre Ruthenosaurus, et ce clade est le groupe frère d’un clade contenant les genres Angelosaurus et Ennatosaurus[7]
Ci-dessous, le cladogramme des Caseidae publié par Romano et Nicosia en 2015[7].
| Caseasauria |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
En 2020, deux cladogrammes publiés par Berman et des collègues récupèrent également Cotylorhynchus comme l’un des caséidés les plus dérivés. Dans le premier cladogramme, les trois espèces de Cotylorhynchus forment avec Angelosaurus et Alierasaurus, une polytomie non résolue. Dans le second cladogramme, Cotylorhynchus hancocki et C. bransoni sont des taxons frères et forment une polytomie avec Cotylorhynchus romeri et Alierasaurus[49].
Ci-dessous, les deux cladogrammes des Caseidae publié par Berman et des collègues en 2020[49].
| Caseidae |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Caseidae |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Une analyse phylogénétique publiée en 2022 par Werneburg et des collègues suggère que le genre Cotylorhynchus serait paraphylétique. Selon ces auteurs, les espèces Cotylorhynchus hancocki et C. bransoni n'appartiendrait pas à ce genre et nécessiteraient une révision détaillée pour clarifier leur statut, ces taxons n'ayant pas été étudiés depuis les années 1960. Dans cette analyse, l’espèce type C. romeri est positionnée juste au-dessus du genre Angelosaurus, et forme une polytomie avec un clade contenant Ruthenosaurus et Caseopsis et un autre clade contenant Alierasaurus, les deux autres espèces de Cotylorhynchus et Lalieudorhynchus. Au sein de ce dernier clade, Alierasaurus est le groupe frère de “Cotylorhynchus” bransoni et d’un clade plus dérivé incluant Lalieudorhynchus et “Cotylorhynchus” hancocki[4].
Ci-dessous, le cladogramme publié par Werneburg et des collègues en 2022[50].
Liens externes
- Ressources relatives au vivant :
Notes et références
Notes
- La formule phalangienne correspond au nombre de phalanges constituant chaque doigt des mains et des pieds des tétrapodes. Elle s’énumère en partant du doigt I (correspondant chez l’homme au pouce et au gros orteil) jusqu’au doigt V (l’équivalent de l’auriculaire et du petit orteil).
- Pris individuellement les sept genres d’ammonoïdes de cette faune ont une distribution temporelle s’étendant du Cisuralien au Lopingien : trois sont connus dans les gisements du Cisuralien et du Guadalupien, deux s'étendent du Cisuralien au Lopingien, et deux sont enregistrés dans les roches du Guadalupien au Lopingien inférieur. Cependant, le Roadien (= base du Guadalupien) est le seul étage durant lequel les sept genres coexistent.
- De ces niveaux proviennent également les genres très fragmentaires Steppesaurus et Mastersonia. En 1953, Olson et Beerbower classèrent d’abord Steppesaurus parmi les pélycosaures Sphenacodontidae. Puis en 1962 Olson le considéra comme un thérapside Phtinosuchidae. Dans le même article Olson décrivit Mastersonia qu’il considérait comme un thérapside « éodinocéphalien ». Dans une courte note publiée en 1995, Sidor et Hopson ont rejeté la nature thérapside de ces deux taxons, leurs restes appartenant selon eux à des pélycosaures. Laurin et Hook (2022) souligne toutefois la nécessité de réétudier ces spécimens avec les méthodes modernes.
- Olson et Beerbower (1953), puis Olson (1962), ont nommés d’autres taxons fragmentaires provenant de la carrière de Kahn et de localités voisines de même âge qu’ils attribuèrent à divers groupes de thérapsides, comme Knoxosaurus, Gorgodon, Dimacrodon, Eosyodon, Driveria, et Tappenosaurus. En 1995 Sidor et Hopson ont réinterprété les fossiles de tous ces taxons comme des restes de pélycosaures caséidés et sphénacodontidés plus ou moins déterminables. Cependant, une nouvelle étude de ces spécimens par des méthodes modernes serait nécessaire (Laurin et Hook, 2022).
Références
- (en) J.W. Stovall, « Cotylorhynchus romeri, a new genus and species of pelycosaurian reptile from Oklahoma », American Journal of Science (series 5), vol. 34, , p. 308-313
- (en) R.R. Reisz, D. Scott et S.P. Modesto, « Cranial Anatomy of the Caseid Synapsid Cotylorhynchus romeri, a Large Terrestrial Herbivore From the Lower Permian of Oklahoma, U.S.A », Frontiers in Earth Science, vol. 10, , p. 1-19 (DOI 10.3389/feart.2022.847560)
- (en) E.C. Olson, « The family Caseidae », Fieldianna (Geology), vol. 17, , p. 225–349
- (en) R. Werneburg, F. Spindler, J. Falconnet, J.-S. Steyer, M. Vianey-Liaud et J.W. Schneider, « A new caseid synapsid from the Permian (Guadalupian) of the Lodève basin (Occitanie, France) », Palaeovertebrata, vol. 45 (2)-e2, , p. 1-36 (DOI 10.18563/pv.45.2.e2)
- (en) A.S. Romer et L.I. Price, « Review of the Pelycosauria », Geological Society of America Special Paper, vol. 28, , p. 1-538
- (en) J.W. Stovall, L.I. Price et A.S. Romer, « The Postcranial Skeleton of the Giant Permian Pelycosaur Cotylorhynchus romeri », Bulletin of the Museum of Comparative Zoology, vol. 135, no 1, , p. 1-30
- (en) M. Romano et U. Nicosia, « Cladistic analysis of Caseidae (Caseasauria, Synapsida): using the gap-weighting method to include taxa based on incomplete specimens », Palaeontology, vol. 58, no 6, , p. 1109–1130 (DOI 10.1111/pala.12197)
- (en) M. Romano et U. Nicosia, « Data from: Cladistic analysis of Caseidae (Caseasauria, Synapsida): using the gap-weighting method to include taxa based on incomplete specimens, Dryad, Dataset », Dryad, Dataset, (DOI 10.5061/dryad.pb1sb)
- (en) E.C. Olson et J.R. Beerbower, « The San Angelo formation, Permian of Texas and its vertebrates », The Journal of Geology, vol. 61, no 5, , p. 384-423
- (en) E.C. Olson, « Late Permian terrestrial vertebrates, U.S.A and U.S.S.R. », Transactions of the American Philosophical Society, New Series, vol. 52, , p. 1-224 (DOI 10.2307/1005904)
- (en) A. Ronchi, E. Sacchi, M. Romano et U. Nicosia, « A huge caseid pelycosaur from north-western Sardinia and its bearing on European Permian stratigraphy and palaeobiogeography », Acta Palaeontologica Polonica, vol. 56, no 4, , p. 723–738 (DOI 10.4202/app.2010.0087)
- (en) M. Romano et U. Nicosia, « Alierasaurus ronchii, gen. et sp. nov., a caseid from the Permian of Sardinia, Italy », Journal of Vertebrate Paleontology, vol. 34, no 4, , p. 900–913 (DOI 10.1080/02724634.2014.837056)
- (en) M. Romano, A. Ronchi, S. Maganuco et U. Nicosia, « New material of Alierasaurus ronchii (Synapsida, Caseidae) from the Permian of Sardinia (Italy), and its phylogenetic affinities », Palaeontologia Electronica, vol. 20.2.26A, , p. 1-27 (DOI 10.26879/684)
- (en) M. Romano, P. Citton, S. Maganuco, E. Sacchi, M. Caratelli, A. Ronchi et U. Nicosia, « New basal synapsid discovery at the Permian outcrop of Torre del Porticciolo (Alghero, Italy) », Geological Journal, vol. 54, no 3, , p. 1-13 (DOI 10.1002/gj.3250)
- (en) E.C. Olson et H. Barghusen, « Vertebrates from the Flowerpot Formation, Permian of Oklahoma, Part I of Permian Vertebrates from Oklahoma and Texas », Oklahoma Geological Survey, circular 59, , p. 5-48 (lire en ligne)
- (en) E.C. Olson, « New Permian Vertebrates from the Chickasha formation in Oklahoma », Oklahoma Geological Survey, circular 70, , p. 1-70 (lire en ligne)
- (en) E.C. Olson, « Early Permian Vertebrates of Oklahoma », Oklahoma Geological Survey, circular 74, , p. 5-111 (lire en ligne)
- (en) S.G. Lucas, « Global Permian tetrapod biostratigraphy and biochronology », dans Lucas, S.G., Cassinis, G. and Schneider, J.W., Non-Marine Permian Biostratigraphy and Biochronology, London, Geological Society, Special Publications, 265, (ISBN 978-1-86239-206-9), p. 65–93
- (en) J.W. Schneider, S.G. Lucas, F. Scholze, S. Voigt, L. Marchetti, H. Klein, S. Opluštil, R. Werneburg, V.K. Golubev, J.E. Barrick, T. Nemyrovska, A. Ronchi, M.O. Day, V.V. Silantiev, R. Rößler, H. Saber, U. Linnemann, V. Zharinova et S-Z. Shen, « Late Paleozoic–early Mesozoic continental biostratigraphy — Links to the Standard Global Chronostratigraphic Scale », Palaeoworld, vol. 29, no 2, , p. 186-238 (DOI 10.1016/j.palwor.2019.09.001)
- (en) M. Laurin et R.W. Hook, « The age of North America’s youngest Paleozoic continental vertebrates : a review of data from the Middle Permian Pease River (Texas) and El Reno (Oklahoma) Groups », BSGF – Earth Sciences Bulletin, vol. 193, no 10, , p. 1-30 (DOI 10.1051/bsgf/2022007)
- (en) S.G. Lucas et V.K. Golubev, « Age and duration of Olson’s Gap, a global hiatus in the Permian tetrapod fossil record », Permophiles, vol. 67, , p. 20- 23 (lire en ligne)
- (en) R.R. Reisz et M. Laurin, « The reptile Macroleter: First vertebrate evidence for correlation of Upper Permian continental strata of North America and Russia », Geological Society of America Bulletin, vol. 113, no 9, , p. 1229-1233 (DOI 10.1130/0016-7606(2001)113<1229:TRMFVE>2.0.CO;2)
- (en) R.R. Reisz et M. Laurin, « Discussion and reply : The reptile Macroleter: First vertebrate evidence for correlation of Upper Permian continental strata of North America and Russia – Reply », Geological Society of America Bulletin, vol. 114, no 9, , p. 1176-1177
- (en) S. Maho, B.M. Gee et R.R. Reisz, « A new varanopid synapsid from the early Permian of oklahoma and the evolutionary stasis in this clade », Royal Society Open Science, vol. 6, no 10, , p. 1-16 (DOI 10.1098/rsos.191297)
- (en) L. Marchetti, S. Voigt, E. Mujal, S.G. Lucas, H. Francischini, J. Fortuny et V.L. Santucci, « Extending the footprint record of Pareiasauromorpha to the Cisuralian : earlier appearance and wider palaeobiogeography of the group », Papers in Palaeontology, vol. 7, no 3, , p. 1297-1319 (DOI 10.1002/spp2.1342)
- (en) S. McLoughlin, « The breakup history of Gondwana and its impact on pre-Cenozoic floristic provincialism », Australian Journal of Botany, vol. 49, , p. 271-300 (DOI 10.1071/BT00023)
- (en) A.M.C. Şengör, « Tectonics of the Tethysides: orogenic collage development in a collisional setting », Annual Review of Earth and Planetary Sciences, no 15, , p. 214-244 (DOI 10.1146/annurev.ea.15.050187.001241)
- (en) G.E. Smith, « Depositional Systems, San Angelo Formation (Permian), North Central Texas – Facies Control of Red-Bed Copper Mineralization », The University of Texas at Austin Bureau of Economic Geology Report of Investigation, vol. 80, , p. 1-74 (DOI 10.23867/RI0080D)
- (en) T.S. Kemp, « Pelycosaurs », dans Kemp, T.S., Mammal-like reptiles and the origin of Mammals, London, Academic Press, (ISBN 978-0124041202), p. 73
- (en) M.J. Soreghan, M.M. Swift et G.S. Soreghan, « Provenance of Permian eolian and related strata in the North American midcontinent: Tectonic and climatic controls on sediment dispersal in western tropical Pangea », dans Ingersoll, R.V., Lawton, T.F., and Graham, S.A., Tectonics, Sedimentary Basins, and Provenance: A Celebration of William R. Dickinson’s Career, Boulder, Geological Society of America Special Paper 540, (ISBN 978-0813725406, DOI 10.1130/2018.2540(28)), p. 661-688
- (en) M. Lambertz, C.D. Shelton, F. Spindler et S.F. Perry, « A caseian point for the evolution of a diaphragm homologue among the earliest synapsids », Annals of the New York Academy of Sciences, vol. 1385, , p. 1-18 (DOI 10.1111/nyas.13264)
- (en) E.C. Olson, « New and little known genera and species of vertebrates from the lower Permian of Oklahoma », Fieldiana: Geology, vol. 18, no 3, , p. 359-434 (lire en ligne)
- (en) M. Gavan, S.S. Sumida et J.P. Jung, « A New Genus of Captorhinid Reptile (Amniota: Eureptilia) from the Lower Permian Hennessey Formation of Central Oklahoma, and a Consideration of Homoplasy in the Family Captorhinidae », Annals of Carnegie Museum, vol. 87, no 2, , p. 89-116 (DOI 10.2992/007.087.0201)
- (en) C.F. Wellstead, « Taxonomic revision of the Lysorophia, Permo-Carboniferous lepospondyl amphibians », Bulletin of the American Museum of Natural History, vol. 209, , p. 1-90 (lire en ligne)
- (en) J.D. Pardo et J.S. Anderson, « Cranial Morphology of the Carboniferous-Permian Tetrapod Brachydectes newberryi (Lepospondyli, Lysorophia) : New Data from µCT », PLoS ONE, vol. 11, no 8, , e0161823 (DOI 10.1371/journal.pone.0161823)
- (en) M. Szostakiwskyj, J.D. Pardo et J.S. Anderson, « Micro-CT Study of Rhynchonkos stovalli (Lepospondyli, Recumbirostra) with Description of Two New Genera », PLoS ONE, vol. 10, no 6, , e0127307 (DOI 10.1371/journal.pone.0127307)
- (en) S.G. Lucas et N. Suneson, « Amphibian and reptile tracks from the Hennessey Formation (Leonardian, Permian), Oklahoma County, Oklahoma », Oklahoma Geology Notes, vol. 62, , p. 56-62 (lire en ligne)
- (en) L. Marchetti, G. Forte, E. Kustatscher, W.A. DiMichele, S.G. Lucas, G. Roghi, M.A. Juncal, C. Hartkopf-Fröder, K. Krainer, C. Morelli et A. Ronchi, « The Artinskian Warming Event : an Euramerican change in climate and the terrestrial biota during the early Permian », Earth-Science Review, vol. 226, , p. 1-38 (DOI 10.1016/j.earscirev.2022.103922)
- (en) S. Voigt, A. Hminna, H. Saber, J.W. Schneider et H. Klein, « Tetrapod footprints from the uppermost level of the Permian Ikakern Formation (Argana basin, western High Atlas, Morocco) », Journal of African Earth Sciences, vol. 57, no 5, , p. 470-478 (DOI 10.1016/j.jafrearsci.2009.12.003)
- (en) A. Logghe, E. Mujal, L. Marchetti, A. Nel, J.-M. Pouillon, S. Giner, R. Garrouste et J.-S. Steyer, « Hyloidichnus trackways with digit and tail drag traces from the Permian of Gonfaron (Var, France): New insights on the locomotion of captorhinomorph eureptiles », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 573, , p. 110436 (DOI 10.1016/j.palaeo.2021.110436)
- (en) T.M. Foster, G.S. Soreghan, M.J. Soreghan, K.C. Benison et R.D. Elmore, « Climatic and paleogeographic significance of eolian sediment in the Middle Permian Dog Creek Shale (Midcontinent U.S.) », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 402, , p. 12-29 (DOI 10.1016/j.palaeo.2014.02.031)
- (en) W.A. DiMichele, S.H. Mamay, D.S. Chaney, R.W. Hook et W.J. Nelson, « An Early Permian flora with Late Permian and Mesozoic affinities from north-central Texas », Journal of Paleontology, vol. 75, no 2, , p. 449-460 (DOI 10.1666/0022-3360(2001)075˂0449:AEPFWL˃2.0.CO;2)
- (en) W.A. DiMichele, N.J. Tabor, D.S. Chaney et W.J. Nelson, « From wetlands to wet spots: Environmental tracking and the fate of Carboniferous elements in Early Permian tropical floras », dans Greb, S.F. & DiMichele, W.A., Wetlands through time, Boulder, The Geological Society of America Special Paper 399, (DOI 10.1130/2006.2399(11)), p. 223-248
- (en) B.M. Gee, D. Scott et R.R. Reisz, « Reappraisal of the Permian dissorophid Fayella chickashaensis », Canadian Journal of Earth Sciences, vol. 55, no 10, , p. 1103-1114 (DOI 10.1139/cjes-2018-0053)
- (en) R.R. Reisz et M. Laurin, « A reevaluation of the enigmatic Permian synapsid Watongia and its stratigraphic significance », Canadian Journal of Earth Sciences, vol. 41, no 4, , p. 377-386 (DOI 10.1139/e04-016)
- (en) K.D. Angielczyk et C.F. Kammerer, « Non-Mammalian synapsids : the deep roots of the mammalian family tree », dans Zachos, F.E. & Asher, R.J., Handbook of Zoology : Mammalian Evolution, Diversity and Systematics, Berlin, de Gruyter, (ISBN 978-3-11-027590-2), p. 138-139
- (en) H.C. Maddin, C.A. Sidor et R.R. Reisz, « Cranial anatomy of Ennatosaurus tecton (Synapsida: Caseidae) from the Middle Permian of Russia and the evolutionary relationships of Caseidae », Journal of Vertebrate Paleontology, vol. 28, no 1, , p. 160-180 (DOI 10.1671/0272-4634(2008)28[160:CAOETS]2.0.CO;2)
- (en) R.B.J. Benson, « Interrelationships of basal synapsids: cranial and postcranial morphological partitions suggest different topologies », Journal of Systematic Palaeontology, vol. 10, no 4, , p. 601-624 (DOI 10.1080/14772019.2011.631042)
- (en) D.S. Berman, H.C. Maddin, A.C. Henrici, S.S. Sumida, D. Scott et R.R. Reisz, « New primitive Caseid (Synapsida, Caseasauria) from the Early Permian of Germany », Annals of Carnegie Museum, vol. 86, no 1, , p. 43-75 (DOI 10.2992/007.086.0103)
- (en) R. Werneburg, F. Spindler, J. Falconnet, J.-S. Steyer, M. Vianey-Liaud et J.W. Schneider, « A new caseid synapsid from the Permian (Guadalupian) of the Lodève basin (Occitanie, France) », Palaeovertebrata, vol. 45 (2)-e2, , p. 1-36 (DOI 10.18563/pv.45.2.e2).