Caseidae
Les Caseidae forment une famille éteinte et fossile de synapsides basaux ayant vécu du Carbonifère supérieur au Permien moyen il y a entre 300 et 265 millions d’années environ. Les fossiles de ces animaux proviennent de la partie sud-centrale des États-Unis (Texas, Oklahoma, et Kansas), de diverses régions d’Europe (Russie européenne, France, Allemagne, Sardaigne, et Pologne), et peut être d’Afrique du Sud si le genre Eunotosaurus est bien un caséidé comme certains auteurs l’ont proposé en 2021.
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Synapsida |
| Clade | † Caseasauria |
Genres de rang inférieur
Les caséidés présentent une grande diversité taxonomique et morphologique. Les taxons les plus basaux étaient des formes insectivores et omnivores de petites tailles ayant vécu principalement au Carbonifère supérieur et au Permien inférieur, tels Eocasea, Callibrachion, et Martensius. Ce type de caséidé persiste jusqu’aux Permien moyen avec Phreatophasma et peut être Eunotosaurus. Durant le Permien inférieur, le clade est surtout représenté par de nombreuses espèces ayant adoptées un régime alimentaire herbivore. Certaines ont évoluées vers des formes gigantesques pouvant atteindre près de 7 mètres de longueur comme Cotylorhynchus hancocki et Alierasaurus ronchii, faisant d’eux les plus grands synapsides du Permien.
Les caséidés sont considérées comme des composants importants des premiers écosystèmes terrestres de l’histoire des vertébrés car les nombreuses espèces herbivores du groupe sont parmi les premiers tétrapodes terrestres à occuper le rôle de consommateur primaire. Les caséidés ont connu une importante radiation évolutive à la fin du Permien inférieur en devenant, avec les eureptiles Captorhinidae, les herbivores dominants des écosystèmes terrestres à la place des synapsides Edaphosauridae et des Diadectidae.
Présentation
En 2016, des paléontologues ont proposé un mode de vie semi-aquatique pour les genres les plus dérivées comme Cotylorhynchus et Lalieudorhynchus, mais cette hypothèse est contestée par d’autres chercheurs.
Avec un registre fossile s’étendant du Carbonifère supérieur au Permien moyen, les caséidés sont parmi les groupes de synapsides basaux (autrefois connus sous le nom de “pélycosaures”) ayant la plus grande répartition stratigraphique. Ils représentent également l’un des deux seuls groupes de synapsides basaux (avec les Varanopidae) à survivre dans des communautés terrestres dominées par les thérapsides. Ainsi, les derniers caséidés connus proviennent des strates du milieu du Permien moyen (Roadien supérieur-Wordien, et possiblement du Capitanien) de France et de Russie d’Europe, où ils cohabitaient notamment avec des dinocéphales[N 1]. Ces derniers caséidés montrent encore une certaine diversité morphologique avec des herbivores de tailles moyennes à grandes (Ennatosaurus et Lalieudorhynchus), ainsi que de petites formes prédatrices ou omnivores comme Phreatophasma et possiblement Eunotosaurus. Les caséidés sont pour l’instant inconnus dans les strates du Permien supérieur et disparaissent probablement à la fin du Permien moyen. Ils furent remplacés par les paréiasaures (à la denture similaire) et les dicynodontes.
Description
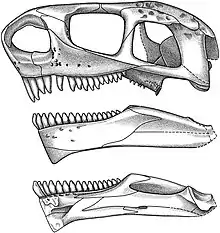
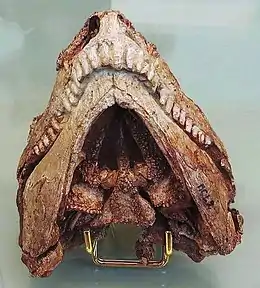
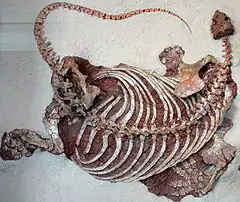
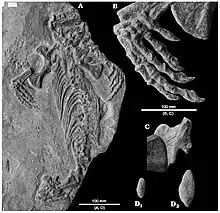
Les caséidés mesuraient de moins d’un mètre à près de 7 m de longueur[1] - [2] - [3]. Ils possédaient une petite tête plus large que haute et au museau incliné vers l’avant, un cou très court, une longue queue, des membres antérieurs robustes, et un corps aux proportions variables selon leur régime alimentaire. Les petites espèces insectivores comme Eocasea avaient un tronc non élargi[4]. D’autres, au régime alimentaire omnivore comme Martensius, présentait une cage thoracique à peine élargi, un crâne plus allongé, des narines plus petites, et un museau moins incliné vers l’avant que chez les caséidés herbivores[5]. Ces derniers se caractérisaient par leur crâne disproportionnellement petit comparé à la taille du corps. Le squelette postcrânien montre en effet une augmentation spectaculaire du volume de la cage thoracique qui devient très large et en forme de tonneau, probablement pour accueillir un intestin particulièrement développé, nécessaire à la digestion de végétaux riches en fibres. Chez ces formes, le crâne possède de très grandes narines externes et une région faciale très courte avec une forte inclinaison vers l’avant de l’extrémité du museau lequel surplombe nettement la rangée dentaire. Les fosses temporales sont également relativement grandes (en particulier chez Ennatosaurus), les supratemporaux sont de grandes tailles, et, sur la surface occipitale, les processus paroccipitaux sont massivement développés, établissant de puissants contacts d'appui avec les squamosaux[6]. La surface dorsale du crâne est recouverte de nombreuses petites dépressions. Celles-ci suggèrent la présence de larges écailles sur la tête de ces animaux[7]. De nombreux foramens labiaux disposés parallèlement au bord ventral du prémaxillaire et du maxillaire, ainsi que le long de la marge dorsale du dentaire, suggère la présence de « lèvres » écailleuses qui devaient masquer la denture lorsque les mâchoires étaient fermées[8] - [7]. Les dents, simplement coniques et pointues chez les espèces insectivores, adoptent chez les espèces herbivores une morphologie feuillue ou spatulée, et sont pourvues de cuspules plus ou moins nombreuses. De nombreuses petites dents ornaient également plusieurs os du palais. Les espèces herbivores ne montrent pas une tendance évolutive simple vers l’augmentation de la complexité dentaire[9]. Ainsi, les dents des taxons basaux Casea et Arisierpeton possèdent trois cuspules[10] - [11] tout comme chez les formes plus dérivées Cotylorhynchus et Caseopsis[10]. Ennatosaurus et Euromycter, qui occupent une position phylogénétique intermédiaire, possèdent des dents portant respectivement 5 à 7 cuspules et 5 à 8 cuspules[9] - [12]. Angelosaurus, l’un des caséidés les plus dérivés, possèdent des dents à 5 cuspules[10]. Chez Angelosaurus les dents présentent une morphologie bulbeuse avec des couronnes très courtes et larges. Leur robustesse et l’usure importante qu’elles présentent, indiquent qu’Angelosaurus devait se nourrir de végétaux plus coriaces que ceux dont se nourrissait la plupart des autres caséidés végétariens[10]. Les caséidés herbivores présentent également des adaptations alimentaires très différentes de celles observées chez un autre groupe de synapsides basaux, les Edaphosauridae. Ces derniers disposaient, en plus de la denture marginale, d’une batterie dentaire constituée de nombreuses dents situées à la fois sur le palais et sur la surface interne de la mâchoire inférieure. Chez les caséidés herbivores, les dents palatines sont plus petites et la surface interne des mâchoires inférieures ne porte aucunes dents. A la place d’une batterie dentaire, ils avaient une langue massive (comme l’indique la présence d’un appareil hyoïde très développée retrouvé chez Ennatosaurus et Euromycter) peut être rugueuse, avec laquelle ils devaient comprimer la nourriture contre les dents palatines[10] - [8].
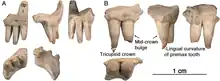

Les membres antérieurs des caséidés sont souvent plus robustes que les membres postérieurs. Il a en effet été constaté que les os des membres antérieurs ont gagné en robustesse dès le début de l’évolution du groupe, avant l’apparition d’espèces de grandes tailles, alors que les membres postérieurs restaient eux plus graciles. Ces caractéristiques suggèrent que le renforcement initial des membres antérieurs était probablement lié à une fonction particulière comme creuser, et que ce caractère a par la suite était exaptée par les caséidés plus dérivés et plus gros, pour supporter leurs poids pouvant atteindre plusieurs centaines de kilos[1]. Au cours de leur histoire évolutive, les caséidés montrent également une réduction de leur formule phalangienne[N 2]. Les caséidés les plus basaux comme Eoasea, Callibrachion, et Martensius, possédaient la condition plésiomorphe des premiers amniotes avec une formule phalangienne de 2-3-4-5-3 pour les mains et 2-3-4-5-4 pour les pieds[4] - [13] - [5]. Chez Euromycter, la main avait une formule de 2-3-4-4-3 (le pied n’est pas connu)[12]. Chez les formes les plus dérivées comme Cotylorhynchus, les mains et les pieds montrent une formule phalangienne de 2-2-3-3-2[N 3] - [14] - [15] - [10] - [16]. Parallèlement à cette réduction du nombre de phalanges, les proportions des autopodes changent également chez les caséidés dérivés avec des métacarpes, des métatarses, et des phalanges qui deviennent plus courts et plus larges. A l’extrême de cette spécialisation, le genre Angelosaurus possède des phalanges unguéales courtes, larges, et lisses qui ressemblent à des sabots plutôt qu’à des griffes[10] - [17].
Empreintes de pas
De nombreuses pistes de vertébrés ont été proposées comme appartenant à des Caseidae. Au début des années 2000, de grandes empreintes de pas connues sous le nom de Brontopus giganteus et provenant du bassin Permien de Lodève dans le sud de la France, furent considérées comme appartenant soit à un caséidé soit à un thérapside dinocéphale[18]. En 2019, Lorenzo Marchetti et des collègues ont toutefois déterminé que les dinocéphales étaient les auteurs les plus probables de l’ichnogenre Brontopus[19]. En 2012, Rafael Costa da Silva et des collègues ont proposé que l’ichnogenre Chelichnus, largement répandu dans les faciès désertiques du Permien d’Europe, d’Amérique du Nord et d’Amérique du Sud, pourrait représenter des empreintes de pas de caséidés[20]. En 2019, Marchetti et des collègues ont toutefois réinterprété Chelichnus comme un nomen dubium et un taphotaxon, ce type de traces présentant de fausses caractéristiques anatomiques générées par la locomotion sur une paléosurface inclinée et meuble (anciennes dunes)[21]. En 2014, Eva Sacchi et des collègues décrivirent l’ichnotaxon Dimetropus osageorum à partir d’une centaine d’empreintes de pas isolées ou organisées en pistes et provenant du Permien inférieur de la formation de Wellington en Oklahoma. L’étude morphologique de ces empreintes et leur comparaison avec des squelettes de tétrapodes a révélé qu’elles appartiennent probablement à un grand caséidé de taille comparable à Cotylorhynchus romeri (ce dernier provenant de strates plus récentes)[22]. D’après Sacchi et des collègues, quelques empreintes de pas du bassin de Lodève (formation géologique non précisée) sont similaires à celles de la formation de Wellington et ces auteurs les désignent comme Dimetropus cf. osageorum[22]. L’étude de Sacchi et al. démontre également que l’ichnogenre Dimetropus présente une grande variation morphologique et que ses producteurs peuvent être attribués à différents groupes zoologiques parmi les synapsides basaux et pas seulement aux Sphenacodontidae comme on le pensait autrefois[22]. En 2021, Rafel Matamales-Andreu et des collègues ont attribué à un caséidé des empreintes de pas trouvées dans le Permien inférieur (Artinskien-Kungurien) de la formation de Port des Canonge à Mallorque. Ces empreintes ressemblent à celles de D. osageorum mais elles présentent aussi des différences. Ces empreintes sont laissées en nomenclature ouverte en tant que cf. Dimetropus sp.. Elles sont toutefois plus petites que celles de D. osageorum et auraient été produites par un caséidé de taille modeste aux proportions comparables à Ennatosaurus[23].
Paléobiologie
Régimes alimentaires
Au cours de leur histoire évolutive, les caséidés sont passés d’un régime alimentaire faunivore à herbivore, un schéma qui s’est également produit de façon indépendante chez d’autres groupes de tétrapodes du Carbonifère et du Permien tels les Captorhinidae et les Edaphosauridae. Les caséidés les plus anciens et les plus basaux, comme Eocasea du Carbonifère supérieur et Callibrachion du Permien basal, avaient une cage thoracique non expansée et une denture composée de très petites dents coniques simples suggérant un régime alimentaire insectivore. Un autre caséidé basal, Martensius, possède un tronc en forme de tonneau légèrement élargi ainsi qu’une denture dans laquelle des dents indiquant un régime insectivore chez le juvénile ont été remplacées ontogénétiquement chez l’adulte par des dents suggérant un régime omnivore. Chez Martensius, l’adulte était toujours capable de se nourrir d’insectes, mais il possède également une amorce des spécialisations à un régime alimentaire herbivore présentes chez les caséidés plus tardifs, comme un museau relativement court et faiblement incliné vers l’avant, et une denture qui est presque homodonte sur la mâchoire supérieure et qu’il est totalement sur la mandibule. La séquence d’acquisition des traits dentaires chez Martensius suggère que le traitement intestinal de la végétation a précédé le traitement oral dans l’évolution de l’herbivorie des caséidés. Un régime insectivore juvénile aurait fourni l’opportunité d’une introduction réussie dans l’intestin de micro-organismes capables de cellulolyse endosymbiotique, en particulier s’il s’agissait d’insectes herbivores lesquels abritent de tels micro-organismes dans leur viscères. Par la suite, les caséidés ont adopté un régime alimentaire strictement végétarien et ont évolué vers des formes gigantesques. Ces caséidés herbivores avaient des dents spatulées équipées de cuspules plus ou moins nombreuses et une cage thoracique très élargie et en forme de tonneau qui devait abriter des intestins très développés nécessaires à la digestion de végétaux à faible valeur nutritive. Cette adaptation expliquerait en partie la diversification et l’expansion du groupe à la fin du Permien inférieur et au Permien moyen, car elle leur a permis d’exploiter une ressource végétale riche en fibres qui était alors devenue abondante et répandue. Néanmoins, de petits caséidés probablement faunivores comme Phreatophasma semblent avoir persisté jusqu’au Permien moyen[4] - [13] - [24] - [5].
Mode de vie semi aquatique vs terrestre

Les caséidés sont généralement considérés comme des animaux principalement terrestres. Everett C. Olson notamment considérait que le degré d’ossification du squelette, les pieds et les mains relativement courts, les griffes massives, les membres aux muscles extenseurs très puissants, et le sacrum solide, suggéraient fortement un mode de vie terrestre. Olson n’excluait pas que les caséidés aient passé quelque temps dans l’eau, mais il considérait que la locomotion sur la terre ferme était un aspect important de leur mode de vie[10]. Il a été suggéré que les membres antérieurs très puissants, avec des muscles extenseurs forts et très tendineux, ainsi que des griffes très massives, pouvaient servir à déterrer des racines ou des turbercules[10]. Toutefois, le cou très court impliquait une faible amplitude de mouvements verticaux de la tête qui interdisait aux grandes espèces de se nourrir au ras du sol[25]. Une autre hypothèse suggère que les caséidés auraient pu se servir de leurs puissants membres antérieurs pour rabattre vers eux de grandes plantes qu’ils auraient arrachées avec leurs griffes puissantes[10]. D’autres hypothèses suggèrent que certains caséidés comme Cotylorhynchus se servaient de leurs membres aux griffes puissantes comme moyen de défense contre les prédateurs, ou lors d’activités intraspécifiques liés notamment à la reproduction. Selon Olson, un élément intéressant à ce sujet est que presque tous les spécimens connus de l’espèce Cotylorhynchus hancocki ont une à dix côtes cassées ayant guéries au cours de leur vie[15] - [10]. Enfin, pour certains auteurs, les grands caséidés dérivés auraient été des animaux semi-aquatiques qui se servaient de leurs mains aux larges griffes comme des pagaies, lesquelles pouvaient également être utilisées pour manipuler les plantes dont ils se nourrissaient[25].
En effet, en 2016, Markus Lambertz et des collègues remirent en cause le mode de vie terrestre des grands caséidés comme Cotylorhynchus. Ces auteurs ont montré que la microstructure osseuse de l’humérus, du fémur, et des côtes de spécimens adultes et immatures de Cotylorhynchus romeri ressemblait davantage à celle d’animaux aquatiques plutôt qu’à celle d’animaux terrestres, avec un os à la structure très spongieuse, au cortex extrêmement fin, et à l’absence de canal médullaire distinct. Cette faible densité osseuse aurait été un handicap pour des animaux pesant plusieurs centaines de kilos au mode de vie strictement terrestre. Lambertz et al. ont également estimé que les articulations entre les vertèbres et les côtes dorsales ne permettaient que de faibles amplitudes de mouvement de la cage thoracique, limitant ainsi la ventilation costale. Pour pallier cela, ils ont proposé qu’un proto-diaphragme devait être présent pour faciliter la respiration, en particulier dans un milieu aquatique. Ces auteurs estiment également que les paléoclimats arides auxquels correspondent les gisements fossilifères à caséidés ne sont pas incompatibles avec un mode de vie aquatique de ces animaux. Ces paléoenvironnements incluaient en fait un nombre non négligeable de plans d’eau (cours d’eau, lacs et lagunes). Les conditions arides auraient pu être la raison pour laquelle les animaux se seraient parfois rassemblés et seraient finalement morts. De plus, les environnements arides présentent une faible densité de plantes, ce qui exigerait encore plus d’efforts locomoteurs pour satisfaire les demandes énergétiques de ces animaux. Ainsi pour Lambertz et al., les grands caséidés comme Cotylorhynchus devaient être des animaux principalement aquatiques qui ne devaient s’aventurer sur terre qu’à des fins de reproduction ou de thermorégulation[25].
Cette hypothèse a été contestée par Kenneth D. Angielczyk et Christian F. Kammerer au motif que la faible densité osseuse des caséidés identifiée par Lambertz et al. ne ressemble pas à celle d’animaux semi-aquatiques. Ces derniers tendent à avoir un squelette plus fortement ossifié pour assurer un contrôle passif de la flottabilité et une stabilité accrue contre l’action du courant et des vagues. La microstructure osseuse des caséidés ressemble davantage à ce qui est observé chez les animaux vivant en haute mer, comme les cétacés et les pinnipèdes, qui mettent l'accent sur une maniabilité élevée, une accélération rapide et un contrôle hydrodynamique de la flottabilité. Toutefois, la morphologie des caséidés était totalement incompatible avec un mode de vie pélagique. Ainsi, en raison de ces données inhabituelles, Angielczyk et Kammerer considèrent que les éléments disponibles sont encore insuffisants pour remettre en question le mode de vie terrestre plus largement supposé des caséidés[2]. Robert Reisz et des collègues contestent également le mode de vie semi-aquatique supposé des caséidés sur le fait que ces derniers ne possèdent aucunes adaptations morphologiques à un mode de vie aquatique et, dans le cas de l’espèce Cotylorhynchus romeri, sur l’interprétation que cet animal vivait dans un environnement sec une partie de l’année comme l’indique la présence de nombreux squelettes de l’amphibien Brachydectes conservés en estivation et du dipneuste Gnathorhiza, un autre estivateur bien connu[8].
En 2022, Ralf Werneburg et des collègues ont proposé un mode de vie semi-aquatique un peu différent, dans lequel les grands caséidés comme Lalieudorhynchus (dont la texture osseuse est encore plus ostéoporotique que celle de Cotylorhynchus) seraient des équivalents écologiques des hippopotames actuels, passant une partie de leur temps dans l’eau (en étant des marcheurs subaquatiques plutôt que des animaux nageurs) mais venant sur terre pour se nourrir[26].
Évolution
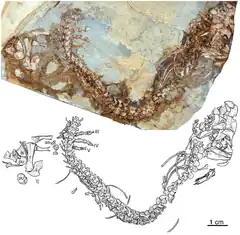

Les caséidés apparaissent pour la première fois dans les archives fossiles à la fin du Carbonifère et sont déjà présents à la fois en Amérique du Nord et en Europe avec de petites formes prédatrices comme Eocasea et Datheosaurus[4] - [13]. Ces caséidés faunivores existent également au début du Permien inférieur, comme Callibrachion[13], et ont peut-être existé jusqu’à la base du Permien moyen avec Phreatophasma[24]. Durant le Permien, les représentants du clade ont principalement évolué vers l’herbivorie. Ces caséidés herbivores ont connu une importante radiation évolutive au cours de la seconde moitié du Permien inférieur en devenant, avec les eureptiles Moradisaurinae, les principaux herbivores des écosystèmes terrestres à la place des Edaphosauridae et des Diadectidae. Le déclin des édaphosauridés et la propagation des caséidés coïncide avec une aridification de l’environnement survenue à partir de l’Artinskien qui aurait favorisé l’expansion des caséidés[27] - [26]. Les données sédimentologiques et taphonomiques indiquent en effet que la majorité des Edaphosauridae affectionnaient les habitats humides (leurs restes étant retrouvés principalement dans des dépôts lacustres et marécageux) tandis que les caséidés herbivores vivaient généralement dans des biotopes plus secs où les étangs et les cours d’eau étaient éphémères[28]. Les derniers caséidés datent du Permien moyen et sont principalement connu en Europe avec Phreatophasma et Ennatosaurus du Roadien-Wordien de Russie[29] - [30] - [31], Alierasaurus du Roadien-(Wordien ?) de Sardaigne[32] - [33] - [26], et Lalieudorhynchus du Wordien supérieur-Capitanien inférieur du sud de la France[26]. En Amérique du Nord, Angelosaurus romeri et Cotylorhynchus bransoni de la formation de Chickasha en Oklahoma datent probablement du Roadien inférieur, tandis que les caséidés de la formation de San Angelo au Texas sont légèrement plus anciens et peuvent chevaucher la limite Kungurien-Roadien sans qu’il ne soit encore possible de préciser s’ils datent du Kungurien terminal ou du Roadien basal[34].
Paléobiogéographie
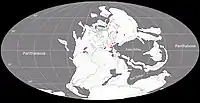
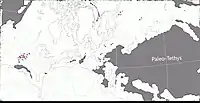
Des fossiles de caséidés ont été découverts dans le sud et le centre des États-Unis (Texas, Oklahoma, Kansas), en France, en Allemagne, en Pologne, en Sardaigne, et en Russie européenne. Cette distribution géographique correspond à la ceinture paléoéquatoriale de la Pangée durant le Carbonifère et le Permien, à l’exception des gisements Russes qui se trouvaient au niveau du 30e parallèle nord où régnait un climat plus tempéré. L’absence en Russie de gisements de vertébrés terrestres antérieurs au Kungurien ne permet pas de connaitre le moment précis de l’arrivé des caséidés dans cette région du monde[24]. Selon Werneburg et des collègues la présence de caséidés à cette paléolatitude suggère leur possible existence dans les régions tempérées du Gondwana[26]. Une possible occurrence gondwanienne a été proposée dès les années 1990 par Michael S.Y. Lee et en 2021 par Asher J. Lichtig et Spencer G. Lucas, qui ont réinterprété le taxon Eunotosaurus du Permien moyen d’Afrique du Sud comme un petit caséidé fouisseur[35] - [36]. Entre ces deux dates, d’autres chercheurs ont classé Eunotosaurus comme un parareptile[37] ou un pantestudines (groupe incluant les tortues et tous leurs proches parents disparus)[38] - [39]. Si les trois premiers auteurs ont raison, Eunotosaurus serait le premier caséidé trouvé dans l’hémisphère sud et le dernier représentant connu de la famille avec un âge Capitanien terminal pour les spécimens les plus récents[40]. Ailleurs dans le Gondwana, la présence de l’ichnotaxon Dimetropus dans le Permien du Maroc suggère la découverte future de synapsides basaux (incluant les caséidés) dans les bassins permiens d’Afrique du Nord, lesquels se trouvaient également dans la ceinture paléoéquatoriale et constituaient l’une des principales voies migratoires entre les hémisphères nord et sud, et entre l'Amérique du Nord et l'Europe[41] - [42].
Phylogénie
La famille des Caseidae fut érigée par Samuel Wendell Williston en 1911[43]. En 1940, Alfred Sherwood Romer et L.W. Price placèrent les Caseidae et les Edaphosauridae dans un même sous-ordre qu’ils nommèrent Edaphosauria[44]. Ce groupe est aujourd’hui abandonné, les édaphosauridés étant plus proche des Sphenacodontia (avec lesquels ils forment le clade des Sphenacomorpha) que des caséidés[28]. Ces derniers sont regroupés avec les Eothyrididae dans le clade des Caseasauria, lesquels représentent les synapsides les plus basaux[45].
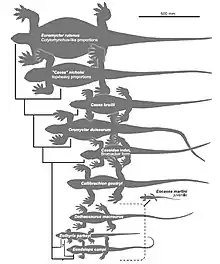
La première analyse phylogénétique des Caseidae fut publiée en 2008 par Hillary C. Maddin et des collègues. Dans cette analyse, le genre Oromycter occupe la position la plus basale au sein du clade. Ennatosaurus constitue le groupe frère d’un clade contenant Cotylorhynchus romeri et Angelosaurus dolani. Cette analyse révèle pour la première fois la paraphylie du genre Casea, l’espèce “Casea’’ rutena représentant un genre distinct qui sera nommé en 2011 Euromycter[9] - [46].
Ci-dessous, le premier cladogramme des Caseidae publié par Maddin et al. en 2008[9].
Une autre analyse phylogénétique réalisée en 2012 par Benson inclut le genre Trichasaurus qui occupe une position intermédiaire entre Casea broilii et “Casea” rutena. Ennatosaurus est identifié comme le groupe frère d’un clade incluant Angelosaurus et les trois espèces de Cotylorhynchus. Au sein de ce dernier genre, Cotylorhynchus romeri est le groupe frère des deux espèces C. hancocki et C. bransoni[47].
Ci-dessous, le cladogramme des Caseasauria publié par Benson en 2012[47].
En 2015, Marco Romano et Umberto Nicosia ont publié la première étude cladistique incluant presque tous les Caseidae (à l’exception d’Alierasaurus ronchii de Sardaigne, alors jugé trop fragmentaire). Cette étude résout une nouvelle fois le genre Casea comme paraphylétique, l’espèce “Casea’’ nicholsi représentant un genre distinct nom nommé. Dans leur analyse la plus parcimonieuse, Ruthenosaurus est étroitement apparenté à Cotylorhynchus hancocki. Ennatosaurus occupe une position plus élevée que dans les analyses précédentes et est identifié comme plus étroitement apparenté à Angelosaurus dolani. Toutefois, la relation étroite entre A. dolani et Ennatosaurus est peut être faussée par l'extrême incomplétude du matériel de l’espèce Nord-Américaine[16].
Ci-dessous, le cladogramme des Caseidae utilisant le principe de parsimonie publié par Romano et Nicosia en 2015[16].
Une analyse phylogénétique publiée en 2016 par Neil Brocklehurst et des collègues se démarque en incluant pour la première fois les genres Callibrachion et Datheosaurus qui sont identifiés comme des caséidés basaux occupant une position intermédiaire entre Eocasea et Oromycter[45]
Ci-dessous, l’analyse phylogénétique publiée par Neil Brocklehurst et des collègues en 2016[45].
En 2017, Romano et des collègues ont publié la première analyse phylogénétique incluant le genre Alierasaurus. Celui-ci est récupéré comme le taxon frère du genre Cotylorhynchus[48].
Ci-dessous, l’analyse phylogénétique publiée par Romano et des collègues en 2017[48].
En décrivant l’espèce Martensius bromackerensis en 2020, Berman et des collègues ont publié deux cladogrammes dans lesquels Martensius est identifié comme l’un des caséidés les plus basaux, et est positionné juste au-dessus d’Eocasea martini du Carbonifère supérieur. Dans le premier cladogramme, la position des caséidés restant est mal résolue. Dans le second cladogramme, Casea broilii est positionné au-dessus de Martensius bromackerensis, et est suivie d'une polytomie entre Oromycter dolesorum, Trichasaurus texensis et un clade de caséidés restants. Au sein de ces taxons restants, une séquence de taxons ramifiés commence par Casea nicholsi, suivi par Euromycter rutenus, puis Ennatosaurus tecton, puis Angelosaurus romeri, puis un clade apical des trois espèces de Cotylorhynchus plus Alierasaurus ronchii. Dans ce clade final, Cotylorhynchus hancocki et C. bransoni sont des taxons frères et le clade forme une polytomie avec C. romeri et Alierasaurus ronchii[5].
Ci-dessous, les deux cladogrammes des Caseidae publié par Berman et des collègues en 2020[5].
| Caseidae | |
| Caseidae | |
En 2022, Werneburg et des collègues décrivent le genre Lalieudorhynchus et publient une analyse phylogénétique qui conclut à la paraphylie des genres Angelosaurus et Cotylorhynchus, lesquels ne seraient représentés que par leur espèce type. Dans cette analyse, l’espèce Cotylorhynchus romeri est positionnée juste au-dessus du genre Angelosaurus, et forme une polytomie avec un clade contenant Ruthenosaurus et Caseopsis et un autre clade contenant Alierasaurus, les deux autres espèces de Cotylorhynchus et Lalieudorhynchus. Au sein de ce dernier clade, Alierasaurus est le groupe frère de “Cotylorhynchus” bransoni et d’un clade plus dérivé incluant Lalieudorhynchus et “Cotylorhynchus” hancocki[26].
Ci-dessous, le cladogramme publié par Werneburg et des collègues en 2022[49].
Liens externes
- Ressources relatives au vivant :
Notes et références
Notes
- Les dinocéphales ne sont connus en France que par leurs empreintes de pas attribuées à l’ichnogenre Brontopus. Ce dernier a également été trouvé dans la formation d’Abrahamskraal en Afrique du Sud où les restes squelettiques des dinocéphales sont abondants. En Russie, le caséidé Ennatosaurus est présent dans l’assemblage de Mezen, lequel comprend également une espèce encore non décrite de dinocéphale antéosauridé.
- La formule phalangienne correspond au nombre de phalanges constituant chaque doigts des mains et des pieds des tétrapodes. Elle s’énumère en partant du doigt I (correspondant chez l’homme au pouce et au gros orteil) jusqu’au doigt V (l’équivalent de l’auriculaire et du petit orteil).
- En 1962, Olson et Barghusen avaient signalé chez l’espèce Cotylorhynchus bransoni un pied à la formule phalangienne de 2-2-2-3-2, soit une formule plus réduite que chez l’espèce type C. romeri. En 2015, Romano et Nicosia ont toutefois démontré que le doigt III du pied de cette espèce comptait bien trois phalanges et non deux comme le croyait Olson et Barghusen. En conséquence, la formule phalangienne du pied de C. bransoni était 2-2-3-3-2 comme chez C. romeri.
Références taxonomiques
- (en) Référence Paleobiology Database : Caseidae Williston, 1911
Références
- (en) M. Romano, « Long bone scaling of caseid synapsids: a combined morphometric and cladistic approach », Lethaia, vol. 50, no 4, , p. 511-526 (DOI 10.1111/let.12207)
- (en) K.D. Angielczyk et C.F. Kammerer, « Non-Mammalian synapsids: the deep roots of the mammalian family tree », dans Zachos, F.E. & Asher, R.J., Mammalian Evolution, Diversity and Systematics, Berlin, Boston, De Gruyter, (ISBN 9783110341553), p. 117–198
- (en) M. Romano, P. Citton, S. Maganuco, E. Sacchi, M. Caratelli, A. Ronchi et U. Nicosia, « New basal synapsid discovery at the Permian outcrop of Torre del Porticciolo (Alghero, Italy) », Geological Journal, vol. 54, no 3, , p. 1554–1566 (DOI 10.1002/gj.3250)
- (en) R.R. Reisz et J. Fröbisch, « Oldest caseid synapsid from the late Pennsylvanian of Kansas, and the evolution of herbivory in terrestrial vertebrates », PLoS One, vol. 9, no 4, , e94518 (PMID 24739998, PMCID 3989228, DOI 10.1371/journal.pone.0094518)
- (en) D.S. Berman, H.C. Maddin, A.C. Henrici, S.S. Sumida, D. Scott et R.R. Reisz, « New primitive Caseid (Synapsida, Caseasauria) from the Early Permian of Germany », Annals of Carnegie Museum, vol. 86, no 1, , p. 43-75 (DOI 10.2992/007.086.0103)
- (en) T.S. Kemp, « Pelycosaurs », dans Kemp, T.S., Mammal-like reptiles and the origin of Mammals, London, Academic Press, (ISBN 978-0124041202), p. 39
- (en) M. Romano, N. Brocklehurst et J. Fröbisch, « The postcranial skeleton of Ennatosaurus tecton (Synapsida, Caseidae) », Journal of Systematic Paleontology, vol. 16, no 13, , p. 1097-1122 (DOI 10.1080/14772019.2017.1367729)
- (en) R.R. Reisz, D. Scott et S.P. Modesto, « Cranial Anatomy of the Caseid Synapsid Cotylorhynchus romeri, a Large Terrestrial Herbivore From the Lower Permian of Oklahoma, U.S.A », Frontiers in Earth Science, vol. 10, , p. 1-19 (DOI 10.3389/feart.2022.847560)
- (en) H.C. Maddin, C.A. Sidor et R.R. Reisz, « Cranial anatomy of Ennatosaurus tecton (Synapsida: Caseidae) from the Middle Permian of Russia and the evolutionary relationships of Caseidae », Journal of Vertebrate Paleontology, vol. 28, no 1, , p. 160-180 (DOI 10.1671/0272-4634(2008)28[160:CAOETS]2.0.CO;2)
- (en) E.C. Olson, « The family Caseidae », Fieldianna (Geology), vol. 17, , p. 225–349
- (en) R.R. Reisz, « A small caseid synapsid, Arisierpeton simplex gen. et sp. nov., from the early Permian of Oklahoma, with a discussion of synapsid diversity at the classic Richards Spur locality », PeerJ, vol. 7:e6615, , p. 1-20 (DOI 10.7717/peerj.6615, lire en ligne)
- D. Sigogneau-Russell et D.E. Russell, « Étude du premier caséidé (Reptilia, Pelycosauria) d’Europe occidentale », Bulletin du Muséum national d'Histoire naturelle Série 3, vol. 38, no 230, , p. 145-215 (lire en ligne)
- (en) F. Spindler, J. Falconnet et J. Fröbisch, « Callibrachion and Datheosaurus, two historical and previously mistaken basal caseasaurian synapsids from Europe », Acta Palaeontologica Polonica, vol. 361, no 3, , p. 597-616 (DOI 10.4202/app.00221.2015)
- (en) J.W. Stovall, L.I. Price et A.S. Romer, « The Postcranial Skeleton of the Giant Permian Pelycosaur Cotylorhynchus romeri », Bulletin of the Museum of Comparative Zoology, vol. 135, no 1, , p. 1-30
- (en) E.C. Olson, « Late Permian terrestrial vertebrates, U.S.A and U.S.S.R. », Transactions of the American Philosophical Society, New Series, vol. 52, , p. 1-224 (DOI 10.2307/1005904)
- (en) M. Romano et U. Nicosia, « Cladistic analysis of Caseidae (Caseasauria, Synapsida): using the gap-weighting method to include taxa based on incomplete specimens », Palaeontology, vol. 58, no 6, , p. 1109–1130 (DOI 10.1111/pala.12197)
- (en) A. Ronchi, E. Sacchi, M. Romano et U. Nicosia, « A huge caseid pelycosaur from north-western Sardinia and its bearing on European Permian stratigraphy and palaeobiogeography », Acta Palaeontologica Polonica, vol. 56, no 4, , p. 723-738 (DOI 10.4202/app.2010.0087)
- G. Gand, J. Garric, G. Demathieu et P. Ellenberger, « La palichnofaune de vertébrés tétrapodes du Permien supérieur du bassin de Lodève (Languedoc-France) », Palaeovertebrata, vol. 29, no 1, , p. 1-82 (lire en ligne)
- (en) L. Marchetti, H. Klein, M. Buchwitz, A. Ronchi, R.M.H. Smith, W.J. De Klerk, L. Sciscio et G.H. Groenewald, « Permian-Triassic vertebrate footprints from South Africa: Ichnotaxonomy, producers and biostratigraphy through two major faunal crises », Gondwana Research, vol. 72, , p. 139-168 (DOI 10.1016/j.gr.2019.03.009)
- (en) R.C. Silva, F.A. Sedor et A.C.S. Fernandes, « Fossil footprints from the Late Permian of Brazil: An example of hidden biodiversity », Journal of South American Earth Sciences, vol. 38, , p. 31-43 (DOI 10.1016/j.jsames.2012.05.001)
- (en) L. Marchetti, S. Voigt et S.G. Lucas, « An anatomy-consistent study of the Lopingian eolian tracks of Germany and Scotland reveals the first evidence of the end-Guadalupian mass extinction at low paleolatitudes of Pangea », Gondwana Research, vol. 73, , p. 3-53 (DOI 10.1016/j.gr.2019.03.013)
- (en) E. Sacchi, R. Cifelli, P. Citton, U. Nicosia et M. Romano, « Dimetropus osageorum n. isp. from the Early Permian of Oklahoma (USA) : A Trace and its Trackmaker », Ichnos: An International Journal for Plant and Animal Traces, vol. 21, no 3, , p. 175-192 (DOI 10.1080/10420940.2014.933070)
- (en) R. Matamales-Andreu, E. Mujal, À. Galobart et J. Fortuny, « Insight on the evolution of synapsid locomotion based on tetrapod tracks from the lower Permian of Mallorca (Balearic Islands, western Mediterranean) », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 579, , p. 110589 (DOI 10.1016/j.palaeo.2021.110589)
- (en) N. Brocklehurst et J. Fröbisch, « A re-examination of the enigmatic Russian tetrapod Phreatophasma aenigmaticum and its evolutionary implications », Fossil Record, vol. 20, no 1, , p. 87-93 (DOI 10.5194/fr-20-87-2017)
- (en) M. Lambertz, C.D. Shelton, F. Spindler et S.F. Perry, « A caseian point for the evolution of a diaphragm homologue among the earliest synapsids », Annals of the New York Academy of Sciences, vol. 1385, , p. 1-18 (DOI 10.1111/nyas.13264)
- (en) R. Werneburg, F. Spindler, J. Falconnet, J.-S. Steyer, M. Vianey-Liaud et J.W. Schneider, « A new caseid synapsid from the Permian (Guadalupian) of the Lodève basin (Occitanie, France) », Palaeovertebrata, vol. 45 (2)-e2, , p. 1-36 (DOI 10.18563/pv.45.2.e2)
- (en) L. Marchetti, G. Forte, E. Kustatscher, W.A. DiMichele, S.G. Lucas, G. Roghi, M.A. Juncal, C. Hartkopf-Fröder, K. Krainer, C. Morelli et A. Ronchi, « The Artinskian Warming Event: an Euramerican change in climate and the terrestrial biota during the early Permian », Earth-Science Reviews, vol. 226, , p. 103922 (DOI 10.1016/j.earscirev.2022.103922)
- (en) F. Spindler, S. Voigt et J. Fischer, « Edaphosauridae (Synapsida, Eupelycosauria) from Europe and their relationship to North American representatives », PalZ, vol. 94, no 1, , p. 125-153 (DOI 10.1007/s12542-019-00453-2)
- (en) V.K. Golubev, « The faunal assemblages of Permian terrestrial vertebrates from Eastern Europe », Paleontological Journal, vol. 34, no Suppl. 2, , S211–S224 (lire en ligne)
- (en) V.K. Golubev, « Event Stratigraphy and Correlation of Kazanian Marine Deposits in the Stratotype Area », Stratigraphy and geological Correlation, vol. 9, no 5, , p. 454-472 (lire en ligne)
- (en) V.K. Golubev, « Dinocephalian Stage in the History of the Permian Tetrapod Fauna of Eastern Europe », Paleontological Journal, vol. 49, no 12, , p. 1346-1352 (DOI 10.1134/S0031030115120059)
- (en) P. Citton, A. Ronchi, S. Maganuco, M. Caratelli, U. Nicosia, E. Sacchi et M. Romano, « First tetrapod footprints from the Permian of Sardinia and their palaeontological and stratigraphical significance », Geological Journal, vol. 54, no 4, , p. 2084-2098 (DOI 10.1002/gj.3285)
- (en) J.W. Schneider, S.G. Lucas, F. Scholze, S. Voigt, L. Marchetti, H. Klein, S. Opluštil, R. Werneburg, V.K. Golubev, J.E. Barrick, T. Nemyrovska, A. Ronchi, M.O. Day, V.V. Silantiev, R. Rößler, H. Saber, U. Linnemann, V. Zharinova et S-Z. Shen, « Late Paleozoic–early Mesozoic continental biostratigraphy — Links to the Standard Global Chronostratigraphic Scale », Palaeoworld, vol. 29, no 2, , p. 186-238 (DOI 10.1016/j.palwor.2019.09.001)
- (en) M. Laurin et R.W. Hook, « The age of North America’s youngest Paleozoic continental vertebrates : a review of data from the Middle Permian Pease River (Texas) and El Reno (Oklahoma) Groups », BSGF – Earth Sciences Bulletin, vol. 193, no 10, , p. 1-30 (DOI 10.1051/bsgf/2022007)
- (en) M.S.Y. Lee, « Evolutionary Morphology of Pareiasaurs », Cambridge, Ph.D. Thesis, Dept of Zoology, University of Cambridge, , p. 151-155
- (en) A.J. Lichtig et S.G. Lucas, « Chinlechelys from the Upper Triassic of New Mexico, USA, and the origin of turtles », Palaeontologica Electronica, vol. 24(1):a13, , p. 1-49 (DOI 10.26879/886)
- (en) S.P. Modesto, « Eunotosaurus africanus and the Gondwanan ancestry of anapsid reptiles », Palaeontologia Africana, vol. 36, , p. 15-20 (lire en ligne)
- (en) G.S. Bever, T.R. Lyson, D.J. Field et B-A.S. Bhullar, « Evolutionary origin of the turtle skull », Nature, vol. 525, no 7568, , p. 239-242 (DOI 10.1038/nature14900)
- (en) T.R. Lyson, B.S. Rubidge, T.M. Scheyer, K. de Queiroz, E.R. Schachner, R.M.H. Smith, J. Botha-Brink et G.S. Bever, « Fossorial origin of the turtle shell », Current Biology, vol. 26, no 14, , p. 1887-1894 (DOI 10.1016/j.cub.2016.05.020)
- (en) M.O. Day et R.M.H. Smith, « Biostratigraphy of the Endothiodon Assemblage Zone (Beaufort Group, Karoo Supergroup), South Africa », South African Journal of Geology, vol. 123, no 2, , p. 165-180 (DOI 10.25131/sajg.123.0011)
- (en) S. Voigt, A. Lagnaoui, A. Hminna, H. Saber et J.W. Schneider, « Revisional notes on the Permian tetrapod ichnofauna from the Tiddas Basin, central Morocco », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 302, nos 3-4, , p. 474-483 (DOI 10.1016/j.palaeo.2011.02.010)
- (en) S. Voigt, H. Saber, J.W. Schneider, D. Hmich et A. Hminna, « Late Carboniferous-Early Permian Tetrapod Ichnofauna from the Khenifra Basin, Central Morocco », Geobios, vol. 44, no 4, , p. 399-407 (DOI 10.1016/j.geobios.2010.11.008)
- (en) S.W. Williston, « Permian Reptiles », Sciences, vol. 33, no 851, , p. 631-632 (DOI 10.1126/science.33.851.631)
- (en) A.S. Romer et L.I. Price, « Review of the Pelycosauria », Geological Society of America Special Paper, vol. 28, , p. 1-538
- (en) N. Brocklehurst, R.R. Reisz, V. Fernandez et J. Fröbisch, « A Re-Description of ‘Mycterosaurus’ smithae, an Early Permian Eothyridid, and Its Impact on the phylogeny of Pelycosaurian-Grade Synapsids », PLoS ONE, vol. 11, no 6, , e0156810 (DOI 10.1371/journal.pone.0156810)
- (en) R.R. Reisz et H.C. Maddin, « A new large caseid (Synapsida, Caseasauria) from the Permian of Rodez (France), including a reappraisal of "Casea" rutena Sigogneau-Russell & Russell, 1974 », Geodiversitas, vol. 33, no 2, , p. 227-246 (lire en ligne)
- (en) R.B.J. Benson, « Interrelationships of basal synapsids: cranial and postcranial morphological partitions suggest different topologies », Journal of Systematic Palaeontology, vol. 10, no 4, , p. 601-624 (DOI 10.1080/14772019.2011.631042)
- (en) M. Romano, A. Ronchi, S. Maganuco et Nicosia, « New material of Alierasaurus ronchii (Synapsida, Caseidae) from the Permian of Sardinia (Italy), and its phylogenetic affinities », Palaeontologia Electronica, vol. 20.2.26A, , p. 1–27 (DOI 10.26879/684)
- (en) R. Werneburg, F. Spindler, J. Falconnet, J.-S. Steyer, M. Vianey-Liaud et J.W. Schneider, « A new caseid synapsid from the Permian (Guadalupian) of the Lodève basin (Occitanie, France) », Palaeovertebrata, vol. 45 (2)-e2, , p. 1-36 (DOI 10.18563/pv.45.2.e2).