Martensius
Martensius bromackerensis

Martensius est un genre éteint de synapsides Caseidae omnivore ayant vécu il y a 294 à 292 millions d’années environ au Permien inférieur (Sakmarien) dans ce qui est aujourd’hui le centre de l’Allemagne. Le genre n’est représenté que par son espèce type, Martensius bromackerensis, qui fut érigée en 2020 par Berman et des collègues, à partir de quatre squelettes plus ou moins entiers. Ils appartiennent à trois individus adultes et un juvénile. Ensemble, ces spécimens fournissent une connaissance presque complète du squelette de ce taxon qui font de lui l’un des caséidés les mieux connus avec Cotylorhynchus romeri. Comparé aux caséidés herbivores plus tardifs, caractérisés par leur très grandes narines externes, leur cage thoracique très large en forme de tonneau, et leurs dents en formes de feuilles ou spatulées et pourvues de cuspides plus ou moins nombreuses, Martensius se distingue par ses narines externes beaucoup plus petites, sa cage thoracique à peine élargie, et ses dents pointues. Martensius est également remarquable par la présence d’une denture différente entre les juvéniles et les adultes, indiquant un changement de régime alimentaire au cours de la vie de l’animal. Celui-ci passait d’un régime insectivore au stade juvénile à omnivore à l’âge adulte. Le régime alimentaire de Martensius, couplée à la découverte du genre insectivore Eocasea du Carbonifère supérieur, suggère que les grands caseidés herbivores de la fin du Permien inférieur et du Permien moyen ont évolué à partir d’espèces prédatrices de petites tailles[1]. Martensius appartient à un écosystème permien unique qui s’est développé dans un environnement montagneux, au centre d’un fossé d’effondrement où les paysages étaient relativement plats. Ces plaines d’altitudes étaient dépourvues d’animaux franchement aquatiques et étaient dominés par des tétrapodes terrestres et herbivores (les Diadectidae) et omnivores comme Martensius, tandis que les carnivores comme Dimetrodon étaient particulièrement rares.
Étymologie
Le nom de genre honore le Dr Thomas Martens, découvreur des premiers restes squelettiques dans la carrière de Bromacker dans les années 1970, et instigateur du programme à long terme d’exploitation du site. L’épithète spécifique bromackerensis réfère à la localité type, la carrière de Bromacker, la seule localité où l'espèce est connue[1].
Description
Martensius est représenté par quatre squelettes partiels à presque complets. L’holotype, qui est le plus grand individu connu, ainsi que le plus petit spécimen, sont les seuls squelettes ayant conservés tout ou partie du crâne.
- L’holotype MNG 13814 consiste en un squelette presque complet et bien conservé, se présentant en plusieurs sections articulées ou étroitement associées comprenant le crâne presque complet, faiblement désarticulé mais écrasé dorsoventralement ; la colonne vertébrale présacrée largement articulée; les deux premières vertèbres sacrées à côtes fusionnées et l’intercentrum de la troisième ; trois sections de la série caudale de 26, 6, et 21 vertèbres de positions progressivement plus postérieures dans la queue ; de grandes parties des ceintures scapulaires, mais sans les clavicules ; une plus grande partie de la ceinture pelvienne qui comprend l’ilium droit et des plaques pubo-ischiatiques articulées et conservées principalement sous forme d’empreintes ; les membres antérieurs articulés presque complets (le bras gauche étant dépourvu principalement de l’humérus et de la partie proximale de l’ulna) ; et le pied gauche complet et articulé avec l’extrémité distale de la fibula.
- MNG 14230 est le plus petit des quatre spécimens de Martensius et représente un individu juvénile. Il est composé d'un squelette articulé presque complet qui comprend la partie antérieure du crâne (incluant le prémaxillaire et le maxillaire droit partiels, des restes du palais, une grande partie antérieure de la mandibule gauche et une partie antérieure de la mandibule droite) ; une grande section articulée de la colonne vertébrale s’étendant des trois ou quatre dernières vertèbres cervicales jusqu’aux sept premières caudales, laquelle est suivie de deux séries de 6 et 11 vertèbres qui sont chacune précédées de mauvaises empreintes de trois et quatre vertèbres respectivement ; les ceintures scapulaires fragmentaires et les ceintures pelviennes complètes; un membre antérieur gauche partiel et les membres antérieurs et postérieurs droit en grande partie complets et articulés.
- MNG 10552 est un spécimen adulte légèrement plus petit que l'holotype. Il est composé d'os postcrâniens désarticulés et dispersés de manière aléatoire et de quelques éléments crâniens.
- MNG 10595 est la plus grande partie d'un squelette postcrânien articulé d'un adulte légèrement plus petit que l'holotype. Il comprend presque toutes les vertèbres dorsales, des membres antérieurs partiels, un membre postérieur droit presque complet, et un ensemble presque complet de gastralia[1].
Le crâne
Comparés aux autres caséidés, le crâne de Martensius présente plusieurs caractères primitifs qui le distingue clairement des membres plus dérivés de la famille. Le crâne est proportionnellement plus long et plus étroit. Le museau est beaucoup moins incliné vers l’avant et les narines externes sont beaucoup plus petites dorsoventralement. Elles forment une ouverture oblongue deux fois plus longue que haute qui occupait une zone réduite sur le museau. Chez les caséidés plus dérivés, la narine est considérablement élargie dorsalement en une ouverture subcirculaire qui occupe la majeure partie de la surface latérale du museau et rivalise en taille avec l’orbite. Les narines de Martensius diffèrent également de celles des autres caséidés par l'absence d'extensions médiales en forme d'étagère des marges nasales des prémaxillaires, du maxillaire et des lacrymaux, qui forment ensemble une paroi nasale étroite et continue. En vue dorsale, le crâne de Martensius montre un contour triangulaire à base large dont les marges latérales convergent fortement en avant vers un museau pointu. Ceci le distingue des autres caséidés chez qui la largeur du crâne reste inchangée de l'occiput à environ la mi-longueur du crâne avant de se rétrécir rapidement en un museau pointu. En vue latérale, le toit crânien est modérément convexe sur toute sa longueur. Le lacrymal est très caractéristique par sa grande taille et sa morphologie. D’une part il s’étend postérieurement pour contribuer à la marge antéroventrale de l’orbite. D’autre part il s’étend antérieurement bien au-delà de son contact dorsal avec le préfrontal, et se termine par un contact irrégulier avec la marge postéro-ventrale du nasal et a une contribution très étroite à la marge postéro-dorsale des narines externes. Le squamosal bordant la fenêtre temporale est relativement large avec sa plus grande largeur presque égale à celle de la fenêtre. La fenêtre temporale est de taille modeste. Elle est allongée verticalement, de forme légèrement ovale, avec sa plus grande longueur égale à environ 40% de la longueur de la région postorbitaire. En comparaison, chez d'autres caséidés cette mesure peut atteindre 75%, ce qui se reflète chez ces formes dans l’extrême étroitesse du squamosal bordant la marge postérieure de l'ouverture. Le crâne se caractérise également par la présence d’un condyle occipital double. La mâchoire inférieure est caractérisée par la non participation du splénial à la symphyse mandibulaire, et par la présence d’une éminence coronoïde entièrement formée par le surangulaire[1].
Les dents
Martensius montre une denture adulte et juvénile qui diffère l’une de l’autre par le nombre et la morphologie des dents de la mâchoire inférieure. Chez l’adulte, la denture supérieure est composée de quatre dents sur les prémaxillaires et 18 dents sur les maxillaires (contre 8 à 15 dents maxillaires chez les autres caséidés). Elles sont étroitement triangulaires et très légèrement recourbées. Les deux premières dents du prémaxillaire sont les plus grandes de la denture marginale. La taille des dents maxillaires augmente progressivement en série en arrière jusqu'à environ la neuvième dent avant de diminuer progressivement en arrière, les dernières étant extrêmement petites. Sur la mandibule, le dentaire porte 25 dents, ce qui dépasse de loin ce qui est observé chez les autres caséidés, dont le nombre de dents varie de 8 à 17 ou 18. Elles sont identiques à celles du maxillaire mais sont de taille légèrement inférieure. Chez le juvénile, les dents supérieures sont similaires à celles de l’adulte. En revanche, la denture de la mandibule se distingue en portant 31 dents qui, bien que représentées uniquement par leurs bases, sont extrêmement petites et de forme cylindriques ou tubulaires[1].
Le squelette postcrânien
Le squelette postcrânien est caractérisé par ses vertèbres cervicales, dorsales et sacrées dont les marges latérales des zygapophyses antérieures se courbent vers le haut pour englober les marges latérales des zygapophyses postérieures, ce qui aurait vraisemblablement limité partiellement la flexion latérale du tronc. Toutes les vertèbres dorsales, à l'exception peut-être des deux premières, possèdent une petite excavation en forme de fossette bien définie dans l'angle formé entre la zygapophyse antérieure et la marge antérieure du processus transverse. Il n'y a pas d'encoche ovale profonde sur la marge antérieure de la lame scapulaire, comme cela est observé chez certains genres de caséidés et qui marquerait l'étendue dorsale du contact de la clavicule. De manière unique chez les caséidés, chez Martensius l’avant-dernière phalange des doigts II à V de la main et du pied est plus longue que l’antépénultième phalange, et l’avant-dernière phalange du doigt I du pied est plus longue que le métatarse I. Les unguéaux sont exceptionnellement longs, massifs, fortement incurvés, étroits distalement, et possèdent un grand processus basal triangulaire ou rétracteur. Martensius a conservé une formule phalangienne[N 1] primitive de 2-3-4-5-3 pour les mains et 2-3-4-5-4 pour les pieds[1].
Évolution du régime alimentaire des caséidés
Martensius occupe une position temporelle et phylogénétique intermédiaire entre Eocasea du Carbonifère supérieur (qui est le caséidé le plus ancien et le plus primitif connu) et les caséidés de la fin du Permien inférieur et du Permien moyen. Les caséidés furent longtemps tous considérés comme des herbivores se nourrissant de végétaux à hautes teneurs en fibre et possédant un corps de taille moyenne à grande, comme en témoignent les caractéristiques distinctives d'un tronc en forme de tonneau très élargi et leurs dents spatulées ou en forme de feuilles, et pourvu de cuspides. Cette vision des caséidés a été quelque peu modifiée par la découverte d’Eocasea, et par la réidentification des genres Datheosaurus et Callibrachion comme des caséidés basaux. Ces animaux ne possédaient pas les caractéristiques des caséidés herbivores et avait plutôt une cage thoracique non expansée et une denture composée de très petites dents coniques simples suggérant un régime alimentaire insectivore[2] - [3] - [4]. Martensius, lui, possède un tronc en forme de tonneau légèrement élargi ainsi qu’une denture dans laquelle des dents indiquant un régime insectivore chez le juvénile ont été remplacées ontogénétiquement chez l’adulte par des dents suggérant un régime omnivore. Bien qu’un Martensius adulte était toujours capable de se nourrir d’insectes, il possède également une amorce des spécialisations à un régime alimentaire herbivore présentes chez les caséidés plus tardifs, comme un museau relativement court et faiblement incliné vers l’avant, et une denture qui est presque homodonte sur la mâchoire supérieure et qu’il est totalement sur la mandibule. De plus, il existe une corrélation entre le régime alimentaire des synapsides basaux et la longueur du crâne par rapport à la longueur museau/cloaque. Chez Martensius, ce rapport indique plutôt un régime alimentaire herbivore chez l’adulte. Une autre indication possible d’un régime herbivore que l'adulte partage avec d’autres caséidés plus dérivés, concerne ses pieds exceptionnellement grands aux griffes massives, allongées et fortement recourbées, dont les traces d’insertions pour les tendons indiquent qu’elles étaient mus par de puissants muscles fléchisseurs. Chez les caséidés, la présence de membres disproportionnellement grands et puissants (en particulier les phalanges unguéales) suggère une capacité à creuser notamment pour trouver de la nourriture végétale. Un autre comportement spécialisé de recherche de nourriture de Martensius est suggéré par sa possession de trois grandes vertèbres sacrées massives avec de grandes côtes qui sont considérablement étendues distalement et contactent indépendamment l’ilium. Cette structure a peut-être fourni le support sacro-lombaire nécessaire pour adopter une posture semi-verticale, lui permettant d’atteindre avec ses membres antérieurs les branches des plantes situées à une certaine hauteur[1].
La séquence d’acquisition des traits dentaires chez Martensius suggère également que le traitement intestinal de la végétation a précédé le traitement oral dans l’évolution de l’herbivorie des caséidés. Un régime insectivore juvénile aurait permis l’introduction initiale dans l’intestin de micro-organismes capables de cellulolyse endosymbiotique, en particulier s’il s’agissait d’insectes herbivores lesquels abritent de tels micro-organismes dans leur viscères. Le changement ontogénétique de la denture corrélé à un changement alimentaire chez Martensius suggère une chronologie probable en trois étapes des changements évolutifs de la denture et des régimes alimentaires associés des caséidés: le stade initial de la denture était représenté par le type strictement insectivore présent chez Eocasea du Carbonifère supérieur; cela a été suivi d’une denture similaire à celle de Martensius du milieu du Permien inférieur dans laquelle il y avait un remplacement ontogénétique d’une denture insectivore juvénile par une denture adulte omnivore; enfin, la denture très modifiée des caséidés de la fin du Permien inférieur et du Permien moyen, adaptée à un régime exclusivement riche en fibres. La dernière étape expliquerait la diversification et l’expansion des caséidés à la fin du Permien inférieur et au Permien moyen, car elle leur a permis d’exploiter une ressource végétale riche en fibres qui était alors devenue abondante et répandue[1].
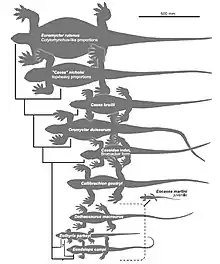
Phylogénie
Berman et des collègues ont publié deux cladogrammes dans lesquels Martensius bromackerensis est identifié comme l’un des caséidés les plus basaux, et est positionné juste au-dessus d’Eocasea martini du Carbonifère supérieur. Dans le premier cladogramme, la position des caséidés restant est mal résolue. Dans le second cladogramme, Casea broilii est positionné au-dessus de Martensius bromackerensis, et est suivie d'une polytomie entre Oromycter dolesorum, Trichasaurus texensis et un clade de caséidés restants. Au sein de ces taxons restants, une séquence de taxons ramifiés commence par Casea nicholsi, suivi par Euromycter rutenus, puis Ennatosaurus tecton, puis Angelosaurus romeri, puis un clade apical des trois espèces de Cotylorhynchus plus Alierasaurus ronchii. Dans ce clade final, Cotylorhynchus hancocki et Cotylorhynchus bransoni sont des taxons frères et le clade forme une polytomie avec Cotylorhynchus romeri et Alierasaurus ronchii[1].
Ci-dessous, les deux cladogrammes des Caseidae publié par Berman et des collègues en 2020[1].
Ci-dessous, le cladogramme publié par Werneburg et des collègues en 2022[5].
Répartition géographique et stratigraphique

Tous les spécimens de Martensius proviennent de la carrière de Bromacker, située près du village de Tambach-Dietharz, à environ 20 km au sud de la ville de Gotha, dans le centre de l’Allemagne (Land de Thuringe). Les roches exposées dans la carrière de Bromacker appartiennent au Membre du grès de Tambach, correspondant à la partie centrale de la Formation de Tambach, et sont constituées de deux successions stratigraphiques superposées et caractérisées par leur faciès d’association de chenaux alluviaux et d’inondations en nappes (constituant les lits inférieurs) et de dépôts lacustres en suspension (formant les lits supérieurs). La quasi-totalité des squelettes découverts dans la Formation de Tambach proviennent des lits inférieurs et plus précisément de deux couches massives de grès à grains fins et de siltites brun-rouge séparées l’une de l’autre par 50 cm de roche, le tout étant localisé dans un intervalle stratigraphique de 1,20 m d’épaisseur. L’holotype et les paratypes de Martensius proviennent du dépôt inférieur d’inondation en nappe. Les vertébrés fossiles très bien conservés, articulés et désarticulés, indiquent des temps d’expositions subaériennes de courte durée et de remaniement limité. Dans le cas des spécimens articulés, la mort et l’enfouissement étaient des événements contemporains, très probablement causés par des inondations[1].
Aucune datation radiométrique n’est disponible pour la Formation de Tambach. Les estimations de l’âge de cette formation reposent principalement sur la biostratigraphie qui a fourni des résultats variables, la formation étant datée alternativement du Sakmarien, de l’Artinskien, ou du Kungurien[6]. Dans une étude publiée en 2022, Menning et des collègues considèrent que l’âge de la formation de Tambach est probablement compris entre 294 et 292 Ma, ce qui correspond au Sakmarien[6]. Cette estimation est basée principalement sur l’âge radiométrique de 295,8 ± 0,4 Ma (Assélien terminal) de la formation de Rotterode qui sous-tend en discordance la formation de Tambach, et sur l’estimation que la durée géologique non représentée entre les deux formations est inférieure à 2 millions années[6] - [7]. De plus, la comparaison de l’assemblage d’empreintes de pas de la formation de Tambach avec des assemblages d’empreintes de pas du Permien de France et d’Italie datés radiométriquement suggère également un âge Sakmarien[6] - [8].
Paléoenvironnements
Les affleurements de la Formation de Tambach sont limités à une superficie d'environ 50 km². La formation a été déposée dans un petit graben, appelé bassin de Tambach, dont l'étendue d'origine était d'environ 250 km². L’écosystème de la Formation de Tambach est inhabituel en raison de l’absence totale de poissons (comme les requins xenacanthiformes) et d’amphibiens franchement aquatiques qui sont habituellement communs dans les lits rouges du Permien inférieur. Cela s'explique par la situation géographique particulière du bassin de Tambach qui se situait à une altitude élevée durant le Permien inférieur. Ces hautes terres étaient situées loin en amont des vastes plaines côtières et alluviales d’où proviennent la majorité des fossiles de tétrapodes du Permien. Bien que se trouvant à une altitude élevée et entouré par les montagnes de la chaîne varisque, le paysage du bassin de Tambach était lui relativement plat et parsemé de petits ruisseaux, de lacs, et d'étangs, tous temporaires[9]. Au Permien inférieur, le bassin de Tambach était plus proche de l’équateur qu’il ne l’est aujourd’hui, à une paléolatitude comprise entre le 10e et le 20e parallèle nord[10]. A partir de l’analyse des sédiments, David E. Eberth et des collègues ont proposé que le climat de la Formation de Tambach était chaud toute l’année avec des cycles saisonniers de sécheresse et d’épisodes de fortes précipitations. Les périodes de sécheresse étaient suffisamment sévères pour évaporer en quelques jours les lacs éphémères induits par les inondations du bassin, limitant fortement les possibilités d’installation d'une faune aquatique permanente. Les nombreuses racines fossiles orientés horizontalement (plutôt que verticalement) indique toutefois que le climat était généralement suffisamment humide pour que les plantes indigènes n’aient pas besoin de développer un système racinaire profond, ou d’autres adaptations xérophytiques. Pour cette raison, Eberth et al. considèrent que le climat de la Formation de Tambach était probablement comparable à l’actuel climat tropical de savane (malgré l’absence d'herbe au Permien), dont les équivalents climatiques modernes incluent la savane nord-africaine et les Llanos du Venezuela et de la Colombie[9]. Cependant, à partir de la géochimie des sédiments du Membre des Grès de Tambach, Scholze et Pint ont proposé une température annuelle moyenne de seulement 10,9 à 15°C (12,7°C en moyenne)[11]. Par ailleurs, la présence de structures sédimentaires identifiées comme des marques de cristaux de glace indique l’existence de variations quotidiennes de la température avec des périodes de gel temporaire se produisant la nuit, probablement en raison de la haute altitude du bassin[10] - [11].

Le bassin de Tambach abritait une faune diversifiée d'amphibiens composée uniquement de formes adaptées à un mode vie terrestre, notamment des dissorophoïdes comme Georgenthalia, Rotaryus, et Tambachia, des seymouriamorphes comme Seymouria, mais aussi le microsaure Tambaroter. On y trouvait aussi le parareptile Eudibamus et le Captorhinidae Thuringothyris. Mais les spécimens les plus nombreux étaient le Caseidae Martensius et les Diadectidae herbivores Diadectes et Orobates. En revanche, les synapsides carnivores comme le Varanopidae Tambacarnifex et le petit Sphenacodontidae Dimetrodon teutonis sont relativement rares dans cet assemblage. Cela contraste avec les environnements nord-américains du Permien inférieur, où les fossiles de carnivores tels que Dimetrodon sont plus nombreux que les fossiles d'herbivores. Les conditions environnementales de la Formation de Tambach ont probablement créé un réseau trophique très différent de celui des basses terres. Les plantes les plus courantes étaient des types résistants adaptés à la sécheresse tels que les conifères, tandis que les fougères à graines et autres plantes de plaine étaient beaucoup plus rares. Les plantes terrestres fibreuses ont encouragé la colonisation du bassin par des animaux terrestres herbivores, mais le climat plus sec a empêché le développement d'une chaîne alimentaire aquatique dont dépendaient certains animaux comme les grandes espèces de Dimetrodon[9] - [12] - [1].
Liens externes
- Ressources relatives au vivant :
Notes et références
Notes
- La formule phalangienne correspond au nombre de phalanges constituant chaque doigt des mains et des pieds des tétrapodes. Elle s’énumère en partant du doigt I (correspondant chez l’homme au pouce et au gros orteil) jusqu’au doigt V (l’équivalent de l’auriculaire et du petit orteil).
Références
- (en) D.S. Berman, H.C. Maddin, A.C. Henrici, S.S. Sumida, D. Scott et R.R. Reisz, « New primitive Caseid (Synapsida, Caseasauria) from the Early Permian of Germany », Annals of Carnegie Museum, vol. 86, no 1, , p. 43-75 (DOI 10.2992/007.086.0103)
- (en) R.R. Reisz et J. Fröbisch, « Oldest caseid synapsid from the late Pennsylvanian of Kansas, and the evolution of herbivory in terrestrial vertebrates », PLoS One, vol. 9 (4): e94518, (PMID 24739998, PMCID 3989228, DOI 10.1371/journal.pone.0094518)
- (en) F. Spindler, J. Falconnet et J. Fröbisch, « Callibrachion and Datheosaurus, two historical and previously mistaken basal caseasaurian synapsids from Europe », Acta Palaeontologica Polonica, vol. 361 (3), , p. 597-616 (DOI 10.4202/app.00221.2015)
- (en) N. Brocklehurst, R.R. Reisz, V. Fernandez et J. Fröbisch, « A Re-Description of ‘Mycterosaurus’ smithae, an Early Permian Eothyridid, and Its Impact on the phylogeny of Pelycosaurian-Grade Synapsids », PLoS ONE, vol. 11(6), , e0156810 (DOI 10.1371/journal.pone.0156810)
- (en) R. Werneburg, F. Spindler, J. Falconnet, J.-S. Steyer, M. Vianey-Liaud et J.W. Schneider, « A new caseid synapsid from the Permian (Guadalupian) of the Lodève basin (Occitanie, France) », Palaeovertebrata, vol. 45 (2)-e2, , p. 1-36 (DOI 10.18563/pv.45.2.e2).
- (en) M. Menning, J. Glodny, J. Boy, R. Gast, G. Kowalczyk, T. Martens, R. Rößler, T. Schindler, V. von Seckendorff et S. Voigt, « The Rotliegend in the Stratigraphic Table of Germany 2016 (STG 2016) », Zeitschrift der Deutschen Gesellschaft für Geowissenschaften, vol. 173, , p. 3-139 (DOI 10.1127/zdgg/2022/0311)
- (en) H. Lützner, M. Tichomirowa, A. Käßner et R. Gaupp, « Latest Carboniferous to early Permian volcano-stratigraphic evolution in Central Europe: U−Pb CA−ID−TIMS ages of volcanic rocks in the Thuringian Forest Basin (Germany) », International Journal of Earth Sciences, vol. 110, , p. 377-398 (DOI 10.1007/s00531-020-01957-y)
- (en) L. Marchetti, G. Forte, E. Kustatscher, W.A. DiMichelle, S.G. Lucas, G. Roghi, M.A. Juncal, C. Hartkopf-Fröder, K. Krainer, C. Morelli et A. Ronchi, « The Artinskian Warming Event: an Euramerican change in climate and the terrestrial biota during the early Permian », Earth-Science Rewiews, vol. 226, , p. 103922 (DOI 10.1016/j.earscirev.2022.103922)
- (en) D.A. Eberth, D.S. Berman, S.S. Sumida et H. Hopf, « Lower Permian Terrestrial Paleoenvironments and Vertebrate Paleoecology of the Tambach Basin (Thuringia, Central Germany) : The Upland Holy Grail », Palaios, vol. 15(4), , p. 293-313 (DOI 10.1669/0883-1351(2000)015<0293:LPTPAV>2.0.CO;2)
- (de) T. Martens, « Die Bedeutung von Sedimentmarken für die Analyse der Klimaelemente im kontinentalen Unterperm », Zeitschrift für Geologische Wissenschaften, vol. 35 (3), , p. 117-211
- (en) F. Scholze et A. Pint, « Early Permian paleotemperature values proposed for continental red-bed deposits of the Tambach Formation at the Bromacker section », Proceedings of Kazan University. Natural Sciences / Uchenye Zapiski Kazanskogo Universiteta. Seriya Estestvennye Nauki, vol. 163, no 3, , p. 338-350 (DOI 10.26907/2542-064X.2021.3.338-350)
- (en) T. Martens, D.S. Berman, A.C. Henrici et S.S. Sumida, « The Bromacker quarry – the most important locality of Lower Permian terrestrial vertebrate fossils outside of North America », dans Lucas, S.G. and Zeigler, K.E., The Nonmarine Permian, Albuquerque, New Mexico Museum of Natural History and Science Bulletin, No30, , p. 214–215