Hydroxychloroquine
L’hydroxychloroquine (HCQ) est un médicament (commercialisé sous forme de sulfate d'hydroxychloroquine, par Sanofi sous les noms de marque Plaquenil/Quensyl/Plaquinol, et d'autres producteurs sous le nom d'Axemal et Dolquine) indiqué en rhumatologie dans le traitement de la polyarthrite rhumatoïde et du lupus érythémateux disséminé pour ses propriétés anti-inflammatoires et immunomodulatrices[2]. Elle est inscrite sur la liste des médicaments essentiels de l'OMS. En 2020, cette molécule est également le sujet de recherches dans le contexte de la lutte contre le coronavirus SARS-CoV-2.
| Hydroxychloroquine | ||
| ||
 | ||
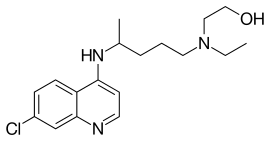
| structure canonique de l'hydroxychloroquine (en haut) et animation de la structure de la (R)-hydroxychloroquine (en bas) | ||
| Identification | ||
|---|---|---|
| Nom UICPA | (RS)-2-[{4-[(7-chloroquinolin-4-yl)amino]pentyl}(éthyl)amino]éthanol | |
| No CAS | (R/S) | |
| No ECHA | 100.003.864 | |
| Code ATC | P01 | |
| DrugBank | DB01611 | |
| PubChem | 3652 | |
| ChEBI | 5801 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C18H26ClN3O [Isomères] |
|
| Masse molaire[1] | 335,872 ± 0,019 g/mol C 64,37 %, H 7,8 %, Cl 10,56 %, N 12,51 %, O 4,76 %, 335,18 unité de masse atomique unifiée |
|
| Données pharmacocinétiques | ||
| Métabolisme | rénal | |
| Demi-vie d’élim. | 1 à 2 mois | |
| Excrétion | ||
| Considérations thérapeutiques | ||
| Voie d’administration | Orale | |
| Grossesse | D (Au), C (États-Unis) | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Histoire
Les propriétés fébrifuges et antipaludéennes de l'écorce amère de l'arbuste quinquina originaire d'Amérique du Sud sont connues en Europe au XVIIe siècle. En 1820 les pharmaciens français Caventou et Pelletier isolent l'amer ou alcaloïde qui en est le principe actif, auquel ils donnent le nom de quinine. En 1934, un chimiste allemand, Hans Andersag, synthétise la chloroquine, un dérivé de la quinoléine, le noyau aromatique de la quinine.
Dans les années 1960, en raison de leurs propriétés anti-inflammatoires, la chloroquine et l'hydroxychloroquine sont prescrites, notamment en rhumatologie.
Très utilisées à titre préventif par les voyageurs, les fonctionnaires et les soldats qui se rendent dans des pays où sévit le paludisme et certaines infections tropicales, la quinine était consommée couramment dans des sodas « à base d'écorce amère de quinquina » comme la version primitive de l'Indian Tonic de Schweppes.
En 2020, en raison de propriétés anti-virales in vitro, l'intérêt de l'hydroxychloroquine est étudié, notamment chez les patients en début d'infection par le coronavirus SARS-CoV-2.
La chloroquine et l'hydroxychloroquine sont commercialisées en France sous forme de sulfates, respectivement sous les marques Nivaquine et Plaquenil.
L'hydroxychloroquine était délivrée sans ordonnance jusqu'en janvier 2020[3].
Caractéristiques physico-chimiques
L'hydroxychloroquine est chimiquement apparentée à deux autres antipaludéens : la quinacrine et la chloroquine. Elle partage avec cette dernière une structure de type 4-amino-quinoléine et ne diffère que par un groupe hydroxyle (OH) en bout de chaîne. Elle se présente également sous la forme de deux énantiomères car elle est chirale. En effet, l'atome de carbone en α de l'amine et qui porte un substituant méthyle est asymétrique, comme dans la chloroquine. Les différences dans les propriétés pharmacologiques de chaque énantiomère de l'hydroxychloroquine sont vraisemblablement du même ordre que celles observées avec la chloroquine.
Le sulfate d'hydroxychloroquine est une poudre cristalline blanche blanchâtre, soluble dans l'eau, presque insoluble dans l'alcool, le chloroforme et l'éther[4].
Pharmacocinétique et métabolisation
L'hydroxychloroquine a une pharmacocinétique proche de celle de la chloroquine : absorption gastro-intestinale rapide, élimination par les reins. Une fois dans le tractus digestif, la molécule passe facilement dans le sang pour atteindre son taux plasmatique maximal en 1 à 2 heures (taux qui persistera en raison d'une forte liaison aux protéines plasmatiques)[5]. La molécule a ensuite un tropisme marqué pour le foie et le rein, et moindrement l'œil. Elle passe la barrière placentaire (« les concentrations sanguines chez le fœtus sont similaires aux concentrations sanguines maternelles »[5] (on la retrouve aussi en faible quantité dans le lait maternel)[5].
Métabolisation : la molécule est directement (mais très lentement) éliminée par le rein ou préalablement métabolisée par alkylation et glycuroconjugaison en N-déséthyl-hydroxychloroquine grâce à des enzymes du cytochrome P450 (CYP2D6, 2C8, 3A4 et 3A5)[6] - [7].
Indications en clinique
| Hydroxychloroquine | |
| Informations générales | |
|---|---|
| Princeps | Plaquenil (d) |
| Classe | 4-amino-quinoléine |
| Forme | comprimé pelliculé |
| Administration | orale |
| Sels | sulfate |
| Laboratoire | Sanofi (Plaquenil) |
| Statut légal | |
| Statut légal | Liste II (France) |
| Remboursement | 65 % (France) / Oui (Suisse) |
| Identification | |
| No CAS | |
| No ECHA | 100.003.864 |
| Code ATC | P01BA02 |
| DrugBank | 01611 |
Paludisme
Initialement utilisé dès 1955[8] dans le traitement du paludisme, il ne l'est plus aujourd'hui en raison du développement de résistances chez le Plasmodium, parasite responsable du paludisme.
L'hydroxychloroquine était initialement utilisée[9] comme une alternative moins toxique à la chloroquine, sans être efficace contre les formes latentes de Plasmodium vivax et Plasmodium ovale (dites « hypnozoïtes » : causes de rechutes tardives). En 2020, elle n'est plus recommandée pour la prévention ou prise en charge du paludisme dans le Sahel par l'OMS[10] - [11], ni pour le « paludisme d’importation » en France par la Société de pathologie infectieuse de langue française (SPILF) (2017)[12], et ne figure plus pour cet usage dans la Base de données française des médicaments[5]. Son usage comme antipaludéen est parfois remplacé au profit notamment de composés contenant entre autres de l'artémisinine (avec certaines restrictions[13] - [14] - [15]) ou de la méfloquine (malgré certains effets indésirables}, mais elle est encore le traitement de choix dans d'autres pays d'Europe, par exemple pour le paludisme non compliqué importé en Norvège[16] et elle reste en 2020 (de même que la chloroquine) approuvés par la FDA « pour prévenir et traiter certains types de paludisme » (paludisme non compliqué dû à P. falciparum, P. malariae, P. ovale et P. vivax) dans les zones géographiques où la résistance à la chloroquine n'est pas signalée. Le NIH recommande aux médecins de consulter le site Web du CDC sur la malaria[17] avant de prescrire ce médicament pour le traitement ou la prophylaxie du paludisme.
Rhumatologie
Dans le lupus érythémateux disséminé (ou systémique) elle permet de maintenir la rémission et améliore les manifestations cutanées, articulaires et autres[18]. L'hydroxychloroquine réduit la morbidité néonatale chez les femmes atteintes de lupus érythémateux disséminé (moins de bébés prématurés et anormalement petits)[19], comme immunomodulateur, à des doses plus élevées (200–400 mg/j) que contre le paludisme[20]. Les autres indications en rhumatologie incluent :
- la polyarthrite rhumatoïde aiguë ou chronique (chez l'adulte),
- porphyria cutanea tarda (en) et
Mais aussi les troubles articulaires infectieux :
- arthrite due à la maladie de Lyme (dite « arthrite de Lyme »)[18].
L'hydroxychloroquine a un effet immunomodulateur étudié depuis les années 1960[21] ; elle augmente[22] le pH lysosomial dans les cellules présentatrices d'antigène. En conditions inflammatoires, elle bloque les récepteurs de type Toll des cellules dendritiques plasmacytoïdes. Les récepteurs de type Toll 9 conduisent à la production d'interféron et poussent les cellules dendritiques à mûrir et à présenter des antigènes aux lymphocytes T. L'hydroxychloroquine, en diminuant les signaux des récepteurs de type Toll, réduit l'activation des cellules dendritiques et le processus inflammatoire. Dans un modèle murin (rat) d'arthrite, cette molécule testée comme immunomodulateur a aussi eu un effet antioxydant. Et pour les neutrophiles humains, elle semble réduire la concentration d'oxydants externes tout en diminuant la phosphorylation de la protéine kinase C, ce qui pourrait être l'une des explications de son effet anti-inflammatoire encore mal compris[23].
Dermatologie
L'hydroxychloroquine est indiquée en prévention des lucites (une forme d'allergie solaire)[24].
Législation
L'hydroxychloroquine est inscrite sur la liste des médicaments essentiels de l'OMS pour son utilisation en rhumatologie[25].
En France, l'hydroxychloroquine est classée substance vénéneuse sous toutes ses formes depuis l'arrêté du signé par le Directeur Général de la Santé Jérôme Salomon. Le 8 octobre 2019 l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) demande un avis à l’Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (ANSES) qui rend son avis en date le [26]. Il rejoint l'avis de l'ANSM et porte l'hydroxychloroquine sur la liste II des substances vénéneuses (médicaments comprenant des substances toxiques)[27].
La molécule est aussi utilisée en médecine vétérinaire, notamment pour les chiens[28] - [29] - [30]. En France, « Cette substance active n’entre pas dans la composition de médicaments vétérinaires autorisés, son classement est donc sans impact en médecine vétérinaire[31]. »
Contre-indications, interactions, effets secondaires
L'étiquetage du médicament mentionne notamment que l'hydroxychloroquine ne doit pas être prescrite aux personnes présentant une hypersensibilité connue aux composés de la 4-amino-quinoléine[18]. D'autres contre-indications existent[32] :
- diabète de type 2 ;
- épilepsie ;
- psoriasis ;
- maladies cardiaques (insuffisance cardiaque, infarctus, arythmie, allongement congénital du QTc) ;
- maladie de Parkinson ;
- porphyrie, déficit en G6PD (favisme) ;
- troubles de la kaliémie ou de la magnésémie[33].
Des médicaments interagissant négativement avec l'hydroxychloroquine sont déconseillés, à éviter ou à doser différemment, dont :
- les médicaments allongeant l'intervalle QT sur l'électrocardiogramme ou favorisant les torsades de pointe peuvent être contre-indiqués ou déconseillés : citalopram, escitalopram, hydroxyzine, dompéridone, pipéraquine (en), halofantrine (en), antidépresseurs tricycliques, les antipsychotiques et certains anti-infectieux)[5]. La fiche « hydroxychloroquine » de la FDA répertorie les interactions médicamenteuses connues pour le Plaquenil[34] ;
- les médicaments altérant la fonction hépatique (ex. : aurothioglucose (Solganal), cimétidine (Tagamet) ou digoxine (Lanoxin)[35] ;
- les médicaments altérant la fonction rénale (ex. : pénicillamine dont l'hydroxychloroquine peut augmenter les concentrations plasmatiques, ce qui peut induire des effets secondaires graves) ;
- Les antiacides car ils peuvent diminuer l'absorption de l'hydroxychloroquine[35] ;
- La néostigmine et la pyridostigmine qui antagonisent l'action de l'hydroxychloroquine[35] ;
- l'insuline et les hypoglycémiants oraux qui voient leurs effets hypoglycémiants exacerbés par l'hydroxychloroquine. Leur posologie est à adapter pour prévenir une grave hypoglycémie.
Effets indésirables et toxicité
L'hydroxychloroquine est un médicament à marge thérapeutique étroite (hautement toxique en cas de surdose)[33]. À dose égale et à propriétés pharmacologiques comparables, elle est cependant réputée 2 à 3 fois moins toxique que la chloroquine (selon le modèle animal)[36] - [37] - [38], mais avec des conséquences semblables en termes d’organes ou fonctions physiologiques affectés. Certaines sont expliquées depuis les années 1940[39] et d'autres encore mal comprises. « Non toxique, le Plaquenil a des effets secondaires tout à fait supportables, même pour les patients fragiles et âgés » explique Guillaume Robert de l'INSERM . Selon l’Agence nationale de sécurité du médicament et des produits de santé, sur la base des effets secondaires de la chloroquine rapportés, comparés aux données de ventes (3 987 854 boîtes de trente comprimés dosés à 200 mg vendues en France entre le et le , les données de pharmacovigilance rapportent sur la période (72 mois) 312 cas signalés pour « au moins un effet indésirable », soit moins de 0,01 %. Sur ces 312 cas d'effets indésirables signalés, 21 (6,7 %) sont des effets cardiovasculaires dont quatre cas d’insuffisance cardiaque, huit cas de cardiomyopathie, huit cas de troubles du rythme au sens large et un cas d'hypertension pulmonaire. Deux cas sont des décès (dont un par intoxication médicamenteuse chez un sujet prenant en outre six psychotropes[40]).
Le surdosage est la première cause de problèmes graves ; et comme la molécule est très vite absorbée, les symptômes peuvent survenir dès trente minutes après ingestion : effets visuels et auditifs, gastro-intestinaux, cutanés, cérébraux (somnolence, céphalée) et neuromusculaires (convulsions), sanguins et cardiovasculaires (arythmie, insuffisance cardiaque, etc.), difficultés respiratoires, etc.
Les posologies non-antipaludéennes conduisent souvent à un cumul de doses susceptibles de déclencher une toxicose médicamenteuse[41]. Outre cette dose cumulée, les facteurs de risques sont :
- l’obésité,
- être enfant[42],
- avoir plus de 60 ans,
- avoir une maladie rétinienne,
- prendre des médicaments interagissant négativement avec l’hydroxychloroquine (tamoxifène notamment[43]),
- souffrir d'insuffisance rénale ou hépatique (insuffisance causant une accumulation d'hydroxychloroquine dans les tissus, ce qui équivaut à un surdosage)[44].
Les mécanismes en sont pour partie mal compris, mais pourraient notamment être liés à des métabolites sources d’espèces réactives de l'oxygène[45]. Des protocoles de soins sont décrits par la littérature médicale[46] - [47].
| Effets toxicologiques | Descriptions des effets de l’hydroxychloroquine (ou de ses dérivés, sulphate, phosphate) |
|---|---|
| Mort par empoisonnement | L’hydroxychloroquine est moins toxique que la chloroquine, ou que la quinine, mais elle est une des premières causes d'empoisonnement par les antipaludéens ; |
| Cardiotoxicité | Le traitement (aigu ou chronique) a fréquemment des effets cardiovasculaires potentiellement graves (faisant alors généralement à la suite d'un surdosage) ; comme pour la chloroquine, ils incluent :
|
| Neurotoxicité | L'hydroxychloroquine affecte le système nerveux, avec :
|
| Néphrotoxicité | L'administration chronique d'hydroxychloroquine au rat affecte la morphologie et la fonction des cellules rénales, pouvant induire (même à court terme) des nécroses cellulaires (mais moins que dans le cas de la chloroquine : 70 % des rats traités à la chloroquine développent une fibrose tissulaire intersticielle, contre seulement 20 % du groupe traité à l’hydroxychloroquine)[38]. |
| Hépatotoxicité | Le foie accumule l'hydroxychloroquine ;
Ces derniers deviennent anormalement nombreux et gros ; et sont surchargés par du matériel non-digestible[57].
|
| Toxicité oculaire Rétinopathie… | La toxicité oculaire de l'hydroxychloroquine concerne deux zones distinctes du globe oculaire :
1) la cornée : des dépôts peuvent s’y former en générant des kératopathies vortex ou verticillates cornéennes. Ces « dépôts cornéens », selon Stokkermans (2019) résultent d'une liaison entre chloroquine et des lipides des cellules de l'épithélium basal de la cornée[59]. Ils causent des halos et reflets qui parasitent la vision. En outre le cristallin peut partiellement s'opacifier et le corps ciliaire fonctionne mal ; Ces troubles sont sans rapport avec la posologie et généralement réversibles à l'arrêt de l’hydroxychloroquine ; 2) la macula : en cas de rétinopathie avancée, elle peut être irréversiblement dégradée (« Des lésions rétiniennes irréversibles ont été observées chez certains patients ayant reçu du sulfate d’hydroxychloroquine » précise la notice du Plaquenil[18]) :
Facteurs de risque : ils varient selon les auteurs, mais le seuil posologique est généralement estimé de 5 à 6,5 mg/kg de poids corpore/jour de sulfate d'hydroxychloroquine, utilisé sur plus de cinq ans. Le risque augmente en cas de filtration glomérulaire subnormale, et de prise conjointe de citrate de tamoxifène (qui présente aussi une toxicité oculaire) ou si une maladie maculaire est concomitante au traitement[18]. (voir détail plus bas dans l'article) ; Dépistage : il doit être initial en cas de traitement long, puis annuel après cinq ans d'utilisation. (voir détail plus bas dans l'article). Chez des patients âgés, pour des traitements non antipaludéens, la posologie recommandée suffit parfois à induire une toxicité oculaire[65] ; |
| Troubles digestifs | Les troubles digestifs sont le symptôme le plus courant (même à court terme), avec pour un traitement antipaludéens : de légères nausées, des crampes d'estomac occasionnelles accompagnées d'une légère diarrhée[42], des crampes une diminution de l’appétit, allant éventuellement jusqu'aux vomissements et à l’anorexie[42].
|
| Allergies (et autres effets cutanés) | C'est le trouble le plus fréquent après les troubles digestifs. Comme la quinine ou la chloroquine, même à faible dose, l’hydroxychloroquine peut induire (dans les 2 à 33 jours après la première prise)[66] :
Nota : divers protocoles de désensibilisation prolongée aux allergies à l'hydroxychloroquine ont été proposés[66] ; ils durent 4 à 36 jours et visent plutôt des allergies légères à modérées, un cas de désensibilisation accélérée en cinq heures, sous surveillance médicale, a été décrit[66]. Un autre, deux étapes et via des prises orales, s'est montré efficace chez douze de treize patients l'ayant testé[71]. Ils peuvent améliorer la qualité de vie des patients modérément allergiques et réduire les non-observances du traitement pour cause d'allergie[72] - [71]. |
| Toxicité cellulaire | La chloroquine se réparti dans tout le corps mais cible particulièrement certaines cellules (de l’œil, dans la rétine et la cornée) ou elle se concentre dans le foie ou le rein chargés de détoxiquer l'organisme[42]. |
| Ototoxicité | Le risque de troubles de l'audition augmente (comme sous chloroquine), avec principalement des acouphènes[42] et des vertiges voire une surdité[5]. |
| Génotoxicité, cancérogénicité | « La chloroquine est (en France) inscrite sur la liste II des substances vénéneuses […] par arrêté du . »
Selon la Base française de données publique du médicament[73] (version ), « Les données disponibles sur la génotoxicité de l’hydroxychloroquine sont limitées, par conséquent les données de la chloroquine ont été prises en compte en raison de la similitude de structure et des propriétés pharmacologiques des deux molécules. Les données issues de la littérature ont montré un potentiel génotoxique de la chloroquine in vitro et in vivo. Aucune étude pertinente de cancérogénicité n’a été fournie pour l’hydroxychloroquine ou la chloroquine. Chez l’Homme, les données sont insuffisantes pour écarter un risque augmenté de cancer chez les patients recevant un traitement au long cours »[5] ; |
| Reprotoxicité | Elle est encore discutée. En France, selon la fiche Plaquenil de la base de données publique du médicament (version ) « en raison du potentiel génotoxique de la chloroquine, les hommes et les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement et jusqu’à huit mois après l’arrêt du traitement ». De même, la chloroquine ne doit pas être utilisée pendant la grossesse »[5]. |
Doses toxiques pour l'homme
La dose toxique pour l'homme est de 400 mg/j (ou 6,5 mg/kg de poids corporel idéal) en traitement long[44], c'est-à-dire après cinq ans, ou à la suite d'une dose cumulée d'un kilogramme[74] était considéré comme la dose sûre en termes de toxicité oculaire pour un adulte moyen, mais il est apparu que la toxicité de l'hydroxychloroquine n’est pas dose-dépendante mais plutôt liée à la dose cumulée totale, et à la durée du traitement[74]. Selon le modèle animal, toutes les couches de la rétine sont endommagées, mais les cônes et bâtonnets le sont le plus[75].
Des preuves récentes plaident pour une toxicité rétinienne plus élevée qu’on le pensait. La prévalence d'effets toxiques rétiniens serait en moyenne en Corée du Sud de 2,9 % pour les traitements rhumatologiques[76], mais de 7,5 % au Royaume-Uni pour les traitements non paludéens de long terme, et selon la dose cumulée, elle y augmente de 20 à 50 % après vingt ans de traitement (étude basée sur 2 361 patients). Au Royaume-Uni, le Royal College of Opthalmologists a produit un formulaire de référence récent et des lignes directrices (depuis 2018) aidant les médecins à identifier les patients à haut risque et nécessitant un dépistage rétinien approfondi[77]. La dose est à ajuster au poids du patient[78], à partir d'algorithmes ad hoc et de calculateurs[44] - [78], mais selon l'algorithme, les résultats diffèrent ; les femmes, moins lourdes que les hommes, sont exposées au surdosage (vers 2010, 16 % à 98 % d'entre elles étaient dans la plage toxique et 12 %–56 % des patients des États-Unis étaient surdosés)[79] - [80] - [81] - [44].
Remarque : certaines cellules de l’œil concentrent la molécule ; y compris in utero (si la mère est traitée par de la chloroquine)[82] - [83].
Prévention, dépistage des effets secondaires
Le dépistage porte sur la qualité de la vision (vision floue, difficulté à concentrer le regard) et du champ visuel[84] - [85]. Dès qu'une anomalie rétinienne est détectée, un examen ophtalmologique approfondi est recommandé[18]. L'examen annuel doit inclure BCVA, VF et SD- OCT (et l'électrorétinogramme multifocal (mfERG), la tomographie à cohérence optique dans le domaine spectral (SD-OCT) ainsi que l'autofluorescence du fond d'œil (FAF), peuvent être plus précis que la simple évaluation des champs visuels[78]). « Les tests de grille Amsler ne sont plus recommandés. Les examens du fond d'œil sont conseillés pour la documentation, mais la « maculopathie à œil de bœuf » visible est un changement tardif, et l'objectif du dépistage est de reconnaître la toxicité à un stade plus précoce »[78]. Pour les autres patients, ce rythme d’examen peut commencer après cinq ans de traitement[18]. L'hydroxychloroquine ayant une « demi-vie particulièrement longue »[86], notamment dans l’œil, même après un arrêt du traitement justifié par une toxicité oculaire « le patient doit être étroitement surveillé étant donné que les modifications de la rétine (et les troubles visuels) peuvent progresser même après l'arrêt du traitement ». Les recommandations de l'American Academy of Ophthalmology pour le dépistage de la rétinopathie à la chloroquine (CQ) et à l'hydroxychloroquine (HCQ) ont été publiées en 2002 les outils et connaissances ont évolué depuis, mais en 2020 selon cette académie : « Aucun traitement n'existe encore pour ce trouble […] Les patients doivent être conscients du risque de toxicité et de la justification du dépistage (pour détecter les changements précoces et minimiser la perte visuelle, pas nécessairement pour l'éviter). Les médicaments doivent être arrêtés si possible lorsque la toxicité est reconnue ou fortement suspectée, mais il s'agit d'une décision à prendre en collaboration avec les patients et leurs médecins »[78].
Traitement du surdosage ou de l'intoxication par hydroxychloroquine
Tout surdosage en amino-4-quinoléine est grave, notamment chez les nourrissons (chez qui 1 à 2 g suffisent parfois à provoquer la mort)[5].
Une intoxication avérée par hydroxychloroquine impose une prise en charge pré-hospitalière urgente (SAMU ou autre service mobile d’urgence). Avant l'arrivée d'une ambulance, une perfusion IV avec une solution de remplissage peut être posée. À partir de 4 g supposés ingérés ou en cas d'hypotension (et/ou de signes ECG), les mesures préconisées sont l'injection d'adrénaline (0,25 µg kg−1 min−1) ; l'intubation et ventilation assistée ; le diazépam (2 mg/kg en 30 min, puis 2 à 4 mg/kg par 24 heures). Une suspicion d'intoxication exige aussi une hospitalisation (quelle que soit la quantité estimée ingérée)[5].
En cas d’intoxication, ni l’acidification des urines, ni l’hémodialyse, ni la dialyse péritonéale ni même l'exsanguinotransfusion n’apportent de bénéfice (l'hémodialyse n'élimine que très lentement l’hydroxychloroquine ; la clairance de dialyse représente 15 % de la clairance totale)[5].
Production
Fin 2020 (20 décembre), l'usine de Taoyuan de la SCI Pharmtech, l'un des premiers producteurs de précurseurs de médicaments, et en particulier de sulphate d'hydroxychloroquine à Taiwan a connu une explosion et un grave incendie (un mort et un blessé) ; il a fallu 45 h pour maitriser le feu qui s'était étendu à 5 autres usines de la zone industrielle. Il n'y a pas de risque de pénurie d'hydroxychloroquine grâce à d'autres usines fabricant aussi ce produit[87].
Utilisation contre la Covid-19
L'utilisation de l'hydroxychloroquine contre la Covid-19 est suggérée début 2020 par le compte-rendu d'une réunion d'officiels chinois, puis par l'infectiologue français Didier Raoult (en association à l'azithromycine), ce qui a conduit à son autorisation temporaire à titre dérogatoire dans plusieurs pays et à son utilisation courante dans plusieurs autres pays, notamment en Afrique, en Inde et en Grèce, pays producteurs de la molécule[88].
En avril 2020, l'ancien ministre de la santé Philippe Douste-Blazy et l'urgentiste Patrick Pelloux demandent au gouvernement d'ouvrir la délivrance du médicament à plus de patients atteints du coronavirus, en modifiant « en urgence » le décret qui le réserve aux cas les plus graves[89].
Elle est ensuite écartée dans le cadre des soins d'urgence par certains pays, notamment le 15 juin par la FDA aux États-Unis[90], le 26 juin par la Corée du Sud[91], ainsi que par l'OMS[92] à la suite d'une série de résultats négatifs ou non probants de différentes études[93] et essais cliniques[94] - [95]. L'OMS précise cependant, à l'époque, que les études visant les patients non hospitalisés, ou la prise d'hydroxychloroquine en prévention, ne sont pas interrompues[96] mais en mars 2021 elle déconseille vivement l’hydroxychloroquine comme traitement préventif : « Des recherches ont permis de démontrer avec certitude que l’hydroxychloroquine n’a pas d’effet significatif sur le risque de décès ou d’admission à l’hôpital, tandis que d’autres recherches ont montré que l’hydroxychloroquine n’a pas d’effet sur le nombre de cas de Covid-19 rapportés positifs confirmés par les laboratoires et qu’elle augmente probablement le risque d’effets indésirables » [97] .
L'hydroxychloroquine n'ayant pas une autorisation de mise sur le marché (AMM) pour la Covid-19, la prescription hors AMM (off-label) par ordonnance est possible au cas par cas sous la responsabilité du médecin avec obligation d'information du patient[98].
Essais et études
- 5 octobre 2020 : l'essai britannique Recovery montre l'absence d'effet bénéfique de l'hydroxychloroquine chez les patients déjà hospitalisés[99] - [100].
- 16 octobre 2020 : l'essai international Solidarity confirme l'inefficacité de l'hydroxychloroquine également chez les patients hospitalisés[101] - [102].
- l'essai français Covidoc, censé tester la combinaison hydroxychloroquine / azithromycine, est interrompu en 2020 sans avoir démontré le bénéfice du traitement[103].
- 5 avril 2021 : une étude montre par méta-analyse sur 10 ans d'observations, que les traitements avec la chloroquine et l'hydroxychloroquine sont sûrs et qu'il n'y a pas de risques cardiaques avérés, quelques rares arythmies ventriculaires et infarctus du myocarde remarqués sur des patients hospitalisés pour Covid-19 étant dus à l'application de doses plus élevées que les doses habituelles, l'étude concluant qu'il faut éviter de recourir à de telles prescriptions[104]. Cette méta-étude ne porte pas sur l'efficacité des traitements contre le covid en elle-même.
Théories conspirationnistes
Les débats sur l'hydroxychloroquine inspirent plusieurs théories du complot[105]. Paradoxalement, alors que cette molécule est produite et distribuée par les industries pharmaceutiques (ce qui pourrait nourrir la théorie du complot de Big Pharma) et qu'elle est préconisée par Didier Raoult, elle n'est pas associée aux théories conspirationnistes mais aux discours antisystème ciblant notamment ces industries[106].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hydroxychloroquine » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Académie de pharmacie, « Hydroxychloroquine (sulfate de) — acadpharm », sur dictionnaire.acadpharm.org, (consulté le ).
- VIDAL, « VIDAL - PLAQUENIL (hydroxychloroquine) : la prescription médicale devient obligatoire - Actualités », sur https://www.vidal.fr, 2020-15-01 (consulté le ).
- (en) « DailyMed - PLAQUENIL- hydroxychloroquine sulfate tablet », sur dailymed.nlm.nih.gov (consulté le ).
- « Résumé des caractéristiques du produit - Plaquenil 200 mg, comprimé pelliculé - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le ).
- (en) S. Kalia et J. P. Dutz, « New concepts in antimalarial use and mode of action in dermatology », Dermatologic Therapy, vol. 20 (4), , p. 160–174 (PMID 17970883, DOI 10.1111/j.1529-8019.2007.00131.x)
- (en) Sunil Kalia et Jan P. Dutz, « New concepts in antimalarial use and mode of action in dermatology », Dermatologic Therapy, vol. 20, no 4, , p. 160–174 (ISSN 1396-0296, PMID 17970883, DOI 10.1111/j.1529-8019.2007.00131.x, lire en ligne, consulté le ).
- (en) D. J. Wallace, « The history of antimalarials », Lupus, vol. 5 Suppl 1, , S2–3 (ISSN 0961-2033, PMID 8803902, lire en ligne, consulté le ).
- (en) Miguel Nieto-Caicedo, « Hydroxychloroquine in the Treatment of Malaria », The American Journal of Tropical Medicine and Hygiene, vol. 5, no 4, , p. 681–685 (ISSN 0002-9637 et 1476-1645, DOI 10.4269/ajtmh.1956.5.681, lire en ligne, consulté le ).
- (en) Organisation mondiale de la santé, « WHO | Guidelines for the treatment of malaria. Third edition », sur who.int, (consulté le ), p. 317.
- Organisation mondiale de la santé, « Recommandation de politique générale de l’OMS : Chimioprévention du paludisme saisonnier pour lutter contre le paludisme à Plasmodium falciparum en zone de forte transmission saisonnière dans la sous région du Sahel en Afrique » [PDF], sur who.int, (consulté le ).
- SPILF, « Prise en charge et prévention du paludisme d’importation » [PDF], sur infectiologie.com, (consulté le ), p. 71.
- La promotion de l'Artémisia contre le paludisme inquiète l'OMS
- Etude de l’efficacité et de la tolérance d’une tisane à base de Artemisia annua L. (Asteraceae) cultivée au Bénin pour la prise en charge du paludisme simple
- Paludisme : des résistances à l’artémisine en Asie du Sud-Est
- (en) Solbakken M.J (2019) « Malaria in Myanmar-Causes, treatment, prevention and prognosis of malaria, and the occurrence in the endemic Myanmar and non-endemic Norway[PDF] » (Master's thesis ; Department of Community Medicine and Global Health, University of Oslo). Voir chap. 6.4 Diagnosis and treatment, p. 23.
- (en-US) « CDC - Parasites - Malaria », sur www.cdc.gov, (consulté le ).
- (en) Steere AC et Angelis SM, « Therapy for Lyme arthritis: strategies for the treatment of antibiotic-refractory arthritis », Arthritis Rheum., vol. 54, no 10, , p. 3079–3086 (PMID 17009226, DOI 10.1002/art.22131).
- (en) M Leroux, C Desveaux, M Parcevaux et B Julliac, « Impact of hydroxychloroquine on preterm delivery and intrauterine growth restriction in pregnant women with systemic lupus erythematosus: a descriptive cohort study », Lupus, vol. 24, no 13, , p. 1384–1391 (ISSN 0961-2033 et 1477-0962, DOI 10.1177/0961203315591027, lire en ligne, consulté le ).
- (en) Claire de Moreuil, Zarrin Alavi et Elisabeth Pasquier, « Hydroxychloroquine may be beneficial in preeclampsia and recurrent miscarriage », British Journal of Clinical Pharmacology, vol. 86, no 1, , p. 39–49 (ISSN 1365-2125, PMID 31633823, PMCID PMC6983516, DOI 10.1111/bcp.14131, lire en ligne, consulté le ).
- (en) Kalmanson, G. M., & Guze, L. B. (1965). Studies of the Effects of Hydroxychloroquine on Immune Responses. Journal of Laboratory and Clinical Medicine, 65(3), 484-9.
- (en) Waller et al., Medical pharmacology and therapeutics, 2e éd., p. 370.
- (en) Viera Jančinová, Silvia Pažoureková, Marianna Lucová et Tomáš Perečko, « Selective inhibition of extracellular oxidants liberated from human neutrophils—A new mechanism potentially involved in the anti-inflammatory activity of hydroxychloroquine », International Immunopharmacology, vol. 28, no 1, , p. 175–181 (DOI 10.1016/j.intimp.2015.05.048, lire en ligne, consulté le ).
- « VIDAL - PLAQUENIL 200 mg cp pellic - Indications », sur www.vidal.fr (consulté le )
- (en) Organisation mondiale de la santé, « World Health Organization Model List of Essential Medicines » [PDF], sur apps.who.int, (consulté le ), p. 65.
- Roger Genet, « AVIS de l’Agence nationale de sécurité sanitaire de l’alimentation,de l’environnement et du travail », sur www.anses.fr
- « Arrêté du portant classement sur les listes des substances vénéneuses », sur Légifrance, .
- (en) Ursula Oberkirchner, Keith E. Linder et Thierry Olivry, « Successful treatment of a novel generalized variant of canine discoid lupus erythematosus with oral hydroxychloroquine », Veterinary Dermatology, vol. 23, no 1, , p. 65–e16 (ISSN 1365-3164, DOI 10.1111/j.1365-3164.2011.00994.x, lire en ligne, consulté le ).
- (en) Elizabeth A. Mauldin, Daniel O. Morris, Dorothy C. Brown et Margret L. Casal, « Exfoliative cutaneous lupus erythematosus in German shorthaired pointer dogs: disease development, progression and evaluation of three immunomodulatory drugs (ciclosporin, hydroxychloroquine, and adalimumab) in a controlled environment », Veterinary Dermatology, (PMID 20374572, PMCID PMC3294011, DOI 10.1111/j.1365-3164.2010.00867.x, lire en ligne, consulté le ).
- (en) Bryden, S. L., White, S. D., Dunston, S. M., Burrows, A. K., & Olivry, T. (2005). Clinical, histopathological and immunological characteristics of exfoliative cutaneous lupus erythematosus in 25 German short‐haired pointers. Veterinary dermatology, 16(4), 239-252.
- ANSES (2019), Avis de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail portant sur une « demande d'avis relatif à une proposition d'arrêté portant inscription sur les listes des substances vénéneuses »[PDF], .
- (en) « Plaquenil (hydroxychloroquine sulfate) dose, indications, adverse effects, interactions… from PDR.net », sur pdr.net (consulté le ).
- boss, « Chloroquine et hydroxychloroquine », sur Réseau français des centres régionaux de pharmacovigilance, (consulté le ).
- (en) Samya Mohammad, Megan E. B. Clowse, Amanda M. Eudy et Lisa G. Criscione-Schreiber, « DailyMed - PLAQUENIL- hydroxychloroquine sulfate tablet », Arthritis Care & Research, vol. 70, no 3, , p. 481–485 (ISSN 2151-4658, PMID 28556555, DOI 10.1002/acr.23296, lire en ligne, consulté le ).
- (ru) K. Marquardt et T. E. Albertson, « Плаквенил (Plaquenil) - инструкция по применению, состав, аналоги препарата, дозировки, побочные действия », sur rlsnet.ru, The American Journal of Emergency Medicine, (ISSN 0735-6757, PMID 11555803, DOI 10.1053/ajem.2001.25774, consulté le ), p. 420–424.
- (en) Jordan, P. ; Brookes, J.G. ; Nikolic, G. et al. (1999), Hydroxychloroquine overdose: toxicokinetics and management, Clin. Toxicol., 37(7): 861-864.
- Smith et Klein-Schwartz.
- (en) El Shishtawy, M. A., Hassan, K. H., Ramzy, R., Berri, F., Mortada, M., Nasreddine, S. et Ezzedine, M. (2014), Comparative toxicity study of chloroquine and hydroxychloroquine on adult albino rats[PDF]. In 2nd Mediterranean interdisciplinary forum on social sciences and humanities, MIFS 2014 (voir p. 399).
- (en) Alf S. Alving, Lillian Eichelberger, Branch Craige et Ralph Jones, « Studies on the chronicité toxicity of chloroquine (SN-7618) », The Journal of Clinical Investigation, vol. 27, no 3, , p. 60–65 (ISSN 0021-9738, PMID 16695637, DOI 10.1172/JCI101974, lire en ligne, consulté le ).
- « Un collectif de médecins cite une étude de l'Agence du médicament pour prôner l'usage de la chloroquine », sur lci.fr, (consulté le ).
- (en) Ruther K ; Forester J ; berndt S et al., Chloroquine / hydroxychloroquine: variability of retinotoxic cumulative doses, Ophthalmologe, 104: 875-879, 2007.
- (en) « Hydroxychloroquine Use During Pregnancy », sur Drugs.com (consulté le ).
- (en) Tomas Miranda-Aquino, Silvia Esmeralda Perez-Topete, Williams Ortega-Pantoja et Carlos Alejandro Gomez-Vazquez, « Long QT syndrome secondary to drug interaction between hydroxychloroquine and amiodarone », Revista Mexicana de Cardiologia, vol. 29, no 2, , p. 98–101 (ISSN 0188-2198, lire en ligne, consulté le ).
- (en) David J Browning, Chong Lee et David Rotberg, « The impact of different algorithms for ideal body weight on screening for hydroxychloroquine retinopathy in women », Clinical Ophthalmology (Auckland, N.Z.), vol. 8, , p. 1401–1407 (ISSN 1177-5467, PMID 25092963, PMCID 4116363, DOI 10.2147/OPTH.S66531, lire en ligne, consulté le ).
- (en) Al- Jassabi, L.; Azirun, S.M. et Saad.A. (2011) Biochemical Studies on the Role of Curcumin in the Protection of Liver and Kidney Damage by Anti-Malaria Drug. AETJS, 3(1):17-22.
- (en) K. Marquardt et T. E. Albertson, « Treatment of hydroxychloroquine overdose », The American Journal of Emergency Medicine, vol. 19, no 5, , p. 420–424 (ISSN 0735-6757, PMID 11555803, DOI 10.1053/ajem.2001.25774, lire en ligne, consulté le ).
- (en) N. Gunja, D. Roberts, D. McCoubrie et P. Lamberth, « Survival after Massive Hydroxychloroquine Overdose », Anaesthesia and Intensive Care, vol. 37, no 1, , p. 130–133 (ISSN 0310-057X, DOI 10.1177/0310057X0903700112).
- Vincent Danel et Patrick Barriot, Intoxications aiguës en réanimation, 2e éd..
- (en) Mongenot, F., Gonthier, Y. T., Derderian, F., Durand, M. et Blin, D. (2006). Treatment of hydroxychloroquine poisoning with extracorporeal circulation. Dans : Annales françaises d'anesthesie et de reanimation (vol. 26, novembre, no 2, p. 164-167).
- (en) « DailyMed - PLAQUENIL- hydroxychloroquine sulfate tablet », sur dailymed.nlm.nih.gov (consulté le ).
- (en) Chun-Yu Chen, Feng-Lin Wang et Chih-Chuan Lin, « Chronic Hydroxychloroquine Use Associated with QT Prolongation and Refractory Ventricular Arrhythmia », Clinical Toxicology, vol. 44, no 2, , p. 173–175 (ISSN 1556-3650, DOI 10.1080/15563650500514558).
- (en) J A Gonzalez-Nieto et E Costa-Juan, « Psychiatric symptoms induced by hydroxychloroquine », sur Lupus, (ISSN 0961-2033, DOI 10.1177/0961203314558863, consulté le ), p. 339–340.
- H. Artaguine, O. Hocar, K. Laissaoui et N. Akhadari, « P 37 : Accès psychotique aigu induit par la Chloroquine », Annales de Dermatologie et de Vénéréologie, 30 Congrès de l’Association des Dermatologistes Francophones, 20-23 avril 2016 - Abidjan, Côte d’Ivoire, vol. 143, no 4, Supplement 1, , S48–S49 (ISSN 0151-9638, PMID 21220626, DOI 10.1016/S0151-9638(16)30212-5, lire en ligne, consulté le ).
- V. Ferraro, F. Mantoux, K. Denis et M. -A. Lay-Macagno, « Hallucinations au cours d’un traitement par hydroxychloroquine », Annales de Dermatologie et de Vénéréologie, vol. 131, no 5, , p. 471–473 (ISSN 0151-9638, DOI 10.1016/S0151-9638(04)93642-3, lire en ligne, consulté le ).
- (en) Annamaria Mascolo, Pasquale Maria Berrino, Pietro Gareri et Alberto Castagna, « Neuropsychiatric clinical manifestations in elderly patients treated with hydroxychloroquine: a review article », Inflammopharmacology, vol. 26, no 5, , p. 1141–1149 (ISSN 1568-5608, DOI 10.1007/s10787-018-0498-5).
- « Médicaments utilisés chez les patients atteints du COVID-19 : une surveillance renforcée des effets indésirables - Point d'information (actualisé le 14/05/2020) », ANSM, (lire en ligne).
- (en) Schneider P, Korolenko T.A et Busch U (1997), A review of druginduced lysosomal disorders of the liver in man and laboratory animals. Microsc. Res. Tech., 36(4): 253-275.
- (en) Zhao H, Cai Y, Santi S et al. (2005), Chloroquine mediated radiosensitization is due to the destabilization of the lysosomal membrane and subsequent induction of cell death by necrosis. Radiat. Res., 164(3): 250-7.
- (en) Raizman MB, Hamrah P, Holland EJ, Kim T, Mah FS, Rapuano CJ, Ulrich RG. Drug-induced corneal epithelial changes. Surv Ophthalmol. 2017 May - Jun;62(3):286-301.
- (en) Francis P, Michaelides M, Niamh S et Weleber R, Retinal toxicity associated with hydroxychloroquine and chloroquine, Arch. Ophthalmol., 2011, 129:30-9.
- (en) Yam JC, Kwok AK. Ocular toxicity of hydroxychloroquine. Hong Kong Med J. 2006 Aug;12(4):294-304 (résumé).
- (en) Cabral RTS, Klumb EM, Couto MINN, Carneiro S. Evaluation of toxic retinopathy caused by antimalarial medications with spectral domain optical coherence tomography. Arq Bras Oftalmol. 2019 Jan-Feb;82(1):12-17.
- (en) Yusuf IH, Sharma S, Luqmani R, Downes SM. Hydroxychloroquine retinopathy. Eye (Lond) 2017 Jun;31(6):828-845.
- (en) Stokkermans T.J et Trichonas G (2019), Chloroquine And Hydroxychloroquine Toxicity, Review from StatPearls Publishing, Treasure Island (FL), , CC-BY-SA 4.0.
- (en) « Hydroxychloroquine toxicity despite normal dose therapy. Europe PMC », Annals of Ophthalmology, (lire en ligne, consulté le ).
- (en) Marija Rowane, Jason Schend, Jaimin Patel et Robert Hostoffer, « Rapid desensitization of hydroxychloroquine », Annals of Allergy, Asthma & Immunology, vol. 124, no 1, , p. 97–98 (ISSN 1081-1206 et 1534-4436, PMID 31606403, DOI 10.1016/j.anai.2019.10.001, lire en ligne, consulté le ).
- (en) J. Jiménez‐Alonso, J. Tercedor, L. Jáimez et E. García‐Lora, « Antimalarial drug-induced aquagenic-type pruritus in patients with lupus », Arthritis & Rheumatism, vol. 41, no 4, , p. 744–745 ; voir aussi https://pdfs.semanticscholar.org/1049/1fddf1c560407cbf9f2a355a1bb8f94befe0.pdf (ISSN 1529-0131, DOI 10.1002/1529-0131(199804)41:43.0.CO;2-F, lire en ligne, consulté le ).
- (en) Moez Jallouli, « Hydroxychloroquine-Induced Pigmentation in Patients With Systemic Lupus Erythematosus: A Case-Control Study », JAMA Dermatology, vol. 149, no 8, , p. 935 (ISSN 2168-6068, DOI 10.1001/jamadermatol.2013.709, lire en ligne, consulté le ).
- Amin N'Cho C (2019), Dosage des spécialités et génériques pharmaceutiques de la chloroquine par chromatographie liquide haute performance.
- (en) Melles RB, Marmor MF. Pericentral retinopathy and racial differences in hydroxychloroquine toxicity. Ophthalmology. 2015 Jan;122(1):110-6.
- (en-US) Y Tal, R Maoz Segal, P Langevitz et S Kivity, « Hydroxychloroquine desensitization, an effective method to overcome hypersensitivity—a multicenter experience », Lupus, vol. 27, no 5, , p. 703–707 (ISSN 0961-2033 et 1477-0962, DOI 10.1177/0961203317735185).
- (en) M Jolly, L Galicier, O Aumaître et C Francès, « Quality of life in systemic lupus erythematosus: description in a cohort of French patients and association with blood hydroxychloroquine levels », Lupus, vol. 25, no 7, , p. 735–740 (ISSN 0961-2033 et 1477-0962, DOI 10.1177/0961203315627200, lire en ligne, consulté le ).
- Base de données publique du médicament,
- (en) Allan J. Flach, « Improving the risk-benefit relationship and informed consent for patients treated with hydroxychloroquine », sur Transactions of the American Ophthalmological Society, (ISSN 1545-6110, PMID 18427609, PMCID 2258132, consulté le ), p. 191–194; discussion 195–197.
- (en) Nathalie Costedoat-Chalumeau, Bertrand Dunogué, Gaëlle Leroux et Nathalie Morel, « A Critical Review of the Effects of Hydroxychloroquine and Chloroquine on the Eye », Clinical Reviews in Allergy & Immunology, vol. 49, no 3, , p. 317–326 (ISSN 1080-0549 et 1559-0267, DOI 10.1007/s12016-015-8469-8, lire en ligne, consulté le ).
- (en) Doo-ri Eo, Min Gyu Lee, Don-Il Ham et Se Woong Kang, « Frequency and Clinical Characteristics of Hydroxychloroquine Retinopathy in Korean Patients with Rheumatologic Diseases », Journal of Korean Medical Science, vol. 32, no 3, , p. 522–527 (ISSN 1011-8934, PMID 28145658, PMCID PMC5290114, DOI 10.3346/jkms.2017.32.3.522).
- (en) Ursula Laverty, Gerard Reid, Julie Silvestri et Adrian Pendleton, « Fri0200 Review of Hydroxychloroquine Use and Development of a Regional Strategy to Minimise Retinal Toxicity », Annals of the Rheumatic Diseases, vol. 78, no Suppl 2, , p. 779–779 (ISSN 0003-4967 et 1468-2060, DOI 10.1136/annrheumdis-2019-eular.5898, lire en ligne, consulté le ).
- (en) Michael F. Marmor, Ulrich Kellner, Timothy Y. Y. Lai et Jonathan S. Lyons, « Revised recommendations on screening for chloroquine and hydroxychloroquine retinopathy », Ophthalmology, vol. 118, no 2, , p. 415–422 (ISSN 1549-4713, PMID 21292109, DOI 10.1016/j.ophtha.2010.11.017, lire en ligne, consulté le ).
- (en) G. D. Levy, S. J. Munz, J. Paschal et H. B. Cohen, « Incidence of hydroxychloroquine retinopathy in 1,207 patients in a large multicenter outpatient practice », Arthritis and Rheumatism, vol. 40, no 8, , p. 1482–1486 (ISSN 0004-3591, PMID 9259429, DOI 10.1002/art.1780400817, lire en ligne, consulté le ).
- (en) David J. Browning, S. J. Munz, J. Paschal et H. B. Cohen, « Impact of the revised american academy of ophthalmology guidelines regarding hydroxychloroquine screening on actual practice », American Journal of Ophthalmology, vol. 155, no 3, , p. 418–428.e1 (ISSN 1879-1891, PMID 23218706, DOI 10.1016/j.ajo.2012.09.025, lire en ligne, consulté le ).
- (en) Matthew D. Walvick, Michael P. Walvick, Edison Tongson et Chau H. Ngo, « Hydroxychloroquine: lean body weight dosing », Ophthalmology, vol. 118, no 10, , p. 2100; author reply 2101 (ISSN 1549-4713, PMID 21968180, DOI 10.1016/j.ophtha.2011.07.020, lire en ligne, consulté le ).
- (en) Ullberg S, Lindquist NG, Sjòstrand SE. Accumulation of chorio-retinotoxic drugs in the foetal eye. Nature. 1970 Sep 19;227(5264):1257-8.
- (en + ru) Kolotova A et Ermakov N.V, « Toxic lesions of the organ of vision caused by chloroquine derivatives », Vestnik oftalmologii, vol. 119, no 1, , p. 39-42 (lire en ligne, consulté le ).
- (en) Kellner U, Lai T, Lyons J, Marmor M et Mieler W, Revised recommendations on screening for chloroquine and hydroxychloroquine retinopathy, Ophthalmology, 2011, 118:415-22.
- (en) Michel Michaelides, Niamh B. Stover, Peter J. Francis et Richard G. Weleber, « Retinal toxicity associated with hydroxychloroquine and chloroquine: risk factors, screening, and progression despite cessation of therapy », Archives of Ophthalmology (Chicago, Ill.: 1960), vol. 129, no 1, , p. 30–39 (ISSN 1538-3601, PMID 21220626, DOI 10.1001/archophthalmol.2010.321, lire en ligne, consulté le ).
- Nathalie Costedoat-Chalumeau, « Etude du rapport bénéfice/ risque du traitement par hydroxychloroquine dans le lupus systématique : étude de la toxicité fœtale, de la toxicité cardiaque et optimisation posologique basée sur la détermination de sa concentration sanguine », Paris 6, (consulté le ).
- (zh) « Emissions - Explosion de SCI Pharmtech, l’usine de production d’hydroxychloroquine taiwanaise », sur Radio Taiwan International (consulté le )
- « France, Italie, Brésil... Le monde divisé sur l’utilisation de l’hydroxychloroquine », L'Obs, (lire en ligne, consulté le ).
- Astrid de Villaines, « Douste-Blazy et Pelloux prennent parti pour la chloroquine et en appellent à Philippe », HuffPost, (lire en ligne, consulté le ).
- (en) « Coronavirus (COVID-19) Update: FDA Revokes Emergency Use Authorization for Chloroquine and Hydroxychloroquine », FDA, (consulté le ).
- (en) « South Korea backs remdesivir for COVID-19, urges caution with dexamethasone », Reuters, (consulté le ).
- (en) « Hydroxychloroquine Halted in WHO-Sponsored Covid-19 Trials », Bloomberg News, (consulté le ).
- (en) David R. Boulware, Matthew F. Pullen, Ananta S. Bangdiwala, Katelyn A. Pastick, Sarah M. Lofgren, Elizabeth C. Okafor, Caleb P. Skipper, Alanna A. Nascene, Melanie R. Nicol, Mahsa Abassi, Nicole W. Engen, Matthew P. Cheng, Derek LaBar, Sylvain A. Lother, Lauren J. MacKenzie, Glen Drobot, Nicole Marten, Ryan Zarychanski, Lauren E. Kelly, Ilan S. Schwartz, Emily G. McDonald, Radha Rajasingham, Todd C. Lee et Kathy H. Hullsiek, « A Randomized Trial of Hydroxychloroquine as Postexposure Prophylaxis for Covid-19 », The New England Journal of Medicine, (PMID 32492293, PMCID 7289276, DOI 10.1056/NEJMoa2016638, lire en ligne)
- (en) « No clinical benefit from use of hydroxychloroquine in hospitalised patients with COVID-19 », Essai clinique Recovery, (consulté le )
- (en) Reed AC Siemieniuk, Jessica J. Bartoszko, Long Ge et Dena Zeraatkar, « Drug treatments for covid-19: living systematic review and network meta-analysis », BMJ, vol. 370, (ISSN 1756-1833, PMID 32732190, DOI 10.1136/bmj.m2980, lire en ligne, consulté le )
- Coronavirus - L'OMS met fin aux essais cliniques sur l'hydroxychloroquine "qui ne réduit pas ou très peu la mortalité"
- Covid-19 : l’OMS déconseille vivement l’hydroxychloroquine comme traitement préventif
- Marianne Schaffner, Prescription d’hydroxychloroquine : un cadre réglementaire exigeant mais protecteur Le club des juristes, 10 juin 2020
- « « Pas d'effet bénéfique » de l'hydroxychloroquine, selon les résultats préliminaires de l'essai britannique Recovery », sur Le Quotidien du médecin (consulté le ).
- « Covid-19 : l’hydroxychloroquine n’a « aucun effet bénéfique » sur les patients hospitalisés, selon l’essai Recovery », sur Le Monde.fr, Le Monde, (ISSN 1950-6244, consulté le ).
- « Traitements du Covid-19 : résultats négatifs pour l’essai Solidarity, confirmant l’inefficacité du Remdesivir et de l’hydroxychloroquine », sur Le Monde.fr, Le Monde, (ISSN 1950-6244, consulté le ).
- « Solidarity confirme l’inefficacité de plusieurs traitements anti-covid », sur Le Temps, (consulté le ).
- Hervé Seitz, Hydroxychloroquine et Covid-19 : résumé d'un an de controverse, (lire en ligne)
- (en) Fernando Luiz Barros Edington, Sandra Rocha Gadellha et Mittermayer Barreto Santiago, « Safety of treatment with chloroquine and hydroxychloroquine: A ten-year systematic review and meta-analysis », European Journal of Internal Medicine, vol. 88, , p. 63–72 (ISSN 0953-6205, DOI 10.1016/j.ejim.2021.03.028, lire en ligne, consulté le ).
- Damien Leloup et Lucie Soullier, « Coronavirus : comment le professeur Didier Raoult est devenu une figure centrale des théories complotistes. Les débats sur l’hydroxychloroquine ont inspiré des théories conspirationnistes, avec une question récurrente : pourquoi le traitement n’est-il pas généralisé ? », sur lemonde.fr,
- (en) Paul Bertin, Kenzo Nera & Sylvain Delouvée, « Conspiracy Beliefs, Rejection of Vaccination, and Support for hydroxychloroquine: A Conceptual Replication-Extension in the COVID-19 Pandemic Contex », Front. Psychol., vol. 11, no 1, (DOI 10.3389/fpsyg.2020.565128)
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) International Union of Pharmacology
- (en) Medical Subject Headings
- (en) National Drug File
- (en) PatientLikeMe
- (no + nn + nb) Store medisinske leksikon
- (en) Article sur l'hydroxychloroquine sur Medicinenet