Australopithecus sediba
Australopithecus sediba est une espèce éteinte d'Hominina ayant vécu durant le Pléistocène inférieur, il y a 1,98 million d'années, dans ce qui est actuellement l'Afrique du Sud. Le taxon est connu à partir d'un squelette juvénile partiel, l'holotype MH1, et du squelette partiel d'une femelle adulte, le paratype MH2, tous deux découverts à Malapa, dans la région du « berceau de l'humanité », près de Johannesbourg. Le registre fossile indique qu'A. sediba a coexisté avec Paranthropus robustus et les premiers représentants du genre Homo. Le site de Malapa est interprété comme ayant été un piège mortel naturel, la base d'un long puits vertical dans lequel des animaux sont tombés accidentellement. A. sediba pourrait représenter une population survivante tardive ou un groupe frère d'Australopithecus africanus qui avait auparavant habité la région.
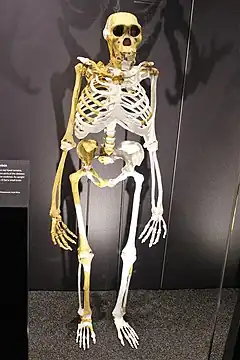
MH1 a un volume cérébral d'environ 420 à 440 cm3, similaire aux autres australopithèques. Sa face semble toutefois plus dérivée, avec une arcade sourcilière, des pommettes et un prognathisme moins prononcés. On note la possible présence d'un léger menton. Cependant, ce pourraient être des traits juvéniles non conservés à l'âge adulte. Les dents sont assez petites pour un australopithèque. La taille de MH1 est estimée à 1,3 m, ce qui équivaudrait à une taille adulte de 1,5 à 1,56 m. Les chercheurs estiment que MH1 et MH2 avaient à peu près le même poids, entre 30 et 36 kg. Comme les autres australopithèques, A. sediba aurait eu un haut de poitrine étroit et ressemblant à celui d'un chimpanzé, mais un bas de poitrine large et de forme humaine. L'anatomie du bras semble suggérer une capacité arboricole, mais le bassin indique qu'A. sediba était capable d'une foulée humaine, ce qui pourrait représenter un compromis entre la bipédie habituelle et l'arboricolisme occasionnel.
Historique
Spécimens
Le premier fossile identifié est une clavicule droite, appartenant au spécimen catalogué MH1 (UW 88-1[N 1]), découvert dans la grotte de Malapa, dans la région du « berceau de l'humanité », en Afrique du Sud. Il a été trouvé par Matthew Berger le alors qu'il explorait le site de fouilles dirigé par son père, le paléoanthropologue sud-africain Lee Rogers Berger. Des fouilles plus poussées ont conduit à la découverte d'un squelette partiel (spécimen MH1), comprenant un crâne partiel et des fragments de mandibule, ainsi que des parties des bras, des doigts, des épaules, de la cage thoracique, de la colonne vertébrale, du bassin, des jambes et des pieds. MH1 a été considéré par les découvreurs comme un mâle juvénile en raison du développement apparemment prononcé de l'arcade sourcilière et des racines dentaires des canines, de l'éversion de l'angle de la mandibule et des larges cicatrices sur les os[1]. Cependant, les paléoanthropologues William Kimbel (en) et Yoel Rak (de) soutiennent que ce ne sont pas des critères fiables pour déterminer le sexe et suggèrent que MH1 serait une femelle en raison de l'absence de piliers antérieurs (des colonnes descendant le long de l'ouverture nasale jusqu'autour de la bouche) et d'une plaque sous-nasale légèrement convexe, critères fondés sur les méthodes de détermination du sexe utilisées pour Australopithecus africanus[2]. MH1 a été surnommé Karabo, signifiant « réponse » en tswana, par Omphemetse Keepile, 17 ans, de la St Mary's School (en) de Johannesbourg, lors d'un concours de dénomination. Elle a choisi ce nom car le fossile représenterait « une solution pour comprendre les origines de l'humanité »[3].
Un autre squelette partiel, catalogué MH2, un adulte, a été découvert par Lee Berger le avec des dents supérieures isolées, une mandibule partielle, un bras droit presque complet, l'omoplate droite et des fragments des épaules, du bras droit, de la colonne vertébrale, des côtes, du bassin, l'articulation du genou et les pieds. L'os pubien large et carré et les cicatrices musculaires sur le corps allant de faibles à modérées suggèrent que le spécimen MH2 est une femelle. En 2010, Lee Berger et al. décrivent l'espèce A. sediba avec le spécimen MH1 comme holotype et MH2 comme paratype. L'épithète spécifique sediba signifie « fontaine » ou « source » dans la langue locale sesotho[1].
Datation
La présence d'espèces animales fossiles qui sont apparues il y a 2,36 millions d'années et se sont éteintes il y a environ 1,5 million d'années indiquait que la couche d'A. sediba datait de cet intervalle de temps, au cours du Pléistocène inférieur. La datation par l'uranium-plomb d'une coulée recouvrant la couche a donné une date de 2,026 ± 0,021 millions d'années. En utilisant la datation paléomagnétique, les sédiments ont une polarité magnétique normale (comme la polarité magnétique actuelle) et le seul moment où cela s'est produit pendant cet intervalle se situe entre 1,95 et 1,78 million d'années[4]. En 2011, la coulée sus-jacente est plus fermement datée de 1,977 ± 0,002 million d'années en utilisant à nouveau la datation par l'uranium-plomb[5].
Géologie

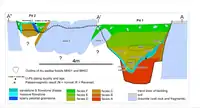
Les réseaux de grottes autour de Malapa comprennent de longues cavités interconnectées dans une zone de 500 m × 100 m. Le site de Malapa était peut-être à l'origine un système de cavernes de plus de 30 m de profondeur. La grotte se trouve à l'intersection d'une fracture remplie de chaille au nord-nord-est et au nord-nord-ouest, et les restes d'Hominina ont été mis au jour dans une section de 3,3 m × 4,4 m × 3,5 m au nord – fracture nord-ouest. La couche archéologique a été exposée par l'extraction de calcaire au début du XXe siècle. La grotte comprend cinq faciès sédimentaires de grès hydrique, notés A à E, A. sediba ayant été trouvé dans le faciès D, et d'autres restes d'Hominina dans le faciès E. MH1 et MH2 sont séparés verticalement de plus de 40 cm. Le faciès D est une couche légèrement colorée de 1,5 m d'épaisseur recouvrant la coulée. Les petits péloïdes sont communs, mais sont fusionnés en grands groupes irréguliers, ce qui indique qu'ils ont été déposés dans un environnement gorgé d'eau. Les péloïdes peuvent représenter des matières fécales ou des microbes du sol[4].
Taphonomie
L'état de conservation de MH1 et MH2 indique qu'ils ont été très peu déplacés et ont été cémentés peu de temps après leur dépôt dans un environnement phréatique. Il n'y a aucune preuve de charognards, ce qui indique que la zone était inaccessible aux carnivores[4].
Tout cela pourrait indiquer que la grotte de Malapa était un piège mortel, avec des ouvertures de grotte discrètes à la surface. Les animaux peuvent avoir été attirés par l'odeur de l'eau émanant du puits, et les carnivores par l'odeur d'animaux morts, tombés sans possibilité d'y survivre. Une importante coulée de débris a provoqué le dépôt des restes plus profondément dans la grotte le long d'un ruisseau souterrain, peut-être en raison d'une forte tempête de pluie. La chambre s'est finalement effondrée et a été remplie de boue[4].
Description
Crâne
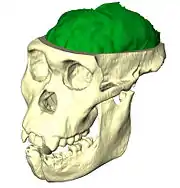
Du calvarium de MH1, seules la face et une partie de la voûte crânienne ont été trouvées. Celle-ci représente un volume crânien estimé à 363 cm3, tandis que l'arrière du cerveau ferait entre 7 et 10 cm3. Pour estimer le volume du cervelet, les chercheurs ont extrapolé les spécimens catalogués KNM-ER 23000 (Paranthropus boisei) et Sts 19 (Australopithecus africanus), avec des volumes de 40 à 50 cm3, ainsi que KNM-ER 1813, KNM-ER 1805 (Homo habilis) et KNM-ER 1470 (Homo rudolfensis), avec des volumes de 55 à 75 cm3, et en ont déduit un cervelet de MH1 d'environ 50 cm3. Compte tenu de tout cela, MH1 aurait eu un volume cérébral d'environ 420 à 440 cm3, dans le bas de la fourchette des australopithèques[1]. En utilisant les variations observées chez les grands singes modernes entre la taille du cerveau adulte et celle du nouveau-né, la taille du cerveau du nouveau-né d'A. sediba peut avoir été de 153 à 201 cm3, similaire à ce qui est présumé pour les autres espèces d'australopithèques[6]. La configuration cérébrale d'A. sediba semble typique des australopithèques, mais le cortex orbitofrontal semble avoir été plus proche du genre Homo[7].
Dans l'ensemble, l'anatomie crânienne la plus proche d'A. sediba est celle d'A. africanus. Cependant, MH1 a un crâne plus petit, une voûte crânienne transversalement plus large, des parois de l'os pariétal plus inclinées verticalement et des lignes temporales plus espacées. Comme chez le genre Homo, l'arcade sourcilière est moins prononcée, les pommettes sont moins évasées, le bas du visage est moins avancé (moins prognathe) que chez les autres australopithèques, et il y a un léger menton[1]. Cependant, de telles caractéristiques se trouvent également sur certains crânes juvéniles d'A. africanus du membre 4 de Sterkfontein, ce qui, selon William Kimbel et Yoel Rak, pourrait indiquer que de tels traits dérivés auraient été perdus avec la maturité. De plus, si le prognathisme est mesuré en utilisant l'épine nasale antérieure au lieu de la base même du nez, le prognathisme de MH1 est équivalent à celui d'A. africanus[2]. Les dents sont assez petites pour un australopithèque, et sont plus dans la gamme de celles des premiers représentants du genre Homo. Cependant, contrairement à Homo, les molaires augmentent progressivement de taille vers l'arrière de la mâchoire et les cuspides sont plus rapprochées, ce qui sont des traits d'australopithèque[1].

La forme de la branche mandibulaire (qui relie la mandibule au crâne) est assez différente entre MH1 et MH2. Celle de MH1 est plus haute et plus large ; les bordures avant et arrière sont presque verticales et parallèles, contrairement aux bordures non parallèles de MH2 avec une bordure avant concave. Le processus coronoïde de MH1 est incliné vers l'arrière avec une encoche mandibulaire profonde et asymétrique, tandis que MH2 a un processus coronoïde non courbé avec une encoche mandibulaire peu profonde. Par rapport aux schémas observés chez les hominidés modernes, des différences aussi marquées dépassent ce qu'on pourrait attendre d'un dimorphisme sexuel ou du statut juvénile de MH1. Dans sa morphologie squelettique, A. sediba pourrait avoir été une espèce très variable[8].
Tronc
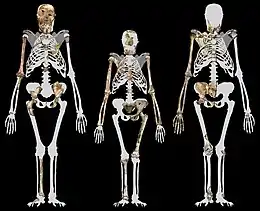
Les spécimens MH1 et MH2 ont à peu près la même taille et auraient pesé entre 30 et 36 kg. C'est plus petit que les premiers représentants du genre Homo, mais dans la moyenne des australopithèques[10]. MH1 mesurait environ 1,30 m mais était un juvénile avec à peu près le même développement squelettique qu'un enfant humain de 12 ans ou un chimpanzé de 9 ans. Sur la base du développement dentaire, A. sediba, tout comme les autres australopithèques, semble avoir eu un taux de croissance proche de celui des chimpanzés, de sorte que MH1 aurait atteint à sa mort environ 85 % de sa taille adulte en supposant une trajectoire de croissance semblable à celle d'un chimpanzé, ou 80 % en supposant une trajectoire humaine. Cela aurait donné une taille d'1,50 à 1,56 m à l'âge adulte[9].
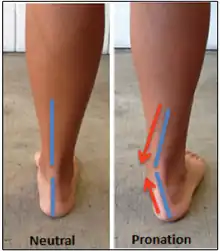
Le spécimen MH1 compte quatre vertèbres cervicales, six vertèbres thoraciques et deux vertèbres lombaires. MH2 présente deux vertèbres cervicales, sept vertèbres thoraciques, deux vertèbres lombaires et une vertèbre sacrée[11]. La lordose et les articulations des vertèbres du cou indiquent une posture de tête similaire à celle des humains. Cependant, l'anatomie générale des vertèbres du cou ressemble à celle d'un chimpanzé et indique un cou beaucoup plus rigide. A. sediba n'a pas de plexus brachial de type humain (qui est identifié chez certains A. afarensis). Le plexus brachial humain est responsable des nerfs et de l'innervation musculaire des bras et des mains, améliorant le contrôle moteur[12]. Comme les humains, A. sediba semble avoir eu une série lombaire flexible, comprenant 5 vertèbres contre 6 vertèbres statiques chez les chimpanzés, et présentant une lordose lombaire (courbure humaine de la colonne vertébrale) compatible avec la posture verticale habituelle. Cependant, A. sediba semble avoir eu un bas du dos très mobile et une lordose lombaire exagérée[11], qui peuvent avoir été impliqués dans la lutte contre les couples dirigés vers l'intérieur lors de la marche dans la démarche hyperpronatrice proposée pour A. sediba[13].
MH1 conserve deux côtes thoraciques supérieures, une côte mi-thoracique et trois côtes thoraciques inférieures, et MH2 quatre côtes thoraciques supérieures à moyennes consécutives et trois côtes thoraciques inférieures jointes aux vertèbres[11]. Cela indique qu'A. sediba avait un haut de poitrine resserré semblable à un chimpanzé. Toutefois, l'anatomie du bassin suggère qu'A. sediba avait un bas de poitrine large et de forme humaine. Le haut de poitrine étroit aurait gêné le balancement des bras pendant la marche et aurait réduit la cage thoracique, empêchant une respiration puissante et ainsi la marche rapide ou la course sur de longues distances. En revanche, A. sediba semble avoir eu une taille étroite semblable à celle d'un humain, des muscles obliques externes abdominaux repositionnés et des muscles ilio-costals plus larges sur le dos, ce qui aurait amélioré l'efficacité de la marche en contrecarrant la flexion latérale du torse[14].
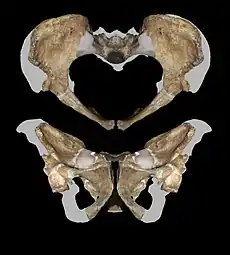
Le bassin partage plusieurs traits avec les premiers représentants du genre Homo, avec Homo ergaster, ainsi qu'avec KNM-ER 3228 de Koobi Fora (un os coxal daté de 1,95 Ma), au Kenya, et OH 28 des gorges d'Olduvaï, en Tanzanie, qui sont classés Homo sp.. A. sediba montre un renforcement le long de l'acetabulum et du sacrum, améliorant l'extension de la hanche, un élargissement de l'attache du ligament ilio-fémoral, déplaçant le poids derrière le centre de rotation de la hanche, un renforcement le long de la crête iliaque, améliorant l'inclinaison pelvienne alternée, et plus de distance entre l'acetabulum et le bras de moment réducteur de la tubérosité ischiatique au niveau des muscles ischio-jambiers. Cela aurait peut-être permis une démarche humaine chez A. sediba. L'articulation de la hanche semble avoir eu un modèle de portance plus humain que chez le spécimen d'Homo habilis OH 62[1]. Le canal de naissance d'A. sediba semble être plus gynécoïde (la condition humaine normale) que ceux des autres australopithèques qui sont plus platypelloïdes, bien qu'A. sediba ne soit pas complètement gynécoïde, ce qui peut être dû à la taille plus petite de la tête du nouveau-né. Comme chez les humains, le canal de naissance avait un diamètre accru sagittalement (de l'avant vers l'arrière) et l'os du pubis recourbé vers le haut[6].
Membres supérieurs
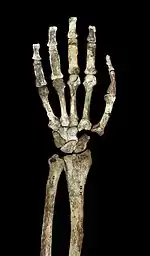
Comme les autres australopithèques et les premiers représentants du genre Homo, A. sediba a des proportions du haut du corps proches de celles du chimpanzé, avec des bras relativement longs, un indice brachial élevé (rapport entre le radius et l'humérus) de 84 et de grandes surfaces articulaires. La configuration simienne des membres supérieurs des australopithèques peut soit indiquer un comportement arboricole, soit être seulement un trait plésiomorphique hérité d'ancêtres arboricoles en l'absence de pressions sélectives pour adopter une anatomie du bras plus humaine. Les épaules sont hautes, l'omoplate a un bord axillaire (en) bien développé et le tubercule conoïde (important dans la fixation musculaire autour de l'articulation de l'épaule) est bien défini[1]. Les marques d'insertion musculaire sur la clavicule indiquent une amplitude de mouvement semblable à celle d'un humain. L'omoplate ressemble le plus à celle des orang-outans en termes de taille de la cavité glénoïde (qui forme l'articulation de l'épaule) et de son angle avec la colonne vertébrale, bien que la forme de l'omoplate ressemble le plus à celle des humains et des chimpanzés. L'humérus a un faible degré de torsion, contrairement aux humains, aux gorilles et aux chimpanzés, ce qui (avec la clavicule courte) suggère que l'omoplate était placée plus loin de la ligne médiane comme chez Homo, bien qu'elle soit positionnée plus haut dans le dos comme chez les autres australopithèques[15]. Les traits simiens des bras sont apparemment plus marqués chez A. sediba que chez le plus ancien A. afarensis, et si ce dernier est ancestral d'A. sediba, cela pourrait indiquer un changement adaptatif vers un comportement plus arboricole[16].
Au niveau de l'articulation du coude, les épicondyles latéral et médial de l'humérus sont allongés, tout comme les autres australopithèques et les Homininae africains non humains. L'humérus arbore également une crête développée au niveau de l'articulation du coude pour soutenir le muscle brachio-radial qui fléchit l'avant-bras. Comme chez les Homininae africains non humains, il existe une forte attache pour le biceps sur le radius et pour le triceps sur l'ulna. Cependant, il y a moins d'avantage mécanique pour le biceps et le brachial[15]. L'ulna comporte également une forte attache pour le muscle fléchisseur ulnaire du carpe. La fosse de l'olécrane est grande et profonde et il y a une incisure trochléenne proéminente, qui est importante pour maintenir la stabilité des bras lorsqu'ils sont étendus. Les os des doigts sont longs, robustes et incurvés, et soutiennent de puissants muscles fléchisseurs superficiels des doigts, importants pour la flexion des doigts[1]. Ceux-ci sont parfois présentés comme la preuve d'un comportement arboricole chez les australopithèques. La main comporte également un pouce relativement long et des doigts courts, un peu comme chez Homo, ce qui pourrait suggérer une meilleure saisie de précision dans la fabrication et l'utilisation d'outils lithiques[17].
Membres inférieurs
Comme chez les autres australopithèques, les articulations de la cheville, du genou et de la hanche indiquent une bipédie habituelle. Les os des jambes sont similaires à ceux d'A. afarensis. La cheville est principalement de forme humaine avec peut-être un tendon d'Achille humain[18].
L'os du talus est robuste et ressemble davantage à ceux des hominoïdes non humains. Il présente un col tordu médialement et un angle de torsion du col bas. On ne sait pas si A. sediba avait une voûte plantaire de forme humaine ou si le pied était de type australopithèque[19]. Le calcanéus est incliné à un angle de 45 degrés et est nettement incliné de l'avant vers l'arrière, le plus fortement au niveau de la trochlée péronière. La trochlée péronière robuste indique des muscles péroniers forts qui s'étendent du mollet jusqu'à la cheville. Le pied n'a pas le tubercule plantaire latéral (qui peut être impliqué dans la dissipation des forces lorsque le talon touche le sol dans une démarche humaine normale) observé chez l'homme et A. afarensis[1] - [18]. Le corps gracile du calcanéus et la malléole robuste (la proéminence osseuse de chaque côté de la cheville) ressemblent à ceux des Homininae non humains, avec un transfert de force moins efficace entre l'os du talon et le talus, et une mobilité simienne au milieu du pied. A. sediba ressemble le plus à la condition observée chez les gorilles. Le pied semble fonctionnellement équivalent à celui d'A. africanus[18] - [20].
Phylogénie
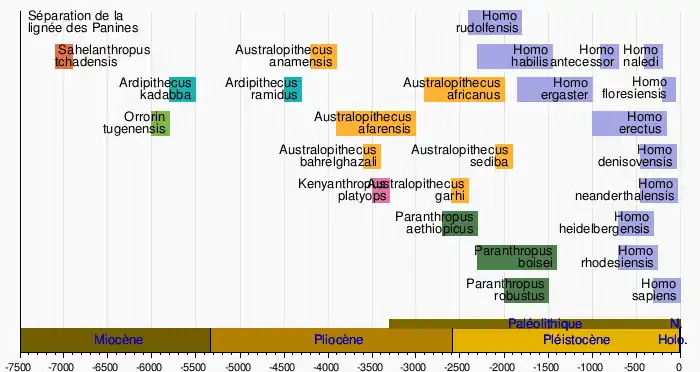
A. sediba ayant de nombreux traits en commun avec les premiers représentants du genre Homo, en particulier dans le bassin et les jambes, les descripteurs ont émis l'hypothèse que le taxon puisse être une forme transitionnelle entre les genres Australopithecus et Homo[1]. Les caractères dentaires suggéraient également une parenté entre A. sediba et Homo[21]. Cependant, les spécimens de Malapa sont datés de 1,98 million d'années, alors qu'on connaissait déjà en 2010 un fossile humain daté de 2,33 millions d'années, un Homo habilis trouvé à Hadar, en Éthiopie[1]. Le plus ancien fossile du genre Homo connu à ce jour est LD 350-1, daté de 2,8 à 2,75 millions d'années, découvert en 2013 à Ledi-Geraru (en), toujours en Éthiopie[22]. Pour résoudre la contradiction, les descripteurs ont émis l'hypothèse qu'A. sediba aurait évolué il y a plus de 2,5 millions d'années à partir d'une population d'Australopithecus africanus (qui habitait auparavant la même région), et que le genre Homo se serait séparé d'A. sediba quelque temps après[1]. Ils ont également suggéré qu'A. sediba, au lieu de Homo habilis ou Homo rudolfensis, puisse être l'ancêtre direct d'Homo ergaster (le plus ancien représentant incontesté du genre Homo), qui apparait toutefois lui-même dans le registre fossile il y a deux millions d'années[5]. De plus, l'holotype d'A. sediba étant un spécimen juvénile, Kimbel et Rak estiment que certaines de ses caractéristiques faciales jugées dérivées auraient pu être perdues avec la maturité[2].
Les chercheurs pensent maintenant qu'A. sediba était contemporain du genre Homo et de Paranthropus robustus en Afrique australe[23]. A. sediba pourrait représenter une forme tardive ou un groupe frère d'A. africanus non apparenté au genre Homo, ce qui signifie que des traits similaires auraient évolué indépendamment chez A. sediba et chez Homo[2] - [24] - [25] - [26] - [27]. Le registre fossile des premiers représentants du genre Homo est maigre et fragmentaire, ce qui rend les analyses difficiles[27]. A. africanus, A. afarensis et A. garhi ont également été proposés comme ancêtres du genre Homo, sans susciter aucun consensus[22].
La phylogénie des Hominina n'est pas encore stabilisée. Les australopithèques tendent à être considérés comme un grade évolutif dont les membres sont unis par leur morphologie similaire, et non comme un clade qui devrait inclure le genre Homo. Les chercheurs ne savent pas vraiment à ce jour comment s'établit la généalogie des espèces connues d'Hominina[28].
Paléobiologie
Régime alimentaire
A. sediba semble n'avoir mangé que des plantes en C3, telles que certaines graminées, des carex, des fruits, des feuilles et de l'écorce. Cela contraste avec les autres Hominina pré-Homo qui mangeaient un mélange de plantes en C3 et en C4.
L'analyse des phytolithes (particules siliceuses microscopiques des plantes) de la plaque dentaire des deux spécimens et l'analyse des isotopes (en) du carbone montrent un régime alimentaire composé presque exclusivement de plantes forestières en C3, malgré une disponibilité vraisemblablement large de plantes en C4 dans leur environnement de savane arborée. Un tel modèle alimentaire est également observé chez les chimpanzés de savane actuels et est supposé chez Ardipithecus ramidus au début du Pliocène, mais est assez différent des autres Hominina pré-Homo. Au total, 38 phytolithes ont été collectés sur deux dents de MH1, dont 15 sont compatibles avec des dicotylédones, 9 monocotylédones et les 14 autres restants indéterminés. Les monocotylédones provenaient probablement d'herbes et de carex en C3 poussant dans des zones bien arrosées et ombragées, et d'autres phytolithes provenaient de fruits, de feuilles et de bois, ou encore d'écorce. Bien que l'écorce soit couramment consommée par d'autres primates pour sa teneur élevée en protéines et en sucre, aucun autre Hominina n'est connu pour avoir consommé de l'écorce régulièrement. L'analyse de la micro-usure dentaire suggère aussi que les deux individus de Malapa mangeaient des aliments durs, d'une dureté comprise entre le régime d'Homo ergaster et celui de Paranthropus robustus[29]. Néanmoins, leur mandibule ne semble pas avoir été en mesure de produire une aussi forte pression que celle d'autres Hominina robustes, ce qui pourrait indiquer une moindre dépendance envers des aliments coriaces[30] - [31].
L'interprétation d'A. sediba comme espèce végétivore généraliste des plantes forestières en C3 est cohérente avec sa capacité au moins partiellement arboricole. Un régime aussi large aurait peut-être permis aux groupes d'A. sediba d'occuper des territoires plus réduits que les chimpanzés de savane actuels qui consomment surtout des fruits, car A. sediba aurait pu se rabattre sur de l'écorce et autres aliments coriaces[29]. La région de Malapa était peut-être il y a 2 millions d'années plus fraiche et plus humide qu'actuellement, avec des forêts denses entourées de prairies plus ouvertes.
Démarche
Le pied d'A. sediba indique une démarche particulière qui n'a été trouvée chez aucun autre Hominina, impliquant une hyperpronation de la cheville et, par conséquent, une rotation de la jambe vers l'intérieur tout en poussant lors de la marche.
En marchant, A. sediba pourrait avoir présenté une hyperpronation de l'articulation de la cheville, provoquant un transfert exagéré de poids vers l'intérieur pendant la phase d'appui. Pour les hyperpronateurs humains actuels, le pied est fortement inversé pendant la phase de balancement, et le contact avec le sol se fait d'abord par le bord extérieur du pied, provoquant des couples élevés faisant tourner toute la jambe vers l'intérieur. De même, les attaches du muscle droit fémoral et du muscle biceps fémoral chez A. sediba sont compatibles avec des contraintes sur les jambes, les hanches et les genoux dirigées vers la ligne médiane. Ce type de marche est problématique pour l'anatomie humaine moderne, et les hyperpronateurs courent un risque plus élevé de développer une aponévrosite plantaire, des attelles de tibia (en) et des fractures de fatigue du tibia. Pour contrer cela, A. sediba pourrait avoir eu un pied médial mobile, par opposition à un pied médial raide de type humain, afin d'éviter une trop grande pression sur la cheville[13].
La démarche hyperpronatrice et la suite d'adaptations associées n'ont pas été identifiées chez d'autres Hominina, et on ne sait pas encore expliquer complètement l'intérêt de ce trait[13]. Un pied médial mobile pourrait être utile en phase d'escalade[1] - [13] - [18], de sorte que l'hyperpronation pourrait avoir été un compromis entre la bipédie habituelle et l'arboricolisme occasionnel[13].
Naissance
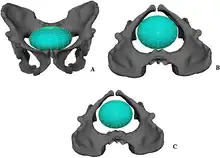
Le détroit supérieur d'une femelle A. sediba aurait fait 8,8 cm en longueur sagittale et 11,24 cm en largeur transversale. Comme la taille de sa tête est estimée à 8,92 cm dans sa plus grande dimension, le nouveau-né entrait probablement dans le canal du bassin orienté transversalement comme les autres Hominina. Le plan médian de l'entrée pelvienne se resserre jusqu'à un minimum de 9,69 cm, de sorte que le nouveau-né n'avait peut-être pas besoin d'opérer une rotation pendant l'accouchement. Les dimensions de l'entrée pelvienne ont été calculées à l'aide d'une reconstitution composite incluant l'ischion juvénile mâle, ce qui signifie que le canal de naissance était peut-être plus grand qu'estimé. Les épaules du nouveau-né auraient mesuré 7,43 cm de diamètre, de sorte qu'elles n'auraient pas gêné la naissance plus que la tête. Par conséquent, le nouveau-né aurait occupé, au point de plus grande constriction, environ 92,1 % du canal de naissance, laissant suffisamment de place pour une naissance sans rotation, comme c'est le cas chez les hominoïdes non humains et peut-être même d'autres australopithèques. Une naissance en semi-rotation est également proposée : bien qu'il soit possible de passer sans aucune rotation, le plan médian se dilate antéropostérieurement (d'avant en arrière), et il y aurait eu plus d'espace pour le nouveau-né s'il avait tourné, de manière que la plus grande longueur de la tête soit alignée avec cette expansion[32]. En utilisant une estimation de 145,8 à 180,4 cm3 pour la taille du cerveau d'un nouveau-né d'A. sediba, la taille de sa tête aurait été de 7,3 cm × 8,9 cm, semblable à celle d'un nouveau-né de chimpanzé[32].
Homo sapiens, en comparaison, a une naissance beaucoup plus laborieuse et complexe, nécessitant une rotation complète du nouveau-né, car le grand cerveau, et donc la taille de la tête ainsi que les épaules rigides du nouveau-né humain rendent beaucoup plus difficile son passage à travers le canal de naissance.
Développement
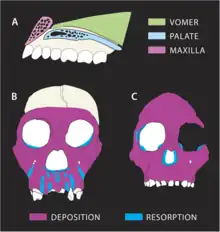
La trajectoire de croissance du spécimen MH1 semble avoir été sensiblement différente de celle des autres hominines. Le complexe naso-maxillaire (os associant le nez à la lèvre supérieure) indique un degré élevé de résorption osseuse, le plus nettement au niveau des racines dentaires des dents antérieures. Cela contraste avec A. africanus et A. afarensis qui sont en déposition osseuse, reflétant un prognathisme croissant avec l'âge. Paranthropus robustus présente également une résorption de la mâchoire supérieure, mais la résorption chez MH1 s'étend le long des dents antérieures jusqu'à la fosse canine près des pommettes, entraînant une face mésognathe (légèrement prognathe), par opposition à une face plate chez Paranthropus robustus. La résorption se produisant si près des pommettes, cela peut expliquer pourquoi MH1 ne présente pas les pommettes évasées caractéristiques d'A. africanus. L'éruption dentaire n'a probablement pas affecté le bas du visage car MH1 a déjà toutes ses dents permanentes. Néanmoins, la taille plus petite des dents jugales aurait permis une réduction du prognathisme.
A. sediba avait apparemment un régime alimentaire nettement différent des régimes typiques des autres hominines, peut-être similaire à celui du singe colobe vert moderne, qui mange principalement de jeunes feuilles ; les deux espèces semblent avoir des schémas similaires de croissance des os du visage. Cela pourrait être lié aux schémas de résorption et de déposition divergents chez A. sediba par rapport aux autres hominines. Les bords des orbites de MH1 sont courbes, alors qu'ils sont indentés chez A. africanus, ce qui peut indiquer une déposition osseuse chez A. sediba dans les régions où une résorption osseuse se produit chez A. africanus[33]
Pathologie
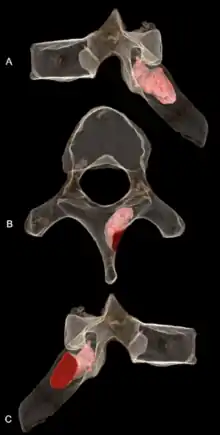
La lame droite de la sixième vertèbre thoracique de MH1 présente une tumeur osseuse pénétrante, probablement un ostéome ostéoïde bénin. La lésion pénètre à 6,7 mm de profondeur et mesure 5,9 mm de largeur, et était toujours active au moment du décès. N'ayant pas pénétré dans le canal neural, il n'a donc probablement pas causé de complications neurologiques et il n'y a aucun signe de scoliose. Il peut avoir affecté le mouvement de l'omoplate et du quadrant supérieur droit du dos, provoquant peut-être une douleur aiguë ou chronique, des troubles musculaires ou des spasmes musculaires. Étant donné qu'A. sediba peut nécessiter une capacité d'escalade, la position de la lésion près de l'insertion des trapèzes, des érecteurs de la colonne vertébrale et des muscles majeurs rhomboïdes peut avoir des schémas de mouvement normaux limités. MH1 est le premier cas de cancer diagnostiqué pour un hominine d'au moins 200 000 ans, antérieur au fragment du métatarse catalogué SK 7923, présentant un ostéosarcome, connu de Swartkrans, dans le « berceau de l'humanité » et datant de 1,8 à 1,6 million d'années. Les tumeurs sont rares dans les archives fossiles d'hominines, probablement en raison du faible taux d'incidence en général pour les primates ; les premiers hominidés ayant probablement eu les mêmes taux d'incidence que les primates modernes. Le spécimen juvénile MH1 développant une tumeur osseuse est cohérent avec la tendance générale des tumeurs osseuses survenant principalement chez les individus plus jeunes[34].
Les spécimens MH1 et MH2 présentent des lésions osseuses au moment du décès compatibles avec un traumatisme contondant. Cela concorde avec l'interprétation du site de Malapa comme la base d'un grand puits, agissant comme un piège mortel naturel dans lequel des animaux tombaient accidentellement. MH1 et MH2 peuvent être tombés d'environ 5 à 10 m sur un tas en pente de gravier, de sable et de guano de chauve-souris, ce qui a probablement amorti la chute dans une certaine mesure. Pour MH1, les fractures perimortem sont les plus importantes sur la mâchoire et les dents, bien qu'il soit possible que ces blessures soient dues à la chute d'un objet en plus de la chute elle-même. MH2 porte des preuves de contreventement pendant la blessure, avec une charge sur l'avant-bras et la main et un impact sur la poitrine, une fracture perimortem identifiée sur le côté droit du corps. Ce sont les premiers décès dans les archives fossiles d'australopithèques qui ne sont assurément pas attribués à la prédation ou à des causes naturelles[35].
Paléoécologie

Au total, 209 fossiles ont été récupérés aux côtés des Hominina dans les faciès D et E en 2010, et les taxons identifiés parmi ceux-ci sont : le félin à dents de sabre Dinofelis barlowi, le Léopard, le Chat sauvage d'Afrique, le Chat à pieds noirs, l'Hyène brune, le Renard du Cap, les mangoustes Atilax paludinosus et Mungos, une Genette, un Lycaon, un représentant du genre Equus, un porcin, un Oréotrague, les bovidés Megalotragus et un grand alcélaphiné, un parent du Guib harnaché, un parent du Grand koudou et un Lièvre[4] - [36]. Aujourd'hui, le Chat à pieds noirs et le Renard du Cap sont endémiques de l'herbe, de la brousse et de la fruticée d'Afrique du Sud. De même, la Hyène brune habite des habitats secs et ouverts et n'a jamais été signalée dans un milieu forestier fermé. Dinofelis et Atilax, d'autre part, sont généralement des indicateurs d'un habitat fermé et humide. Cela peut indiquer que la zone comportait un habitat fermé ainsi que des prairies, à en juger par le domaine vital du Renard du Cap, les deux ayant existé à moins de 20 km du site[36].
Le coprolithe d'un carnivore du faciès D contient du pollen et des phytolithes d'arbres des genres Podocarpus ou Afrocarpus, ainsi que des fragments de bois de conifères et de dicotylédones non identifiés. Aucun phytolithe de graminées n'a été trouvé. De nos jours, le site de Malapa est une prairie, et Podocarpus et Afrocarpus se trouvent à 30 km dans le biome forestier afromontane dans les canyons situés entre 1 500 et 1 900 m d'altitude dans la chaîne de montagnes de Magaliesberg, où les incendies de forêt sont moins fréquents. Cela peut indiquer que Malapa était une zone plus fraîche et plus humide qu'aujourd'hui, permettant une réduction suffisante des incendies pour permettre à ces plantes forestières de se propager bien au-delà des zones naturellement abritées. Malapa, au début du Pléistocène, peut également avoir été à une altitude un peu plus basse qu'aujourd'hui, les vallées et le Magaliesberg étant moins prononcés[37].
Les australopithèques et les premiers représentants du genre Homo ont probablement préféré des conditions plus fraîches que les derniers Homo, car il n'y a pas de sites d'australopithèques qui sont en dessous de 1 000 m d'altitude au moment du dépôt. Cela signifierait que, comme les chimpanzés, ils habitaient souvent des zones avec une température diurne moyenne de 25 °C, tombant à 10 ou 5 °C la nuit[38]. La grotte de Malapa est actuellement à 1 442 m d'altitude[4]. A. sediba cohabitait avec Paranthropus robustus et Homo ergaster. A. africanus s'étant éteint à cette époque, il est possible que l'Afrique du Sud ait été un refuge pour les australopithèques jusqu'à il y a environ 2 millions d'années avec le début d'une variabilité et d'une volatilité climatiques majeures, et potentiellement d'une concurrence avec Homo et Paranthropus[23].
Notes et références
Notes
- Conformément aux règlements de l'université du Witwatersrand (UW), toutes les découvertes de la grotte de Malapa ont été enregistrées sous le numéro UW 88.
Références
- (en) L. R. Berger, D. J. de Ruiter, S. E. Churchill, P. Schmid, K. J. Carlson, P. H. G. M. Dirks et J. M. Kibii, « Australopithecus sediba: a new species of Homo-like australopith from South Africa », Science, vol. 328, no 5975, , p. 195-204 (PMID 20378811, DOI 10.1126/science.1184944, Bibcode 2010Sci...328..195B, S2CID 14209370, CiteSeerx 10.1.1.729.7802, lire en ligne)
- (en) W. Kimbel et Y. Rak, « Australopithecus sediba and the emergence of Homo: Questionable evidence from the cranium of the juvenile holotype MH 1 », Journal of Human Evolution, vol. 107, , p. 94–106 (PMID 28526292, DOI 10.1016/j.jhevol.2017.03.011, S2CID 4629400)
- (en) J. King, « Australopithecus sediba fossil named by 17-year-old Johannesburg student », Origins Centre, (lire en ligne [archive du ], consulté le )
- (en) P. H. G. M. Dirks, J. M. Kibii, B. F. Kuhn, C. Steininger, S. E. Churchill, J. D. Kramers, R. Pickering, D. L. Farber, A.-S. Mériaux, A. I. R. Herries, G. C. P. King et L. R. Berger, « Geological setting and age of Australopithecus sediba from Southern Africa », Science, vol. 328, no 5975, , p. 205-208 (PMID 20378812, DOI 10.1126/science.1184950, Bibcode 2010Sci...328..205D, S2CID 206524717, lire en ligne [PDF])
- (en) R. Pickering et al., « Australopithecus sediba at 1.977 Ma and Implications for the Origins of the Genus Homo », Science, vol. 333, no 6048, , p. 1421-1423 (PMID 21903808, DOI 10.1126/science.1203697, Bibcode 2011Sci...333.1421P, S2CID 22633702)
- (en) J. M. Kibii, S. E. Churchill, P. Schmid, K. J. Carlson, N. D. Reed, D. J. De Ruiter et L. R. Berger, « A Partial Pelvis of Australopithecus sediba », Science, vol. 333, no 6048, , p. 1407-1411 (PMID 21903805, DOI 10.1126/science.1202521, Bibcode 2011Sci...333.1407K, S2CID 206532267, lire en ligne [PDF])
- (en) K. J. Carlson, D. Stout, T. Jashashvili, D. J. De Ruiter, P. Tafforeau, K. Carlson et L. R. Berger, « The Endocast of MH1, Australopithecus sediba », Science, vol. 333, no 6048, , p. 1402-1407 (PMID 21903804, DOI 10.1126/science.1203922, Bibcode 2011Sci...333.1402C, S2CID 206533255, lire en ligne)
- (en) T. B. Ritzman, C. E. Terhune, P. Gunz et C. A. Robinson, « Mandibular ramus shape of Australopithecus sediba suggests a single variable species », Journal of Human Evolution, vol. 100, , p. 54-64 (PMID 27765149, DOI 10.1016/j.jhevol.2016.09.002, S2CID 4229293, lire en ligne [PDF])
- (en) N. Cameron, B. Bogin, D. Bolter et Lee R. Berger, « The postcranial skeletal maturation of Australopithecus sediba », American Journal of Physical Anthropology, vol. 163, no 3, , p. 633-640 (PMID 28464269, DOI 10.1002/ajpa.23234, S2CID 3287309, lire en ligne)
- (en) T. W. Holliday, S. E. Churchill, K. J. Carlson, Jeremy M. DeSilva, P. Schmid, C. S. Walker et Lee Rogers Berger, « Body Size and Proportions of Australopithecus sediba », PaleoAnthropology, , p. 406-422 (DOI 10.4207/PA.2018.ART118, S2CID 195728113, lire en ligne [PDF])
- (en) S. A. Williams, K. R. Ostrofsky, N. Frater, S. E. Churchill, P. Schmid et Lee R. Berger, « The Vertebral Column of Australopithecus sediba », Science, vol. 340, no 6129, , p. 1232996 (PMID 23580532, DOI 10.1126/science.1232996, S2CID 206546736)
- (en) M. R. Meyer, S. A. Williams, P. Schmid, S. E. Churchill et Lee R. Berger, « The cervical spine of Australopithecus sediba », Journal of Human Evolution, vol. 104, , p. 32-49 (PMID 28317555, DOI 10.1016/j.jhevol.2017.01.001, S2CID 4229865)
- (en) J. M. DeSilva, K. G. Holt, S. E. Churchill, K. J. Carlson, C. S. Walker, B. Zipfel et L. R. Berger, « The Lower Limb and Mechanics of Walking in Australopithecus sediba », Science, vol. 340, no 6149, , p. 1232999 (PMID 23580534, DOI 10.1126/science.1232999, S2CID 13288792)
- (en) P. Schmid, S. E. Churchill et S. Nalla, « Mosaic Morphology in the Thorax of Australopithecus sediba », Science, vol. 340, no 6129, , p. 1234598 (PMID 23580537, DOI 10.1126/science.1234598, S2CID 31073328)
- (en) S. E. Churchill, T. W. Holliday, K. J. Carlson, T. Jashashvili, M. E. Macias, S. Mathews, T. L. Sparling, P. Schmid, D. J. De Ruiter et L. R. Berger, « The Upper Limb of Australopithecus sediba », Science, vol. 340, no 6129, , p. 1233477 (PMID 23580536, DOI 10.1126/science.1233477, S2CID 206547001)
- (en) T. R. Rein, T. Harrison, K. J. Carlson et K. Harvati, « Adaptation to suspensory locomotion in Australopithecus sediba », Journal of Human Evolution, vol. 104, nos 1-12, (PMID 28317552, DOI 10.1016/j.jhevol.2016.12.005
 , S2CID 4240538)
, S2CID 4240538) - (en) T. L. Kivell, J. M. Kibii, S. E. Churchill, P. Schmid et L. R. Berger, « Australopithecus sediba hand demonstrates mosaic evolution of locomotor and manipulative abilities », Science, vol. 333, no 6048, , p. 1411-1417 (PMID 21903806, DOI 10.1126/science.1202625, Bibcode 2011Sci...333.1411K, S2CID 11610235)
- (en) B. Zipfel, J. M. DeSilva, R. S. Kidd, K. J. Carison, S. E. Churchill et L. R. Berger, « The foot and ankle of Australopithecus sediba », Science, vol. 333, no 6048, , p. 1417-1420 (PMID 21903807, DOI 10.1126/science.1202703, JSTOR 23060229, Bibcode 2011Sci...333.1417Z, S2CID 206532338, lire en ligne [PDF]).
- (en) T. C. Prang, « Rearfoot posture of Australopithecus sediba and the evolution of the hominin longitudinal arch », Scientific Reports, vol. 5, , p. 17677 (PMID 26628197, PMCID 4667273, DOI 10.1038/srep17677
 , Bibcode 2015NatSR...517677P)
, Bibcode 2015NatSR...517677P) - (en) T. C. Prang, « The subtalar joint complex of Australopithecus sediba », Journal of Human Evolution, vol. 90, , p. 105-119 (PMID 26767963, DOI 10.1016/j.jhevol.2015.10.009, S2CID 19143048)
- (en) J. D. Irish, D. Gautelli-Steinberg, S. S. Legge, D. J. De Ruiter et L. R Berrger, « Dental Morphology and the Phylogenetic "Place" of Australopithecus sediba », Science, vol. 340, no 6129, , p. 1233062 (PMID 23580535, DOI 10.1126/science.1233062, S2CID 206546794)
- (en) Brian Villmoare, William H. Kimbel, Chalachew Seyoum, Christopher J. Campisano, Erin DiMaggio, John Rowan, David R. Braun, J. Ramon Arrowsmith et Kaye E. Reed, « Early Homo at 2.8 Ma from Ledi-Geraru, Afar, Ethiopia », Science, vol. 347, no 6228, , p. 1352-1355 (PMID 25739410, DOI 10.1126/science.aaa1343
 , Bibcode 2015Sci...347.1352V, S2CID 206632944)
, Bibcode 2015Sci...347.1352V, S2CID 206632944) - (en) A. I. R. Herries et al., « Contemporaneity of Australopithecus, Paranthropus, and early Homo erectus in South Africa », Science, vol. 368, no 6486, , eaaw7293 (PMID 32241925, DOI 10.1126/science.aaw7293, hdl 11568/1040368
 , S2CID 214763272)
, S2CID 214763272) - (en) Michael Balter, « Candidate human ancestor from South Africa sparks praise and debate », Science, vol. 328, no 5975, , p. 154-155 (PMID 20378782, DOI 10.1126/science.328.5975.154, S2CID 206590099, lire en ligne [PDF])
- (en) M. Cherry, « Claim over 'human ancestor' sparks furore », Nature, (DOI 10.1038/news.2010.171
 , S2CID 84209680)
, S2CID 84209680) - (en) A. Du et Z. Alemseged, « Temporal evidence shows Australopithecus sediba is unlikely to be the ancestor of Homo », Science, vol. 5, no 5, , e9038 (PMID 31086821, PMCID 6506247, DOI 10.1126/sciadv.aav9038
 , Bibcode 2019SciA....5.9038D)
, Bibcode 2019SciA....5.9038D) - (en) Fred Spoor, « Palaeoanthropology: Malapa and the genus Homo », Nature, (PMID 21979041, DOI 10.1038/478044a, S2CID 205067652)
- (en) K. P. McNulty, « Hominin Taxonomy and Phylogeny: What's In A Name? », Nature Education Knowledge, vol. 7, no 1, , p. 2 (lire en ligne)
- (en) Amanda G. Henry, Peter S. Ungar, Benjamin H. Passey, Matt Sponheimer, Lloyd Rossouw, Marion Bamford, Paul Sandberg, Darryl J. de Ruiter et Lee Berger, « The diet of Australopithecus sediba », Nature, vol. 487, no 7405, , p. 90-93 (PMID 22763449, DOI 10.1038/nature11185, Bibcode 2012Natur.487...90H, S2CID 205229276)
- (en) J. A. Ledogar et al., « Mechanical evidence that Australopithecus sediba was limited in its ability to eat hard foods », Nature Communications, vol. 7, no 10596, , p. 10596 (PMID 26853550, PMCID 4748115, DOI 10.1038/ncomms10596
 , Bibcode 2016NatCo...710596L)
, Bibcode 2016NatCo...710596L) - (en) D. J. Daegling, K. J. Carlson, P. Tafforeau, D. J. de Ruiter et L. R. Berger, « Comparative biomechanics of Australopithecus sediba mandibles », Journal of Human Evolution, vol. 100, , p. 73–86 (PMID 27765151, DOI 10.1016/j.jhevol.2016.08.006, S2CID 4241936)
- (en) N. M. Laudicina, F. Rodriguez et J. M. DeSilva, « Reconstructing birth in Australopithecus sediba », PLOS ONE, vol. 14, no 9, , e0221871 (PMID 31532788, PMCID 6750590, DOI 10.1371/journal.pone.0221871
 , Bibcode 2019PLoSO..1421871L)
, Bibcode 2019PLoSO..1421871L) - (en) R. S. Lacruz, T. G. Bromage, P. O'Higgins, V. Toro-Ibacache, J. Warshaw et L. R. Berger, « Distinct growth of the nasomaxillary complex in Au. sediba », Scientific Reports, vol. 5, no 1, , p. 15175 (PMID 26469387, PMCID 4606807, DOI 10.1038/srep15175
 , Bibcode 2015NatSR...515175L)
, Bibcode 2015NatSR...515175L) - (en) P. S. Randolph-Quinney, S. A. Williams, M. Steyn, M. R. Meyer, J. S. Smilg, S. E. Churchill, E. J. Odes, T. Augustine, P. Tafforeau et L. R. Berger, « Osteogenic tumour in Australopithecus sediba: Earliest hominin evidence for neoplastic disease », South African Journal of Science, vol. 112, nos 7-8, (DOI 10.17159/sajs.2016/20150470
 , S2CID 54957063)
, S2CID 54957063) - (en) E. N. L'Abbé, S. A. Symes, J. T. Pokines et L. L. Cabo, « Evidence of fatal skeletal injuries on Malapa Hominins 1 and 2 », Scientific Reports, vol. 5, no 1, , p. 15120 (PMID 26459912, PMCID 4602312, DOI 10.1038/srep15120
 , Bibcode 2015NatSR...515120L)
, Bibcode 2015NatSR...515120L) - (en) B. F. Kuhn, L. Werdelin, A. Hartstone-Rose, R. S. Lacruz et L. R. Berger, « Carnivoran Remains from the Malapa Hominin Site, South Africa », PLOS ONE, vol. 6, no 11, , e26940 (PMID 22073222, PMCID 3207828, DOI 10.1371/journal.pone.0026940
 , Bibcode 2011PLoSO...626940K)
, Bibcode 2011PLoSO...626940K) - (en) M. K. Bamford, F.H. Neumann, F. H. Pereira, L. M. Scott, P. H. G. M. Dirks et L. R. Berger, « Botanical remains from a coprolite from the Pleistocene hominin site of Malapa, Sterkfontein Valley, South Africa », Palaeontologia Africana, vol. 45, , p. 23-28 (lire en ligne)
- (en) T. Dávid-Barrett et R. I. M. Dunbar, « Bipedality and hair loss in human evolution revisited: The impact of altitude and activity scheduling », Journal of Human Evolution, vol. 94, , p. 72-82 (PMID 27178459, PMCID 4874949, DOI 10.1016/j.jhevol.2016.02.006
 )
)
Voir aussi
Bibliographie
- (en) S. A. Williams et al., « The Vertebrae, Ribs, and Sternum of Australopithecus sediba », PaleoAnthropology, , p. 156-233 (DOI 10.4207/PA.2018.ART113, lire en ligne)
- (en) Ann Gibbons, « Skeletons Present an Exquisite Paleo-Puzzle », Science, vol. 333, no 6048, , p. 1370-1372 (PMID 21903788, DOI 10.1126/science.333.6048.1370, Bibcode 2011Sci...333.1370G, S2CID 38839702)
- (en) D. J. de Ruiter, S. E. Churchill et Lee Rogers Berger, « Australopithecus sediba from Malapa, South Africa », dans Kaye E. Reed, John G. Fleagle, Richard E. Leakey, The Paleobiology of Australopithecus, coll. « Vertebrate Paleobiology and Paleoanthropology », (ISBN 978-94-007-5919-0, DOI 10.1007/978-94-007-5919-0_9, S2CID 130996925), p. 147-160
Articles connexes
En français
- Tristan Vey, « Le nouvel australopithèque découvert est un para-Homo », sur Le Figaro
- « Australopithecus sediba, l'évolution en mosaïque », sur www.hominides.com
En anglais
- (en) John Gurche (en), « Australopithecus sediba », sur www.gurche.com
- (en) John D. Hawks (en), « What, if anything, is Australopithecus sediba? », sur www.johnhawks.net
- (en) Malapa Hominin Site Entire Catalogue 2013 Part 1
- (en) Malapa Hominin Site Entire Catalogue 2013 Part 2
- (en) « Human Evolution Interactive Timeline », sur Smithsonian
- Ressources relatives au vivant :
- Notice dans un dictionnaire ou une encyclopédie généraliste :