Gluten
Le gluten est une substance viscoélastique composée de protéines et impliquée notamment dans l'alimentation. Le terme dérive du latin classique gluten signifiant « colle, glu, gomme »[1], il était initialement appelé glutine. Il désigne aussi le réseau glutineux formé par la réticulation des macromolécules protéiques.

Aujourd'hui, l'utilisation du gluten comme adjuvant des produits alimentaires industriels s'est généralisée.
Le gluten est principalement constitué de deux types de protéines insolubles dans l'eau : les prolamines et les glutélines[2]. Ces protéines permettent de stocker des oligo-éléments et des acides aminés nécessaires au développement de la jeune pousse lors de la germination de la graine.
Les prolamines du blé, de l'orge, du seigle et de l'avoine sont respectivement appelées gliadine, hordéine, sécaline et avénine. La glutéline du blé est appelée gluténine.
Le gluten proprement dit n'est pas présent dans les céréales, il se forme lors de la fabrication de la pâte, quand on mélange avec de l'eau la farine obtenue après mouture des graines. Les glutens, plus particulièrement le gluten de blé tendre, sont appréciés pour leurs propriétés viscoélastiques, qui confèrent à la pâte son élasticité, l'aident à lever puis conserver sa forme, laissant au produit final une texture moelleuse[3] - [4]. Ce réseau viscoélastique de structure tridimensionnelle formé irréversiblement est le véritable gluten.
Par métonymie, on nomme aussi gluten les protéines qui le composent.
Il se trouve dans toutes les céréales vraies (de la famille des poacées ou graminées comme le blé[5]). Les céréales à forte teneur en gluten sont l'épeautre (10 à 12 g/100 g de farine type 630), le blé tendre (8 à 14 g/100 g de farine de type 405), le blé khorasan (Kamut), l'amidonnier et le blé dur (12 à 14 g). L'engrain (7 à 8 g) contient un peu moins de gluten. Le seigle (3,2 g/100 g de farine de type 815), l'avoine (5,6 g/100 g de farine de grains entiers), l'orge (5,6 g/100 g de grains entiers décortiqués) en contiennent beaucoup moins. Une étude récente portant sur un panel d'essais concernant le blé tendre, le blé dur, l'amidonnier, l'épeautre et l'engrain en conditions ordinaires de culture confirme une grande partie de ces données avec toutefois des écarts resserrés entre espèces et souligne la forte variabilité de ces résultats pour le blé tendre (faibles dans ces essais) selon la variété et les conditions de culture[6]. Les objectifs de sélection du blé tendre divergent en effet selon qu'il s'agit de blé boulanger ou biscuitier[7] - [8]. Des études sont en cours en France concernant ces valeurs en conditions d'agriculture biologique et avec des variétés anciennes[9].

Les céréales telles que l'avoine, le teff, le mil, le maïs, le sorgho et le riz contiennent un gluten aux propriétés différentes, et les pseudo-céréales telles que le quinoa, l'amarante (des amaranthacées) et le sarrasin (une polygonacée) n'en contiennent pas.
Dans une petite partie de la population humaine, le gluten peut déclencher des réactions auto-immunes indésirables, responsables d'un large éventail de troubles, notamment d'un trouble spécifique de la digestion nommé maladie cœliaque. La prévalence de la maladie a été estimée à environ 0,5 % - 1 % dans différentes régions du monde[10] (environ 0,7 % de la population aux États-Unis[11]). La recherche d'anticorps anti-transglutaminases de type Ig A, suivie d'une fibroscopie avec biopsie de la muqueuse duodénale permet de détecter cette maladie[12].
Les autres troubles sont l'ataxie au gluten[13], l'allergie au blé, et la dermatite herpétiforme. L'existence de la sensibilité non-cœliaque au gluten reste en revanche controversée mais lors d'enquêtes basées sur l'auto-évaluation entre 0,5 % et 13 % de la population générale s'estimaient elles-mêmes intolérantes au gluten[14] - [15] . La toxicité liée aux glutens de l'avoine, de l'engrain (petit épeautre) et du maïs est discutée.
Le traitement de ces pathologies est le régime strict sans gluten[16].

À partir des années 2000, un effet de mode alimentaire venu des États-Unis a mis en cause l'innocuité de ces protéines en général et a permis l'émergence d'un marché de produits alimentaires « sans gluten » ou « gluten free », dont la pertinence n'est pas établie chez les patients non-cœliaques[17]. Certaines études auraient démontré que le gluten n'a aucun effet délétère sur un organisme exempt de pathologie liée au gluten[18]. Cette mode représente un marché de niche très lucratif pour l'industrie agroalimentaire[19] - [20] permettant de pratiquer des prix de vente deux à cinq fois plus élevés[21].
Éléments historiques
Depuis les débuts de l'agriculture, ses propriétés sont mises en valeur dans des aliments emblématiques des civilisations comme le pain, les galettes, les pâtes, et le malt qui permet de fabriquer la bière[22].
En Extrême-Orient, le gluten est préparé et consommé depuis le VIe siècle comme aliment en soi[23].
Le gluten est pour la première fois décrit en 1728 par Giacomo Beccari, professeur à l'université de Bologne et sa préparation par lixiviation est mise au point par Johannes Kesselmeyer, à Strasbourg[24].
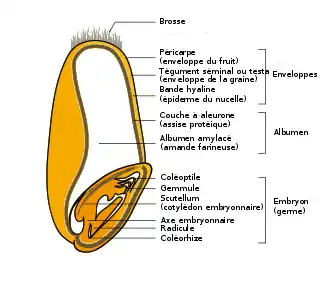
Composition du grain de blé et séparation des éléments
Le gluten est un composant de l'albumen, structure de réserve des graines des angiospermes. Il occupe une partie majeure du caryopse, fruit des graminées, ou grain.
L'albumen d'un grain de blé est un tissu de réserve essentiellement constitué de granules d'amidon, enchâssés dans une matrice protéique composée de gliadines, de gluténines, d'albumines et de globulines[25]. La partie centrale ou albumen amylacé est constituée de cellules mortes tandis que la couche à aleurone périphérique reste vivante pour fournir les enzymes nécessaires à la dissociation de l'amidon en sucres nutritifs et des protéines en acides aminés, pour assurer la germination et le développement de la plantule. Cette propriété est aussi utilisée pour le maltage. Ces protéines du gluten se caractérisent par une teneur élevée en glutamine et en proline et par une faible teneur en acides aminés basiques (lysine, histidine arginine) .
La farine blanche (ou très raffinée, T45, T55, T65) ne contient que de l'albumen amylacé moulu, le reste du grain formant le son. Les farines bises (T80, ayant subi un raffinage partiel) contiennent une partie de la couche à aleurone permettant un équilibre en nutriments (lipides, minéraux, vitamines). Les farines complètes (peu raffinées, T110) contiennent de plus une partie des enveloppes[26]. La présence de son tend à diminuer le taux de gluten.


Extraction du gluten
Les protéines de l'albumen du blé sont caractérisées par leur solubilité :

- les albumines sont solubles dans l'eau ;
- les globulines sont solubles dans des solutions salines ;
- les gliadines sont solubles dans une solution d'alcool (éthanol à 70 %)
- les gluténines, insolubles dans les solvants précédents, sont partiellement solubles dans les solutions acides diluées et dans l'urée.
Les protéines insolubles qui sont les composants du gluten (gliadine, gluténine) représentent de 75 à 85 % de toutes les protéines[27]. Les gliadines ont un poids moléculaire inférieur à celui des gluténines.
Le gluten de blé peut être obtenu par lixiviation à l'eau : après avoir pétri de la farine accompagnée de 50 % de son poids d'eau, on obtient une pâte élastique. Lavés sous un filet d'eau, peu à peu, l'amidon et les protéines solubles se dissolvent et sont évacués par le courant d'eau. Il subsiste une substance insoluble, verdâtre, gélatineuse, nommée « gluten »[27].
Les granules d'amidon se dispersant dans de l'eau à basse température, on procède en rinçant à l'eau froide une pâte simple obtenue à partir du mélange de farine et d'eau et en la malaxant jusqu'à ce que l'eau de rinçage soit claire et exempte d'amidon et de son. L'amidon dispersé est sédimenté et séché. Si une solution saline est utilisée à la place de l'eau, un gluten plus pur est obtenu, les globulines et certaines impuretés quittant la solution avec l'amidon. Lorsque l'amidon est le produit principal recherché, l'eau froide est le solvant préféré, car les impuretés se détachent avec le gluten. Le composé obtenu est ensuite séché par atomisation.
Dans la production industrielle actuelle, le gluten de blé est obtenu par séparation centrifuge : une pâte est préparée à partir de farine de blé et d'eau, cette pâte est malaxée vigoureusement par des machines jusqu'à ce que le gluten s'agglomère en une masse qui est recueillie par centrifugation, puis transportée à travers plusieurs étapes intégrées dans un processus continu. Environ 65 % de l'eau contenue dans le gluten humide est éliminée à l'aide d'une presse à vis qui sépare l'amidon, le gluten et les sucres solubles du blé. Le gluten est ensuite lavé, essoré, séché et pulvérisé à travers une buse d'atomiseur dans une chambre de séchage, où il reste brièvement à température élevée pour permettre à l'eau de s'évaporer sans dénaturer le gluten. Le processus donne une farine à 7 % d'humidité, qui est refroidie à l'air et transportée pneumatiquement. Dans la dernière étape, le gluten traité est tamisé et moulu pour produire un produit uniforme, afin d'obtenir de la farine de gluten.
Propriétés viscoélastiques du réseau de gluten
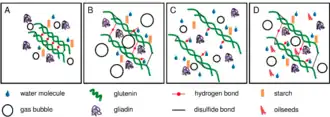
(A) Farine de blé en dessous de la teneur optimale. (B) Farine à la teneur optimale. (C) Farine au-dessus de la teneur optimale. (D) Mélange à pâte à la teneur optimale[28].
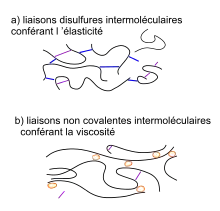
- liaison mauve disulfure intramoléculaire
- liaison orange non covalente
a) protéines associées par des liaisons disulfures intermoléculaires conférant une certaine élasticité à l'agrégat protéique
b) protéines associées par des liaisons non covalentes intermoléculaires conférant une certaine viscosité à l'agrégat moléculaire, d'après Pierre Feillet[2].
Lors de la confection des pâtes de pâtisserie, le pétrissage[29] fournit l'énergie mécanique qui permet aux protéines insolubles (gliadines et gluténines pour le blé) de se lier entre elles par un réarrangement des ponts disulfures (cassure mécanique des liaisons disulfure puis reformation avec alignement des molécules de gluténines et de gliadines)[30]. Il s'établit alors un réseau de gluten, complexé avec les lipides de la farine et certains composés glucidiques, enserrant les grains d'amidon et les bulles d'air[31] - [32].
La formation d'interactions entre les protéines du gluten de la farine confèrent aux pâtes leurs propriétés viscoélastiques, notamment l'élasticité et la « masticabilité » des produits à base de céréales cuits au four[33], du moëlleux et de la tenue des pâtes alimentaires (mais les propriétés du gluten de blé dur ne s'expriment qu'après cuisson).

Quand elles sont hydratées, les gliadines du blé tendre sont des protéines globulaires très extensibles qui, en affaiblissant les interactions entre les chaînes de gluténine, confèrent à la pâte son extensibilité, sa viscosité et sa plasticité facilitant la rétention de gaz[35]. Les gluténines sont quant à elles, des protéines fibreuses responsables de la ténacité et de l'élasticité de la pâte[2] - [36]. Les sous-unités gluténines de haut poids moléculaires forment des polymères liés par des ponts disulfures qui contribuent à l'élasticité du gluten[37]. La capacité de la pâte à se déformer sans se briser est appelée force boulangère et est notée W ; elle varie de 100 à 300. Elle est en gros proportionnelle au taux de gluten[26].
Cette viscoélasticité est utile à la fabrication du pain[38] : les bulles de CO2 dégagées lors de la dégradation anaérobie des sucres fermentescibles par les levures, sont figées dans le réseau de gluten à la fois tenace et élastique (la pâte « lève »). On le retrouve donc dans les farines de céréales panifiables comme le blé, l'épeautre (69 % d'alpha gliadine), le seigle (30 % à 50 % de sécaline), mais également dans des céréales difficilement panifiables, comme l'orge (46 % à 52 % de hordéine), le maïs (55 % de zéine ou zénine), le riz (5 % d'orzénine)[39].
| Céréale | Prolamine | Taux % par rapport aux protéines totales |
|---|---|---|
| Avoine | Avénine | 16 |
| Blé | Gliadine | 69 |
| Maïs | Zéïne | 55 |
| Millet | Panicine | 40 |
| Orge | Hordéine | 46 - 52 |
| Riz | Orzéine | 5 |
| Seigle | Sécaline | 30 - 50 |
| Sorgho | Kafirine | 0 |
De la farine sans gluten est proposée dans le commerce, cependant son comportement est différent d'une farine contenant du gluten. Lors de la réalisation d'une préparation culinaire avec une telle farine, les quantités des ingrédients individuels peuvent donc différer des informations de la recette classique. Les produits de boulangerie sans gluten ne sont souvent pas aussi facilement réussis et aussi délicieux qu'avec la farine conventionnelle, car le gluten assure une bonne formation de pores et une mie ferme pendant la cuisson
Valeur nutritionnelle
Le gluten permet de couvrir une grande partie des besoins en acides aminés en particulier en acides aminés essentiels sauf la lysine, un des plus importants; la digestibilité mesurée du gluten est excellente (99% pour le gluten de blé)[40].
Dix acides aminés sont considérés comme essentiels, car l'être humain ne peut pas les synthétiser et il doit les obtenir obligatoirement par le biais de la nourriture[40]. Si le niveau d'au moins un de ces acides aminés essentiels est déficient, une partie des autres acides aminés, ne pouvant entrer dans la synthèse protéique par manque d'un élément essentiel, sera décomposée et excrétée, ce qui limite notamment la croissance des enfants et provoque des pertes d'azote alimentaire. Pour compenser cette carence relative, il est nécessaire de compléter les aliments comportant du gluten avec d'autres aliments comportant d'autres protéines telles les légumineuses, les brassicacées, certains champignons ou des produits animaux.
Évolution de la part du gluten dans la ration
Dès le début du néolithique, les céréales étaient associés empiriquement dans la nourriture à une autre source de protéines permettant de compenser cette insuffisance en lysine, par exemple, les lentilles ou le pois (Les paires alimentaires). Les protéines animales (lait, viande, œufs, poisson) permettaient également de corriger ce déséquilibre.
Plus récemment entre 1750 et 1950, en Europe, les soupes de pain paysannes au chou ou aux haricots (eau, sel, pain semi-complet, chou ou haricots, légumes de saison, un peu de pommes de terre et de lard) ont pu constituer le plat unique et répétitif de nombreux paysans. Le pain et donc le gluten y étaient valorisés au mieux. Ces soupes permettaient de couvrir, outre des besoins importants en énergie, tous les besoins en acides aminés, fibres, vitamines et minéraux pour un prix de revient modique. On peut en dire autant, par exemple, du couscous nord-africain ou des pizzas simples d'Italie d'autrefois. Aujourd'hui, des préparations telles que les empanadas ou pastelles, chaussons de pâte fourrés de légumes et d'un peu de viande ou poisson, sont extrêmement populaires dans de nombreux pays émergents.
Il semble que les variétés modernes de blé tendre ne contiennent pas plus de gluten en moyenne que les anciennes. La teneur en gluten des blés tendres serait en légère diminution du fait de l'intensification de la culture[41]. Les variétés boulangères ont été sélectionnées pour obtenir un W plus élevé, c'est-à-dire un gluten plus tenace. Au contraire les variétés biscuitières demandent un W faible[42]. Les shortbread sont des biscuits traditionnels d'Europe du Nord, utilisant des farines pauvres en gluten, qui connaissent un renouveau et sont à l'origine des cookies nord-américains. Aux États-Unis on préfère utiliser le blé hérisson (club wheat) à très faible taux de gluten pour la biscuiterie -cookies et gâteaux japonais (japanese coton sponge cakes)- on peut obtenir alors des crackers ou des gâteaux non levés mais très aérés[43]. Les variétés fourragères, utilisables en alimentation humaine, ont surtout été sélectionnées sur les critères de rendement et secondairement de teneur en protéines mais pas sur le W.
Le blé dur à l'origine des pâtes alimentaires et couscous est la céréale la plus riche en gluten. Pour obtenir des blés durs à haute teneur en protéines et donc en gluten, les céréaliers privilégient des variétés améliorées et un apport supplémentaire tardif d'engrais azoté[44].
Si la consommation de pain traditionnel est en diminution, la consommation de pâtes[45], pizzas, pâtisseries, biscuits, viennoiserie et pains industriels de toutes sortes[46] est en progression constante. Les français sont devenus les seconds consommateurs de pizzas avant les italiens mais après les américains. La consommation de crêpes de type français (bien que l'ingrédient principal ne soit pas toujours la farine de blé) est aussi très développée en Belgique, France, Afrique du Nord et au Liban et s'étend partout dans le monde. Comme les pizzas, les crêpes, bagels, hamburgers permettent, à partir d'ingrédients très industrialisés, de proposer des assiettes variées, élaborées éventuellement de façon conviviale devant le client ou entre convives, suivant le goût de chacun ; la rapidité d'exécution permet de plus d'enchaîner les services. Les pâtes prêtes à farcir, empiler ou garnir comme les pizzas, galettes, crêpes, fonds de tarte, pains à fourrer, feuilletés, conchiglioni, cannelloni, lasagnes sont très diversifiées et disponibles à la vente séparément (liste de pâtes). Elles sont utilisées aussi bien à la maison qu'en restauration rapide. Les qualités pratiques des pâtes à fort taux de gluten ne sont pas pour rien dans le succès de ces modes.
Aujourd'hui dans les sociétés occidentalisées, la consommation souvent exclusive de pain blanc et de produits à base de farines blanches, c'est-à-dire sans le son ni le germe, et éventuellement enrichies en gluten, des pâtes et semoules appréciées pour leur facilité d'emploi, ainsi que l'utilisation généralisée du gluten comme adjuvant dans l'alimentation industrielle peut faire beaucoup augmenter la proportion de gluten ingéré, ce qui change évidemment la donne.
Utilisations
Ingrédient naturel de fabrications traditionnelles
_-_n._6144_-_(Mangiamaccheroni).jpg.webp)
Produits de boulangerie et pâtisseries
Le gluten se forme lorsque les molécules de gluténine subissent la réticulation via des liaisons disulfure pour former un réseau sub-microscopique attaché à la gliadine, ce qui contribue à la viscosité et à l'extensibilité à l'ensemble[37]. Si cette pâte est levée avec de la levure, la fermentation produit des bulles de dioxyde de carbone qui, emprisonnées par le réseau de gluten, font lever la pâte[47]. La cuisson au four coagule le gluten qui, avec l'amidon, stabilise la forme du produit final. La teneur en gluten a été impliquée en tant que facteur dans la stabilisation du pain, peut-être parce qu'il lie l'eau par hydratation[48].
La formation de gluten affecte la texture des produits de boulangerie[49]. L'élasticité atteignable du gluten est proportionnelle à sa teneur en gluténines de faible poids moléculaire, car cette partie contient la plupart des atomes de soufre responsables de la réticulation du gluten[50].
Un raffinage plus poussé de la farine conduit à des pâtes plus riches en gluten comme celles que l'on trouve dans le pain blanc, les pizzas et les bagels, alors qu'un raffinage moindre fournit les produits de pâtisserie[51]. En général, les farines pour pâtes élastiques (macaronis, pizza, crêpe) et produits bien levés (pain de blé tendre et viennoiseries comme les brioches et croissants) sont plus riches en gluten que les farines de pâtisserie et biscuiterie[26]. Le malaxage favorise la formation de brins de gluten et de liaisons croisées, créant des produits de boulangerie plus mous (par opposition à ceux plus fragiles et plus friables). Le besoin de mastiquer le produit fini augmente à mesure que la pâte est pétrie plus longtemps[52]. Une teneur accrue en humidité dans la pâte favorise le développement du gluten et les pâtes très humides laissées longtemps à lever ne nécessitent aucun pétrissage. Un temps de maturation moindre inhibe la formation de liaisons croisées et est utilisé avec une diminution de l'eau et moins de pétrissage lorsqu'un produit tendre et feuilleté est souhaité, comme une croûte à tarte[53].
La force et l'élasticité du gluten dans la farine sont mesurées dans l'industrie de la boulangerie à l'aide d'un farinographe[54] et d'un extensographe. Cela donne au boulanger une mesure de la qualité pour différentes variétés de farines lors de l'élaboration de recettes pour divers produits de boulangerie[55].
Biscottes au gluten
Les farines des céréales se composant d'amidon soluble dans l'eau et de gluten qui subsiste après un rinçage modéré à l'eau froide, leur appauvrissement en amidon par rinçage les enrichit donc bien en gluten, à masse identique. Déjà dans les années 1950-1960 étaient vendues en boulangerie des biscottes pour les diabétiques appauvries en amidon afin de réduire leurs apports glucidiques. Par exemple des fabricants comme Heudebert et Pelletier, les mettaient en vente dans les boulangeries et quelques magasins d'alimentation en tant que Biscottes au gluten.
Actuellement existe encore en France une biscotte au gluten, Heudebert Forme (+/- 280 g), vendue sous les marques Heudebert, Lu et Mondelèz International, dont la composition est : céréales 90,5 % (farine de blé et gluten de blé 57,8 %, farine complète de blé 31 %, farine de blé malté) et qui est enrichie en vitamines E, B1, B2, B6, acide folique, calcium, fer, magnésium et riche en phosphore.
Plats de gluten traditionnels d'Asie
_Dish.jpg.webp)
Le gluten de blé est utilisé depuis le VIe siècle pour remplacer la viande en Chine, probablement à l'initiative de moines du bouddhisme mahāyāna[23]. Il était réalisé artisanalement en lavant la farine de blé et appelé miàn jīn. Le gluten passé au four est appelé kao fu. Il a été très tôt adopté dans la cuisine japonaise d'inspiration bouddhiste sous le nom de fu. Dans la cuisine vietnamienne, c'est le mì căn. Il est souvent proposé sous forme de saucisses ou de boulettes, blanches ou brunes. Le seitan peut être considéré comme la forme industrielle moderne de ces plats traditionnels.
Malts
Le maltage des céréales consiste à provoquer un début de germination des grains. Il se produit alors naturellement une hydrolyse enzymatique des réserves de l'albumen. Le gluten est dissocié en acides aminés et l'amidon en sucres. Dans la nature, ces sucres et ces acides aminés facilement disponibles provoquent un démarrage fulgurant de la plantule. Cette observation est peut-être une des raisons du succès, depuis les années 1900, des boissons reconstituantes (Horlicks dans les pays de l'ancien Empire britannique) et des préparations (Ovomaltine) et en-cas maltés au chocolat surtout destinés au départ aux enfants des classes ouvrières .
En brasserie, cela favorise ensuite la croissance optimale des levures lors de la fermentation du moût. La proportion de molécules hydrolysées joue sur la qualité du malt et in fine sur celui de la bière[56]. Le gluten insoluble et une partie des acides aminés sont retirés du moût avec les résidus de malt, cependant la bière en contient encore de petites quantités.
Les bières sans gluten peuvent être fabriquées, par exemple, à partir de sorgho ou de riz non maltés.
Autres

Le gluten est naturellement présent les bouillies et gruaux de céréales qui ont constitué la principale nourriture de l'humanité bien avant les galettes et le pain, dans les semoules (couscous, boulghour ...) et pâtes alimentaires qui sont à la base d'une multitude de plats populaires, les biscuits, viennoiseries, dans de nombreux desserts, sauces et tous produits incorporant de la farine de céréales.
Parmi les produits traditionnels exigeant des farines à haute teneur en gluten, on peut citer les pâtes alimentaires, les pizzas (farines italiennes 00 ou farine de force T45 pour obtenir une pâte élastique et tenace) et les bagels.
Selon le Vatican, les hosties consommées lors de la messe contiennent du gluten ; il s'agit d'un pain sans levain (pain azyme de la Bible) à base de farine de froment et sa teneur en gluten est probablement faible.
Utilisation industrielle dans l'alimentation
Le gluten est un coproduit de l'industrie de l'amidonnerie qui traite principalement des farines de maïs, mais aussi de blé et de riz. Seul le gluten de blé est utilisé pour ses propriétés améliorantes en boulangerie.
Le gluten est très demandé dans le monde entier, principalement par l'industrie alimentaire mais également par d'autres types d'industries, en raison de son faible coût économique et de ses propriétés viscoélastiques et adhésives uniques s'il s'agit de gluten de blé.
Ajouts de gluten dans les farines
Le gluten, une fois séché, moulu peut être ajouté à une farine ordinaire pour l'aider à améliorer sa capacité à augmenter en volume. Le mélange obtenu augmente également la stabilité structurelle du pain et sa texture. Une pâte avec du gluten ajouté doit être travaillée vigoureusement pour la faire monter à pleine capacité. Une machine à pain automatique ou un robot culinaire peuvent être nécessaires pour malaxer une pâte contenant beaucoup de gluten. En règle générale, des taux de gluten plus élevés sont associés à une teneur globale en protéines plus élevée. Toutefois, un taux de gluten trop élevé (au-delà de 12 %) ne permet plus de fabriquer le pain traditionnel français[41].
Le gluten peut représenter 8 à 12 % d'une farine boulangère. Son action peut être encore amplifiée par l'ajout de petites quantités de farines de malt, de féverole ou de soja et d'acide ascorbique[57]. Ces farines spéciales ne sont pas accessibles au grand public. Elles sont systématiquement utilisées avec du gluten ajouté pour la fabrication des pains de mie[58] et des pains à hamburgers.
On retrouve souvent des ajouts (quelques pour cent) de gluten dans les boulangeries industrielles pour complémenter les farines trop pauvres. Ceux-ci sont nécessaires pour les fabrications industrielles de pains complets, de pains de campagne et de pains de seigle afin d'obtenir une levée presque identique à celle du pain blanc. En effet, contrairement au pétrin traditionnel du boulanger d'antan, les procédés industriels actuels nécessitent des farines contenant beaucoup plus de gluten pour être pétries mécaniquement, puis subir la congélation après une cuisson partielle, puis le stockage, le transport jusqu'au lieu de décongélation et enfin la cuisson finale sur le lieu de production ou de vente.
Les spécialités de la restauration rapide (pizzas, crêpes, hamburgers...) exigent des pâtes à haute teneur en gluten. Les hamburgers, bagels, hotdogs utilisent souvent des pâtes briochées fermes mais spongieuses permettant d'absorber les sauces, elles sont généralement additionnées de malt pour le goût. Toutes ces pâtes tenaces permettent une préparation et un service rapides ; elles évitent les miettes, permettent de multiplier les services ou facilitent l'emport par le consommateur. Elles permettent de se passer de salle dans la restauration de rue. De plus, le caractère souvent artisanal et convivial de la préparation finale (garnissage des pâtes) est apprécié.
Imitations de viande
_2007.jpg.webp)
Le seitan, en particulier à base de gluten de blé, est souvent à la base des imitations de viande ressemblant au bœuf, au poulet, au canard, au poisson et au porc. Le seitan est préparé en le trempant (s'il est fabriqué à partir de poudre de gluten), en le pétrissant et en le faisant bouillir pendant une durée variable, entre 30 et 90 minutes en fonction notamment de son épaisseur ou du type de casserole. Une fois cuit, il a une consistance ferme et prend un peu de la saveur du bouillon dans lequel il est cuit. Cette propriété et sa teneur en protéines en font un matériau apprécié comme substitut de la viande dans les recettes végétariennes et végétaliennes[59].
Le gluten est grandement apprécié par les adeptes de l'alimentation végétarienne ou végane, les adventistes du septième jour, Hare Krishna et les bouddhistes, qui s'abstiennent souvent de consommer de la viande. ll se fait une place parmi les protéines végétales texturées, sa consistance étant plus proche de la véritable viande que la protéine de soja texturée qui ressemble un peu à la viande hâchée.
Adjuvant
Le gluten est souvent présent dans la sauce de soja et peut être utilisé comme agent stabilisant dans des produits alimentaires plus inattendus, tels que les pétales de maïs, la crème glacée et le ketchup. Les aliments de ce type, contenant du gluten caché, peuvent donc poser de gros problèmes et constituer un danger pour les personnes atteintes de la maladie cœliaque et de diverses sensibilités au gluten.
Plus de la moitié des aliments actuellement commercialisés contiennent du gluten de blé, d'orge, de seigle ou d'avoine, utilisé comme épaississant ou liant, sous forme de contamination croisée ou même adultération (pratique frauduleuse consistant en l'ajout d'un produit de moindre valeur à un autre produit, qui est alors vendu ou donné pour ce qu'il n'est pas). Ils posent un risque sérieux pour la santé des patients atteints de maladie cœliaque et des personnes présentant une sensibilité non cœliaque au gluten. Un contrôle rigoureux de la teneur en gluten est donc nécessaire pour leur certification en tant qu'aliments adaptés à la consommation par ces patients.
Alimentation animale
L'industrie de l'alimentation animale utilise tout type de gluten et principalement le gluten de maïs sous le nom technique de corn gluten meal (farine de gluten). Cette farine contient environ 65% de protéines brutes[60].
Le corn gluten feed est un mélange complexe de coproduits des industries de l'amidonnerie et de l'huilerie de maïs; sa composition variable est proche de 22 % de protéines brutes[61]. Ils sont très utilisés car la digestibilité des glutens est excellente. Ils sont particulièrement recherchés en alimentation des ruminants malgré leur faiblesse en lysine car les glutens ne sont pas dégradés dans la panse et peuvent donc contribuer directement à la fourniture de protéines. On le retrouve donc dans les rations ou les aliments industriels des animaux d'élevage et de compagnie, pour augmenter leur teneur en protéines[62].
Les brasseries et distilleries de whisky et d'autres alcools à base de grains fournissent des drèches riches en gluten, environ 30% de protéines brutes[61]; leur efficacité peut être limitée si le chauffage du malt ou des moûts a été trop intense.
Autres utilisations
Le gluten est également utilisé dans les shampoings pour chiens, les pâtes à modeler pour enfants (telles que Play-Doh), la fabrication de produits pharmaceutiques (des médicaments sans ordonnance, des gargarismes et bains de bouche, des suppléments de vitamines et de minéraux, des produits à base de plantes médicinales, des suppléments alimentaires, des pansements adhésifs et bandes adhésives sanitaires), tous types de produits cosmétiques et de soins personnels (rouges à lèvres, baumes et brillants à lèvres, dentifrices, bains de bouche, produits pour le soin de la peau et des cheveux, etc.).
Le gluten est utilisé depuis des années dans la recherche pour développer des plastiques biodégradables destinés à la conservation des aliments et à d'autres utilisations, en tant qu'alternative aux plastiques à base de pétrole[63] - [64]. L'impact sur les personnes présentant un trouble lié au gluten est une préoccupation qui se doit d'être réglementée.
Pathologies liées au gluten
Les troubles liés au gluten
Il s'agit d'un terme générique concernant toutes les maladies déclenchées par le gluten[65], qui comprennent la maladie cœliaque[66], la sensibilité non-cœliaque au gluten (SNCG)[67], l'allergie au blé, l'ataxie au gluten et la dermatite herpétiforme (DH)[67]. Actuellement, leur incidence est en augmentation dans la plupart des régions géographiques du monde[68]. Cela peut probablement s'expliquer par l'occidentalisation croissante des régimes alimentaires, l'utilisation croissante d'aliments à base de blé inclus dans le régime méditerranéen[69], le remplacement progressif du riz par le blé dans de nombreux pays en Asie, au Moyen-Orient et en Afrique du Nord, le développement au cours des dernières années de nouveaux types de blé avec une quantité plus élevée de peptides cytotoxiques provenant du gluten et la teneur plus élevée en gluten dans le pain et les produits de boulangerie[70] en raison de la réduction du temps de fermentation de la pâte[67] - [71] et plus généralement l'utilisation fréquente du gluten et du malt comme adjuvants dans les industries alimentaires.
Intolérance au gluten (maladie cœliaque)
Certaines personnes présentent une intolérance au gluten appelée maladie cœliaque[72]qui est une maladie auto-immune chronique touchant principalement l'intestin grêle, mais qui peut impliquer de nombreux organes et causer une grande variété de symptômes non gastro-intestinaux. Elle est causée par l'ingestion de céréales à gluten (blé, orge, seigle, épeautre,...voire parfois avoine) et qui apparaît chez les personnes génétiquement prédisposées de tous les âges. Cette maladie est une intolérance permanente à l'une des fractions protéiques du gluten, les prolamines. Elle provoque une atrophie des villosités intestinales au niveau de l'intestin grêle, entraînant une destruction partielle de la paroi qui provoque une malabsorption et donc de graves carences en certains nutriments (sels minéraux, vitamines,…).
Chez le nourrisson, les symptômes peuvent apparaître quelques semaines après l'introduction de farines dans l'alimentation, et sont très variés : diarrhée chronique, hypotrophie, perte de poids, croissance ralentie voire stoppée, vomissement, etc. Chez l'adulte, elle se manifeste par des troubles gastro-intestinaux (douleurs abdominales, digestion difficile, diarrhée, selles molles, reflux gastro-œsophagien, vomissements, stase gastroduodénale, ballonnements), des problèmes articulaires, des troubles neurologiques, dermatologiques, stomatologiques, des carences multiples par malabsorption (vitamines, sels minéraux), anémie, ostéoporose, une fatigue chronique…
Les patients porteurs d'une maladie cœliaque présentant des « symptômes classiques », qui incluent des manifestations gastro-intestinales telles que diarrhée chronique et distension abdominale, malabsorption, perte d'appétit et diminution de la croissance, constituent actuellement la forme de présentation la moins courante de la maladie et touchent principalement les enfants de moins de deux ans. La maladie cœliaque présentant des « symptômes non classiques » constitue le type clinique le plus courant et concernent les enfants plus âgés (plus de deux ans)[73], les adolescents et les adultes[74]. Elles se caractérisent par des symptômes gastro-intestinaux plus légers, voire absents, ainsi que par un large éventail de manifestations non intestinales pouvant concerner n'importe quel organe du corps et pouvant très souvent être complètement asymptomatiques, que ce soit chez les enfants (au moins dans 43 % des cas[75]) ou chez les adultes[76].
Sa prévalence a été estimée à environ 1 à 2 % dans différentes régions du monde[10], mais la plupart des cas restent non reconnus, non diagnostiqués et non traités, et risquent de provoquer de graves complications de santé à long terme. En effet, non seulement de nombreux cas de maladies cœliaques peuvent être apparemment asymptomatiques, mais en outre beaucoup de personnes soi-disant asymptomatiques ne le sont en fait pas, présentant divers symptômes non attribués au gluten[77]. S'étant habituées à vivre avec un mauvais état de santé chronique, elles sont cependant capables de reconnaître l'amélioration voire la disparition de leurs symptômes après avoir commencé le régime sans gluten. Des difficultés supplémentaires pour le diagnostic sont le fait que les marqueurs sérologiques (transglutaminase anti-tissulaire [TG2]) ne sont pas toujours présents et que de nombreuses personnes peuvent présenter des lésions muqueuses mineures sans atrophie des villosités intestinales[78].
Ces personnes peuvent souffrir de symptômes graves de la maladie et faire l'objet d'explorations approfondies pendant de nombreuses années, avant que le diagnostic ne soit posé. Une maladie cœliaque non traitée peut entraîner non seulement une qualité de vie réduite, mais également un risque accru de lymphomes intestinaux et une mortalité accrue. Elle est associée à certaines autres maladies auto-immunes[79], telles que diabète de type 1, thyroïdite, ataxie au gluten, psoriasis, vitiligo, hépatite auto-immune, dermatite herpétiforme, cholangite sclérosante primitive, etc[79].
Le seul traitement aujourd'hui connu est un régime strict sans gluten à vie[80]. En effet, aucun traitement médicamenteux n'existe. Cependant des recherches[81] - [82] ont montré que certaines bactéries du microbiote, comme Rothia mucilaginosa produisaient une enzyme, la Rothia subtilisine, capable de briser la protéine de gliadine.
Une autre piste de recherche est basée sur l'ingestion d'enzymes de dégradation du gluten, permettant de le dégrader en fragments non immunogènes[83].
La pratique régulière d'une activité sportive qui entre dans l'activité de l'appareil digestif, est aussi la solution préconisée.
En France, l'AFDIAG (Association française des intolérants au gluten) est un soutien pour tous les cœliaques. En Belgique, la SBC asbl (société belge de la cœliaquie asbl), au Grand-Duché de Luxembourg, l'ALIG (association luxembourgeoise des intolérants au gluten), et en Suisse, l'ARC (Association Suisse Romande de la Coeliakie), remplissent le même rôle.
Hyperperméabilité intestinale
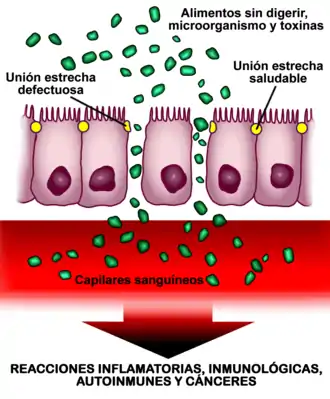
Au niveau de la paroi intestinale, le désassemblage des jonctions serrées (en jaune sur le schéma) provoque une augmentation de la perméabilité intestinale[84]. Le gluten, quelle que soit la prédisposition génétique, à savoir en présence ou non de maladie cœliaque[85] et le lipopolysaccharide (LPS) provenant d'une colonisation bactérienne chronique de l'intestin grêle semblent en être les deux principaux responsables[86]. Cette hyperperméabilité de la paroi intestinale provoque le passage accru dans le sang de substances qui ne doivent pratiquement pas passer (toxines bactériennes, principalement le LPS ; produits chimiques, microorganismes et aliments partiellement digérés[87]). Ces substances stimulent notamment le système immunitaire[88] et, en fonction de la prédisposition génétique de l'individu, peuvent développer diverses pathologies[84].
Une étude de 2011[84] suggère que l'altération de la perméabilité intestinale pourrait être dans certains cas impliquée dans le développement, entre autres, des maladies suivantes :
- Maladies auto-immunes, telles que la maladie cœliaque, le diabète de type 1, la polyarthrite rhumatoïde, la spondylarthrite ankylosante, les maladies inflammatoires de l'intestin (maladie de Crohn), le lupus érythémateux systémique et la cholangite sclérosante primitive[84].
- Cancers tels que gliome (cancer du cerveau ou de la moelle épinière), cancers du sein, de l'ovaire, du pancréas, de la prostate, adénocarcinome du poumon, carcinome hépatocellulaire (cancer du foie) en présence d'une infection par le virus de l'hépatite C, leucémie aiguë non lymphocytaire, anémie de Fanconi, lymphome diffus à grandes cellules B et leucémie myéloïde aiguë[84].
- Maladies du système nerveux, telles que sclérose en plaques, schizophrénie, poly-radiculo-neuropathie démyélinisante inflammatoire chronique et neuromyélite optique[84].
- Maladies inflammatoires[84].
- Infections[84].
- Allergies[84].
- Asthme[84].
Sensibilité non cœliaque au gluten (SNCG)
Le syndrome depuis peu appelé « sensibilité non cœliaque au gluten » (SNCG)[89] est décrit comme un ensemble de symptômes qui s'améliorent lors du passage à un régime sans gluten, après exclusion de la maladie cœliaque et de l'allergie au blé[90]. Reconnue depuis 2010[91], elle figure parmi les troubles liés au gluten, mais sa pathogénie n'est pas encore bien comprise[92]. La SNCG est le syndrome le plus commun des troubles liés au gluten[93], avec une prévalence estimée à 6-10%[94]. Mais sa prévalence réelle est difficile à déterminer car beaucoup de personnes s'auto-diagnostiquent et commencent un régime sans gluten, sans avoir au préalable subi un test de dépistage de la maladie cœliaque ou des recommandations du médecin[95]. Les personnes atteintes restent habituellement dans un no man's land, sans être reconnues par les spécialistes et sans les soins et traitements médicaux adéquats[96]. La plupart de ces personnes ont une longue histoire de problèmes de santé et de consultations infructueuses avec de nombreux médecins. C'est la raison pour laquelle la majorité d'entre elles finissent par avoir recours à un régime sans gluten et à un auto-diagnostic de sensibilité au gluten[97].
Les personnes atteintes peuvent développer soit des symptômes gastro-intestinaux, qui ressemblent à ceux du syndrome du côlon irritable ou de l'allergie au blé[98], soit une grande variété de symptômes non gastro-intestinaux, parfois systémiques[99], tels que des maux de tête, un engourdissement dans les jambes ou les bras, des picotements aux extrémités, un syndrome de fatigue chronique, des myalgies et des tendinites à répétition, voire une fibromyalgie, des maladies atopiques, une dermatite (eczéma ou éruption cutanée), des maladies neurologiques ou des troubles psychiatriques (anxiété, dépression, neuropathie périphérique, ataxie, trouble d'hyperactivité avec déficit de l'attention, hallucinations que certains auteurs ont appelé « psychose du gluten », de l'asthme, une rhinite, une allergie à une ou plusieurs substances inhalées (acariens, poils d'animaux, pollens), une allergie alimentaire (crustacés) ou à des métaux (nickel), ainsi que des intolérances alimentaires associées (principalement l'intolérance au lactose)[100] - [101], etc.
Dans certains cas, il pourrait s'agir d'une sensibilité au gluten, différente de la maladie cœliaque[102], qui toucherait jusqu'à 6 à 10 % de la population américaine[103] et qui est appuyée par certaines publications[104] et ouvrages [105]. Un certain nombre de publications scientifiques, contrôlées par un comité de lecture (peer reviewed), énoncent l'existence d'une irritation de l'intestin mais ne mettent pas en cause avec certitude le gluten[106] - [107] - [108]. Il pourrait s'agir d'une malabsorption intestinale induisant l'absorption de composés intermédiaires de la digestion du gluten appelés peptides opioïdes (gliadorphine ou glutéomorphine), toxiques pour l'organisme.
Outre le gluten, d'autres composants présents dans le blé, le seigle, l'orge, l'avoine et leurs dérivés pourraient provoquer les symptômes de la SNCG, notamment d'autres protéines appelées ATI et les FODMAP[109]. Alors que les effets des FODMAP ne se limitent qu'à un léger inconfort gastro-intestinal, les ATI peuvent provoquer chez les humains une inflammation intestinale médiée par le récepteur de type toll 4 (TLR4)[110]. Une alimentation riche en céréales pourrait aussi entraîner une dysbiose colique de putréfaction à la suite d'un excès de leurs protéines ou une sensibilité aux glucides fermentescibles, les FODMAP (Fermentable Oligo-, Di-, Mono-saccharides And Polyols)[111] qu'ils contiennent. Une étude de 2017 publiée dans la revue Gastroenterology laisse penser que c'est moins la présence de gluten dans les aliments que celle des fructanes, faisant partie des FODMAP, qui serait la cause de l'inconfort ou des ballonnements digestifs[112].
Des études de 2014[113] - [99] montrent que la sensibilité au gluten ou au blé serait plus fréquente chez les adultes et principalement chez les femmes.
L'explication viendrait de la teneur élevée en céréales à gluten de la «malbouffe» (hamburgers, pizzas, céréales de petit-déjeuner, pâtes, sandwiches…), l'arrêt de ces aliments et leur remplacement par une alimentation plus équilibrée et de meilleure qualité entraîne généralement une amélioration de l'état de santé.
C'est cette amélioration qui est ensuite revendiquée par l'industrie du sans gluten comme effet bénéfique de leur régime, alors qu'elle n'a aucun rapport avec le gluten lui-même[18]. Corinne Peirano, diététicienne et nutritionniste, analyse ainsi : « Lorsqu'on se met au régime sans gluten, on se sent mieux. Forcément. Mais l'absence de gluten n'y est pas forcément pour quelque chose. Comme le regard sur l'assiette change, on améliore son contenu, on mange plus diversifié, plus de végétaux, moins de glucides qui fermentent, moins de cochonneries aussi. »[114].
Allergie au blé
Une faible proportion de la population (surtout de très jeunes enfants) présente des symptômes typiques d'allergie après consommation de blé ou de dérivés. Cette proportion est par exemple estimée à 0,2 % au Canada[115]. Comme pour la plupart des allergies, une allergie au blé amène le système immunitaire à réagir anormalement à un composant du blé qu'il traite comme un corps étranger menaçant. Cette réponse immunitaire est souvent limitée dans le temps et ne cause pas de dommages durables aux tissus corporels. Les symptômes se manifestent juste après la consommation du produit, mais, même longtemps après on peut détecter dans le sang des immunoglobulines spécifiques.
Bien que l'allergie au blé et la maladie cœliaque soient des troubles très différents, leurs symptômes gastro-intestinaux sont similaires, mais l'intervalle entre l'exposition au blé et l'apparition des symptômes est différent. Une réaction allergique au blé survient rapidement, de quelques minutes à quelques heures après la consommation d'aliments contenant du blé et peut conduire jusqu'à un choc anaphylaxique.
Le blé figure sur la liste des allergènes reconnus par l'Union européenne, dont l'étiquetage différencié est obligatoire[116]. Plusieurs composants du blé peuvent être à la source de l'allergie, les protéines (dont le gluten, mais pas seulement) jouant un rôle principal[117]. L'allergie au blé des très jeunes enfants peut disparaître progressivement avec l'âge[118].
Dermatite herpétiforme
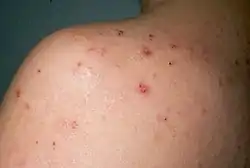
La dermatite herpétiforme (DH) est liée à la consommation de gluten[119] et est une manifestation cutanée de la maladie cœliaque qui se produit chez environ 25 % des patients[120]. Elle est tellement caractéristique qu'elle est considérée comme « la maladie cœliaque de la peau »[121], ainsi que la « carte de visite » du patient cœliaque[122], car sa découverte n'apparaît que chez les individus cœliaques[123].
Elle peut apparaître à tout âge de la vie, mais l'exposition aux rayons ultraviolets du soleil et les microtraumatismes cutanés répétés sont des facteurs externes qui favorisent l'apparition et le maintien de lésions cutanées typiques de la DH[124].
La dermatite herpétiforme disparaît complètement avec le régime sans gluten qui constitue son meilleur et unique traitement[125]. Elle peut réapparaître chez les patients qui semblent avoir un bon suivi de leur régime strict sans gluten, lors de transgressions au régime volontaires ou non[126].
Ataxie au gluten
L'ataxie au gluten est une maladie auto-immune déclenchée par l'ingestion de gluten[127], dont les dommages se produisent au niveau du cervelet, centre d'équilibre du cerveau qui contrôle la coordination et les mouvements complexes comme la marche, la parole et la déglutition, entraînés par la perte des cellules de Purkinje[128]. Les personnes atteintes d'ataxie au gluten présentent généralement une anomalie de la démarche ou une incoordination et des tremblements des membres supérieurs[129]. Le nystagmus évoqué par le regard et d'autres signes oculaires de dysfonctionnement cérébelleux sont courants. Myoclonies, tremblement palatal et opsoclonus-myoclonus peuvent également apparaître.
Un diagnostic précoce et un traitement avec un régime sans gluten peuvent améliorer l'ataxie et prévenir sa progression[130]. L'efficacité du traitement dépend du temps écoulé depuis le début de l'ataxie jusqu'au diagnostic, car la mort des neurones dans le cervelet à la suite d'une exposition au gluten est irréversible[131].
L'ataxie au gluten représente 40 % des ataxies d'origine inconnue et 15 % de toutes les ataxies. Moins de 10 % des personnes atteintes d'ataxie au gluten présentent un symptôme gastro-intestinal, mais environ 40 % ont des lésions intestinales. L'ataxie peut apparaître chez les patients de tous âges, y compris les enfants[132], indépendamment de la présence ou de l'absence de manifestations intestinales. La recommandation actuelle est que tout patient présentant une ataxie cérébelleuse progressive soit évalué pour la maladie cœliaque[133].
Troubles neurologiques liés au gluten (Neurogluten).
Neurogluten est le terme utilisé pour désigner les divers troubles neurologiques causés par la consommation de gluten[134], c'est-à-dire ceux qui affectent tout organe ou tissu du système nerveux[135]. Ils peuvent se développer indépendamment d'une prédisposition génétique et de la présence ou de l'absence de symptômes digestifs, de lésion intestinale, qu'elle soit cœliaque ou pas[136].
Le gluten peut traverser à la fois la barrière intestinale et la barrière hémato-encéphalique, comme l'ont démontré des études sur des rongeurs, ainsi que la présence d'anticorps anti-transglutaminase 6 dans le cerveau de personnes atteintes d'ataxie au gluten[137].
Les premières descriptions du neurogluten remontent à 1966, l'ataxie au gluten étant le trouble le plus connu et le plus étudié[138]. D'autres troubles neurologiques ou psychiatriques, en relation avec neurogluten comprennent des cas de neuropathie périphérique[139], d'épilepsie, de sclérose en plaques[140] - [141], de démence, de maladie d' Alzheimer et de Parkinson, de schizophrénie[142], d'autisme, de TDAH[143], de trouble obsessionnel-compulsif[144], de syndrome de Gilles de la Tourette[145], d'hallucinations ( « psychose du gluten »), d'infirmité motrice cérébrale[146], de chorée (mouvements involontaires anormaux des pieds et des mains)[147], de chorée de Huntington, d'opsoclonus (mouvements involontaires des yeux), de dysarthrie (altération de l'articulation des mots), de perte d'audition neurosensorielle, d'hémiparésie (diminution de la force motrice ou de la paralysie partielle d'un bras et d'une jambe du même côté du corps), de mononévrite multiplex (dommages dans au moins deux zones distinctes du système nerveux), de sclérose latérale amyotrophique (paralysie musculaire progressive), d'autres maladies neuromusculaires (lpolymyosite, dermatomyosite et myosite à inclusion), de troubles du sommeil, de thrombose d'un sinus veineux cérébral (caillot sanguin dans une zone de la base du cerveau)[147].
La régénération du système nerveux avec le régime sans gluten est lente et l'amélioration des symptômes neurologiques prend du temps à se manifester, contrairement à ce qui se passe lorsqu'il y a des symptômes digestifs intenses, qui s'améliorent généralement presque immédiatement. Parfois, la récupération du système nerveux n'a pas lieu ou elle n'est que partielle, comme cela se produit lorsque le diagnostic est retardé en cas d'ataxie du gluten, mais néanmoins le régime strict sans gluten empêche au moins l'aggravation des dommages neurologiques[148].
Des quantités minimes de gluten, telles que celles présentes dans la plupart des produits portant la mention « sans gluten », peuvent maintenir la réponse du système immunitaire activée et être responsable des lésions neuronales[148].
Régime sans gluten
Bien que lorsqu'on parle de « sans gluten », on pense à l'absence totale de gluten, avec les méthodes de détection actuelles, il est impossible de prouver un niveau zéro de gluten dans les aliments. Par conséquent, l'étiquetage « sans gluten » n'est pas synonyme de « zéro gluten ». En général, les lois autorisent jusqu'à 20 ppm, soit 20 parties par million ou 20 milligrammes de gluten par kilogramme de produit.Étant donné que le gluten est présent dans de très nombreux processus de production alimentaire industrielle, cela signifie que l'alimentation ordinaire entraîne inévitablement un minimum de contamination par le gluten[149].
L'industrie du sans gluten
Une industrie estimée à environ 60 millions d'euros en France, et en expansion de 30 % par an[114] s'est développée autour de cette croyance des effets délétères du gluten, allant parfois jusqu'aux pratiques d'escroquerie ou à risque de dérive sectaire[150]. De manière encore plus problématique, les régimes sans gluten sont brandis par certains faux thérapeutes comme traitement miracle contre l'autisme[151].
De nombreuses chaînes de l'agro-industrie (des grandes surfaces à Éric Kayser), ainsi que certains chefs, ont récemment développé des menus « gluten free »[152].
Plusieurs sociologues se sont penchés sur ce phénomène. Claude Fischler, de l'EPHE, analyse ainsi que « la tendance est à l'individualisation, aux États-Unis, en particulier, et à la médicalisation des repas »[114], c'est-à-dire au contrôle par des groupes industriels de l'alimentation des citoyens, sous des prétextes médicaux fallacieux. « C'est une offense de refuser un plat lorsqu'on partage un repas. En France plus qu'ailleurs. Mais prétendre une maladie cœliaque ou une hypersensibilité au gluten, c'est une façon commode de dire qu'on ne mangera pas de pâtes ou de céréales »[114]. L'intolérance au gluten pourrait être un comportement orthorexique[153] - [154], ou être une distinction sociale dans sa manière d'être par un mécanisme de consommation ostentatoire.
On peut remarquer que tous les grands groupes industriels ont dans leurs gammes à la fois de très nombreux produits enrichis en gluten et des produits labellisés sans gluten.
Des produits très peu susceptibles d'en contenir comme le poivre ou des jus de fruits sont parfois étiquetés sans gluten pour des raisons promotionnelles. Les aliments étiquetés sans gluten se révèlent cependant être souvent plus riches en graisses et en sucres et plus chers que leurs homologues traditionnels[155].
Précautions à prendre lors d'un régime sans gluten
Pour les personnes qui ne souffrent pas de troubles liés au gluten, c'est-à-dire « l'immense majorité des consommateurs, les produits qui contiennent du gluten sont absolument innofensifs, voire nutritionnellement importants »[155]. Supprimer les céréales classiques, sources importantes d'énergie, de protéines et de fibres, nécessite qu'elles soient remplacées par d'autres produits adaptés. Le simple remplacement du blé par le riz est susceptible d'augmenter l'indice glycémique de la ration. « Adopter un régime sans gluten est donc synonyme d'un budget alimentaire plus élevé sans pour autant obtenir des bénéfices supérieurs, voire d'une certaine nocivité pour les personnes non malades »[155], d'autant plus que certains cumulent les régimes : sans gluten, sans lactose, sans sucres .... Trouver des aliments de substitution adaptés est cependant aisé. La précaution élémentaire est d'opter pour un régime équilibré et varié.
Introduction du gluten dans l'alimentation des jeunes enfants
Il a maintenant été démontré que ni l'exposition précoce au gluten ni la durée de l'allaitement n'empêchent le risque de développer une maladie cœliaque, bien que le retard dans l'introduction du gluten soit associé à un retard dans l'apparition de la maladie[156]. Cela contredit les recommandations formulées en 2008 par la Société européenne de gastroentérologie pédiatrique (ESPGHAN) à l'intention des familles d'enfants risquant de développer la maladie cœliaque, qui préconisait d'introduire progressivement de petites quantités de gluten dans l'alimentation pendant la période entre les 4 et 7 premiers mois de la vie, tout en maintenant l'allaitement au sein, avec l'objectif hypothétique d'induire la tolérance du système immunitaire envers le gluten pour que ce dernier ne s'attaque pas à l'organisme par erreur[157].
Une génétique à risque (présence d'haplotypes HLA-DQ2, HLA-DQ8 ou de l'un de ses allèles) est un facteur important qui prédit la possibilité de développer une maladie cœliaque ou une maladie auto-immune associée, tel un diabète de type 1[158].
La présence dans le lait maternel de gliadine non dégradée à des taux élevés [159], et encore plus dans le colostrum, a été confirmée chez les femmes qui suivent un régime alimentaire normal[160].
Céréales pauvres en gluten ou à glutens peu susceptibles de déclencher une intolérance
Ces céréales ne peuvent être recommandées aux patients astreints à un régime sans gluten. Elles sont cependant recherchées par des personnes préférant une alimentation diététique ou biologique.
Grains anciens
Les céréales pauvres en gluten peuvent être considérées comme intéressantes du point de vue diététique[9] mais aussi parfois comme une simple opportunité commerciale. Les pseudo-céréales (comme le sarrasin, ou le quinoa par exemple), qui ne sont pas des graminées, ne contiennent pas de gluten.
Controverses concernant l'avoine
L'avoine est une espèce de graminée du genre Avena, tribu des Aveneae ou Poeae, qui appartient à la sous-famille des Pooideae comme la tribu des Triticeae (qui comprend entre autres le blé, le seigle et l'orge). L'avoine est donc une espèce proche des céréales « triticées ». Certaines variétés d’avoine paraissent ne déclencher aucune réaction immunitaire, d’autres oui[161].
L'avoine n'a pas les mêmes prolamines que le blé, elle contient principalement de l'avénine[162]. L'avénine est une substance toxique pour la muqueuse intestinale des personnes sensibles au gluten et peut entraîner également une réaction cœliaque[163] - [164] - [165].
Après la Seconde Guerre mondiale, le blé fut suspecté de causer la maladie cœliaque, et le gluten du blé fut très tôt identifié comme en étant la cause. La biopsie duodénale (considérée aujourd'hui comme la méthode de diagnostic de référence) n'avait pas encore été mise au point[166], mais des méthodes indirectes de mesure étaient utilisées. Notamment, dans deux études, trois enfants qui furent nourris avec 75 à 150 g d'avoine développèrent des symptômes. Dans trois études parallèles, 10 enfants et 2 adultes qui furent autorisés à manger de 28 à 60 g d'avoine n'ont pas développé de symptômes[167]. Mais depuis, le blé, l'orge et quelquefois le seigle sont des contaminants courants de l'avoine[168] - [169] dans l'industrie. À cause de cette contamination, l'avoine serait donc considérée comme toxique pour les cœliaques.
L'introduction de l'avoine dans le régime sans gluten a fait l'objet de débats au cours des dernières années. Des recherches récentes indiquent que certaines variétés d'avoine sont inoffensives et bonnes pour une alimentation sans gluten, parce que les différentes variétés d'avoine ont différents niveaux de toxicité[165]. Bien que l'avoine contienne de l'avénine, certaines études suggèrent que ce n'est pas forcément un problème pour les cœliaques. La première de ces études fut publiée en 1995[170]. Une étude suivante précisa qu'il n'était pas dangereux de consommer de l'avoine sur une longue période[171].
En fait, l'avoine est souvent sous-traitée avec le blé, l'orge et d'autres grains, et se retrouve donc contaminée par d'autres glutens. À cause de ce problème, la FAO, responsable du Codex Alimentarius, liste officiellement l'avoine comme contenant du gluten. En Écosse et en Irlande, les terres pauvres ne permettent pas de cultiver blé, orge ou seigle, mais seulement l'avoine, qui de ce fait est moins contaminée par d'autres céréales[172]. L'avoine fait partie de l'alimentation sans gluten en Suède et en Finlande. Les fournisseurs de ces pays offrent des produits «pure avoine» donc non contaminés par les blés.
Une étude publiée en 2011, met en évidence les différents niveaux de toxicité parmi les différentes variétés d'avoine, indiquant que le croisement d'espèces n'est pas la seule raison à l'origine de ces variations et réactions chez les personnes intolérantes au gluten[165]. Une étude publiée en 2008 trouva que sur 109 sources d'avoine étudiées, 85 avaient des taux inacceptables de gluten provenant du blé, de l'orge et du seigle[173].
« Farine d'avoine pure » se réfère à l'avoine sans contamination par d'autres céréales à gluten, ce qui est incorrectement étiquetée comme « avoine sans gluten » ou « sans gluten ». En effet, on considérait traditionnellement que le seul problème de l'avoine était sa contamination par d'autres céréales à gluten. C'est pourquoi, dans de nombreux pays, l'utilisation de « farine d'avoine pure » dans les aliments « sans gluten » est autorisée depuis longtemps et dans la plupart des cas, seule la lecture de la liste détaillée des ingrédients permet de les identifier[174].
La survenue d'une toxicité liée à l'avénine de l'avoine dépend du cultivar d'avoine consommé[175], car l'immunoréactivité des différentes prolamines toxiques varie selon les variétés d'avoine[176].
Les études actuelles montrent que différentes variétés d'avoine présentent différents degrés de toxicité[175]. Certaines variétés d'avoine pure[176] semblent avoir, en théorie, un faible degré de toxicité et certains experts estiment qu'elles pourraient être incluses dans le régime sans gluten[177], mais il serait essentiel de connaître exactement la variété utilisée et il n'existe actuellement aucune réglementation à cet égard[178]. L'étiquetage « flocons d'avoine purs » ou « flocons d'avoine sans gluten » ne fait pas référence à ces variétés, qui n'ont pas encore été identifiées. Des études suffisantes n'ont pas encore été effectuées et, chez les patients cœliaques, on ne connait pas les effets à long terme en cas de consommation d'« avoine sans gluten »[179]. Donc, on ne peut toujours pas faire de recommandations fermes sur la possibilité ou non d'inclure cette « avoine pure » dans le régime sans gluten[180].
Les prolamines de maïs et leurs effets sur la maladie cœliaque
Bien que le maïs soit traditionnellement considéré comme une céréale sans danger dans le régime sans gluten, certains patients atteints de maladie cœliaque ou de sensibilité au gluten peuvent présenter une intolérance aux prolamines du gluten de maïs (55 % de zéine ou zénine), auquel cas ils doivent le supprimer de leur consommation, comme on peut le déduire de certaines études récentes[181].
Le retrait du maïs de l'alimentation, dans certains cas qui ne répondent pas au régime sans gluten, permet de contrôler la maladie, avec disparition des symptômes et récupération des lésions de la muqueuse intestinale[182].
Étiquetage des aliments
Standards internationaux
Le Codex Alimentarius des normes internationales pour l'étiquetage des aliments a une norme relative à l'étiquetage des produits « sans gluten ». Cela ne s'applique qu'aux aliments contenant normalement du gluten.
Brésil
Aux termes de la loi brésilienne, tous les produits alimentaires doivent porter des étiquettes indiquant clairement s'ils contiennent ou non du gluten.
Canada
L'Association canadienne de la maladie cœliaque estime qu'un Canadien sur 133 souffre de symptômes néfastes du gluten provoqué par la maladie cœliaque. Les étiquettes de tous les produits alimentaires vendus au Canada doivent clairement indiquer la présence de gluten s'il est présent à un niveau supérieur à 20 parties par million.
Union européenne
Dans l'Union européenne, tous les aliments préemballés et non préemballés d'un restaurant, les mets à emporter emballés juste avant la vente ou les aliments non emballés servis en institution doivent être identifiés comme étant sans gluten. On entend par « sans gluten » 20 parties par million de gluten ou moins et par « très faible teneur en gluten », 100 parties par million de gluten ou moins; seuls les aliments contenant des ingrédients céréaliers transformés pour éliminer le gluten peuvent indiquer « très peu de gluten » sur les étiquettes.
Tous les aliments contenant du gluten en tant qu'ingrédient doivent être étiquetés en conséquence, car le gluten est défini comme l'un des 14 allergènes reconnus de l'UE.
États-Unis
Aux États-Unis, le gluten ne figure pas sur les étiquettes, sauf s'il est ajouté en tant qu'ingrédient autonome. Le blé ou d'autres allergènes sont énumérés après la ligne d'ingrédients. La Food and Drug Administration (FDA) américaine a toujours classé le gluten dans la catégorie « généralement reconnu comme étant sans danger » (GRAS). En , la FDA a rendu une décision finale, entrée en vigueur en , qui définissait le terme « sans gluten » à usage volontaire dans l'étiquetage des denrées alimentaires comme signifiant que la quantité de gluten contenue dans l'aliment est inférieure à 20 parties par million.
Notes et références
- Informations lexicographiques et étymologiques de « gluten » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- Pierre Feillet, Le grain de blé : Composition et utilisation, INRA, Quae, , 308 p. (ISBN 978-2-7380-0896-1, lire en ligne) (aperçu en ligne sur GBook).
- (en) Shewry, N. G. Halford, P. S. Belton et A. S. Tatham, « The structure and properties of gluten: An elastic protein from wheat grain », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 357, no 1418, , p. 133–142 (PMID 11911770, PMCID 1692935, DOI 10.1098/rstb.2001.1024).
- (en) Lamacchia C, Camarca A, Picascia S, Di Luccia A, Gianfrani C, « Cereal-based gluten-free food: how to reconcile nutritional and technological properties of wheat proteins with safety for celiac disease patients », Nutrients, vol. 6, no 2, , p. 575–90 (PMID 24481131, PMCID 3942718, DOI 10.3390/nu6020575) :
« The distinctive feature that makes wheat unique is, precisely, the visco-elasticity of gluten. When the grain is milled and mixed with water, storage proteins form a dough, capable of retaining gas bubbles. These properties make wheat suitable for the preparation of a great diversity of food products. »
- (en) Biesiekierski JR, « What is gluten? », J Gastroenterol Hepatol, vol. 32 Suppl 1, , p. 78–81 (PMID 28244676, DOI 10.1111/jgh.13703) :
« Similar proteins to the gliadin found in wheat exist as secalin in rye, hordein in barley, and avenins in oats and are collectively referred to as “gluten.” The gluten found in all of these grains has been identified as the component capable of triggering the immune-mediated disorder, coeliac disease.
 »
» - Sabrina Geisslitz, C. Friedrich H. Longin, Katharina A. Scherf et Peter Koehler, « Comparative Study on Gluten Protein Composition of Ancient (Einkorn, Emmer and Spelt) and Modern Wheat Species (Durum and Common Wheat) », Foods (Basel, Switzerland), vol. 8, no 9, (ISSN 2304-8158, PMID 31547385, PMCID 6769531, DOI 10.3390/foods8090409, lire en ligne, consulté le ).
- « Choix des variétés de blé tendre », sur Arvalis.info (consulté le )
- « Hard White Wheat Vs. Hard Red Wheat », sur o.e.l. (consulté le ).
- Amir Magali, « Les pratiques de relance des variétés paysannes de céréales dans le Luberon », sur Culture.gouv, (consulté le )
- (en) Naiyana Gujral, Hugh J Freeman et Alan BR Thomson, « Celiac disease: Prevalence, diagnosis, pathogenesis and treatment », World J Gastroenterol, vol. 18, no 42, , p. 6036-6059 (DOI 10.3748/wjg.v18.i42.6036, lire en ligne).
- (en) Rubio-Tapia A, Ludvigsson JF, Brantner TL, Murray JA, Everhart JE. The prevalence of celiac disease in the United States. Am J Gastroenterol. 2012; 107(10):1538-1544
- « La mode du sans gluten : légitime ou pas ? », sur mutuellebleue.fr.
- (en) Panagiotis Zis et Marios Hadjivassiliou, « Treatment of Neurological Manifestations of Gluten Sensitivity and Coeliac Disease », Current Treatment Options in Neurology, vol. 21, no 3, (ISSN 1092-8480 et 1534-3138, DOI 10.1007/s11940-019-0552-7, lire en ligne, consulté le ).
- (en) J. Molina-Infante, S. Santolaria, D. S. Sanders et F. Fernández-Bañares, « Systematic review: noncoeliac gluten sensitivity », Alimentary Pharmacology & Therapeutics, vol. 41, no 9, , p. 807–820 (DOI 10.1111/apt.13155, lire en ligne, consulté le ).
- (en) Carlo Catassi, Julio Bai, Bruno Bonaz et Gerd Bouma, « Non-Celiac Gluten Sensitivity: The New Frontier of Gluten Related Disorders », Nutrients, vol. 5, no 10, , p. 3839–3853 (ISSN 2072-6643, PMID 24077239, PMCID PMC3820047, DOI 10.3390/nu5103839, lire en ligne, consulté le ).
- (en) Francesca Penagini, Dario Dilillo, Fabio Meneghin et Chiara Mameli, « Gluten-Free Diet in Children: An Approach to a Nutritionally Adequate and Balanced Diet », Nutrients, vol. 5, no 11, , p. 4553–4565 (ISSN 2072-6643, DOI 10.3390/nu5114553, lire en ligne, consulté le ).
- (en) Missbach et al., « Gluten-free food database: the nutritional quality and cost of packaged gluten-free foods », PeerJ, , p. 18 (lire en ligne [PDF]).
- (en) Dr Jason Wu, « Don't believe the hype on gluten-free food », sur georgeinstitute.org.au, .
- Le sans gluten, un marché de niche qui cherche à s'imposer au-delà d'un effet de mode, La Dépêche, 31 janvier 2016.
- Le sans-gluten poursuit son envolée, LSA-Conso, 13 janvier 2016.
- « Gluten : c'est plus cher… et ça ne vaut pas mieux ! », Metronews, 27 janvier 2016.
- (en) Jonas F Ludvigsson, Daniel A Leffler, Julio C Bai et Federico Biagi, « The Oslo definitions for coeliac disease and related terms », Gut, vol. 62, no 1, , p. 43–52 (ISSN 0017-5749 et 1468-3288, DOI 10.1136/gutjnl-2011-301346, lire en ligne, consulté le ).
- Shurtleff, William, 1941- et Aoyagi, Akiko,, History of soybeans and soyfoods in China and Taiwan, and in Chinese cookbooks, restaurants, and Chinese work with soyfoods outside China (1024 BCE to 2014) : extensively annotated bibliography and sourcebook : including Manchuria, Hong Kong and Tibet, , 3015 p. (ISBN 978-1-928914-68-6 et 1-928914-68-3, OCLC 890394084, lire en ligne)
- (en) Hervé This, « Who discovered the gluten and who discovered its production by lixiviation? », Notes Académiques de l'Académie d'Agriculture de France/Academic Notes from the French Academy of Agriculture, vol. 3, no 3, , p. 1-11 (PMID 11911770, PMCID 1692935, DOI 10.1098/rstb.2001.1024).
- Clément DEBITON, Identification des critères du grain de blé (Triticum aestivum L.)favorables à la production de bioéthanol par l'étude d'un ensemble de cultivars et par l'analyse protéomique de lignées isogéniques waxy, thèse : Université Blaise Pascal,
- « Classification des farines », sur Agir (consulté le )
- Armand Boudreau et Germain Menard, Le blé : fondamentaux et transformation, Laval Presse Univers., , 439 p. (ISBN 2-7637-7296-X, lire en ligne)
- (en) Marina Schopf, Katharina Anne Scherf, « Water Absorption Capacity Determines the Functionality of Vital Gluten Related to Specific Bread Volume », Foods, vol. 10, no 2, , p. 228 (DOI 10.3390/foods10020228).
- « En formant le réseau glutineux, le pétrissage impacte directement la structure finale du pain. Une pâte sous-pétrie conduit à une répartition irrégulière des grains d’amidon et des protéines. Des masses compactes de protéines sont formées et étirées en feuillets lors du mélange. Si le pétrissage est prolongé sur une durée optimale, une phase continue de gluten se forme. Lors d’un sur-pétrissage de la pâte, le milieu est rendu très homogène mais la structure du gluten devient très fine, ce qui diminue sa capacité de rétention du gaz ». Cf Solenne Jourdren, Le processus oral, une étape clé à l’origine des propriétés sensorielles de texture et d’arôme du pain. Quels sont les rôles de sa structure et de sa déstructuration en bouche sur les dynamiques de perceptions ?, Génie des procédés, Université Paris Saclay (COmUE), 2017, p. 31
- (en) V. Giannou, V. Kessoglou, C. Tzia, « Quality and safety characteristics of bread made from frozen dough », Trends in Food Science & Technology, vol. 14, no 3, , p. 99-108 (DOI 10.1016/S0924-2244(02)00278-9).
- (en) Bogdan Jan Dobraszczyk et Marco P. Morgenstern, « Rheology and the breadmaking process », Journal of Cereal Science, vol. 38, no 3, , p. 229-245 (DOI 10.1016/S0733-5210(03)00059-6).
- (en) Bram Pareyt, Sean M.Finnie, Joke A.Putseys, Jan A.Delcour, « Lipids in bread making: Sources, interactions, and impact on bread quality », Journal of Cereal Science, vol. 54, no 3, , p. 266-279 (DOI 10.1016/j.jcs.2011.08.011).
- G.L. Friedli et Nazlin Howell, « Gelation properties of deamidated soluble wheat proteins », Food Hydrocolloids, vol. 10, no 2, , p. 255–261 (ISSN 0268-005X, DOI 10.1016/s0268-005x(96)80043-9, lire en ligne, consulté le )
- Le voile désigne la couche de pâte étirée. Une expérience permet de visualiser ce réseau glutineux. Elle consiste à malaxer un pâton puis à le laisser sous un filet d'eau pendant plusieurs minutes, ce qui conduit à la lixiviation de l'amidon et l'apparition du réseau protéique. Cf Hervé This, Révélations gastronomiques, Belin, , p. 40
- (en) Jan A Delcour, Iris J Joye, Bram Pareyt, Edith Wilderjans, Kristof Brijs, Bert Lagrain, « Wheat gluten functionality as a quality determinant in cereal-based food products », Annu Rev Food Sci Technol, vol. 3, , p. 469-492 (DOI 10.1146/annurev-food-022811-101303).
- (en) P.S. Belton, « Mini review: On the elasticity of wheat gluten », Journal of Cereal Science, vol. 29, no 2, , p. 103–107 (DOI 10.1006/jcrs.1998.0227).
- P. R. Shewry, N. G. Halford, P. S. Belton et A. S. Tatham, « The structure and properties of gluten: an elastic protein from wheat grain », Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, vol. 357, no 1418, , p. 133–142 (ISSN 1471-2970, DOI 10.1098/rstb.2001.1024, lire en ligne, consulté le )
- A. K. Uhlen, E. M. Magnus, E. M. Færgestad et S. Sahlstrøm, « Effects of genotype, N-fertilisation, and temperature during grain filling on baking quality of hearth bread », dans Special Publications, Royal Society of Chemistry (ISBN 9780854048656, lire en ligne), p. 484–487
- « Taux de prolamines des céréales »
- (en) OMS, Technical Report Series 936, WHO Press, (lire en ligne), p. 94
- Hubert Chiron, INRA, « Les variétés de blés contiennent-elles plus de gluten qu’avant ? », sur initiative gluten (consulté le )
- « Qualité ses blés biscuitiers français », sur Arvalis, (consulté le )
- (en) A.D. Bettge, « Club wheat: Functionally, the best sub-class and sub-species in soft wheat », sur Cereals & Grains Association, (consulté le )
- « Oui, l’azote apporté jusqu’à début épiaison est valorisé en quintaux et en protéines », sur Arvalis.info (consulté le )
- « Tendances de consommation de pâtes alimentaires UE27 », sur Bureau des marchés internationaux Canada, (consulté le )
- « Le marché de la boulangerie, viennoiserie, pâtisserie industrielle en France », sur leséchos, (consulté le )
- « La farine », cours de bac pro [PDF], Technologie boulangerie pâtisserie, sur Académie de Versailles (consulté le )
- S. Sahlström et E. Bråthen, « Effects of enzyme preparations for baking, mixing time and resting time on bread quality and bread staling », Food Chemistry, vol. 58, nos 1-2, , p. 75–80 (ISSN 0308-8146, DOI 10.1016/s0308-8146(96)00216-6, lire en ligne, consulté le )
- Paola Tosi, Stefania Masci, Angela Giovangrossi et Renato D'Ovidio, « Modification of the Low Molecular Weight (LMW) Glutenin Composition of Transgenic Durum Wheat: Effects on Glutenin Polymer Size and Gluten Functionality », Molecular Breeding, vol. 16, no 2, , p. 113–126 (ISSN 1380-3743 et 1572-9788, DOI 10.1007/s11032-005-5912-1, lire en ligne, consulté le )
- N. M. Edwards, S. J. Mulvaney, M. G. Scanlon et J. E. Dexter, « Role of Gluten and Its Components in Determining Durum Semolina Dough Viscoelastic Properties », Cereal Chemistry Journal, vol. 80, no 6, , p. 755–763 (ISSN 0009-0352, DOI 10.1094/cchem.2003.80.6.755, lire en ligne, consulté le )
- N.L. KENT et A.D. EVERS, « Bread-baking Technology », dans Kent's Technology of Cereals, Elsevier, (ISBN 9781855733619, lire en ligne), p. 191–217
- Raymond Calvel, « Specialty Breads », dans The Taste of Bread, Springer US, (ISBN 9781475768114, lire en ligne), p. 102–128
- Xan Arch, « Under the Hood -- New To You », Against the Grain, vol. 23, no 2, (ISSN 2380-176X, DOI 10.7771/2380-176x.5815, lire en ligne, consulté le )
- (en) « "Farinograph". », Wheat Quality and Carbohydrate Research. North Dakota State University.,
- (en) J.R. Oliver et H.M. Allen, « The prediction of bread baking performance using the farinograph and extensograph », Journal of Cereal Science, vol. 15, no 1, , p. 79–89 (DOI 10.1016/S0733-5210(09)80058-1, lire en ligne, consulté le )
- (en) Mark Schmitt, « Like Malt? You’ll Love This Malting Barley Research! », sur USDA, (consulté le )
- « Panification », sur Le petit boulanger (consulté le ).
- Annabelle Kiema, « Les substances que nous cache le pain de mie du supermarché », sur consoglobe, (consulté le )
- (en) Abramowski, Nicole, « How to Make Seitan: An Illustrated Guide. », Vegan Nom Noms.,
- (en) Heuzé V. (INRA), « Corn gluten meal », sur Feedipedia, (consulté le )
- Institut national de la recherche agronomique (France)., Alimentation des bovins, ovins et caprins besoins des animaux, valeurs des aliments : tables Inra 2007, Versailles, Quae, cop. 2007, 307 p. (ISBN 978-2-7592-0020-7 et 2-7592-0020-5, OCLC 708296469, lire en ligne)
- (en) « Pet Foods. », International Wheat Gluten Association, archived from the original on 2007-10-07.
- L. Day, M.A. Augustin, I.L. Batey et C.W. Wrigley, « Wheat-gluten uses and industry needs », Trends in Food Science & Technology, vol. 17, no 2, , p. 82–90 (ISSN 0924-2244, DOI 10.1016/j.tifs.2005.10.003, lire en ligne, consulté le )
- Joël Zink, Tom Wyrobnik, Tobias Prinz et Markus Schmid, « Physical, Chemical and Biochemical Modifications of Protein-Based Films and Coatings: An Extensive Review », International Journal of Molecular Sciences, vol. 17, no 9, , p. 1376 (ISSN 1422-0067, DOI 10.3390/ijms17091376, lire en ligne, consulté le )
- Francesco Tovoli, « Clinical and diagnostic aspects of gluten related disorders », World Journal of Clinical Cases, vol. 3, no 3, , p. 275 (ISSN 2307-8960, DOI 10.12998/wjcc.v3.i3.275, lire en ligne, consulté le )
- Elena Lionetti, Simona Gatti, Alfredo Pulvirenti et Carlo Catassi, « Celiac disease from a global perspective », Best Practice & Research Clinical Gastroenterology, vol. 29, no 3, , p. 365–379 (ISSN 1521-6918, DOI 10.1016/j.bpg.2015.05.004, lire en ligne, consulté le )
- Umberto Volta, Giacomo Caio, Francesco Tovoli et Roberto De Giorgio, « Non-celiac gluten sensitivity: questions still to be answered despite increasing awareness », Cellular & Molecular Immunology, vol. 10, no 5, , p. 383–392 (ISSN 1672-7681 et 2042-0226, DOI 10.1038/cmi.2013.28, lire en ligne, consulté le )
- Anna Sapone, Julio C Bai, Carolina Ciacci et Jernej Dolinsek, « Spectrum of gluten-related disorders: consensus on new nomenclature and classification », BMC Medicine, vol. 10, no 1, (ISSN 1741-7015, DOI 10.1186/1741-7015-10-13, lire en ligne, consulté le )
- (en) Stefano Guandalini et Isabel Polanco, « Nonceliac Gluten Sensitivity or Wheat Intolerance Syndrome? », The Journal of Pediatrics, vol. 166, no 4, , p. 805–811 (DOI 10.1016/j.jpeds.2014.12.039, lire en ligne, consulté le )
- (en) Belderok B, « Developments in bread-making processes. », Plant Foods Hum Nutr (Review). 55 (1): 1–86., (PMID 10823487)
- Marco Gobbetti, Carlo Giuseppe Rizzello, Raffaella Di Cagno et Maria De Angelis, « Sourdough lactobacilli and celiac disease », Food Microbiology, vol. 24, no 2, , p. 187–196 (ISSN 0740-0020, DOI 10.1016/j.fm.2006.07.014, lire en ligne, consulté le )
- « World Gastroenterology Organisation Global Guidelines - Celiac Disease, February 2017 », Journal of Clinical Gastroenterology, vol. 53, no 4, , p. 313 (ISSN 0192-0790, DOI 10.1097/mcg.0000000000001198, lire en ligne, consulté le )
- Alessio Fasano, « Clinical presentation of celiac disease in the pediatric population », Gastroenterology, vol. 128, no 4, , S68–S73 (ISSN 0016-5085, DOI 10.1053/j.gastro.2005.02.015, lire en ligne, consulté le )
- Luca Elli, Federica Branchi, Carolina Tomba et Danilo Villalta, « Diagnosis of gluten related disorders: Celiac disease, wheat allergy and non-celiac gluten sensitivity », World Journal of Gastroenterology, vol. 21, no 23, , p. 7110–7119 (ISSN 1007-9327, DOI 10.3748/wjg.v21.i23.7110, lire en ligne, consulté le )
- Sabine L. Vriezinga, Joachim J. Schweizer, Frits Koning et M. Luisa Mearin, « Coeliac disease and gluten-related disorders in childhood », Nature Reviews Gastroenterology & Hepatology, vol. 12, no 9, , p. 527–536 (ISSN 1759-5045 et 1759-5053, DOI 10.1038/nrgastro.2015.98, lire en ligne, consulté le )
- Kamran Rostami, Justine Bold, Alison Parr et Matt Johnson, « Gluten-Free Diet Indications, Safety, Quality, Labels, and Challenges », Nutrients, vol. 9, no 8, , p. 846 (ISSN 2072-6643, DOI 10.3390/nu9080846, lire en ligne, consulté le )
- Benjamin Lebwohl, Jonas F Ludvigsson et Peter H R Green, « Celiac disease and non-celiac gluten sensitivity », BMJ, , h4347 (ISSN 1756-1833, DOI 10.1136/bmj.h4347, lire en ligne, consulté le )
- Alessio Fasano et Carlo Catassi, « Celiac Disease », New England Journal of Medicine, vol. 367, no 25, , p. 2419–2426 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/nejmcp1113994, lire en ligne, consulté le )
- Knut E. A. Lundin et Cisca Wijmenga, « Coeliac disease and autoimmune disease—genetic overlap and screening », Nature Reviews Gastroenterology & Hepatology, vol. 12, no 9, , p. 507–515 (ISSN 1759-5045 et 1759-5053, DOI 10.1038/nrgastro.2015.136, lire en ligne, consulté le )
- Jonas F Ludvigsson, Tim Card, Paul J Ciclitira et Gillian L Swift, « Support for patients with celiac disease: A literature review », United European Gastroenterology Journal, vol. 3, no 2, , p. 146–159 (ISSN 2050-6406 et 2050-6414, DOI 10.1177/2050640614562599, lire en ligne, consulté le )
- "Gluten Digested by Enzymes from Probiotics"
- "Nbci, 2016:Identification of food-grade subtilisins as gluten-degrading enzymes to treat celiac disease"
- "Premier traitement de la maladie cœliaque"
- (en) Alessio Fasano, « Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer », Physiological Reviews, vol. 91, no 1, , p. 151–175 (ISSN 0031-9333, PMID 21248165, DOI 10.1152/physrev.00003.2008)
- (en) Justin Hollon, Elaine Puppa, Bruce Greenwald et Eric Goldberg, « Effect of Gliadin on Permeability of Intestinal Biopsy Explants from Celiac Disease Patients and Patients with Non-Celiac Gluten Sensitivity », Nutrients, vol. 7, no 3, , p. 1565–1576 (ISSN 2072-6643, DOI 10.3390/nu7031565, lire en ligne, consulté le )
- (en) Alessio Fasano, « Intestinal Permeability and Its Regulation by Zonulin: Diagnostic and Therapeutic Implications », Clinical Gastroenterology and Hepatology, vol. 10, no 10, , p. 1096–1100 (DOI 10.1016/j.cgh.2012.08.012, lire en ligne, consulté le )
- (en) Hanna Karakuła-Juchnowicz, Patrycja Szachta, Aneta Opolska et Justyna Morylowska-Topolska, « The role of IgG hypersensitivity in the pathogenesis and therapy of depressive disorders », Nutritional Neuroscience, vol. 20, no 2, , p. 110–118 (ISSN 1028-415X et 1476-8305, DOI 10.1179/1476830514Y.0000000158, lire en ligne, consulté le )
- (en) Karin de Punder et Leo Pruimboom, « The Dietary Intake of Wheat and other Cereal Grains and Their Role in Inflammation », Nutrients, vol. 5, no 3, , p. 771–787 (ISSN 2072-6643, DOI 10.3390/nu5030771, lire en ligne, consulté le )
- Molkhou, P., « La sensibilité au gluten non maladie cœliaque. Où en sommes-nous en 2016? », Revue Française d'Allergologie, 56(7-8), , p. 556-561 (lire en ligne)
- P. D. Mooney, I. Aziz et D. S. Sanders, « Non-celiac gluten sensitivity: clinical relevance and recommendations for future research », Neurogastroenterology & Motility, vol. 25, no 11, , p. 864–871 (ISSN 1350-1925, DOI 10.1111/nmo.12216, lire en ligne, consulté le )
- Carlo Catassi, Julio Bai, Bruno Bonaz et Gerd Bouma, « Non-Celiac Gluten Sensitivity: The New Frontier of Gluten Related Disorders », Nutrients, vol. 5, no 10, , p. 3839–3853 (ISSN 2072-6643, DOI 10.3390/nu5103839, lire en ligne, consulté le )
- Alessio Fasano, Anna Sapone, Victor Zevallos et Detlef Schuppan, « Nonceliac Gluten Sensitivity », Gastroenterology, vol. 148, no 6, , p. 1195–1204 (ISSN 0016-5085, DOI 10.1053/j.gastro.2014.12.049, lire en ligne, consulté le )
- Grażyna Czaja-Bulsa, « Non coeliac gluten sensitivity – A new disease with gluten intolerance », Clinical Nutrition, vol. 34, no 2, , p. 189–194 (ISSN 0261-5614, DOI 10.1016/j.clnu.2014.08.012, lire en ligne, consulté le )
- Javier Molina-Infante, Santos Santolaria, Miguel Montoro et María Esteve, « Sensibilidad al gluten no celiaca: una revisión crítica de la evidencia actual », Gastroenterología y Hepatología, vol. 37, no 6, , p. 362–371 (ISSN 0210-5705, DOI 10.1016/j.gastrohep.2014.01.005, lire en ligne, consulté le )
- Samuel O Igbinedion, Junaid Ansari, Anush Vasikaran et Felicity N Gavins, « Non-celiac gluten sensitivity: All wheat attack is not celiac », World Journal of Gastroenterology, vol. 23, no 40, , p. 7201–7210 (ISSN 1007-9327, DOI 10.3748/wjg.v23.i40.7201, lire en ligne, consulté le )
- Elena F Verdu, David Armstrong et Joseph A Murray, « Between Celiac Disease and Irritable Bowel Syndrome: The “No Man's Land” of Gluten Sensitivity », The American Journal of Gastroenterology, vol. 104, no 6, , p. 1587–1594 (ISSN 0002-9270 et 1572-0241, DOI 10.1038/ajg.2009.188, lire en ligne, consulté le )
- Pasquale Mansueto, Aurelio Seidita, Alberto D'Alcamo et Antonio Carroccio, « Non-Celiac Gluten Sensitivity: Literature Review », Journal of the American College of Nutrition, vol. 33, no 1, , p. 39–54 (ISSN 0731-5724 et 1541-1087, DOI 10.1080/07315724.2014.869996, lire en ligne, consulté le )
- Luca Elli, « Non-celiac gluten sensitivity: Time for sifting the grain », World Journal of Gastroenterology, vol. 21, no 27, , p. 8221 (ISSN 1007-9327, DOI 10.3748/wjg.v21.i27.8221, lire en ligne, consulté le )
- Umberto Volta, Maria Teresa Bardella, Antonino Calabrò et Riccardo Troncone, « An Italian prospective multicenter survey on patients suspected of having non-celiac gluten sensitivity », BMC Medicine, vol. 12, , p. 85 (ISSN 1741-7015, DOI 10.1186/1741-7015-12-85, lire en ligne, consulté le )
- Umberto Volta, Giacomo Caio, Roberto De Giorgio et Christine Henriksen, « Non-celiac gluten sensitivity: A work-in-progress entity in the spectrum of wheat-related disorders », Best Practice & Research Clinical Gastroenterology, vol. 29, no 3, , p. 477–491 (ISSN 1521-6918, DOI 10.1016/j.bpg.2015.04.006, lire en ligne, consulté le )
- (en) Barone, Maria; Troncone, Riccardo; Auricchio, Salvatore, « Gliadin Peptides as Triggers of the Proliferative and Stress/Innate Immune Response of the Celiac Small Intestinal Mucosa. », International Journal of Molecular Sciences (Review). 15 (11): 20518–20537.,
- ,
- « Sosgluten.ca », sur sosgluten.ca (consulté le ).
- Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med. 2011 Mar 9;9(1):23.
- Par exemple : Julien Venesson, Gluten, comment le blé moderne nous intoxique, Thierry Souccar Editions,
- (en) Anderson LA, McMillan SA, Watson RG, Monaghan P, Gavin AT, Fox C et Murray LJ, « Malignancy and mortality in a population-based cohort of patients with coeliac disease or "gluten sensitivity" », World J Gastroenterol, , p. 146-151
- "Ncbi, décembre 2015:The Overlap between Irritable Bowel Syndrome and Non-Celiac Gluten Sensitivity: A Clinical Dilemma"
- "Nbci, 2013: What Role Does Wheat Play in the Symptoms of Irritable Bowel Syndrome?"
- Santos Santolaria Piedrafita, « Celiac Disease and Gastrointestinal Functional Disorders », dans Celiac Disease and Non-Celiac Gluten Sensitivity, OmniaScience, (ISBN 9788494211829, lire en ligne), p. 347–362
- (en) Junker, Y.; Zeissig, S.; Kim, S.-J.; Barisani, D.; Wieser, H.; Leffler, D. A.; Zevallos, V.; Libermann, T. A.; Dillon, S.; Freitag, T. L.; Kelly, C. P.; Schuppan, D., « Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. . PMC 3526354. », Journal of Experimental Medicine. 209 (13): 2395–2408., (ISSN 0022-1007, PMID 23209313)
- Non celiac gluten sensitivity
- Les fructanes, et non le gluten, seraient responsables de problèmes intestinaux, Publié le mardi 14 novembre 2017 sur le site de Radio-Canada, consulté le 30 décembre 2017.
- (en) « Nonceliac Gluten Sensitivity or Wheat Intolerance Syndrome? », The Journal of Pediatrics, vol. 166, no 4, , p. 805–811 (ISSN 0022-3476, DOI 10.1016/j.jpeds.2014.12.039, lire en ligne, consulté le )
- Julie Lastérade, « Le régime sans gluten : la solution à tout ? », sur Grazia, .
- Adjusting for nonresponse bias corrects overestimates of food allergy prevalenceSoller, S et coll. (2015), Journal of Allergy and Clinical Immunology, 3(2), 291-293. DOI 10.1016/j.jaip.2014.11.006
- Règlement 1169/2011 Annexe II
- Wheat allergy
- The natural history of wheat allergy
- "Dermatitis herpetiformis" sur Medline Plus, U.S. National Library of Medicine
- Carme Farré, « Utilidad de la serología en el cribado, diagnóstico y seguimiento de los pacientes con enfermedad celíaca », dans Enfermedad celíaca y sensibilidad al gluten no celíaca, OmniaScience, (ISBN 9788494023439, lire en ligne), p. 151–170
- (en) Humbert P, « Gluten intolerance and skin diseases. », Eur J Dermatol. 16 (1): 4–11.,
- Miguel Montoro Huguet et Manuel Domínguez Cajal, « Enfermedad celíaca en el adulto », dans Enfermedad celíaca y sensibilidad al gluten no celíaca, OmniaScience, (ISBN 9788494023439, lire en ligne), p. 233–284
- Lionel Fry, Peter Keir, R.M.H. Mcminn et JeanD. Cowan, « SMALL-INTESTINAL STRUCTURE AND FUNCTION AND HÆMATOLOGICAL CHANGES IN DERMATITIS HERPETIFORMIS », The Lancet, vol. 290, no 7519, , p. 729–734 (ISSN 0140-6736, DOI 10.1016/s0140-6736(67)91942-3, lire en ligne, consulté le )
- Javier Alonso-Llamazares, Lawrence E. Gibson et Roy S. Rogers, « Clinical, pathologic, and immunopathologic features of dermatitis herpetiformis: review of the Mayo Clinic experience,? », International Journal of Dermatology, vol. 46, no 9, , p. 910–919 (ISSN 0011-9059 et 1365-4632, DOI 10.1111/j.1365-4632.2007.03214.x, lire en ligne, consulté le )
- D J Gawkrodger, J N Blackwell, H M Gilmour et E A Rifkind, « Dermatitis herpetiformis: diagnosis, diet and demography. », Gut, vol. 25, no 2, , p. 151–157 (ISSN 0017-5749, DOI 10.1136/gut.25.2.151, lire en ligne, consulté le )
- J.J. GARIOCH, H.M. LEWIS, S.A. SARGENT et J.N. LEONARD, « 25 years' experience of a gluten-free diet in the treatment of dermatitis herpetiformis », British Journal of Dermatology, vol. 131, no 4, , p. 541–545 (ISSN 0007-0963 et 1365-2133, DOI 10.1111/j.1365-2133.1994.tb08557.x, lire en ligne, consulté le )
- M Hadjivassiliou, RA Grünewald, AK Chattopadhyay et GAB Davies-Jones, « Clinical, radiological, neurophysiological, and neuropathological characteristics of gluten ataxia », The Lancet, vol. 352, no 9140, , p. 1582–1585 (ISSN 0140-6736, DOI 10.1016/s0140-6736(98)05342-2, lire en ligne, consulté le )
- W. T. COOKE et W. THOMAS SMITH, « NEUROLOGICAL DISORDERS ASSOCIATED WITH ADULT CELIAC DISEASE », Brain, vol. 89, no 4, , p. 683–722 (ISSN 0006-8950 et 1460-2156, DOI 10.1093/brain/89.4.683, lire en ligne, consulté le )
- M. Hadjivassiliou, M. Maki, D. S. Sanders et C. A. Williamson, « Autoantibody targeting of brain and intestinal transglutaminase in gluten ataxia », Neurology, vol. 66, no 3, , p. 373–377 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/01.wnl.0000196480.55601.3a, lire en ligne, consulté le )
- M. T. Pellecchia, R. Scala, A. Filla et G. De Michele, « Idiopathic cerebellar ataxia associated with celiac disease: lack of distinctive neurological features », Journal of Neurology, Neurosurgery & Psychiatry, vol. 66, no 1, , p. 32–35 (ISSN 0022-3050, DOI 10.1136/jnnp.66.1.32, lire en ligne, consulté le )
- (en) Hiroshi Mitoma, Keya Adhikari, Daniel Aeschlimann et Partha Chattopadhyay, « Consensus Paper: Neuroimmune Mechanisms of Cerebellar Ataxias », The Cerebellum, vol. 15, no 2, , p. 213–232 (ISSN 1473-4222 et 1473-4230, DOI 10.1007/s12311-015-0664-x, lire en ligne, consulté le )
- Neil Gordon, « Cerebellar ataxia and gluten sensitivity: a rare but possible cause of ataxia, even in childhood », Developmental Medicine & Child Neurology, vol. 42, no 4, , p. 283–286 (ISSN 0012-1622, DOI 10.1017/s0012162200000499, lire en ligne, consulté le )
- Miguel Montoro Huguet et Manuel Domínguez Cajal, « Enfermedad celíaca en el adulto », dans Enfermedad celíaca y sensibilidad al gluten no celíaca, OmniaScience, (ISBN 9788494023439, DOI 10.3926/oms.32., lire en ligne), p. 233–284
- (en) Ronald F. Pfeiffer, « Gastroenterology and Neurology: », CONTINUUM: Lifelong Learning in Neurology, vol. 23, no 3, , p. 744–761 (ISSN 1080-2371, DOI 10.1212/CON.0000000000000484, lire en ligne, consulté le )
- Carlos Hernández Lahoz, Gerard Mauri Capdevila, Juan Vega Villar et Luis Rodrigo Saez, « Neurogluten: patología neurológica por intolerancia al gluten », Revista de Neurología, vol. 53, no 05, , p. 287 (ISSN 0210-0010, DOI 10.33588/rn.5305.2011372, lire en ligne, consulté le )
- (en) Marios Hadjivassiliou, David D. Sanders et Daniel P. Aeschlimann, « Gluten-Related Disorders: Gluten Ataxia », Digestive Diseases, vol. 33, no 2, , p. 264–268 (ISSN 0257-2753 et 1421-9875, DOI 10.1159/000369509, lire en ligne, consulté le )
- (en) Marios Hadjivassiliou, Andrew P. Duker et David S. Sanders, « Gluten-related neurologic dysfunction », dans Handbook of Clinical Neurology, vol. 120, Elsevier, (ISBN 9780702040870, DOI 10.1016/b978-0-7020-4087-0.00041-3., lire en ligne), p. 607–619
- Bernier JJ,, « Nondeficiency chronic polyneuropathies in celiac disease in adults (2 cases with inflammatory neuromuscular vascularitis) », Ann Med Interne (Paris) 127 (10): 721-9., (PMID 1008365)
- (en) Carlo Catassi, Julio Bai, Bruno Bonaz et Gerd Bouma, « Non-Celiac Gluten Sensitivity: The New Frontier of Gluten Related Disorders », Nutrients, vol. 5, no 10, , p. 3839–3853 (ISSN 2072-6643, DOI 10.3390/nu5103839, lire en ligne, consulté le )
- Khalil El-Chammas et Elaine Danner, « Gluten-Free Diet in Nonceliac Disease », Nutrition in Clinical Practice, vol. 26, no 3, , p. 294–299 (ISSN 0884-5336 et 1941-2452, DOI 10.1177/0884533611405538, lire en ligne, consulté le )
- (es) Carlos Hernández-Lahoz et Luis Rodrigo, « Trastornos relacionados con el gluten y enfermedades desmielinizantes », Medicina Clínica, vol. 140, no 7, , p. 314–319 (DOI 10.1016/j.medcli.2012.07.009, lire en ligne, consulté le )
- A. E. Kalaydjian, W. Eaton, N. Cascella et A. Fasano, « The gluten connection: the association between schizophrenia and celiac disease », Acta Psychiatrica Scandinavica, vol. 113, no 2, , p. 82–90 (ISSN 0001-690X et 1600-0447, DOI 10.1111/j.1600-0447.2005.00687.x, lire en ligne, consulté le )
- (en) Alessio Fasano, Anna Sapone, Victor Zevallos et Detlef Schuppan, « Nonceliac Gluten Sensitivity », Gastroenterology, vol. 148, no 6, , p. 1195–1204 (DOI 10.1053/j.gastro.2014.12.049, lire en ligne, consulté le )
- (en) Jasmine Turna, Keren Grosman Kaplan, Rebecca Anglin et Michael Van Ameringen, « “WHAT'S BUGGING THE GUT IN OCD?” A REVIEW OF THE GUT MICROBIOME IN OBSESSIVE-COMPULSIVE DISORDER: Review: A Review of the Gut Micro biome and OCD », Depression and Anxiety, vol. 33, no 3, , p. 171–178 (DOI 10.1002/da.22454, lire en ligne, consulté le )
- (en) Amanda K Ludlow et Samantha L Rogers, « Understanding the impact of diet and nutrition on symptoms of Tourette syndrome: A scoping review », Journal of Child Health Care, vol. 22, no 1, , p. 68–83 (ISSN 1367-4935 et 1741-2889, DOI 10.1177/1367493517748373, lire en ligne, consulté le )
- (en) Reidun Stenberg, Charlotte Dahle, Eva Lindberg et Jens Schollin, « Increased Prevalence of Anti-gliadin Antibodies and Anti-tissue Transglutaminase Antibodies in Children With Cerebral Palsy: », Journal of Pediatric Gastroenterology and Nutrition, vol. 49, no 4, , p. 424–429 (ISSN 0277-2116, DOI 10.1097/MPG.0b013e31819a4e52, lire en ligne, consulté le )
- (en) Melissa Shapiro et David A. Blanco, « Neurological Complications of Gastrointestinal Disease », Seminars in Pediatric Neurology, vol. 24, no 1, , p. 43–53 (DOI 10.1016/j.spen.2017.02.001, lire en ligne, consulté le )
- M Hadjivassiliou, « Gluten sensitivity as a neurological illness », Journal of Neurology, Neurosurgery & Psychiatry, vol. 72, no 5, , p. 560–563 (ISSN 0022-3050, DOI 10.1136/jnnp.72.5.560, lire en ligne, consulté le )
- (en) María Moreno, Alfonso Rodríguez-Herrera, Carolina Sousa et Isabel Comino, « Biomarkers to Monitor Gluten-Free Diet Compliance in Celiac Patients », Nutrients, vol. 9, no 1, , p. 46 (ISSN 2072-6643, DOI 10.3390/nu9010046, lire en ligne, consulté le )
- Chantal Gatignol (MIVILUDES), « Les dérives sectaires liées à l'alimentation et à la nutrition », Information Diététique, La revue de l’Association Française des Diététiciens Nutritionnistes, no 1, , p. 21-34 (lire en ligne).
- « Popular Autism Diet Does Not Demonstrate Behavioral Improvement »
- « Bonne nouvelle : la bouffe sans gluten n'est pas meilleure pour votre santé », sur munchies.vice.com, .
- Paule Neyrat, « Orthorexie : sa fréquence devient inquiétante », sur e-sante.fr, (consulté le )
- « L'orthorexie nerveuse – quand manger trop sain devient malsain », Le Conseil Européen de l'Information sur l'Alimentation (EUFIC),
- « Sans gluten, très cher régime », 60 millions de consommateurs, , p. 42-46
- (en) H. Szajewska, R. Shamir, A. Chmielewska et M. Pieścik-Lech, « Systematic review with meta-analysis: early infant feeding and coeliac disease - update 2015 », Alimentary Pharmacology & Therapeutics, vol. 41, no 11, , p. 1038–1054 (DOI 10.1111/apt.13163, lire en ligne, consulté le )
- (en) Elena Lionetti et Carlo Catassi, « The Role of Environmental Factors in the Development of Celiac Disease: What Is New? », Diseases, vol. 3, no 4, , p. 282–293 (ISSN 2079-9721, DOI 10.3390/diseases3040282, lire en ligne, consulté le )
- (en) Benjamin Lebwohl, Jonas F Ludvigsson et Peter H R Green, « Celiac disease and non-celiac gluten sensitivity », BMJ, , h4347 (ISSN 1756-1833, DOI 10.1136/bmj.h4347, lire en ligne, consulté le )
- (en) Michael T Bethune et Chaitan Khosla, « Parallels between Pathogens and Gluten Peptides in Celiac Sprue », PLoS Pathogens, vol. 4, no 2, , e34 (ISSN 1553-7374, DOI 10.1371/journal.ppat.0040034, lire en ligne, consulté le )
- F. G. CHIRDO, M. RUMBO, M. C. AÑÓN,, « Presence of High Levels of Non-Degraded Gliadin in Breast Milk from Healthy Mothers », Scandinavian Journal of Gastroenterology, vol. 33, no 11, , p. 1186–1192 (ISSN 0036-5521 et 1502-7708, DOI 10.1080/00365529850172557, lire en ligne, consulté le )
- adminligne25, « L’avoine avec ou sans gluten », sur Observatoire des aliments, (consulté le )
- (en) Rottmann LH, « On the Use of Oats in the Gluten-Free Diet » [archive du ], Celiac Sprue Association/United States of America, Inc. (CSA), (consulté le )
- (en) « Info on Oats »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Celiac Sprue Association/United States of America, Inc. (CSA), (consulté le )
- Lien wiki en anglais sur une forma partiulière de sensibilité à l'avoine, la sensibilité à l'avénine : en:Oat sensitivity#Avenin-sensitive_enteropathy
- (en) Isabel Comino, « Diversity in oat potential immunogenicity: basis for the selection of oat varieties with no toxicity in coeliac disease », Gut, vol. 60, no First Online, , p. 915–22 (PMID 21317420, PMCID 3112367, DOI 10.1136/gut.2010.225268, lire en ligne, consulté le )
- (en) SMITH RB, SPRINZ H, CROSBY WH, SULLIVAN BH, « Peroral small bowel mucosal biopsy », Am. J. Med., vol. 25, no 3, , p. 391–4 (PMID 13571252, DOI 10.1016/0002-9343(58)90077-9, lire en ligne)
- (en) Garsed K, Scott BB, « Can oats be taken in a gluten-free diet? A systematic review », Scand. J. Gastroenterol., vol. 42, no 2, , p. 171–8 (PMID 17327936, DOI 10.1080/00365520600863944)
- American Dietetic Association. Nutrition Care Manual: Celiac Disease. Available at: http://www.nutritioncaremanual.org. Accessed December 15, 2004.
- (en) Thompson T, « Gluten contamination of commercial oat products in the United States », N. Engl. J. Med., vol. 351, no 19, , p. 2021–2 (PMID 15525734, DOI 10.1056/NEJM200411043511924)
- (en) Janatuinen, E., et al., « A Comparison of Diets with and without Oats in Adults with Celiac Disease », New England Journal of Medicine,
- (en) E.K. Janatuinen, T.A. Kemppainen, R.J.K. Julkunen, V-M. Kosma, M. Mäki, M. Heikkinen et M.I. Uusitupa, « No harm from five year ingestion of oats in celiac disease », Gut, vol. 50, no 3, , p. 332–335 (PMID 11839710, PMCID 1773136, DOI 10.1136/gut.50.3.332)
- « Encyclopédie des aliments: l'Avoine »
- (en) Hernando A, Mujico JR, Mena MC, Lombardía M, Méndez E, « Measurement of wheat gluten and barley hordeins in contaminated oats from Europe, the United States and Canada by Sandwich R5 ELISA », Eur J Gastroenterol Hepatol, vol. 20, no 6, , p. 545–54 (PMID 18467914, DOI 10.1097/MEG.0b013e3282f46597)
- (en) Carolina Ciacci, Paul Ciclitira, Marios Hadjivassiliou et Katri Kaukinen, « The gluten-free diet and its current application in coeliac disease and dermatitis herpetiformis », United European Gastroenterology Journal, vol. 3, no 2, , p. 121–135 (ISSN 2050-6406 et 2050-6414, DOI 10.1177/2050640614559263, lire en ligne, consulté le )
- Isabel Comino, « Role of oats in celiac disease », World Journal of Gastroenterology, vol. 21, no 41, , p. 11825 (ISSN 1007-9327, DOI 10.3748/wjg.v21.i41.11825, lire en ligne, consulté le )
- M. Cristina P. de Souza, Marie-Eve Deschênes, Suzanne Laurencelle et Patrick Godet, « Pure Oats as Part of the Canadian Gluten-Free Diet in Celiac Disease: The Need to Revisit the Issue », Canadian Journal of Gastroenterology and Hepatology, vol. 2016, , p. 1–8 (ISSN 2291-2789 et 2291-2797, DOI 10.1155/2016/1576360, lire en ligne, consulté le )
- (en) Francesca Penagini, Dario Dilillo, Fabio Meneghin et Chiara Mameli, « Gluten-Free Diet in Children: An Approach to a Nutritionally Adequate and Balanced Diet », Nutrients, vol. 5, no 11, , p. 4553–4565 (ISSN 2072-6643, DOI 10.3390/nu5114553, lire en ligne, consulté le )
- (en) Jessica R Biesiekierski, « What is gluten?: What is gluten? », Journal of Gastroenterology and Hepatology, vol. 32, , p. 78–81 (DOI 10.1111/jgh.13703, lire en ligne, consulté le )
- (en) M. Cristina P. de Souza, Marie-Eve Deschênes, Suzanne Laurencelle et Patrick Godet, « Pure Oats as Part of the Canadian Gluten-Free Diet in Celiac Disease: The Need to Revisit the Issue », Canadian Journal of Gastroenterology and Hepatology, vol. 2016, , p. 1–8 (ISSN 2291-2789 et 2291-2797, DOI 10.1155/2016/1576360, lire en ligne, consulté le )
- (en) N Y Haboubi, S Taylor et S Jones, « Coeliac disease and oats: a systematic review », Postgraduate Medical Journal, vol. 82, no 972, , p. 672–678 (ISSN 0032-5473, DOI 10.1136/pgmj.2006.045443, lire en ligne, consulté le )
- Francisco Cabrera-Chávez, Stefania Iametti, Matteo Miriani et Ana M. Calderón de la Barca, « Maize Prolamins Resistant to Peptic-tryptic Digestion Maintain Immune-recognition by IgA from Some Celiac Disease Patients », Plant Foods for Human Nutrition, vol. 67, no 1, , p. 24–30 (ISSN 0921-9668 et 1573-9104, DOI 10.1007/s11130-012-0274-4, lire en ligne, consulté le )
- S. Accomando, C. Albino, D. Montaperto et G.M. Amato, « Multiple food intolerance or refractory celiac sprue? », Digestive and Liver Disease, vol. 38, no 10, , p. 784–785 (ISSN 1590-8658, DOI 10.1016/j.dld.2005.07.004, lire en ligne, consulté le )