Subtilisine
La subtilisine est une protéase à sérine qui catalyse l'hydrolyse des protéines avec une faible spécificité en matière de liaison peptidique. Elle agit préférentiellement à proximité d'un grand résidu d'acide aminé non chargé. Elle a été isolée à partir de Bacillus subtilis, d'où son nom, mais est également produite par d'autres bactéries, telles que Bacillus amyloliquefaciens.
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
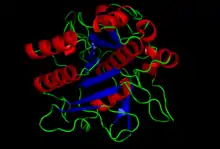
La subtilisine de B. subtilis est une protéine de 275 résidus d'acides aminés. Son mécanisme d'action fait intervenir une triade catalytique constituée des résidus Asp-32, His-64 et Ser-221 : bien qu'ils soient distants les uns des autres dans la structure primaire de la protéine, ces trois acides aminés sont voisins dans la structure tertiaire de l'enzyme, dont ils constituent le site actif. Le carboxylate de la chaîne latérale de l'Asp-32 forme une liaison hydrogène avec le proton de l'atome d'azote de l'imidazole de l'His-64. L'autre atome d'azote de l'His-64 forme une liaison hydrogène avec le proton de l'hydroxyle de la Ser-221, dont l'atome d'oxygène est nucléophile. Ce dernier attaque les liaisons peptidiques des substrats, avec l'aide de l'amide de la chaîne latérale de l'Asn-155.
Notes et références
- (en) R. Bott, M. Ultsch, A. Kossiakoff, T. Graycar, B. Katz et S. Power, « The three-dimensional structure of Bacillus amyloliquefaciens subtilisin at 1.8 A and an analysis of the structural consequences of peroxide inactivation », Journal of Biological Chemistry, vol. 263, no 16, , p. 7895-7906 (PMID 3286644, lire en ligne)
- (en) M. Philipp et M. L. Bender, « Kinetics of subtilisin and thiolsubtilisin », Molecular and Cellular Biochemistry, vol. 51, no 1, , p. 5-32 (PMID 6343835, DOI 10.1007/BF00215583, lire en ligne)
- (en) Peter NEDKOV, Walter OBERTHÜR et Gerhard BRAUNITZER, « Determination of the Complete Amino-Acid Sequence of Subtilisin DY and its Comparison with the Primary Structures of the Subtilisins BPN’, Carlsberg and Amylosacchariticus », Biological Chemistry Hoppe-Seyler, vol. 366, no 4, , p. 421-430 (PMID 3927935, DOI 10.1515/bchm3.1985.366.1.421, lire en ligne)
- (en) H. Ikemura, H. Takagi et M. Inouye, « Requirement of pro-sequence for the production of active subtilisin E in Escherichia coli », Journal of Biological Chemistry, vol. 262, no 16, , p. 7859-7864 (PMID 3108260, lire en ligne)