Médecine de soins critiques
La médecine de soins critiques, aussi connue dans certains systèmes de santé comme médecine de soins intensifs ou plus rarement comme médecine de réanimation, est une discipline médicale qui s'attache à prendre en charge les patients présentant ou susceptibles de présenter une ou plusieurs défaillances viscérales aiguës mettant directement en jeu leur pronostic vital. Elle implique un suivi continu des fonctions vitales et, le cas échéant, le recours à des méthodes de suppléance (transfusion de dérivés sanguins, remplissage vasculaire, ventilation mécanique, catécholamines, hémodialyse, circulation extracorporelle, etc.). L'objectif final est la restauration de l'homéostasie.
La médecine de soins critiques est souvent pratiquée après la réanimation d'urgence par les unités préhospitalières et la réanimation hospitalière médicale, chirurgicale ou polyvalente.
Les affections relevant de la médecine de soins critiques sont nombreuses : états de choc complexes, polytraumatismes, comas, insuffisances organiques aiguës, décompensations de maladies chroniques, hémorragies, intoxications, infections sévères, brûlures étendues, période post-opératoire de chirurgies lourdes, etc.
Historique
La médecine de soins critiques, une pratique ancienne
Si la pratique moderne de la médecine de soins critiques est relativement récente (début du XXe siècle), il existe des témoignages de techniques de réanimation remontant à l’Antiquité. Les Égyptiens pratiquent des gestes qui pourraient s'apparenter à des trachéotomies pour traiter une obstruction des voies aériennes supérieures des 1500 av. J.-C. Mille ans plus tard, Hippocrate décrit une canulation des voies aériennes pour permettre à l'air « d’être aspiré dans les poumons[1]. »
Le bouche-à-bouche est appliqué au cours des siècles par les sages-femmes puis par les patriciens, sur des nouveau-nés dyspnéiques[2]. L'historiographie de la réanimation médicale présente le chirurgien écossais William Tossach comme celui qui introduit cette technique de ventilation artificielle chez les adultes, ce médecin faisant en 1744 la première description clinique du bouche à bouche qu'il pratique le sur un mineur asphyxié[3].
Dans le passé il est plus difficile de définir la mort mais un visage gonflé noir, des yeux vitreux, ratatinés et la putréfaction étaient des critères utilisés pour savoir s'il fallait continuer les tentatives de réanimation des personnes noyées. Plusieurs méthodes de réanimation sont alors utilisées : réchauffement du corps, pendaison par les pieds du patient au-dessus d'un feu, insufflation de fumée de tabac dans le rectum[4]. Ce dernier procédé, dit d'insufflation alvine, se développe entre la seconde partie du XVIIIe siècle et la deuxième moitié du XIXe siècle bien qu'il soit sans aucun fondement médical : préconisé en 1733 par le savant Louis Bourguet pour porter secours aux noyés des lacs suisses, il est introduit en France en 1740 par Réaumur. Les rives des grands fleuves d'Europe sont alors pourvues de boîtes fumigatoires à cet effet[5].
La technique du massage cardiaque externe est décrite par le médecin écossais William Buchan dès la quatrième édition de son ouvrage Médecine domestique en 1775[6].
Florence Nightingale et les débuts des soins critiques modernes

Les soins critiques au sens moderne du terme prennent leurs racines à la guerre de Crimée (1853-1856). Les soldats sont alors hospitalisés dans des conditions précaires et la mortalité atteint 40 %. L’arrivée de l'infirmière britannique Florence Nightingale la fait chuter à seulement 2 % : elle décide de regrouper les patients selon leur degré de gravité et de rapprocher les plus sérieusement atteints du poste de soins infirmiers afin qu'ils bénéficient d'une surveillance accrue (plus souvent et par un effectif supérieur). Le travail de Florence Nightingale a pavé le terrain pour ce qui deviendra la réanimation : la notion-clé de la réanimation réside dans la fréquence et l’intensité des observations infirmières[7]. Nightingale comprend et enseigne l’intérêt de regrouper les patients selon la gravité de leur condition plutôt que simplement par ordre d’arrivée comme cela était le cas auparavant : cela entraîne d'une part une meilleure prise en charge, basée sur les besoins du patient et non sur ceux de l'unité, et une spécialisation des soignants d'autre part[8].
Aux États-Unis, le neurochirurgien Walter Dandy, diplômé de l'école de médecine de Johns Hopkins (Baltimore) en 1910, crée le premier service de surveillance intensive (3 lits) à Boston en 1926 pour ses patients en post-opératoire[8].
Björn Ibsen et la polio

L'exploration de nouvelles techniques de réanimation et de soins critiques sont apparues après la Seconde Guerre mondiale. Les soignants, peu nombreux, sont contraints de suivre l'exemple de Nightingale et de regrouper leurs patients. Des « unités de choc » spécialisées sont créées pour venir en aide aux soldats au plus près du front. Dans les années 1950, la grande épidémie de poliomyélite fait rage en Europe, et en particulier à Copenhague en 1952[9]. 2 722 patients sont touchés, dont 316 souffrent de paralysie respiratoire par atteinte du système nerveux central. Le médecin anesthésiste danois Björn Ibsen (1915–2007)[10], diplômé de l'école de médecine de l'université de Copenhague et formé au Massachusetts General Hospital de Boston, essaye d'utiliser des respirateurs à pression négative. Ibsen crée des unités respiratoires où sont hospitalisés des dizaines de patients enfermés dans ces « poumons d'acier. » Ces machines, bien qu'efficaces, ne permettaient cependant pas l'aspiration des sécrétions bronchiques, indispensable pour ces patients ayant perdu le réflexe de toux, et ceux qui étaient les plus gravement atteints s'encombraient et mouraient.
Ibsen a alors l'idée d'utiliser une ventilation à pression positive (procédé contraire à la ventilation physiologique). Cette nouvelle technique implique l'intubation trachéale du patient. En juin 1953, une enfant atteinte de tétanos est admise à l'hôpital de Blegdam. Ibsen décide de tester son nouveau traitement sur elle. Pour Ibsen les symptômes des patients atteints de tétanos (qui ne peuvent respirer à cause de crampes) et des patients atteints de poliomyélite (qui ne peuvent respirer à cause de la faiblesse musculaire) étaient techniquement très proches. Il utilise du curare afin de mettre sa petite patiente dans un état similaire à celui des patients poliomyélites, l'intube et la ventile pendant une durée de 17 jours jusqu’au réveil de l'enfant. Alors que les respirateurs mécaniques n'ont pas encore été inventés, Ibsen recrute plus de 200 étudiants en médecine pour insuffler manuellement l'air oxygéné en pression dans les poumons de la patiente, 24 heures sur 24[9].
Carl-Gunnar Engström développe alors le premier respirateur en volume contrôlé à pression positive, qui remplacera les étudiants. La mortalité chute de 90 % à environ 25 %. Ibsen, alors élu à la tête du département d'anesthésie de l'hôpital de Copenhague, y crée le premier service de réanimation polyvalente dans une salle de classe pour étudiantes infirmières[10]. Il est aussi l'auteur d'un ouvrage sur les principes de fonctionnement des unités de réanimation[11].
Peter Safar, ABC et RCP
Le premier réanimateur (Intensivist) américain, Peter Safar est pour la première fois diplômé d'anesthésie, et crée les salles d'urgence (Urgency & Emergency room) aujourd'hui connues sous le nom d’Intensive Care Units (ICU). Il crée le protocole ABC (Airway, Breathing, and Circulation pour « voies respiratoires, respiration, circulation »), et popularise la ventilation artificielle et la réanimation cardiopulmonaire (RCP). La réanimation connaît un essor considérable à partir des années 1960, parallèlement à l'anesthésie avec laquelle elle partage un certain nombre de techniques.
Sur un plan juridique, éthique et philosophique, les technologies modernes de réanimation ont conduit à redéfinir la mort en tant que processus, et non en tant que simple moment, en dissociant par exemple l'état de mort cérébrale de l'arrêt cardiorespiratoire.
Généralités
Les patients qui requièrent des soins de réanimation ou des soins intensifs sont atteints de défaillances organiques, telles que l'insuffisance circulatoire (hypotension), la détresse respiratoire (nécessitant une aide mécanique), l'insuffisance rénale aiguë, des troubles graves du rythme cardiaque, des affections neurologiques (traumatisme crânien, accident vasculaire cérébral, coma), etc. Leur association, fréquente, est appelée défaillance multi-viscérale. En effet, il est fréquent que l'une de ces défaillances en entraîne une autre, la plupart des systèmes organiques étant liés les uns aux autres.
Certains patients sont également admis au soins intensifs pour une surveillance continue à la suite d'une chirurgie majeure, ou parce qu'ils sont trop instables pour être transférés dans une unité de soins classique.
Ils peuvent venir du bloc opératoire ou d'un autre service, dans l'attente d'un retour vers leur service d'origine dans l'attente d'une stabilisation de leur état de santé, ou venir de l'extérieur de l'hôpital : ils sont transportés par le SAMU depuis un autre établissement ou depuis le lieu de leur accident (accident de la voie publique (AVP), accident domestique, etc.)
L'exercice de la réanimation hospitalière ou des soins intensifs fait l'objet de dispositions légales dans de nombreux pays[12].
La médecine de soins critiques constitue généralement la branche la plus onéreuse de la médecine, étant donné l'approche complète, intensive et avancée du traitement médical prodigué. En France, le coût de la journée d'hospitalisation en réanimation est compris entre 1 500 et 2 000 euros[13], soit 5 à 10 % du budget hospitalier[14]. Aux États-Unis, les unités de réanimation coûtent de 15 à 55 milliards de dollars, soit 0,56 % du PIB et 13 % des coûts hospitaliers[15].
Systèmes organiques
Les systèmes organiques traités en médecine de soins critiques sont[16] :
- le système cardiovasculaire ;
- le système nerveux central ;
- le système respiratoire ;
- le système endocrinien
- le système rénal et métabolique ;
- le système digestif (dont la nutrition) ;
- le système hématologique ;
- le système microbiologique (dont les infections) ;
- le système périphérique (dont l'intégrité cutanée et osseuse).
Pathologies en réanimation
Cette liste est non exhaustive et dresse la liste des pathologies rencontrées en soins intensifs « médicaux » par système organique[17] (en italique les complications liées à l'hospitalisation en réanimation)[18].
Ne sont pas indiquées ici les indications postopératoires d'une admission en soins intensifs « chirurgicaux », étant donné la diversité des procédures chirurgicales nécessitant une surveillance postopératoire poussée et prolongée.
- Système cardiovasculaire[18]
-
- Arrêt cardiorespiratoire (ACC ou ACR)
- Chocs (hémorragique, hypovolémique, septique, anaphylactique, cardiogénique) ou collapsus
- Insuffisance cardiaque aiguë
- Pré-éclampsie
- Collapsus de reventilation
- Système nerveux central[19]
- Coma (post-traumatique ou non traumatique)
- État de mal épileptique
- Accident vasculaire cérébral (AVC)
- Hypertension intracrânienne (HTIC)
- Système respiratoire[20]
- Système endocrinien
- Coma hypoglycémique
- Acidocétose diabétique
- Système rénal[21]
- Système digestif
- Système hématologique
- Système microbiologique
- Système périphérique
- Pathologies multi-systémiques
Certaines unités de soins intensifs accueillent des patients en mort cérébrale (avant leur arrivée ou dont le coma s'est dépassé au cours de l'hospitalisation) qui sont amenés à être prélevés en vue d'un don d'organes[27].
Exercice de la réanimation
En France
| CHU | CH | |
|---|---|---|
| Services | ~ 80 | ~ 300 |
| Lits / service | 12-40 (~ 15 %) | ~ 10 |
| Admissions / an | 400-800 | 400-2000 |
| Mortalité | 19-30 % (~ 23 %) | 12-30 % (~ 16 %) |
Il existe trois types de services de soins intensifs classiques pour les adultes :
- les soins intensifs médicaux ;
- les soins intensifs chirurgicaux ;
- les soins intensifs médicochirurgicaux.
Les deux premières peuvent faire l'objet de services séparés au sein des hôpitaux qui les dispensent (soins intensifs néphrologiques, soins intensifs neurologiques, soins intensifs de chirurgie cardiovasculaire, etc.). Il faut ajouter à cela les services de soins intensifs spécialisées (soins intensifs pédiatriques, les services de grands brûlés, etc.) et différencier les soins intensifs hospitaliers du service mobile d'urgence et de réanimation (SMUR) et de l'anesthésie.
La discipline de soins intensifs est catégorisée selon trois niveaux de prise en charge basés sur la gravité et/ou le risque d'apparition d'une ou de plusieurs défaillances organiques[14] :
- les unités de surveillance continue : prise en charge du risque de défaillance vitale ;
- les unités de soins intensifs : prise en charge d'une défaillance unique sur une durée limitée (ces unités sont souvent spécialisées, en cardiologie (USIC), néphrologie, néonatalogie, etc.) ;
- les services de réanimation : prise en charge prolongée de défaillances multiples.
La plupart des services de soins intensifs sont implantées dans les centres hospitaliers (régionaux) universitaires (CHU ou CHRU). Cependant, la réanimation (soins intensifs et continus) est aussi exercée dans des centres hospitaliers publics (CH) et des établissements privés à but non lucratif. D'une manière générale, la mortalité est de l'ordre de 20 % en réanimation[14].
L'exercice de la médecine de soins intensifs est codifiée par le décret n° 2002-466 du [28]et le décret 2006-72 du [29] du Code de la santé publique. Ces décrets précisent les modalités d'organisation des services de réanimation selon leur niveau, le matériel qui doit être disponible et le personnel minimum qui doit être présent[30]. Par exemple, un médecin doit être en permanence présent et joignable dans les services de réanimation et de soins intensifs, et l'effectif infirmier est plus important dans les premiers :
- en réanimation : 2 infirmiers pour 5 patients et 1 aide-soignant pour 4 patients 24 h / 24 ;
- en soins intensifs : 1 IDE et 1 AS pour 4 patients le jour, 1 IDE et 1 AS pour 8 patients la nuit.
Dans les autres pays
Aux États-Unis, les services de réanimation sont appelés Intensive care units (ICU). Il existe plusieurs spécialisations, dont la néonatalogie (Neonatal intensive care unit, NICU), la pédiatrie (Pediatric intensive care unit, PICU) et la coronarographie (Coronary care unit, CCU). De la même manière que la France différencie la réanimation et les soins intensifs, il existe des unités de surveillance appelées High dependency unit (HDU).
Au Royaume-Uni, ils sont plus souvent nommés Intensive treatment units (ITU) ou Critical care units (CCU). Il existe également des High dependency units (HDU).
Médical
En France, les médecins qui exercent dans les services de réanimation sont généralement des anesthésistes-réanimateurs ayant validé un DES d'anesthésie-réanimation complété par le diplôme d'État de docteur en médecine, ou des réanimateurs médicaux ayant validé un DES (de pneumologie, cardiologie, néphrologie ou autre spécialité ayant trait à la réanimation) complété par un DESC (diplôme d'études spécialisées complémentaires) de réanimation médicale. Ils sont appelés urgentistes s'ils ont suivi une formation supplémentaire de soins d'urgence. Aux États-Unis, ils sont appelés anesthesiologists, et anaesthetists au Royaume-Uni, au Canada et dans les autres pays du Commonwealth. Lorsqu'ils exercent dans des intensive care units, ils sont appelés intensivists.
Selon les pays, il existe deux types d'exercice en réanimation : les services « fermés » et les services « ouverts ». Dans les services fermés, le réanimateur est responsable du patient dès son entrée dans le service et jusqu'à sa sortie. Il peut consulter des spécialistes, mais le médecin initial du patient (s'il a d'abord été hospitalisé dans un service de médecine ou de chirurgie) n'a qu'un rôle consultatif. Dans les services ouverts, c'est le médecin initial qui assure la direction thérapeutique quotidienne de son patient, le réanimateur ne gérant que les urgences survenues en son absence ou sur les périodes de garde. Cependant, il a été démontré que le fonctionnement des services fermés permettait une meilleure prise en charge du patient et un meilleur pronostic[31] - [32].
Les pharmaciens peuvent également intervenir dans l'analyse pharmaceutique, le contrôle et la validation des choix thérapeutiques des médecins.
Paramédical
En France, la surveillance est assurée par des infirmiers diplômés d'État (IDE). Aucune formation supplémentaire n'est requise pour exercer dans ces services, bien que les sociétés savantes de réanimation (Société française d'anesthésie et de réanimation (SFAR), Société de réanimation de langue française (SRLF), Société française des infirmiers de soins intensifs (SFISI), etc.) se positionnent en faveur d'une spécialisation d'« Infirmière en réanimation » : « il n’existe pas de diplôme ni de formation diplômante dédiés à l’exercice en réanimation. Or, cette discipline fait appel à des savoirs, aptitudes et compétences très spécifiques qui sont peu abordés durant les trois années que passent les étudiants infirmiers à l’Institut de formations aux professions de la santé »[33]. La formation infirmière généraliste dans les Instituts de formation en soins infirmiers ne consacre que 80 heures à l'enseignement des spécifications rencontrées dans les services d'urgences et de réanimation[34]. Des diplômes universitaires de formation à la réanimation (« DU de réanimation », « DU de formation à la réanimation », « DU approche des techniques de soins en réanimation », « DU soins infirmiers prodigués aux patients adultes en réanimation », etc.) sont cependant disponible dans plusieurs universités françaises[35] - [36].
Ils sont assistés pour les soins par des aides-soignants, et supervisés par des cadres infirmiers. Dans certains services, un infirmier anesthésiste (IADE) est aussi compris dans l'effectif. D'autres personnels paramédicaux peuvent aussi intervenir, tels que les kinésithérapeutes, les diététiciens, les psychologues, les assistants sociaux, les biotechniciens, etc.
Aux États-Unis, les infirmiers (nurses) ont la possibilité de faire des formations supplémentaires en réanimation, sanctionnées par un diplôme de soins infirmiers en réanimation (certification in critical care nursing) délivré par l’American Association of Critical Care Nurses. Ils peuvent se spécialiser en soins infirmiers de réanimation néonatale, pédiatrique et adulte, ainsi qu'en fonction des pathologies (néphrologie, cardiologie, traumatologie, etc.). De plus, les infirmiers spécialistes cliniques (clinical nurse specialist) peuvent aussi valider un diplôme en réanimation adulte, pédiatrique et néonatale. Aucune de ces spécialisations ne confèrent aux infirmiers des prérogatives médicales (de prescription notamment), mais démontrent une expertise infirmière et un élargissement des compétences. Elles ne sont pas obligatoires mais restent encouragées par les employeurs, et doivent en général être recyclées chaque année.
Au Royaume-Uni, la spécialité fait l'objet d'une formation universitaire facultative (ITU nursing course) équivalent au DU français, et pouvant être prolongée en une maîtrise de soins infirmiers en réanimation (Master in critical care nursing). Comme aux États-Unis, les soins de réanimation sont dirigés par le personnel infirmier (là où ils sont dirigés par les médecins en France par exemple), octroyant ainsi aux infirmiers une meilleure reconnaissance de leurs compétences et une autonomie plus large. De même, le ratio patient/infirmier est souvent plus important qu'en France (généralement 1 infirmier par patient).
Au Québec, outre leur formation en soins immédiats en réanimation (SIR), les inhalothérapeutes ont la possibilité de parfaire leur formation dans cette discipline par le biais, notamment, de cours spécialisées et sanctionnées par une certification (renouvelable) en soins avancés en réanimation cardiovasculaire (SARC), soins avancés en réanimation pédiatrique (SARP), un programme de réanimation néonatale (PRN) et un cours avancé de réanimation des polytraumatisés.
Surveillances et équipements en réanimation
_2007-03-03.jpg.webp)
La surveillance en réanimation est un moyen de dépistage d'une anomalie pouvant mettre en jeu le pronostic vital. Étant donné l'état de santé des patients, la surveillance médicale et infirmière doit circonscrire chaque système organique cités ci-dessus.
Monitorage
Une liaison continue est établie entre le patient et un moniteur qui permet de surveiller automatiquement toutes les constantes du patient. Son but est de détecter un dysfonctionnement ou suivre l'évolution d'une instabilité.
Matériel
Le matériel de base utilisé en réanimation est :
- un électrocardioscope (fréquemment dit « scope ») : relie le moniteur au patient par le biais de plusieurs brins (trois ou cinq) branchés sur autant d'électrodes au contact direct du patient (sur la poitrine)
- un brassard à tension
- un câble d'oxymétrie colorimétrique : cellule infrarouge placée à une extrémité du patient (souvent le doigt)
Signes vitaux
Les signes vitaux principalement surveillés sont :
- Fréquence cardiaque (FC ou pouls)
- Surveillance de l'activité électrique du cœur en continu pour détecter les anomalies rythmiques par le biais d'alarmes (tachycardie, bradycardie, arythmie, arrêt cardiaque...) et mesurer la fréquence cardiaque. Le monitorage n'est cependant pas aussi précis que l'électrocardiogramme (ECG) pour détecter les anomalies de conduction, d'oxygénation et de contraction.
- Fréquence respiratoire (FR)
- Mesure automatique de la fréquence respiratoire permettant d'alerter en cas d'apnée ou de polypnée.
- Pression artérielle (PA)
- Permet de détecter des anomalies comme l'hypotension, l'hypertension artérielle ou un collapsus cardiovasculaire. Elle peut être mesurée de manière discontinue par un brassard à tension qui se gonfle de manière régulière en fonction du besoin de surveillance, ou de façon continue via un cathéter artériel (elle peut alors être appelée PA sanglante) inséré dans l'artère radiale ou fémorale.
- L'oxymétrie colorimétrique (SpO2)
- Saturation en O2 (ou « sat ») : pourcentage de l'oxyhémoglobine. Elle dépend de la pression partielle en O2 du sang artériel. Elle a pour but de surveiller les fonctions respiratoires et de détecter une désaturation.
- La température
- Permet d'avoir de manière continue (sonde) ou discontinue (thermomètre) le reflet de la thermorégulation et de l'état infectieux du patient.
- La pression veineuse centrale (PVC)
- Permet d'avoir grâce à l'insertion d'un cathéter veineux central le reflet du remplissage vasculaire du patient (pression dans la veine cave supérieure au confluent de l'oreillette droite).
- Autres
- La pression intracrânienne (PIC) : un capteur est inséré à l'intérieur de la boîte crânienne par un trou de trépan.
- Le débit cardiaque (QC), l'index cardiaque (IC), etc. : calcul via un moniteur spécial de certains paramètres cardiaques grâce à l'association d'un cathéter artériel et d'un cathéter veineux central pour certaines mesures hémodynamiques avancées.
- Etc.
Autres surveillances
Bien que beaucoup de constantes soient monitorées, l'observation clinique du patient reste un aspect fondamental de la surveillance en réanimation.
- Surveillance clinique
- Surveillance neurologique
- Pour un patient conscient ou inconscient, différentes échelles de notation sont utilisées, associant l'état d'éveil, la douleur, l'adaptation au respirateur et la réponse aux ordres simples (Glasgow, etc.). D'autres échelles sont utilisées lorsque le patient est sédaté, pour évaluer l'efficacité de la sédation et de l'analgésie (Ramsay, RASS, BPS, etc.).
- Surveillance du réflexe pupillaire avec évaluation de la taille des pupilles, de leur réactivité et de leur symétrisme.
- Surveillance de la motricité des membres chez les patients conscients ou semi-conscients.
- Dans les comas et les traumatismes crâniens, surveillance de la présence / absence des réflexes du tronc cérébral (échelle de Liège).
- Évaluation de la douleur par le patient grâce à l'échelle visuelle analogique (EVA), l'échelle visuelle numérique (EVN), etc., ou hétéroévaluation (par le soignant) par la Behavioral Pain Scale (BPS), etc.
- Surveillance volémique
- La diurèse est évaluée à intervalle régulier afin de dépister la survenue d'une insuffisance rénale (anurie, oligoanurie) ou pouvoir éventuellement compenser des pertes trop importantes.
- De plus, un bilan entrées / sorties doit être réalisé au moins une fois par jour pour avoir un reflet d'un trop grand apport hydrique ou d'une trop grande perte volumique.
- Surveillance de la présence d'œdèmes.
- Surveillance glycémique
- De façon systématique chez les patients diabétiques et chez les patients non-diabétiques (la pathologie peut entraîner des dérèglements hormonaux, notamment sur la production d'insuline) : prévention de la survenue d'hypoglycémie / hyperglycémie.
- Surveillance biologique
- Bilans sanguins réguliers (une ou plusieurs fois par jour pour les patients aigus, différents selon la pathologie) : ionogramme (natrémie, kaliémie, calcémie…), bilan hépatique (bilirubine, lipides, ASAT/ALAT…), bilan rénal (créatinine, urée…), marqueurs infectieux (CRP, PCT…), enzymes cardiaques (troponine, NT-pro BNP…), hémogramme (hémoglobine, hématocrite, plaquettes, VGM…), bilan de coagulation (TP, héparinémie, INR…), etc.
- Gazométries : PaO2, PaCO2, saturation sanguine (SaO2), pH sanguin, bicarbonates (HCO3−).
- Bilans bactériologiques : hémocultures, examen cytobactériologique des urines (ECBU), prélèvements divers (coproculture, prélèvement de crachats ou pulmonaire, recherche de bactéries multirésistantes…).
- Surveillance des drainages
- Les drainages sont nombreux et dépendent de la pathologie du patient. Ils peuvent être aspiratifs (dépression qui aspire le liquide hors du corps) ou non.
- Drainages thoraciques (en cas de pneumothorax, hémothorax, épanchement pleural, etc.) : drain pleural, etc.
- Drainages cérébraux (en cas d'évacuation de collection à l'intérieur des ventricules cérébraux) : drain ventriculaire externe (DVE), etc.
- Drainages digestifs.
- Redons postopératoires (permet de collecter le liquide (sang notamment) qui peut suivre une chirurgie) : la localisation dépend de la chirurgie.
- Sondes diverses (gastrique, urinaire, rectale, etc.).
- Etc.
Respirateur

Le respirateur (ou ventilateur) est un élément constant, présent dans toutes les chambres de réanimation[37].
- Intubation
- Orotrachéale (par la bouche jusque dans la trachée).
- Nasotrachéale (par le nez jusque dans la trachée).
- Trachéotomie (ouverture dans la trachée sous le larynx).
- Masques
- Masque laryngé.
- Masque nasal, bucconasal ou facial (pour VNI).
- Paramètres
- Réglage du mode ventilatoire : ventilation contrôlée ; ventilation contrôlée à régulation de pression ; aide inspiratoire (AI) ; ventilation non invasive (VNI) ; etc.
- Réglage des paramètres ventilatoires : volume, fréquence, fraction inspiratoire en oxygène (FiO2), pression expiratoire positive (PEP ou PEEP), seuil de déclenchement (trigger), etc.
- Réglage des alarmes : pressions, fréquence, ventilation minute (spirométrie), apnée (en AI).
Autres équipements
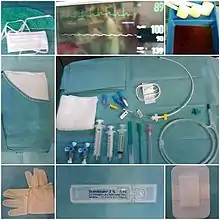
La plupart des patients de réanimation sont « conditionnés » avec des matériels spécifiques :
- Un cathéter artériel (KTA ou Artériocath) : en radial ou en fémoral pour la prise de la pression artérielle sanglante et mesure de la pression artérielle moyenne (PAM)
- Une voie veineuse centrale (VVC ou KTC) : en jugulaire interne, sous-clavière, brachial ou fémoral pour l'administration des thérapeutiques sur 1 à 6 voies (chacune étant indépendante[38])
- Ou une (ou plusieurs) voie veineuse périphérique (VVP) : une seule voie par cathéter
- Une sonde urinaire (SAD, « sonde à demeure »)
- Une sonde naso-gastrique (SNG) : sonde insérée par le nez qui descend jusque dans l'estomac pour la vidange gastrique ou l'alimentation entérale
- Etc.
Selon les pathologies, des équipements / machines peuvent être rajoutés, tels que (non exhaustif) :
- Une dialyse ou épuration extrarénale : en cas d'insuffisance rénale
- Un ballon de contre-pulsion intra-aortique (CPIA) : en cas de choc cardiogénique consécutif à un infarctus du myocarde, d’insuffisance cardiaque réfractaire ou de rupture de pilier / cordage valvulaire
- Une extra-corporeal membrane oxygenator (ECMO) : circulation extracorporelle de suppléance pulmonaire en cas d'insuffisance respiratoire majeure (SDRA) non traitable par les moyens traditionnels : respirateur, monoxyde d'azote (NO), etc.
- Une extra-corporeal life support (ECLS) : circulation extracorporelle de suppléance cardiovasculaire en cas de défaillance cardiaque majeure (insuffisance cardiaque grave associée avec une défaillance hémodynamique, hypothermie, intoxication médicamenteuse) non traitables par les moyens traditionnels : cardiotoniques, CPIA, etc.
- Un cathéter de Swan-Ganz : cathétérisme de l'artère pulmonaire pour un monitorage des paramètres cardiaques (pressions)
- Un monitorage hémodynamique par télémesure : en cas de défaillance hémodynamique afin d'avoir un contrôle en temps réel sur l'état cardiaque du patient
- Un accélérateur de fluides : en cas de choc hypovolémique ou hémorragique
- Un réchauffeur de fluides : en cas d'hypothermie
- un refroidisseur corporel interne ou externe : en cas d'arrêt cardiaque ou d'affection neurologique nécessitant de maintenir la température corporelle en dessous de la normothermie (33 °C pour l'ACR)
- Un stimulateur cardiaque (pace-maker) : en cas de bradycardie sévère et chronique
- Un défibrillateur interne ou externe : en cas de tachycardie/fibrillation ventriculaire
- Un capteur de pression intracrânienne (PIC) : en cas de HTIC pour le monitorage de la pression régnant à l'intérieur du crâne et l'adaptation de la pression artérielle par mesure de la pression de perfusion cérébrale (PPC = PAM - PIC)
- Un index bispectral (BIS) : mesure par le biais d'électrodes collées sur le front de l'activité électrique cérébrale (sorte d'EEG continu) et noté de 0 (pas d'activité) à 100 (réveillé)
- Etc.
Traitements
En plus des équipements de maintien des fonctions vitales évoqués précédemment, de nombreux traitements sont utilisés en réanimation, parmi lesquels :
- Analgésiques (éliminent la douleur)
- Antalgiques (diminuent la douleur)
- Antiarythmiques
- Antibiotiques
- Antihypertenseurs (bêta-bloquants, IEC, ARA II, inhibiteurs calciques)
- Antithrombotiques (anticoagulants, antiagrégants, thrombolytiques)
- Cardiotoniques
- Catécholamines (en fonction de l'effet recherché : inotrope, chronotrope, bathmotrope, dromotrope, vasoconstriction, vasodilatation, bronchodilatation, etc. ; principalement la noradrénaline et l'adrénaline)
- Curares (dépolarisant et non-dépolarisant)
- Diurétiques
- Électrolytes (KCl, NaCl, CaCl, SO4Mg, etc.)
- Perfusions (continues ou discontinues, injections itératives)
- Produits sanguins labiles (concentrés de globules rouges (CGR), concentrés de plaquettes, plasma frais congelé (PFC)
- Sédatifs (barbituriques, benzodiazépines, hypnotiques)
- Solutés de remplissage (solutions isotoniques, macromolécules, cristalloïdes, médicaments dérivés du sang)
La surveillance du patient concerne aussi l'apparition des effets secondaires, nombreux et dangereux étant donné les produits utilisés.
D'autres techniques thérapeutiques peuvent aussi être utilisées pour le traitement ou la prévention de certaines pathologies / affections :
- Les latéralisations (prévention de l'apparition d'escarres et traitement / prévention de l'atélectasie pulmonaire)
- Le décubitus ventral (en cas de SDRA, oxygénation des bases pulmonaires)
- Etc.
Réglementation
En France, l'activité de réanimation est encadrée par divers décrets publiés dans le Code de la santé publique[39] :
- Le décret n° 2002-465 du 5 avril 2002 relatif aux établissements de santé publics et privés pratiquant la réanimation et modifiant le Code de la santé publique[40].
- Le décret n° 2002-466 du 5 avril 2002 relatif aux conditions techniques de fonctionnement auxquelles doivent satisfaire les établissements de santé pour pratiquer les activités de réanimation, de soins intensifs et de surveillance continue et modifiant le code de la santé publique[40].
- Le décret n° 2006-72 du 24 janvier 2006 relatif à la réanimation dans les établissements de santé et modifiant le code de la santé publique[29].
- Le décret n° 2006-74 du 24 janvier 2006 relatif aux conditions techniques de fonctionnement auxquelles doivent satisfaire les établissements de santé pour pratiquer les activités de réanimation pédiatrique et de surveillance continue pédiatrique[41].
Les unités de réanimation :
- [2002-465] Art. R. 712-90 : Sont destinées à des patients qui présentent ou sont susceptibles de présenter plusieurs défaillances viscérales aiguës mettant directement en jeu le pronostic vital et impliquant le recours à des méthodes de suppléance.
- [2002-465] Art. R. 712-95 :
- Assurent vingt-quatre heures sur vingt-quatre, tous les jours de l'année, l'accueil et la prise en charge diagnostique et thérapeutique ainsi que la surveillance des patients visés à l'article R. 712‑90.
- Assurent la sécurité et la continuité des soins en organisant le retour et le transfert des patients dans les unités de surveillance continue ou toute autre unité d'hospitalisation complète dès que leur état de santé le permet. À cet effet, les établissements exerçant les activités de réanimation passent des conventions avec d'autres établissements possédant ces unités afin de définir les modalités permettant d'y transférer les patients.
- [2002-466] Art. D. 712-104 : L'unité de réanimation dispose de locaux distribués en trois zones :
- Une zone d'accueil, située en amont de la zone technique et de la zone d'hospitalisation, permettant le contrôle desflux entrants de personnels, de malades, de visiteurs et de matériels ;
- Une zone d'hospitalisation ;
- Une zone technique de nettoyage, de décontamination et de rangement de matériel.
- [2002-466] Art. D. 712-106 : Dans toute unité de réanimation, la permanence médicale est assurée par au moins un médecin membre de l'équipe médicale dont la composition est définie à l'article D. 712-108 […].
- [2002-466] Art. D. 712-108 : L'équipe médicale d'une unité de réanimation comprend :
- Un ou plusieurs médecins qualifiés compétents en réanimation ou titulaires du diplôme d'études spécialisées complémentaire de réanimation médicale lorsqu'il s'agit d'une unité à orientation médicale ou médicochirurgicale ;
- Un ou plusieurs médecins qualifiés spécialistes ou compétents en anesthésie-réanimation ou qualifiés spécialistes en anesthésiologie-réanimation chirurgicale lorsqu'il s'agit d'une unité à orientation chirurgicale ou médicochirurgicale ;
- Le cas échéant, un ou plusieurs médecins ayant une expérience attestée en réanimation selon des modalités précisées par arrêté du ministre chargé de la santé.
- L'équipe médicale d'une unité de réanimation pédiatrique comprend, en outre, un ou plusieurs médecins qualifiés spécialistes en pédiatrie.
- [2002-466] Art. D. 712-109 : Sous la responsabilité d'un cadre infirmier, l'équipe paramédicale d'une unité de réanimation comprend au minimum :
- Deux infirmiers pour cinq patients ;
- Un aide-soignant pour quatre patients ;
- L'équipe paramédicale d'une unité de réanimation pédiatrique comprend, en outre, au moins une puéricultrice.
- [2002-466] Art. D. 712-110 : L'établissement de santé doit être en mesure de faire intervenir en permanence un masseur-kinésithérapeute justifiant d'une expérience attestée en réanimation et doit disposer, en tant que de besoin, d'un psychologue ou d'un psychiatre et de personnel à compétence biomédicale.
Les unités de soins intensifs :
- [2002-466] Art. D. 712-112 : Les soins intensifs sont pratiqués dans les établissements de santé comprenant une ou plusieurs unités organiséespour prendre en charge des patients qui présentent ou sont susceptibles de présenter une défaillance aiguë de l'organe concerné par la spécialité au titre de laquelle ils sont traités mettant directement en jeu à court terme leur pronostic vital et impliquant le recours à une méthode de suppléance.
Les unités de surveillance continue :
- [2002-466] Art. D. 712-125 : La surveillance continue est pratiquée dans les établissements de santé comprenant une ou exceptionnellement plusieurs unités, si la taille de l'établissement le justifie, organisées pour prendre en charge des malades qui nécessitent, en raison de la gravité de leur état, ou du traitement qui leur est appliqué, une observation clinique et biologique répétée et méthodique.
Notes et références
- Peter Szmuk, Tiberiu Ezri, Shmuel Evron, Yehudah Roth et Jeffrey Katz, « A brief history of tracheostomy and tracheal intubation, from the Bronze Age to the Space Age », Intensive Care Medicine, vol. 2, no 34, , p. 222–228 (DOI 10.1007/s00134-007-0931-5, lire en ligne, consulté le )
- Sandrine Poirson-Sicre, La médecine d'urgence préhospitalière à travers l'histoire, Glyphe & Biotem éditions, , p. 111.
- (en) RV Trubuhovich, « History of mouth-to-mouth rescue breathing. Part 1: the 18th century », Crit Care Resusc., vol. 7, no 3, , p. 250 (lire en ligne).
- Jean-Bernard Cazalaà, David Baker, Marie-Thérèse Cousin, Les instruments d'anesthésie et de réanimation, Éd. Glyphe, , p. 94.
- Anton Serdeczny, Du tabac pour le mort. Une histoire de la réanimation, Champ Vallon, , 390 p. (lire en ligne).
- Joseph Rechtman, « William Buchan (1729-1805). Le bouche à bouche et le massage cardiaque externe », Histoire des Sciences médicales, t. XIII, no 3, , p. 292 (lire en ligne).
- [PDF] (en) Sarah Marsh, « The Evolution of Critical Care Outreach », sur Association of Anaesthetists of Great Britain and Ireland (consulté le )
- Jean-Louis Vincent, « Critical care - where have we been and where are we going? », Critical Care, vol. 1, no 17, (DOI 10.1186/cc11500, lire en ligne, consulté le )
- [PDF] (en) Louise Reisner-Sénélar, « The birth of intensive care medicine: Björn Ibsen’s records, Intensive Care Medicine », (consulté le )
- [PDF] (en) Louise Reisner-Sénélar, « The Danish anaesthesiologist Björn Ibsen a pioneer of long-term ventilation on the upper airways », (consulté le )
- Björn Ibsen, Tone Dahl Kvittingen, Le travail en unité d'observation d'anesthésie (Arbejdet på en Anæsthesiologisk Observationsafdeling), 18 septembre 1958.
- En France, il est encadré par le décret du 5 avril 2002
- « Gros écart entre le tarif et le coût réel en réa », sur www.infirmiers.com, (consulté le ).
- « La Réanimation en France - Organisation et structures », SRLF (consulté le ).
- (en) Neil A. Halpern, Stephen M. Pastores et Robert J. Greenstein, « Critical care medicine in the United States 1985–2000: An analysis of bed numbers, use, and costs », Critical Care Medicine, vol. 32, no 6, , p. 1254–1259 (PMID 15187502, DOI 10.1097/01.CCM.0000128577.31689.4C)
- En anglais, ces neuf systèmes sont appelés the nine key intensive care systems (« les neuf systèmes clés de réanimation »).
- Le système indiqué est le système qui est le plus mis en jeu lors de l'apparition du trouble, mais plusieurs systèmes peuvent être touchés.
- Aubert et Carpentier 2009, p. 115.
- Aubert et Carpentier 2009, p. 142.
- Aubert et Carpentier 2009, p. 132.
- Aubert et Carpentier 2009, p. 155.
- Aubert et Carpentier 2009, p. 183.
- Aubert et Carpentier 2009, p. 178.
- Aubert et Carpentier 2009, p. 171.
- Aubert et Carpentier 2009, p. 159.
- Aubert et Carpentier 2009, p. 195.
- Aubert et Carpentier 2009, p. 150.
- « Décret n° 2002-466 du 5 avril 2002 relatif aux conditions techniques de fonctionnement auxquelles doivent satisfaire les établissements de santé pour pratiquer les activités de réanimation, de soins intensifs et de surveillance continue et modifiant le code de la santé publique », sur Legifrance, (consulté le ).
- « Décret n° 2006-72 du 24 janvier 2006 relatif à la réanimation dans les établissements de santé et modifiant le code de la santé publique », sur Legifrance, (consulté le ).
- « Organisation des réanimations », SRLF, (consulté le ).
- (en) CA Manthous CA, Amoateng-Adjepong Y, al-Kharrat T, Jacob B, Alnuaimat HM, Chatila W, Hall JB., Y Amoateng-Adjepong, T Al-Kharrat, B Jacob, HM Alnuaimat, W Chatila et JB Hall, « Effects of a medical intensivist on patient care in a community teaching hospital », Mayo Clinic Proceedings, vol. 72, no 5, , p. 391–9 (PMID 9146680, DOI 10.4065/72.5.391)
- (en) 3rd Hanson CW 3rd, Deutschman CS, Anderson HL 3rd, Reilly PM, Behringer EC, Schwab CW, Price J., CS Deutschman, 3rd Anderson Hl, PM Reilly, EC Behringer, CW Schwab et J Price, « Effects of an organized critical care service on outcomes and resource utilization: a cohort study », Critical Care Medicine, vol. 27, no 2, , p. 270–4 (PMID 10075049, DOI 10.1097/00003246-199902000-00030)
- « Référentiel de compétences de l’infirmière de réanimation », SRLF (consulté le ).
- Aubert et Carpentier 2009.
- « DU, DIU, autres », SFAR (consulté le ).
- « DU /DIU spécifiques aux paramédicaux exerçant en réanimation », SRLF (consulté le ).
- Aubert et Carpentier 2009, p. 211.
- Cela permet la perfusion de produits qui ne se mélangent pas et d'éviter les bolus de catécholamine comme la noradrénaline, l'adrénaline, etc.
- « Code de la santé publique - Réanimation », sur Legifrance (consulté le ).
- « Décret n° 2002-465 du 5 avril 2002 relatif aux établissements de santé publics et privés pratiquant la réanimation », SNMRHP, France, (consulté le ).
- « Décret n° 2006-74 du 24 janvier 2006 relatif aux conditions techniques de fonctionnement auxquelles doivent satisfaire les établissements de santé pour pratiquer les activités de réanimation pédiatrique et de surveillance continue pédiatrique », sur Legifrance, (consulté le ).
Voir aussi
Bibliographie
- Anton Serdeczny, Du tabac pour le mort, une histoire de la réanimation, préface de Jean-Claude Schmitt, Editions Champ Vallon, 2018
Articles connexes
Liens externes
- Médecine :
- Société française d'anesthésie et de réanimation
- Société de réanimation de langue française
- (en) Society of Critical Care Medicine (États-Unis)
- (en) European Society of Intensive Care Medicine (Europe)
- (en) Intensive Care Society (Royaume-Uni)
- (en) Scottish Intensive Care Society (Écosse)
- (en) Canadian Critical Care Society (Canada)
- (en) College of Intensive Care Medicine (Australie et Nouvelle-Zélande)
- (pt) Sociedade Brasileira de Terapia Intensiva (Brésil)
- (zh) Chinese Society of Critical Care Medicine (Chine)
- (en) Hong Kong Society of Critical Care Medicine (Hong Kong)
- Soins infirmiers :
- Société française des infirmiers de soins intensifs
- (en) American Association of Critical-Care Nurses (États-Unis)
- (en) British Association of Critical Care Nurses (Royaume-Uni)
- (en) Canadian Association of Critical Care Nurses (Canada)
- (en) Australian College of Critical Care Nurses (Australie)
- (en) New Zealand College of Critical Care Nurses (Nouvelle-Zélande)
Autres :
- (en) [vidéo] From Iron Lungs to Intensive Care, entretien sur les origines de la réanimation sur le site de la Royal Institution