Legionella pneumophila
Legionella pneumophila est une bactérie intracellulaire facultative parasitant les monocytes humains et certains protistes phagotrophes (ex/ amibes) retrouvés dans les eaux douces.
| Règne | Bacteria |
|---|---|
| Embranchement | Proteobacteria |
| Classe | Gammaproteobacteria |
| Ordre | Legionellales |
| Famille | Legionellaceae |
| Genre | Legionella |
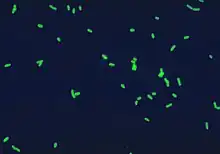
Description
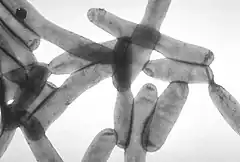
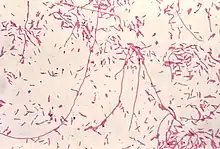
Ces bactéries sont des bacilles à Gram négatif, mobiles grâce à la présence d'un ou plusieurs flagelles. Elles sont retrouvées de manière ubiquitaire dans les environnements d'eau douce et dans les terres humides. La taille des légionnelles varie de 0,5 - 0,8 à 2 - 5 μm[1].
Pathologie
Les légionelles peuvent entraîner trois formes de maladies regroupées sous le terme de légionellose :
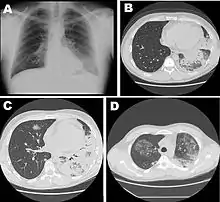
- La maladie du légionnaire, qui est une forme grave d’infection respiratoire. La maladie a été pour la première fois décrite et nommée en 1976, à la suite de la contamination de 181 personnes à Philadelphie au cours d’une convention de la légion américaine (en)[2]. La mortalité dépend de la gravité de la maladie et de la rapidité de la prise en charge. En France, l’institut de veille sanitaire rapporte que 10 à 20 % des cas sont contractés dans les hôpitaux. Pour les cas nécessitant une hospitalisation (99 %), un taux de mortalité de 15 à 20 % est observé. Aux États-Unis, le taux de mortalité, parmi les cas d’infection nosocomiale, atteint 40 %[3]. La maladie du légionnaire ne peut pas être radiologiquement ou cliniquement différenciée des autres pneumonies et requiert une analyse microbiologique pour permettre d’établir le diagnostic avec certitude[4].
- La fièvre de Pontiac qui est une forme bénigne de la Légionellose (95 % des cas)
- Une manifestation extrapulmonaire de la légionellose. Ce type de manifestation est rare et prédomine chez les patients immunodéprimés. Il peut s'agir d'atteintes neurologiques (encéphalite, neuropathie périphérique, polyradiculonévrite, abcès cérébraux, etc.), d'atteintes cardiaques (péricardite, myocardite, endocardite sur prothèse), d' atteintes digestives (péritonite, pancréatite, entérocolite nécrosante, abcès hépatique), d'atteintes rénales (pyélonéphrite, abcès rénal), d'atteintes musculaires, d'atteintes cutanées de type cellulite et abcès et d' atteintes articulaires.

Les Légionelles représenterait 6 % des pneumonies, soit pour les 500 000 pneumonies ambulatoires recensées en 2004 en Allemagne, il faudrait compter 30 000 cas imputables directement aux Légionelles[5].
En 2004, 475 légionelloses ont été diagnostiquées en Allemagne soit 20 % de plus que l’année précédente. Cela est vraisemblablement en partie dû à l’amélioration et le recours plus systématique aux procédés de détection. L’âge et le sexe des cas observés montrent, en concordance avec les observations des années passées, que les malades sont principalement des adultes en particulier des hommes âgés alors que les enfants et les jeunes adultes ne sont guère, voire pas, affectés. Un âge avancé représente, en raison vraisemblablement d’une faible immunité ou d’autres maladies préexistantes, un risque pour la contraction de la maladie du légionnaire. La différence constatée entre les sexes est, jusqu'à présent, restée inexpliquée[6].
Facteurs de multiplication, de survie et de virulence
Les Légionelles sont tolérantes aux milieux acides. Elles ont ainsi pu être observées dans des milieux possédant des pH allant de 2,7 à 8,3, dans des sources d’eau salée ou encore dans des nappes phréatiques dont la température était inférieure à 20 °C[3]. L’étude de l’influence de la température sur le développement de bactéries L. pneumophila de trois souches différentes a permis de définir l’intervalle de température optimal de croissance autour de 42 °C avec une absence de multiplication pour des valeurs supérieures à 44 - 44,2 °C[7]. Des Légionelles ont été observées dans des systèmes d’eau chaude dont la température s’élevait à plus de 66 °C. L’observation d’une production de dioxyde de carbone pour des températures allant jusque 51,6 °C suggère que certains enzymes respiratoires des Légionelles survivent encore à ces températures. Elles peuvent être exposées à des températures de 50 °C pendant plusieurs heures sans être détruites[3]. La température influence également la mobilité et la résistance en modifiant la formation des pili et des flagelles. Cela signifie qu’elle a un impact direct sur la virulence de L. pneumophila[8].
Un certain nombre d’autres variables affecte les Légionelles. L’étude statistique d’eau de réservoir d’eau potable corroborée à la présence et le cas échéant le degré de contamination a permis d’établir ces paramètres. Ainsi, l’augmentation de la dureté de l’eau et de sa conductivité, la présence de volume de stockage et de douches influencent positivement la présence et la croissance des Légionelles. De même, une augmentation du pH coïncide significativement avec une augmentation simultanée de la fréquence de colonisation observée. A contrario, une augmentation de la température au-dessus de 50 °C entraîne une diminution des observations de Légionelles[9] - [10]. Ces paramètres ont une influence variable suivant les souches de Légionelles[11].
La qualité de l’eau a, elle aussi, une influence déterminante sur la survie des Légionelles. Il est en effet démontré que des Légionelles s’étant développées dans une eau faiblement chargée en éléments nutritifs présentent une résistance accrue à l’action désinfectante du chlore[12]. Une eau pure ne permet pas aux Legionella pneumophila de proliférer. Elles y survivent mais ne se multiplient pas. Les acides aminés sont l’élément nutritif principal requis pour la croissance des Légionelles[3]. Les Légionelles ont également besoin de sels de fer dissous qui sont presque toujours présents sous forme de produit d’oxydation ou présents dans l’eau utilisée pour produire l’eau potable[13]. De plus, les concentrations en fer, zinc et potassium favorisent la croissance des L. pneumophila ce qui sous entend que la nature des canalisations et leur produit de corrosions peuvent être des éléments importants dans leur développement[14]. De même, la turbidité doit être prise en compte. En effet, les particules contenues dans l’eau et dont le diamètre est supérieur à 7 μm peuvent protéger les bactéries coliformes de l’action du chlore[15].
La comparaison entre les souches de Légionelles issues de sujet atteint de légionelloses et de souches prélevées dans différents environnements, montre qu’il existe une différence de répartitions. Les Legionella pneumophila représentent 43 % des Légionelles que l’on peut trouver dans l’environnement alors qu’elles sont détectées dans 96 % des cas d’infections humaines. Parmi ces Legionella pneumophila infectieuses, 88 % appartiennent au serogroupe 1 contre 43 % en règle générale. Enfin, 79 % appartiennent au sous groupe mAb2+, lorsque ce rapport est de seulement 43 % dans les prélèvements dans l’environnement. Ces observations permettent d’affirmer que certaines souches de Légionelles sont plus pathogènes pour l’homme que d’autres[16].
Plusieurs organismes, incluant des protozoaires, des algues et certaines bactéries autres que les Légionelles, ont montré, lors de tests en laboratoires, qu’ils favorisaient la croissance, à des degrés divers, des Legionella pneumophila[17].
Parasitisme des amibes
Les contaminations de réseau d’eau potable par les légionelles sont statistiquement corrélées à la présence d’amibes[9]. Les Legionella pneumophila peuvent, en effet, être des parasites intracellulaires. Les Légionelles sont ainsi susceptibles de parasiter des amibes et de se multiplier à l’intérieur. Elles peuvent se multiplier dans 17 espèces d’amibes différentes[3] - [18]. Il semble que leurs mécanismes d’infection aient évolué et contribuent à privilégier certains protozoaires plus que d’autres et en particulier Acanthamoeba, Naegleria et Hartmanella spp[18]. Leur capacité à se multiplier à l’intérieur des amibes reste dépendante de la température. Une étude rapporte que le nombre d’espèces supportant leur multiplication est sensiblement inférieur à 42 °C qu’à 35 °C et qu’à 45 °C aucun des six échantillons d’amibes étudiés dans le cadre de cette étude n’autorisait une augmentation du nombre de Légionelles[17].
Les Légionelles trouvent au sein de ces protozoaires une protection contre l’action des désinfectants. Les Legionella pneumophila infectant des kystes de d’Acanthamoeba polyphaga peuvent même résister à des concentrations de plus de 50 mg/l de chlore[19]. Ces Protozoaires peuvent être issus de cours d’eau, d’eau stagnante ou encore de réservoirs d’eau potable. Ils peuvent donc servir de refuge aux Légionelles et leur permettre ainsi de survivre également à des modifications du milieu telles qu’une dessiccation ou encore une modification de la température devenant moins propice à leur multiplication.
Une étude a montré que les Légionelles qui ressuscitaient après être passées en état VBNC (Viable But Non-Culturable) présentaient une plus forte résistance contre l’action antimicrobienne du cuivre et de l’argent[20]. Les L. pneumophila issues des protozoaires sont courtes, épaisses et hautement mobiles. Elles possèdent une paroi épaisse et lisse, expriment différentes protéines et gènes. Elles possèdent, par exemple, une concentration en b-hydroxybutyrate plus élevée. Toutes ces modifications entraînent une résistance plus importante aux antibiotiques et biocides, une capacité de pénétration des cellules de mammifères supérieure et une virulence accrue[8]. Des études ont montré que les Légionelles dépourvues de flagelles étaient moins aptes à infecter les protozoaires et les macrophages que leurs congénères qui en étaient munies[3]. Les flagelles influent notamment la mobilité. Or, les lignées issues des amibes sont hautement mobiles. Cette propriété est présumée faciliter la contamination et est corrélée à l’expression d’autres traits virulents. Des Légionelles issues d’amibes exposées pendant 24 heures à 5 μg/ml de rifampin (antibiotique) survivent à 71 % lorsque leurs congénères s’étant développées librement périssent à 99,9 %. Les germes issus du parasitisme d’amibes sont donc non seulement plus résistants aux agents antimicrobiens mais également plus virulents[8].
Le parasitisme pourrait être, par le renforcement de la virulence et de la résistance des Légionelles, une première étape nécessaire avant la contamination humaine [21]. Le nombre de germes n’est ainsi donc pas le seul facteur relevant pour provoquer une infection mais également « le vécu » du germe[22].
La virulence des Légionelles est liée à leur capacité de prolifération dans l’hôte où elles infectent de façon opportuniste les cellules phagocytaires. La façon dont elles infectent les macrophages est la même que pour les amibes[17]. L’infection n’est pas seulement liée à la virulence et au nombre de bactéries mais également à la prédisposition et à la sensibilité de l’organisme infecté[3] - [4] notamment la consommation de cigarettes, l’âge et en général les personnes au système immunitaire affaibli. L’infection de l’homme par les Légionelles est, du point de vue des Legionella pneumophila, irrémédiablement fatale. En effet, jamais une transmission d’homme à homme n’a pu être constatée[4]. Cela induit que les mutations permettant à Legionella pneumophila d’infecter et de parasiter les macrophages humains ne peuvent être transmises et disparaissent. La capacité de L. pneumophila à réaliser l’infection pulmonaire d’un hôte est donc la conséquence de la pression sélective exercée par les amibes qui sont une autre classe de phagocytes[8].
Les amibes qui croissent dans une eau à température élevée, tolèrent des températures plus hautes que des amibes issues d’une eau plus froide. Cela signifie que les amibes peuvent, dans une certaine mesure, s’accoutumer à leur environnement[23]. D’autres pathogènes profitent des amibes notamment Mycobacterium, Sarcobium, Vibrio, Pseudomonas, Burkholderia, Listeria, ou encore Francisella[8]. Un parasitisme des protozoaires par Campylobacter jejuni (bactérie responsable d’infections alimentaires la plus répandue dans le monde) a également été observé[24].
Pour finir et souligner une fois de plus l’importance des relations bactérie/protozoaire : une souche inconnue de bactérie, s’apparentant aux Legionella et ne pouvant se multiplier uniquement que grâce à un parasitisme intracellulaire, a été découverte dans des réservoirs d’eau potable[25].
Biofilm
Le biofilm est un facteur important du développement de Legionella pneumophila. Le biofilm contient environ 95 % des microorganismes présents dans les réseaux d'eau[26]. Les micro-organismes forment le biofilm comme un mécanisme de protection contre les conditions défavorables du milieu telles que des températures extrêmes ou une faible concentration en éléments nutritifs. La rugosité de la surface sur laquelle se développe le biofilm joue un rôle essentiel. Le biofilm est constitué de polysaccharide sécrété par les cellules. Cette substance est une matrice de polysaccharide polyanionique hydraté produite par polymérase et rattachée aux composants lipopolysaccharide des cellules du mur[27]. À toutes les étapes de la formation du biofilm, des portions du film peuvent être arrachées par les turbulences du courant de l’eau et ainsi mettre en suspension les micro-organismes contenus dans le biofilm leur permettant de coloniser d’autres parties du système hydraulique. Le biofilm est un écosystème extrêmement complexe constitué de bactéries, d’algues, de fongi et de protozoaires[3].
Le biofilm facilite non seulement les échanges d’éléments nutritifs et gazeux mais aussi, protège les micro-organismes des biocides, des augmentations temporaires de température et des tentatives d’élimination physique en particulier sur les surfaces corrodées ou entartrées. Un biofilm peut se former aux interfaces eau-solide mais également aux interfaces eau-huile. Il se forme préférentiellement là où les vitesses sont moindres et où l’eau stagne. Les Légionelles présentes à l’intérieur du biofilm sont plus résistantes que celles sous forme planctonique. Les biofilms jouent un rôle clé dans la présence persistante des Légionelles pendant des conditions de stress[3] - [28]. Si les biofilms les protègent, les Legionella pneumophila ne semblent cependant pas capables de se multiplier massivement en leur sein. Une étude a ainsi montré que le développement des biofilms de Legionella pneumophila était curieusement dû principalement à la réplication des bactéries planctoniques[29].
La prévention de la formation de biofilm est une mesure déterminante contre la prolifération de Legionella pneumophila. En effet, lorsqu’un biofilm s’est formé, il est difficile de l’enlever, en particulier dans les systèmes de canalisations complexes. Les éléments favorisant l’apparition d’un biofilm sont : la présence de nutriments dans l’eau ou dans les éléments constitutifs du système, l’entartrage et la corrosion, les températures d’eau élevées, l’eau stagnante ou les faibles flux notamment dans les bras morts des réseaux de canalisations ou dans les cuves de stockage par exemple (et aussi les équipements surdimensionnés et/ou faiblement utilisés)[3]. L’accumulation de tartre, d’algues, de boues, de vase ou limons, de rouille et autres produits d’oxydation dans les systèmes d’adduction d’eau potable favorise la croissance de biofilms et de Legionella Pneumophila. L’entartrage et la corrosion augmentent la surface disponible et rendent possible la formation de micro niches protégées des produits désinfectants véhiculés par l’eau. Ils sont responsables d’une augmentation de la concentration en nutriments et en fer. Les croissances de biofilm incontrôlées peuvent même aller jusqu'à obstruer les canalisations. Il convient cependant de relativiser car les biofilms présent dans les réseaux d’eau potable sont le plus souvent très minces. La présence simultanée d’un biofilm et de protozoaires double l’effet protecteur pour les bactéries. Ils permettent l’augmentation de la charge organique et inactivent les concentrations résiduelles de désinfectant[3].
Les matériaux constituant les canalisations sont un facteur de développement du biofilm. Les matériaux synthétiques peuvent, par exemple, comporter des composés organiques qui peuvent fournir une source de nutriments pour les micro-organismes. Il a été observé que le polyéthylène réticulé était lié à des concentrations de biomasse deux à trois fois supérieures à celle observées dans les canalisations en acier inoxydable[30]. Certains caoutchoucs fournissent un substrat riche en nutriments, préférentiellement colonisés par les bactéries. Le cuivre présente une résistance à la colonisation, mais finit à terme par être aussi recouvert d’un biofilm et se corroder, et perd ainsi sa capacité de résistance aux micro-organismes[30]. L’étude de 452 échantillons d‘eau prélevés aléatoirement dans des résidences familiales des banlieues de deux villes allemandes a montré que les canalisations en cuivre n’avaient pas d’effet inhibiteur contre le développement des bactéries et qu’au contraire elles étaient plus fréquemment colonisées que les canalisations synthétiques ou en acier galvanisé[31]. Les matériaux métalliques sont plus sujets à la corrosion ce qui favorise la formation d’un bio film[3].
La contamination d’un système peut être due à une portion très réduite d’un système non exposée aux fluctuations thermiques et aux désinfections[3].
Les biofilms flottants sont aussi très fréquemment contaminés par les Légionelles et les amibes qui leur sont associées. Ces biofilms flottants permettent notamment aux L. pneumophila de coloniser des parties de réseau qui leur seraient normalement inaccessibles[32].
Une étude a mesuré un nombre de colonies bactériennes, dans un réseau expérimental, plusieurs fois plus élevé après une désinfection (dioxyde de chlore) qu’auparavant et la présence persistante d’un biofilm que la désinfection n’a donc pas permis de détruire. Cela montre qu’une désinfection insuffisante peut superficiellement endommager le biofilm et entraîner la libération de micro-organismes dans le système[33].
Moyen de lutte contre Legionella pneumophila
Désinfection
Tout exploitant d’un établissement mettant de l’eau à la disposition du public est responsable de la protection des utilisateurs des installations face aux éventuels risques[34]. La désinfection d’une installation d’eau potable domestique est réservée aux cas de contamination accidentelle du réseau[26]. Le but d’une désinfection d’un système contaminé par les Légionelles est d’obtenir durablement moins de 100 UFC / 100 ml à chaque point de prélèvement[35].
On distingue deux types de désinfection. Les désinfections discontinues, qui procèdent par un traitement choc en coupant le circuit de la distribution et dont la durée de l’intervention est limitée dans le temps. L’eau ne répond alors plus aux normes relatives à la distribution d’eau potable. Le deuxième type de désinfection est la désinfection de type continue, qui consiste comme la première, à installer un dispositif sur le réseau injectant un désinfectant. Contrairement à une désinfection discontinue, une désinfection continue ne cherche pas à obtenir des résultats immédiats. La différence se situe également dans le fait que dans le choix d’une désinfection continue, il faut que l’eau traitée reste aux normes[36]. En effet, l’eau continue d’être utilisée et le réseau continu de fonctionner normalement. Le traitement n’est pas limité dans le temps, il est arrêté lorsque les résultats escomptés sont atteints. Les désinfections discontinues ne permettent souvent qu’une élimination éphémère des germes. Le contrôle des contaminations microbiennes requiert, en effet, le maintien d’une concentration résiduelle de désinfectant constante dans l’ensemble du réseau. Les amibes et en particulier les kystes d’amibes jouent le rôle de réservoir à Légionelles et permettent la recolonisation rapide des réseaux dès l’arrêt des désinfections. Des stratégies de traitement ayant pour cibles les amibes devraient, notamment, permettre d’améliorer le contrôle des Legionella pneumophila[37].
Désinfection thermique
De nombreuses études ont montré que la température minimale pour une désinfection par choc thermique était de 60 °C[38]. L’élévation de la température permet de tuer aussi efficacement les Légionelles qu'une exposition des bactéries aux ultraviolets et plus rapidement qu’une concentration de chlore à 4-6 mg/l ou d’ozone à 1-2 mg/l[39]. L’interruption de la recirculation d’une boucle de recirculation de l’eau chaude et l’augmentation de la température à plus de 60 °C n’a aucun impact sur les populations de Légionelles[31]. D’après la DVGW-Arbeitsblatt W 551, l’ensemble du réseau doit au minimum être désinfecté 3 minutes à 70 °C. Cette action présente le risque d’endommager les installations et d’entraîner une turbidité anormale[36]. La désinfection thermique présente également le risque d’entraîner des brûlures. Des cas mortels de brûlures dues à des réseaux d’eau chaude ont déjà été rapportés[4]. À la suite d'une mise en application d’une désinfection thermique, les auteurs d'une autre expérience rapportent que 5 minutes « de chasse » et de chauffage à plus de 60 °C ne sont pas suffisantes. Ils recommandent 30 minutes. Cette étude rapporte également que le nettoyage des robinets et des pommeaux de douche n’a eu aucune influence sur la contamination de Légionelles[40]. L’étude des effets d’une désinfection thermique sur des Légionelles intra protozoaire montre que 3 minutes à 70 °C ne suffisent pas, l’étude recommande 73 °C pendant 10 minutes pour pouvoir obtenir des résultats probants[33]. Les recommandations en France sont les suivantes : 30 minutes à 60 °C en tout point du réseau.
Désinfection chimique
Le type et la dose de désinfectant doivent être soigneusement sélectionnés en fonction de la situation. C'est-à-dire en prenant en considération les paramètres caractéristiques de l’eau pH, dureté, les teneurs en composés organiques et inorganiques[38].
Les agents désinfectant énumérés ci-après concernent des désinfections chimiques utilisées en continu et non des désinfections par traitement choc.
Cations d’argent et de cuivre
L’injection de cuivre ou d’argent est généralement interdite, par exemple, en Allemagne sauf dérogation accordée par la commission de l’eau potable de la BRD1[36]. Toutefois, de nombreuses études ont été menées sur l’utilisation des ions d’argent et de cuivre et les résultats intéressants méritent d’être cités.
Une étude du pouvoir bactéricide de l’argent s’est intéressée à la résistance de trois bactéries : Legionella pneumophila, Pseudomonas aeruginosa et Escherichia coli. C’est L. pneumophila qui a montré la plus forte tolérance à l’exposition aux cations d’argent[41]. Néanmoins, le recours aux cations d’argent et de cuivre semble permettre de lutter efficacement contre les Légionelles. La désinfection de deux hôpitaux contaminés par des Legionella pneumophila en est un exemple. Les cations ont été pour cela injectés de manière séquentielle dans la boucle de recirculation de l’eau chaude et ont permis d’éliminer les germes en 4 semaines dans le premier bâtiment et en 12 semaines dans le second hôpital. Il n’y a pas eu de recolonisation avant 6 - 12 semaines après la désactivation du dispositif dans le premier hôpital, et après 8 - 12 semaines dans le deuxième hôpital. Des concentrations significatives de cuivre ont été retrouvées dans le biofilm. Cela pourrait expliquer pourquoi il n’y a pas eu de recolonisation avant un certain laps de temps[42]. L’utilisation simultanée de cuivre et d’argent entraîne une efficacité multipliée comparativement à l’action de chaque métal pris individuellement. L’utilisation de ces métaux est une option viable pour les systèmes de recirculation d’eau chaude. Les concentrations résiduelles doivent être contrôlées du point de vue de la potabilité et de la possible action sur les eaux usées[38]. Une autre étude a montré que l’utilisation des ions cuivre-argent ne permettait pas d’éliminer le biofilm et qu'à la suite de l’arrêt du traitement, la recolonisation du réseau s’opérait systématiquement [37].
L’utilisation d’ionisateur de cuivre/argent requiert lors de son utilisation sur des grandes installations de multiplier les équipements, ce qui engendre un coût prohibitif[43].
Agents oxydants
Les oxydants sont les produits de désinfections les plus couramment utilisés[44].
Chlore et composés chlorés associés
Dissous dans l’eau, le chlore gazeux, l’hypochlorite de sodium et l’hypochlorite de calcium, le chlorure de chaux et le chlore produit à partir d’électrolyse d’ions chlorure agissent tous de la même manière, par la formation d’acide hypochloreux (HOCl)[45]. Le chlore est le désinfectant le plus utilisé mais en raison de sa propension à former des sous-produits de réactions toxiques (trihalomethanes, chloroforme…) d’autres réactifs sont utilisés. La dose autorisée est de 1,2 mg/l. En sortie de traitement de désinfection, la concentration résiduelle ne doit pas excédée 0,3 mg/l[44].
Les concentrations requises pour le contrôle des L. pneumophila sont de 2 à 6 mg/l (désinfection discontinue) lorsque les concentrations habituellement utilisés dans le traitement de l’eau potable sont de l’ordre de 1 mg/l[38]. Les limitations de l’utilisation du chlore sont essentiellement liées à l’apparition de sous-produits de réactions, notamment, les méthanes tri-halogénés (THM)[46].
Avec un pH inférieur à 7,6, le chlore est présent majoritairement sous forme d’acide hypochloreux HOCl. Pour un pH supérieur, c’est sous la forme d’ion hypochlorite ClO−. L’acide hypochloreux est plus biocide que l’ion hypochlorite[44] - [38]. Cela a pour effet de diminuer l’efficacité du chlore lorsque le pH augmente[46].
La température améliore sensiblement l’efficacité du chlore contre les Légionelles. Il a été ainsi constaté une réduction du nombre de bactéries plus importante, dans un temps plus restreint, pour une température de 43 °C contre 25 °C, pour les mêmes concentrations de chlore utilisées[39]. Dans les eaux contenant de l’ammoniac, le chlore réagit en formant des chloramines. Même avec des faibles concentrations, cela peut entraîner l’apparition d’odeurs et la diminution de la teneur en chlore libre[46].
Le chlore affecte les mécanismes respiratoires et de transport des bactéries ainsi que les acides nucléiques. Les Légionelles sont plus résistantes aux chlore que les E. coli et d’autres bactéries utilisées comme indicateur de contamination de l’eau. Les retours sur expériences permettent d’affirmer que le chlore permet de supprimer les Légionelles mais rarement de manière définitive sans doute en raison des refuges que constituent les biofilms[47] et les amibes[19] - [37].
Dioxyde de chlore
- Caractéristiques de la molécule et produits de réaction
Le dioxyde de chlore est un gaz explosif et instable en solution à partir d’une certaine concentration. Il ne peut par conséquent n’être utilisé qu’en solution d’une concentration maximale de 4 g/l de ClO2 et cela dans le but de minimiser les concentrations des émanations dans les volumes d’air au-dessus de la solution. Pour des raisons de sécurité et éviter les risques liés au transport, les solutions de dioxyde de chlore doivent être réalisées sur le lieu de leur utilisation.
Dans l’eau potable, les Chlorites ClO2- sont le produit de réaction prédominant du dioxyde de chlore. Ils correspondent à environ 50 à 70 % de la quantité de dioxyde de chlore ayant réagi. Le reste est converti en chlorates ClO3− et Chlorure Cl−[48]. La production des ions chlorites est indésirable. Les chlorites sont, en effet, considéré comme un poison du sang. Les chlorates sont également potentiellement dangereux pour la santé humaine. Il a été ainsi montré chez l’animal que les chlorites comme les chlorates endommageaient le sang par oxydation. De même, ils sont responsables de complications chez la femme enceinte[43]. Leur concentration maximale autorisée est, par conséquent, de 0,2 mg/l[46] - [44] et fait l’objet d’une référence qualité en France fixée à 0,2 mg/l. La concentration maximale de dosage est limitée à 0,4 mg/l en Allemagne[44] - [45].
Il existe plusieurs procédés de fabrication d’une solution de dioxyde de chlore. À la sortie du traitement, il doit rester 0,05 mg/L de dioxyde de chlore résiduel au minimum. Contrairement au Chlore, l’efficacité du dioxyde de chlore n’est pas aussi fortement dépendante du potentiel d’hydrogène. Même si une meilleure efficacité est notable pour des pH élevés[46] - [48]. Il ne réagit pas avec l’eau, mais uniquement avec son contenu. Cela signifie que le dioxyde de chlore est simplement dissout dans l’eau et non pas hydrolysé ou dissocié. Il est important de souligner que le dioxyde de chlore est en revanche peu stable et que cette stabilité est quant à elle fortement liée au pH, à la température ainsi qu’à l’exposition à la lumière[44].
L’utilisation du ClO2 est parfois préférée à celle du chlore car elle produit moins de substances organochlorées et pas de chloroformes. Ses qualités de désinfection ne dépendent pas de la présence d’ammoniac et il n’oxyde pas le bromure. Cependant, les concentrations autorisées en eau potable sont telles que la durée de vie du ClO2 est tout de même fortement dépendante de la qualité de l’eau. Il est pour cela souvent utilisé en complément d’une autre désinfection, en complément d’une désinfection au chlore par exemple[49].
Enfin, comme pour le chlore, les risques de corrosion doivent être pris en considération en particulier pour les réseaux en acier[50].
- Action sur les Légionelles
Plusieurs analyses de cas pratiques d’utilisation du dioxyde de chlore pour la désinfection de réseaux d’eau potable en milieu hospitalier confirment que le choix du dioxyde de chlore est approprié pour lutter contre les Légionelles. Il ressort de ces études que six mois minimum sont nécessaires avant d’observer une diminution importante des Légionelles. Les durées nécessaires observées pour l’élimination des Légionelles varient, le plus souvent, de 39 semaines à 6 ans (17 mois[4]). Une concentration supérieure à 0,1 mg/L est efficace pour éradiquer L. pneumophila et une concentration résiduelle comprise entre 0,3 et 0,5 mg/L est souhaitable (la limitation est de 0,2 mg/l en Allemagne). Les concentrations requises restent au-dessous des limitations de l’EPA contrairement à une hyperchloration par exemple[43] - [51] - [52] - [50].
Le dioxyde de chlore utilisé de manière continue, est rapporté par certains auteurs, comme étant le désinfectant le plus efficace pour contrôler Legionella pneumophila dans l’eau potable. Il est le seul permettant d’observer un effet dans les bras mort du réseau. Il permet de réduire significativement la flore microbienne notamment le biofilm[37].
Le dioxyde de chlore ne semble pas permettre une élimination complète des Legionella pneumophila. Cependant, il a démontré que cela n’est pas nécessaire et que seule une limitation de leur concentration suffit à prévenir de la Légionellose[52].
Il est difficile d’obtenir une concentration résiduelle satisfaisante dans le réseau d’eau chaude. Le fait d’ouvrir et de laisser couler les robinets et les douches régulièrement permet d’améliorer l’efficacité de la désinfection au dioxyde de chlore. Pour minimiser la réaction du dioxyde de chlore avec les composés organiques dissous dans l’eau, l’injection peut se réaliser à la sortie des cuves de stockage de l’eau chaude. Cela a pour effet de réduire le temps de contact du dioxyde de chlore avec l’eau et d’avoir des concentrations résiduelles plus hautes dans les canalisations où cela est souhaité[52] - [51] - [50].
Autres oxydants
Le Brome n’est pas utilisé pour la désinfection de l’eau potable. Reporté comme moins efficace que le chlore, il permet toutefois de maintenir les réseaux vierges de contaminations incontrôlées tant que la concentration résiduelle est maintenue[38].
L’iode a déjà été utilisé pour désinfecter l’eau potable. Cependant, peu d’informations sont disponibles quant à sa capacité de lutte contre les Légionelles[38].
L’eau oxygénée est une solution incolore et soluble dans l’eau. Elle se décompose en eau et oxygène. Sa dégradation est favorisée par la chaleur, la lumière, les matières en suspensions, les métaux lourds et les composés organiques. L’eau oxygénée en forte concentration peut produire des réactions dangereuses et ne doit en conséquence qu’être utilisée qu’en concentration maximale de 35 %[53].
Le peroxyde d’hydrogène et le permanganate de potassium sont des désinfectants moins puissants que le chlore et l’ozone et sont de ce fait peu utilisés. Le peroxyde d’hydrogène n’est pas autorisé en Allemagne pour la désinfection de l’eau potable. L’action désinfectante du permanganate de potassium est fortement dépendante du pH[38].
L’ozone possède une plus puissante capacité désinfectante ainsi que d’oxydation que le chlore ou le dioxyde de chlore. Cela oblige à toujours prendre en compte les réactions complexes que les composés dissous dans l’eau à traiter peuvent engendrer[46]. L’ozone réagit avec le bromure et forme des bromométhane et bromate dont la concentration maximale est limitée à 10 μg/L[46]. Il n’est pas influencé par la température et la présence d’une concentration de 4 à 6 mg/l de matières en suspension n’entrave pas son pouvoir désinfectant[39]. L’ozone est plus efficace que le chlore pour détruire les Légionelles mais il ne permet pas d’obtenir une désinfection résiduelle ce qui est un désavantage majeur par rapport au chlore ou au dioxyde de chlore dans le contrôle de L. pneumophila[38].
L’utilisation des Chloramines pour la désinfection de l’eau potable n’est pas autorisée en Europe. Les résultats d’expériences ci-après proviennent des États Unis d’Amérique.
- Halamine organique
Les Halamines ne peuvent pas être utilisés pour le traitement de l’eau potable. Les Halamines organiques peuvent être utilisés pour la désinfection contre les L. pneumophila et ce sous de larges conditions. Leur stabilité exceptionnelle les destine en particulier au traitement où cette propriété est requise tel que le traitement de circuit de refroidissement ou d’air conditionné. Les Halamines organiques ne sont pas corrosifs. Les Halamines combinés possèdent un grand potentiel pour le maintien de circuit fermé d’eau de refroidissement vierge de contamination aux Legionella pneumophila[54].
- Monochloramines
Une étude portant sur 2 ans a observé l’impact du changement de la désinfection de l’eau municipale en désinfection aux Chloramines. On observe une nette diminution des colonisations par les Légionelles. Seuls dans les bâtiments où la température était inférieure à 50 °C on a observé parfois une augmentation des colonisations. Les auteurs recommandent d’étendre l’utilisation des Chloramines pour la désinfection dans le but de diminuer la prévalence des légionelloses aux États-Unis[55]. Une autre étude de quatre mois portant sur 96 bâtiments confirme ces observations[10]. Les Monochloramines sont plus efficaces sur de grands réseaux que le chlore libre et pénètre plus efficacement les bio films riches en amibes[56].
- Halogen releasing organics
Plusieurs composés organiques libérant des halogènes lorsqu’ils sont mis en solution dans l’eau peuvent être utilisés pour désinfecter celle-ci. Citons le BCDLH, le 2,4-dibromo-5,5- dimethylhydantoin (DBDMH), et le sel de potassium 1.3-dichloro-1,3,5-triazine-2,4,6(1H, 2H, 5H)− trione aussi appelé le dichloroisocyanurate de potassium. Le BCDMH libère de l’acide hypobromeux et de l’acide hypochloreux, le DBDMH, de l’acide hypobromeux seul[38].
L’électrolyse n’est pas un désinfectant à proprement parler mais un processus. L’utilisation d’un processus d’électrolyse engendre la formation d’un mélange de composés chimique dépendant de la qualité de l’eau traitée. Ce procédé électrochimique permet de générer de puissant oxydants autres que le chlore libre tel que l’ozone, H2O2 et OH à des concentrations de 0,3 mg/L et 60 μg/L pour l’ozone et H2O2 respectivement[57]. On distingue deux manières de procéder. La première consiste à électrolyser l’eau à traiter directement, le second consiste à hydrolyser une eau aux caractéristiques connues puis de la doser dans l’eau à traiter ce qui permet d’éviter en particulier les variations dans la formation des produits d’électrolyse dû à la variation de qualité de l’eau brute. Les systèmes de désinfection électrochimique sont cependant décrits comme inadaptés pour garantir la non contamination d’un réseau par les Légionelles[36].
Agents non oxydants
De nombreux désinfectants organiques ont été utilisés dans la lutte contre les Légionelles : cétone hétérocycle (2,2-dibromo-3-nitro-propionamide (DBNPA)), guanidines (polyhexamethylene biguanide (PHMB)), thiocarbamates, aldehydes, amines, thiocyanates, composés organo-tin, amides halogenatées, et glycols halogenatés.
Le glutaraldehyde, (DBNPA), l’isothiazolin (Kathon), le PHMB et le 2-bromo-2-nitropropionamide (Bronopol) présentent une efficacité à des degrés différents. Les plus efficaces étant le DBNPA suivi du glutaraldehyde. Le PHMB, le Bromopol et le Kathon sont moins actifs que ce dernier. Les agents oxydants étant toutefois généralement plus efficaces[38].
Désinfection non continue
L’utilisation d’acide peracétique pour la désinfection ponctuelle d’un hôpital contaminé par les Légionelles a permis d’obtenir des résultats rapidement mais n’a pas empêché la recolonisation rapide du réseau à des taux beaucoup plus élevés qu’avant le traitement quelques jours après. La non-destruction du biofilm, la présence de l’acide peracétique en tant que source de carbone, les probables différences de concentrations en aciers sont des pistes avancées par les auteurs pour tenter d’expliquer ces résultats[58].
- Agents Oxydants : Chlore et composés chlorés associés
La réalisation d’un « choc chloré » permet de désinfecter rapidement une installation hautement contaminée. Pour parvenir à des résultats significatifs, 10 mg/l de chlore libre au minimum (20 à 50 mg de chlore) doivent être utilisés et mesurés en chaque point du réseau et cela pendant au minimum 60 minutes. Conformément à la définition d’une désinfection discontinue, le réseau ne doit pas être utilisé pendant le traitement et être nettoyé jusqu'à retrouver des valeurs d’au maximum 0,3 mg/l avant de pouvoir être réutilisé[36].
Cependant, ces pratiques entraînent une importante production de sous produits de réaction non désirés qui peuvent être notamment préjudiciable aux procédés de traitement des eaux usées et à l’environnement. De plus, le chlore est un élément corrosif au regard des canalisations et ce point ne doit pas être négligé. Enfin, ces méthodes sont rarement efficaces, dans la mesure où elles ne permettent pas d’éliminer les « niches » que constituent le biofilm, les protozoaires et leurs kystes.
Conception du réseau : prévention et lutte active
La découverte de la problématique des Légionelles à la fin du siècle dernier a permis d’accumuler des connaissances sur les facteurs de risques vis-à-vis de l’apparition de colonies de Légionelles dans les réseaux qui permettent de mettre en lumière les principaux facteurs créant les conditions favorables à l’apparition des Légionelles et les moyens de les minimiser.
Équipements à risques
La présence de systèmes complexes et étendus de réseaux d’eau chaude crée les conditions nécessaires pour le développement des Légionelles. En effet, les habitations utilisant des systèmes de chauffages instantanés sont vierges de Légionelles tandis que celles équipées de réservoirs de stockage et de boucles de recirculations sont au contraire fréquemment contaminées. Les résultats d’une enquête portant sur 452 habitations montrent, qu’un facteur des plus importants, est la température. Les réseaux d’eau chaude opérant à des températures inférieures à 46 °C étant les plus souvent contaminés[31]. Une autre enquête rassemblant 711 analyses microbiologiques présente les mêmes conclusions[33].
Les réseaux faiblement utilisés ou de manière discontinue, comme les hôtels saisonniers par exemple, sont plus sujets à la colonisation par les Légionelles[11]. L’aspect technique des installations est aussi primordial. Certains dispositifs sont, en effet, plus souvent atteints. Les réservoirs d’eau chaude verticaux sont par exemple plus souvent contaminés que ceux horizontaux (79 % contre 29 %) en raison vraisemblablement d’une plus grande disposition à l’accumulation de dépôts. Il en va de même pour les réservoir de plus de 5 ans[38].
Conception et dimensionnement du réseau
La conformité du réseau doit avant toute désinfection être vérifiée. Et plus encore, une réflexion poussée doit être conduite vis-à-vis de l’installation en elle-même. La lutte contre le développement potentiel des Legionella pneumophila est avant tout la mise en place d’une combinaison de mesures structurelles visant à limiter l’apparition d’un biofilm et la croissance de la biomasse[30].
Le dimensionnement des installations par rapport à leur utilisation est une condition primordiale à la garantie d’une hygiène durable[26] - [34]. S’ils ne concordent pas, il est nécessaire, en plus des mesures de préventions des Légionelles de reconsidérer les installations en prenant en compte le besoin réel et les aspects économiques[59].
Dès la conception du système de plomberie, il faut prendre en compte la problématique des Légionelles : les canalisations doivent être les plus courtes possibles, des vannes de régulations doivent être installées dans les systèmes complexes pour contrôler les flux. Il ne doit pas y avoir de zones mortes. Des systèmes anti retour doivent être installés sur les zones de chauffage. Il faut prévoir un système de purge[3]. Les temps de stagnation inévitables doivent être gardés les plus courts possibles[26].
Tous les dispositifs entraînant un mélange et l’apparition d’eau tiède, tels que les vannes de mélange eau chaude/eau froide ou les mitigeurs, doivent être placés le plus près possible des robinets ou poire de douche. Les raccords doivent être régulièrement nettoyés. Les systèmes à risque, comme les robinets diffuseurs qui diminuent la consommation d’eau mais augmente la production d’aérosols, ne doivent pas être installés dans des milieux dits « critiques » comme les hôpitaux[3].
Mesures techniques de lutte contre les Légionelles
Des mesures de correction du fonctionnement des installations sont, en règle générale, rapidement réalisables et souvent à exécuter en parallèle avec d’autres mesures, comme une désinfection ou un nettoyage par exemple. Les mesures correctives les plus couramment mises en place, concernant le fonctionnement du réseau à proprement parler, sont les suivantes[35] :
- L’élévation de la température de chauffage de l'eau
- L’élévation de la température de la boucle de circulation d’eau chaude
- La révision des paramètres de la boucle de circulation d’eau chaude
- La modification des réglages du mitigeur central
- Le nettoyage régulier des conduites rarement ou pas utilisées
- Le nettoyage et le curage du chauffe-eau
La suppression des embranchements morts permet d’obtenir immédiatement des effets sur la colonisation des Legionella[43].
Détruire les Légionelles sur le point de consommation de l’eau
La purification de l’eau des Légionelles par Ultra Violet (UV) ou par filtration peuvent convenir si elles sont employées à proximité du point d’utilisation dans le cas contraire, du fait de leur non-dispersivité, elles ne peuvent pas avoir d’impact sur les bio films et les populations bactériennes[3] - [46]. L’utilisation seule de la désinfection UV est insuffisante pour contrôler les L. pneumophila en raison de son faible rayon d’action et des interactions avec les composés de l’eau tels que le biofilm, la turbidité, les matières en suspensions ou encore les dépôts[38]. Une étude a cependant montré qu’une concentration de matières en suspension de 4 à 6 mg/l n’avait pas d’influence sur l’effet biocide de l’irradiation aux ultras violets. Une température de 43 °C n’a également pas eu d’incidence sur l’efficacité des émissions ultras violettes[39].
L’utilisation d’UV peut entrainer la formation de nitrites avec des longueurs d’onde inférieures à 240 nm[36].
Les UV ne peuvent pas détruire les Légionelles à l’intérieur des Amibes. Pour pouvoir détruire toutes les Légionelles, il faut coupler le rayonnement ultra-violet à un rayonnement ultrasonore qui permet de détruire les amibes[36].
Lorsqu’une température de plus de 55 °C n’est pas techniquement atteignable ou n’est pas souhaitée, dans le cadre de conditions particulières, le recours au concept d’Aachner, qui consiste au recours à une désinfection UV sur le point de consommation, peut être envisagé[34].
L’utilisation de filtres stériles est réservée au cas particulier des zones sensibles. Le principe repose sur la filtration de tous les composants contenus dans l’eau à l’aide d’un filtre d’une finesse d’au moins 0,45 μm qui retient donc notamment les micro-organismes tels que les Légionelles[36] - [60].
Une alternative à la désinfection peut être de supprimer purement et simplement le réseau d’eau chaude et d’utiliser des systèmes de chauffages décentralisés sur les points d’utilisation. Le cas pratique d’un hôpital de São Paulo au Brésil contaminé par les Legionella pneumophila montre que cette méthode a permis de supprimer durablement la colonisation du réseau et les cas de légionellose notamment en utilisant des douches électriques qui chauffent instantanément l’eau[61].
Prévention et détection
Méthodes de détection
Le nombre d’occurrences des contaminations de Légionelles dans les réseaux laisse penser que leur impact est sous-estimé. Cela est premièrement dû à la nécessité de recourir à un test propre aux Légionelles pour détecter leur présence dans un réseau. En effet, les Légionelles n’étant pas d'origine fécale, les paramètres traditionnels de surveillance de la qualité microbiologique ne peuvent pas fournir d’indication de contamination[62]. Leurs concentrations sont, de plus, très variables. L’étude d’un réseau expérimental a montré que les concentrations en Légionelles présentaient parfois des « pics » et qu’une fréquence de surveillance faible rendait très probable leur non-détection[30].
À cela s’ajoute que la méthode de détection des Légionelles est relativement longue puisqu’elle nécessite environ 13 jours avant de pouvoir fournir des résultats confirmés. Cela ne permet pas de répondre au besoin de suivi en continu dans les zones à risques et du contrôle avec un pas de temps précis des effets de mesures de désinfection par exemple. De nouveau procédés sont en développement et permettent d’espérer une amélioration des capacités de suivi des contaminations microbiologiques des installations. La société Vermicon AG a, par exemple, développé le système ScanVIT-Legionella qui repose sur l’observation au microscope à fluorescence du développement des colonies bactériennes colorées par des marqueurs fluorescents spécifiques après trois jours de développement sur une Agar GVPC (glycine vancomycim polymixin cyclohexamide)[63].
La détection par PCR pourrait, à l’avenir, être également amenée à jouer un rôle important dans le contrôle des contaminations des réseaux d’eau potable. Une étude en a démontré la faisabilité. Cette méthode présente l’avantage d’être beaucoup plus rapide que les techniques conventionnelles de mise en culture. Les limitations de la méthode sont la présence ponctuelle d’inhibiteurs dans les réseaux et la non-distinction entre les bactéries mortes et vivantes qui pourrait conduire à surestimer le risque d’infection[64]. La présence d’anticorps chez les usagers d’une installation pourrait aussi servir à la détection de contamination par les légionelles même sans cas avérés de légionellose. Cette présence d’anticorps est corrélée à l’exposition aux Legionella pneumophila mais elle est souvent asymptomatique[22].
Dans le cas d’une désinfection au chlore, l’augmentation de la demande en chlore peut être une indication de contamination biologique. Il apparaît que la concentration en bactéries est proportionnelle à leur demande en chlore. Les bactéries résistantes au chlore présentent une demande en chlore plus importante que celles non résistantes. Cela peut donc être utilisé pour estimer le degré de contamination d’un réseau en incluant les Légionelles qui sont particulièrement résistantes au chlore[65].
Enfin, il semble que les colonisations problématiques par les Légionelles ne soient pas limitées aux réseaux d’eau chaude. En effet, dans un nombre croissant de cas, les Légionelles sont détectées en concentrations élevées également dans les réseaux d’eau froide dont la température dépasse les 20 °C et cela en corrélation avec des cas de légionelloses[66]. Le contrôle des réseaux ne doit donc pas se limiter aux seuls réseaux d’eau chaude.
Légionellose
La sous-estimation de l’impact des Légionelles est également évidente au niveau du diagnostic de la maladie.
L’augmentation des cas de légionellose répertoriés ces dernières années a pour origine non pas une augmentation réelle des cas de légionellose mais est très certainement due à l’amélioration des techniques de détection et leur recours plus systématique[5] - [67]. En témoigne l’exemple d’une étude dans un hôpital de San Antonio (Texas) visant à trouver l’origine de l’augmentation du nombre de cas de Légionellose, qui en arrive à la conclusion que cette amplification est la conséquence du recours croissant au test antigène urinaire[68].
Pour le diagnostic d’une légionellose, on effectue le plus souvent un test des anticorps présents dans l’urine des patients mais ce test permet uniquement de détecter les Legionella pneumophila appartenant au sérogroupe 1 qui sont responsables de 90 % des infections, restent 10 %[4].
De nombreux cas de Légionelloses ne sont ainsi certainement pas détectés. Notamment dans les centres de soins longs où les malades n’ont que de faibles réflexes respiratoires et un état mental anormal. Un contrôle régulier des installations d’eau et un dépistage plus systématique des Légionelloses devraient être mis en place dans ces lieux critiques[69]. En raison d’un manque de suspicion de la maladie et, par conséquent, l’absence de test, le nombre de cas de légionelloses est sous-estimé. La mise en place, par le veterans healthcare system, d’une politique agressive de contrôle des infections et d’une politique de prévention incluant un volet « éducation » sous forme de conférences a permis d’obtenir une diminution très significative des cas de Légionelloses[70]. D’autres études rapportent que le contrôle régulier des systèmes de distribution d’eau, suivi, dans les cas le nécessitant, de mesures de désinfection, ainsi que l’utilisation généralisée de détection d’antigènes dans les urines, ont permis de diminuer de manière significative le nombre de cas de Légionellose et d’améliorer significativement le diagnostic de la maladie[67] - [71].
Surveillance des milieux à risques accrus
La tendance actuelle est à l’augmentation du recours aux détections de Légionelles, en particulier dans les zones dites sensibles qui abritent des personnes à risques.
Par exemple, les Centres américains du contrôle et de préventions des maladies (CDC) recommandent le contrôle régulier des eaux utilisées dans des centres de soins critiques tels que les centres de transplantations, de natalité[60]. De même, l'Agence fédérale pour l'environnement en Allemagne distingue trois types d’établissement avec pour chacun une fréquence et surveillance et mesures correspondant au niveau de contamination : les hôpitaux et centres de soins à hauts risques (tous les six mois), les hôpitaux et centres de soins dit « normaux » (tous les ans), et tous les autres établissements (tous les ans ou trois ans lors de contrôles précédents inférieurs à cent unités formant colonie (UFC) dans 100 ml)[62].
Le nouvel arrêté sur l’eau potable de 2003 (en Allemagne) prévoit le contrôle régulier des installations distribuant de l’eau potable publique (écoles, hôpitaux, centres de soins, maisons de retraite) notamment des Légionelles et l’analyse des anomalies du réseau telles que des défauts du réseau, des mauvais raccordements etc.[59] Le développement du concept de plan de sécurité de l’eau (Water Safety Plan)[3] en tant qu’instrument d’auto-contrôle avec la prise en compte des aspects sanitaires et techniques souligne la prise de conscience d’un surveillance accrue[33] - [72].
Vaccination
Des recherches sur la mise au point d'un vaccin existent. Des essais sur des cochons d'inde ont montré un niveau de protection modérément élevé[73].
Voir aussi
Articles connexes
Liens externes
Références
- (de) Hentschel, W et Waider, D., Kommentar zum DVGW-ARbeitsblatt W 551 : Technische Maßnahmen zur Verminderung des Legionellenwachstums in Trinkwasser-Installationen., Bonn, wvgw Wirtschafts- und Verlagsgesellschaft Gas und Wasser mbH, , 141 p. (ISBN 3-89554-151-6)
- (en) Fraser DW, Tsai TR, Orenstein W, Parkin WE, Brachman PS et al., « Legionnaires' disease: description of an epidemic of pneumonia », N Engl J Med, vol. 297, no 22, , p. 1189-97. (PMID 335244, DOI 10.1056/NEJM197712012972201)
- (en) Bartram, J et al., Legionella and the prevention of legionellosis, Genève, World Health Organization, , 252 p. (ISBN 978-92-4-156297-3 et 92-4-156297-8, lire en ligne)
- (de) Eckmanns, T, et al., « Prävention nosokomialer Legionellosen », Deutsches Ärzteblatt, no 103, , p. 19 (ISSN 1294-1301)
- (de) Exner, M, « Legionellen-Infektionen: Nur ein Bruchteil wird diagnostiziert », Trinkwasser Hygiene,
- (de) « Legionellose in Deutschland », Epidemiologisches Bulletin, no 48,
- (en) Konishi, T, et al., « Influence of Temperature on Growth of Legionella pneumophila Biofilm Determined by Precise Temperature Gradient Incubator », Journal of Bioscience and Bioengineering, no 101, , p. 478-484
- (en) Swanson, M S et Hammer, B K., « Legionella Pneumophila Pathogenesis: A Fateful Journey from Amoebae to Macrophages », Annual Review of Microbiology, no 54, , p. 567-613
- (en) Lasheras, A, et al., « Influence of amoebae and physical and chemical characteristics of water on presence and proliferation of Legionella species in hospital water systems. », American Journal of Inection Control, no 34, , p. 520-525
- (en) Moore, M R, et al., « Introduction of Monochloramine into a Municipal Water System: Impact on Colonization of Buildings by Legionella spp », Applied and Environmental Microbiology, no 72, , p. 378-383
- Mouchtouri, V, et al., « Risk Factors for Contamination of Hotel Water Distribution Systems by Legionella Species », Applied and Environmental Microbiology, no 73, , p. 1489-1492
- (en) Kuchta, J M, et al., « Enhanced Chlorine Resistance of Tap Water-Adapted Legionella pneumophila as Compared with Agar Medium-Passaged Strains », Applied and Environmental Microbiology, no 50, , p. 21-26
- (de) « Diskussion des Einsatzes von Desinfektionsverfahren zur Inaktiivierung von Legionellen unter Betrachtung rechtlicher Vorgaben », der Hygieneinspektor, no 12, , p. 9
- (en) States, S J, et al., « Effects of Metals on Legionella pneumophila Growth in Drinking Water Plumbing Systems », Applied and Environmental Microbiology, no 50, , p. 1149-1154
- (en) Berman, D, W. Rice, E and C. Hoff, J., « Inactivation of Particle-Associated Coliforms by Chlorine and Monochloramine », Applied and Environmental Microbiology, no 54, , p. 507-512
- (en) Harrison, T G, et al., « Comparison of clinical and environmental isolates of Legionella pneumophila obtained in the UK over 19 years », Clin Microbiol Infect, no 13, , p. 78-85
- (en) Fields, B S, et al., « Intracellular Multiplication of Legionella pneumophila in Amoebae Isolated from Hospital Hot Water Tanks », Current Microbiology, no 18, , p. 131-137
- (en) Rossier, O, Dao, J et Cianciotto, N P., « The Type II Systems of Legionella pneumophila Elaborates Two Aminopeptidases, as Well as a Metalloprotease That Contributes to Differential Infection among Protozoan Hosts », Applied and Environmental Microbiology, no 74, , p. 753-761
- (en) Kilvington, S et Price, J., « Survival of Legionella pneumophila within cysts of Acanthamoeba polyphaga following chorine exposure », Journal of Industrial Microbiology, no 68, , p. 519
- (en) Hwang, M G, Katayama, H et Ohgaki, S., « Effect of Intracellular Resuscitation of Legionella pneumophila in Acanthamoeba polyphage Cells on the Antimicrobial of Silver and Copper », Environ. Sci. Technol., no 40, , p. 7434-7439
- (en) King, C H, et al., « Survival of Coliforms and Bacterial Pathogens within Protozoa during Chlorination », Applied and Environmental Microbiology, , p. 3023-3033
- (de) Heudorf, U, et al., « Legionellen im hauseigenen Warmwasser - Auswirkungen auf die Gesundheit der Bewohner », Gesundheitswesen, no 63, , p. 326-334
- (en) Rohr, U, et al., « Comparison of Free-Living Amoebae in Hot Water Systems of Hospitals with Isolates from Moist Sanitary Areas by Identifying Genera and Determining Temperatur Tolerance », Applied and Environmental Microbiology, no 64,
- (en) Snelling, W J, et al., « Survival of Campylobacter jejuni in Waterborne Protozoa », Applied and Environmental Microbiology, no 71, , p. 5560-5571
- (en) Michel, R, et al., « Introduction of Monochloramine into a Municipal Water System: Impact on Colonization of Buildings by Legionella spp. », Applied and Environmental Microbiology, no 72, , p. 378-383
- (de) Nissing, W., « Hygienische und korrosionschemische Aspekte bei der Desinfektion von Trinkwasser-Installationen », energie wasser praxis, no 4, , p. 10-14
- Morton, L.H.G., Greenway, D.L.A., Gaylarde, C.C. and Surman, S.B., « Consideration of some implications of the resistance of biofilms to biocides », Int. Biodeterior. Biodegr., no 41,
- (en) Giao, M S, et al., « Incorporation of natural uncultivable Legionella pneumophila into potable water biofilms provides a protective niche against chlorination stress. », Biofouling, no 25, , p. 345-351
- (en) Mampel, J, et al., « Planktonic Replication Is Essential for Biofilm Formation by Legionella pneumophila in a Complex Medium under Static and Dynamic Flow Conditions. », Applied and Environmental Microbiology, no 72, , p. 2885-2895
- (en) van der Kooij, D, Veenendaal, H R et Scheffer, W J H., « Biofilm formation and multiplication of Legionella in a model warm water system with pipes of copper, stainless steel and cross-linked polyethylene », Water Research, no 35, , p. 2789-2798
- (en) Mathys, W, et al., « Occurrence of Legionella in hot water systems of single-family residences in suburbs of two german cities with special reference to solar and district heating. », International Journal of Hygiene and Environmental Health, , p. 7
- (en) Delerck, P, et al., « Detection of Legionella spp. and some of their amoeba hosts in floating biofilms from anthropogenic and natural aquatic environments », Water Research, no 41, , p. 3159-3167
- (de) Weber, Ulrike, Trinkwasser-Pathogene in öffentlichen Einrichtungen : Untersuchungen zur Wasserdesinfektion und zur Begründung eines Water Safety Plan, Ernst-Moritz-Arndt-Universität, Medizinischen Fakultät, Thèse de doctorat, , p. 103
- (de) Kryschi, R., « Trinkwasserhygiene in der Hausinstallation: die VDI-Richtlinie 6023 », BHKSAlmanach, , p. 54-56
- (de) Lange, B., « Legionellenprävention: Anforderung an Trinkwassererwärmungs- und - verteilungsanlagen », bbr., no 6, , p. 48-53
- (de) Gollnisch, A, Gollnisch, C et Klühspies, K., « Diskussion des Einsatzes von Desinfektionsverfahren zur Inaktiivierung von Legionellen unter Betrachtung rechtlicher Vorgaben », der Hygieneinspektor, no 12, , p. 9
- (en) Thomas, V, et al., « Amoebae in domestic water sysems: resistance to disinfection treatments and implication in Legionella persistence », journal of Apllied Miccrobiology, no 97, , p. 950-963
- (en) Kim, B R, et al., « Literature review: efficacy of various disinfectants against Legionella in water systems », Water Research, no 36, , p. 4433-4444
- Muraca, P, Stout, J E et Yu, V L., « Comparative Assessment of Chlorine, Heat, Ozone, and UV Light for Killing Leginoella pneumophila within a Model Plumbing System », Applied and Environmental Microbiology, no 53, , p. 447-453
- (en) Chen, Y S, et al., « Abbreviated duration of superheat-and-flush and disinfection of taps for Legionella disinfection: Lessons learned from failure », American Journal of Infection Control, no 33, , p. 606-610
- (en) Hwang, M G, Katayama, H et Ohgaki, S., « Inactivation of Legionella pneumophila and Pseudomonas aeruginosa: Evaluation of the bactericidal ability of silver cations », Water Research, no 41, , p. 4097-4104
- (en) Liu, Z, et al., « Intermittent Use of Copper-Silver Ionization for Legionella Control in Water Distribution Systems: A potentiel Option in Buildings Housing Individuals at Low Risk of Infection », Clinical infectious Diseases, no 26, , p. 138-140
- (en) Sidari, F P, et al., « Keeping Legionella out of water systems », American Water Work Association, no 96, , p. 111-119
- (de) Schmidt, W., « Unerwünschte Stoffreaktionen bei der Wasseraufbereitung und Wasserverteilung », Erfurt : DVGW, no 11,
- (de) Höll, K., Wasser : Nutzung im Kreislauf, Hygiene, Analyse und Bewertung, Berlin, A Grohmann, (ISBN 3-11-012931-0)
- (de) Wricke, B., « Trinkwasserdesinfektion - Einsatz- und Anforderungskriterien », GWFWasser/Abasser, no 145, , S82-S88
- (en) DeBeer, D, Srinivasan, R et Stewart, P S., « Direct measurement of chlorine penetration into biofilms during disinfection », Applied and Environmental Microbiology, no 60, , p. 4339
- Environmental Protection Agency. 1999. EPA Guidance Manual : Alternative Disinfectants and Oxidants. 1999, 4, pp. 1-41.
- (en) Hoigné, J et Bader, H., « Kinetics of reactions of chlorine dioxid (OClO) in Water- I. Rate constants for inorganic and organic compounds », Water Research, no 28, , p. 45-55
- (en) Zhang, Z., Use of Chlorine Dioxide for Legionella Control in Hospital Water Systems, University of Pittsburgh, Thèse de doctorat, , 105 p.
- (en) Srinivasan, A, et al., « A 17-Month Evaluation of a Chlorine Dioxide Water Treatment System to Control Legionella Species in a Hospital Water Supply », Infection Control and Hospital Epodemiology, no 24, , p. 575-579
- (en) Zhang, Zhe, et al., « Safety and Efficacy of Chlorine Dioxide for Legionella Control in a Hospital Water System », Infection Control and Hospital Epidemiology, no 28, , p. 1009-1012
- (de) DVGW, « Desinfektion von Wasserversorgungsanlagen », DVGW Regelwerk, (ISSN 0176-3504)
- (en) Swango, L J, et al., « Inactivation of Legionella pneumophila by Hypochlorite and an Organic Chloramine », Applied and Environmental Microbiology, no 53, , p. 2983-2986
- (en) Flannery, B, et al., « Reducing Legionella Colonization of Water Systems with Monochloramine », Emerging Infectious Diseases, no 12, , p. 588-596
- Donlan, R, et al. 2000. Monochloramine disinfection of biofilm-associated Legionella pneumophila in a potable water model system. [éd.] R Marre, et al. Legionella. 2000, p. 406-410.
- (en) Jung, Y J, et al., « Control of disinfection and halogenated disinfection byproducts by the electrochemical process », Water Science & Technology, no 131, , p. 835-839
- (en) Ditommaso, S, et al., « Peracetic Acid in the Disinfection of A Hospital Water System Contaminate With Legionella Species », Infection Control and Hospital Epidemiology, no 26, , p. 490-493
- (de) Hentschel, W, Voigt, K et Heudorf, U., « Umsetzung der neuen Trinkwasserverordnung §18: Überwachung von Hausinstallationen - Wasser für die Öffentlichkeit », Bundesgesundheitsblatt Gesundheitsforshung Gesundheitsschutz, no 49, , p. 804-817
- (en) Sheffer, P J, et al., « Efficacy of new point-of-use water filter for preventing exposure to Legionella and waterborne bacteria », American Journal of Infection Control, no 33, , S20-S25. Supplément I.
- (en) Oliveira, M S, et al., « Disconnecting central hot water and using electric showers to avoid colonization of the water system by Legionella pneumophila: an 11-year study », Journal of Hospital Infection, no 66, , p. 327-331
- (de) UMWELTBUNDESAMT, « Empfehlung des Umweltbundesamtes nach Anhörung der Trinkwasserkommission des Bundesministeriums für Gesundheit », Bundesgesundheitsblatt - Gesundheitsforshung - Gesundheitsschutz, no 49, , p. 697-700
- (de) Schulte, S, Kilb, B et Strathmann, M., « Hygiene und Mikrobiologie in industriellen Wassersystemen », Energie Wasser Praxis, , p. 16-18
- (en) Yaradou, D F, et al., « Integrated Real-Time PCR for Detection and Monitoring of Legionella pneumophila in Water Systems », Applied and Environmental Microbiology, no 73, , p. 1452-1456
- (en) Helbling, D E et VanBriesen, J M., « Free chlorine demand and cell survival of microbial suspensions », Water Research, no 41, , p. 4424-4434
- (de) Exner, M, et al., « Wasser als Infektionsquelle in medizinischen Einrichtungen, Prävention und Kontrolle », Bundesgesundheitsblatt - Gesundheitsforshung - Gesundheitsschutz, no 50, , p. 302-311
- (en) Stout, J E, et al., « Role of Environmental Surveillance in Determining the Risck of Hospital-Acquired Legionellosis: A National Surveillance Study With Clinical Correlations », Infection Control and Hospital Epidemiology, no 28, , p. 818-824
- (en) Kool, J L, et al., « Hospital Characteristics Associated With Colonization of Water Systems by Legionella and Risk of Nosocomial Legionnaires' Disease: A Cohort Study of 15 Hospitals », Infection Control and Hospital Epidemiology, no 20, , p. 798-805
- (en) Seenivasan, M H, Yu, V L et Muder, R R., « Legionnaires' Disease in Long-Term Care facilities: Overview and Proposed Solutions », Journal of the American Geriactrics Society, no 53, , p. 875-880
- (en) Kelly, A A, et al., « Legionella in the veterans healthcare system: report of an eight-years survey », Epidemiology and Infection, no 131, , p. 835-839
- (en) Squier, C L, et al., « A proactive approach to prevention of health care-acquired Legionnaires' disease: The Allegheny County (Pittsburgh) experience », American journal of Infection Control, no 33, , p. 360-367
- (de) Waschko, D. et al., « Hygienische Risiken der öffentlichen Trinkwasserversorgung durch technische Fehler in der häuslichen Trinkwasser-Installation », GWF-Wasser/Abwasser, no 148, , p. 872-879
- (en) T K Eisenstein et al., « Vaccination against Legionella pneumophila: serum antibody correlates with protection induced by heat-killed or acetone-killed cells against intraperitoneal but not aerosol infection in guinea pigs. », Infection and Immunity, , p. 685–691