Coloration de Gram
La coloration de Gram doit son nom au bactériologiste danois Hans Christian Gram qui mit au point le protocole en 1884. C'est une coloration qui permet de mettre en évidence les propriétés de la paroi bactérienne, et d'utiliser ces propriétés pour distinguer et classifier les bactéries. Son avantage est de donner une information rapide, facile et bon marché sur les bactéries présentes dans un produit ou un milieu, tant sur le type que sur la forme.
Ainsi, les scientifiques peuvent distinguer les bactéries à Gram positif - on dit aussi « Gram positives » - dotées d'une simple paroi avec une grande quantité de peptidoglycane, des bactéries à Gram négatif, composées de moins de peptidoglycane mais pourvues d'une membrane externe supplémentaire[1]. Ce type de classification n'est pas sans conséquence dans le domaine médical (la résistance des bactéries et l'efficacité d'antibiotiques dépendant du type de bactérie).
Méthodologie
Réalisation du frottis
Elle nécessite d'avoir un frottis fixé, soit :
- Par immersion dans l'alcool durant 5 minutes (et rinçage à l'eau) ;
- Plus classiquement en effectuant une fixation simple à la chaleur : sur une lame, déposer une goutte d'eau stérile (ou directement le prélèvement s'il est liquide). Ajouter à la goutte une colonie isolée (dans le cas où un isolement a été fait). Étaler et fixer à la chaleur d'une platine à environ 40 °C. Une fois sèche, recouvrir la lame d'alcool pendant une minute. Retirer l'alcool et mettre à sécher sur la platine. Poser la lame séchée sur le portoir reposant sur un bac de coloration.
Réalisation de la coloration
Voici succinctement les différentes étapes de cette coloration :
- Coloration par le violet de gentiane ou cristal violet. Laissez agir de 30 secondes à 1 minute, puis rincez à l'eau ;
- Mordançage au lugol (solution iodo-iodurée) : recouvrez de lugol et laissez agir le même temps que le violet de gentiane ; rincez à l'eau déminéralisée ;
- Décoloration (rapide) à l'alcool (+acétone). Cette l'étape est la plus importante de la coloration. Versez goutte à goutte l'alcool ou un mélange alcool-acétone sur la lame inclinée obliquement, et surveillez la décoloration qui doit être rapide. Le filet doit être clair à la fin de la décoloration. Rincez abondamment avec de l'eau déminéralisée pour stopper la décoloration. Attention, l'utilisation abusive de l'alcool aura pour conséquence de rendre toutes les bactéries Gram négatif ;
- Recoloration à la safranine ou à la fuchsine. Mettez de l'eau distillée sur la lame et quelques gouttes de fuchsine. Laissez agir de 30 secondes à 1 minute. Lavez doucement à l'eau déminéralisée. Séchez la lame sur une platine chauffante à 50 °C ;
- Observez avec une goutte d'huile à immersion objectif 100 (grossissement ×1000).
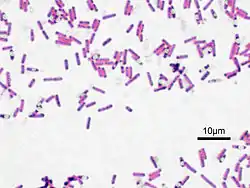
Les étapes 1 et 2 colorent en violet le contenu de la bactérie. Le violet de gentiane se fixe sur les composants cytoplasmiques de toutes les bactéries. Le lugol permet de fixer cette coloration interne.
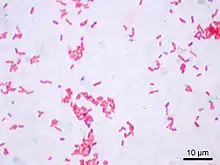
L'étape 3 (alcool) sert à décolorer le cytoplasme des bactéries qui seront dites « Gram négatives ». En effet, celles-ci ont une paroi pauvre en peptidoglycanes - donc plus fine - qui va laisser passer l'alcool (molécule hydrophile) ou le mélange alcool-acétone, et qui décolorera le cytoplasme en éliminant le violet de gentiane. Au contraire, pour les bactéries dites « Gram positif » la paroi constitue une barrière imperméable à l'alcool car elle est composée d'une « couche » de peptidoglycanes plus importante. La paroi est de ce fait plus épaisse. Les bactéries resteront alors de couleur violette.
L'étape 4 est une contre-coloration ayant pour but de donner aux bactéries Gram négatives précédemment décolorées une teinte rose permettant de les visualiser au microscope. Les bactéries à Gram positif restées violettes seront évidemment insensibles à cette contre-coloration plus pâle que le violet imprégnant leur cytoplasme.
La coloration de Gram permet ainsi de différencier la paroi bactérienne et de scinder les bactéries en deux grands groupes :
- Gram + qui ont une paroi de peptidoglycanes épaisse (ex. : Bacillus cereus) ;
- Gram - qui ont une paroi de peptidoglycanes fine, mais ont en plus une membrane externe lipidique (ex. : Escherichia coli).
Ces différences de coloration et les différences de forme (bacille ou cocci) sont à l'origine de la classification des bactéries.
Note : Certaines bactéries restent insensibles à cette coloration, c'est le cas, entre autres, des Mollicutes, ou appelés Ténéricutes, l'une des trois grandes classes d'Eubactéries (Gracilicutes, Firmicutes, Ténéricutes). En effet, ces bactéries sont dépourvues de paroi et apparaissent Gram —.
Utilisation en microbiologie
La coloration de Gram est fréquemment utilisée en microbiologie pour mettre en évidence les bactéries Gram positif ou négatif. Cela permet de différencier et de classer les différentes populations de micro-organismes. Par exemple, lorsqu'il y a suspicion d'infection de l'organisme dans une biopsie, on pourra utiliser cette coloration suivie d'une analyse histopathologique pour émettre un diagnostic. Cette méthode a l'avantage d'être plus rapide qu'une culture classique[2].
Les bactéries détectées sont classées en deux catégories. À titre d'exemples :
- les staphylocoques et les streptocoques, bactéries à Gram +, apparaissent en violet ;
- Escherichia coli, entérobactérie à Gram -, apparaît sous forme de bacille rose/rouge (en fonction de la contre-coloration fuchsine ou safranine).
Alternative
'Gram KOH'
Le but de cette méthode est de confirmer rapidement si une bactérie est à Gram positif ou à Gram négatif sans passer par les étapes de coloration habituelles et sans utiliser de microscope. Il suffit de mettre en contact (sur une lame pour microscope) une colonie isolée avec une goutte d'une solution de potasse (KOH) 3 %. À l'aide d'une pipette Pasteur, on mélange. Quelques secondes plus tard, on tire le mélange vers le haut. Si un filament se forme entre la pipette et la lame, la colonie isolée est alors constituée de bactéries Gram négatives ; si rien n'est entraîné par la pipette, on a affaire à des bactéries Gram positives. La méthode est proposée comme contrôle qualité de la coloration de Gram en 1977[3]. Lors d'une évaluation (John Buck, 1982) les résultats obtenus par cette méthode sur 400 souches de bactéries marines ont été confirmés par la coloration de Gram[4].
Notes et références
- (en) David H. Bergey, John G. Holt, Noel R. Krieg et Peter H.A. Sneath, Bergey's Manual of Determinative Bacteriology, Baltimore/Philadelphia/Hong Kong etc., Lippincott Williams & Wilkins, , 9th éd., 787 p. (ISBN 0-683-00603-7)
- (en-US) « Gram - Histalim », sur Histalim (consulté le )
- Novel quality assurance procedure for the Gram stain Kohn, F. S., and S. A. Henneman. 1977 J. Am. Med. Technol. 39:20-21
- Nonstaining (KOH) method for determination of gram reactions of marine bacteria J D Buck - Appl Environ Microbiol. 1982 Oct; 44(4): 992–993