Ivermectine
L'ivermectine est dans le monde, en 2021 (avec ses analogues) le médicament endectocide le plus utilisé comme anthelminthique (contre les nématodes gastro-intestinaux) en élevage, ainsi qu'en médecine humaine contre certaines parasitoses (gale...). Son large spectre d'action (il est également acaricide et insecticide), sa haute efficacité à très faibles doses, sa persistance et faible toxicité pour les mammifères ont valu un prix Nobel à ses découvreurs. Mais pour les mêmes raisons et parce qu'elle n'est pas biodégradable, cette molécule s'avère mortellement toxique pour de très nombreux invertébrés terrestres et aquatiques, ce qui pose des problèmes graves pour les écosystèmes et pour les agroécosystèmes[2].
| Ivermectine | |||
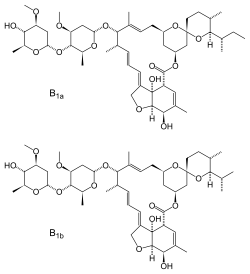
| |||
| Structure de l'ivermectine | |||
| Identification | |||
|---|---|---|---|
| No CAS | (mélange) (B1a) (B1b) |
||
| No ECHA | 100.067.738 | ||
| No CE | 274-536-0 | ||
| No RTECS | IH7891500 | ||
| Code ATC | P02, , « QS02QA03 », « QP54AA01 » | ||
| DrugBank | DB00602 | ||
| PubChem | 6321424 | ||
| ChEBI | 6078 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C48H74O14 (B1a) C47H72O14 (B1b) |
||
| Masse molaire | 875,092 8 ± 0,047 8 g/mol (B1a) 861,066 2 ± 0,046 8 g/mol (B1b) |
||
| Précautions | |||
| SGH[1] | |||
   Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
De formule C95H146O28[3], ce dérivé des avermectines, du groupe des lactones macrocycliques (LM), est principalement vendu, bon marché, en trois formulations anthelminthiques vétérinaires : 1) une solution injectable (en sous-cutanée) ; le Pour-On (application liquide transmutante sur le dos de l'animal) ; et le bolus (gros comprimé libérant très lentement le produit dans le rumen des ruminants.
Il est isolé à partir de la fermentation de Streptomyces avermitilis.
En France, il est vendu par le laboratoire Merck & Co. (MSD) sous les dénominations commerciales Mectizan[4] et Stromectol[5] - [6] et sous le nom d'Ivomec par Merial.
L'ivermectine est testée dans le développement et la recherche de médicaments contre la Covid-19. En , l’OMS recommande « de ne pas utiliser » l'ivermectine pour les malades de la Covid-19 hors essais cliniques[7], alors que certains pays d'Amérique latine ont inclus l'ivermectine dans leur arsenal thérapeutique et que l'Inde la retirait du sien[8].
Histoire
L’ivermectine est découverte par Satoshi Ōmura, spécialiste des antibiotiques à l'Université Kitasato (en) de Tokyo, qui la confie au laboratoire privé américain, Merck, Sharp and Dohme (MSD), en 1974, pour l’évaluation in vitro de sa bio-activité. L’ivermectine est très utilisée en médecine vétérinaire depuis 1981, elle est reconnue pour être active contre de nombreuses espèces de nématodes, d'insectes et d'acariens, y compris en dermatologie[9] ; par exemple contre la gale ou contre le demodex (qui peut proliférer en contexte d'immunodéficience)[10].
William C. Campbell et Satoshi Ōmura obtiennent le prix Nobel de physiologie et de médecine en 2015 pour leurs travaux sur l'ivermectine permettant un traitement de l'onchocercose (cécité des rivières) qui est un problème de santé publique, majoritairement en Afrique[11], ainsi que de la filariose lymphatique.
Pharmacodynamie
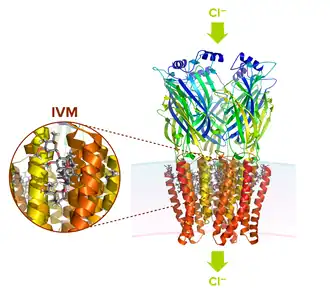
L'ivermectine (IVM) interagit avec une poche de liaison formée par les domaines transmembranaires des sous-unités GluClR adjacentes, « bloquant » le récepteur dans une conformation activée (ouverte) permettant le passage sans restriction des ions chlorure (Cl-) dans la cellule. La membrane plasmique est représentée par un gradient bleu-rose.
Cette molécule fait partie du groupe des avermectines (insecticides souvent utilisés à usage domestique comme appâts contre les fourmis, notamment l'abamectine) qui sont extraites d’une bactérie le Streptomyces avermitilis. Elle a un double effet toxique pour le système nerveux et la fonction musculaire, dont en inhibant la neurotransmission. Son affinité pour les canaux chlorures glutamate-dépendants présents dans les cellules nerveuses et musculaires des invertébrés[12] a pour conséquence la paralysie et la mort par atteinte neuro-musculaire.
Certaines mutations diminuent toutefois l'action de l'ivermectine sur les canaux chlorures. Elles confèrent une résistance à cette molécule[13].
Sa structure est semblable à celle des récepteurs à glycine des canaux ioniques des vertébrés, mais les canaux chlorures glutamate-dépendants sont spécifiques aux invertébrés (Bosselure, 2006). L'absence de canaux chlorures glutamate-dépendants chez les mammifères semble rendre compte en partie de la spécificité de l’action de l'ivermectine sur les parasites invertébrés et de son manque relatif d'effets secondaires sur les mammifères[14].
L'ivermectine interagit aussi avec des canaux chlorures ligand-dépendants faisant intervenir le neuro-médiateur GABA (acide gamma-amino-butyrique) mais leur importance est encore peu claire[15]. Le récepteur périphérique principal des neurotransmetteurs chez les mammifères, le récepteur nicotinique de l'acétylcholine, est relativement peu affecté par la molécule[16], ce qui contribue à son innocuité pour l'homme.
Pharmacocinétique
L’ivermectine peut être administrée en topique, par voie orale ou par voie parentérale.
Selon Schinkle et al. (1994), chez les mammifères - hors exception liée à des spécificités génétiques - elle ne franchit pas facilement la barrière hématoméningée[17]. Le franchissement est cependant significatif si l'ivermectine est prescrite à doses élevées (dans ce cas, le pic au niveau du cerveau est atteint 2 à 5 heures après l’administration).
Sa voie d'administration affecte considérablement sa disponibilité ; des différences considérables sont constatées dans la vitesse et le degré de biodisponibilité de la molécule, et dans sa demi-vie d'élimination selon que l'administration soit faite par injection ou par voie orale[18].
La résorption digestive est rapide et le pic plasmatique est atteint en 4 heures. Sa demi-vie plasmatique est alors de 12 heures environ[19].
Toxicité
L'intérêt thérapeutique des lactones macrocycliques (dont fait partie l'ivermectine) tient à leur spectre d’activité extrêmement large et à leur faible toxicité chez les mammifères[20]. Le risque principal est celui de la neurotoxicité, qui chez la plupart des espèces de mammifères peut se manifester par une dépression du système nerveux central (SNC), avec pour conséquence une ataxie, comme on aurait pu s'y attendre du fait de la potentialisation des synapses inhibitrices du système GABA-ergique[21] - [22]. Les pesticides sont généralement utilisés sous forme de spécialités contenant plusieurs substances, et l'ivermectine est classée par l’Agence de protection de l'environnement des États-Unis (EPA) comme toxiques de catégorie IV (très faiblement toxiques). Ceci signifie que bien que fortement toxiques pour les insectes, en mode normal d’utilisation, les préparations de pesticides contenant de l'ivermectine ne devraient généralement pas avoir d’effet nuisible pour les mammifères. Sa DL50 (dose létale 50) par voie orale est de 650 mg kg−1 chez le rat (toxicité de catégorie III, c'est-à-dire basse toxicité)[23]. Extrapolé à l’homme pour un poids de 80 kilogrammes, la dose létale 50 est de 52 g. Les préparations d'avermectine pures (par opposition aux formulations de pesticides dilués) sont fortement toxiques à la fois pour les insectes et pour les mammifères (également pour la vie aquatique, et les poissons). Une étude indique une DL50 par voie orale de 10 mg·kg-1 chez les rats (ce qui correspond à la catégorie I de toxicité ; toxicité élevée)[23].
Quelques races de chiens (colley surtout), présentent des signes d'atteinte toxique du système nerveux central après exposition à des doses d'ivermectine de seulement 150 à 200 μg·kg-1[24]. Cette hypersensibilité semble due à une mutation du gène MDR1, gène responsable de la synthèse d’une protéine de multi-résistance aux médicaments[25]. Il est depuis recommandé de ne pas traiter les colleys par l'ivermectine ni aucune autre avermectine. Les spécialités vétérinaires d'ivermectine généralement prescrites et utilisées pour la prophylaxie de la filaire du chien (Dirofilaria repens) sont dosés de 6 à 12 μg·kg-1[24], dose généralement considérée comme inoffensive. Un surdosage important serait nécessaire pour induire des effets toxiques[26]. Un test permet aujourd'hui d'évaluer la sensibilité des chiens à l'ivermectine (ainsi qu’à plusieurs autres médicaments)[27].
À la suite des effets différés dans l'espace et dans le temps de ce produit, démontrés par les études toxicologiques et écotoxicologiques, la réglementation française impose désormais un volet écotoxicologique dans tous les dossiers d'autorisation de mise sur le marché des médicaments vétérinaires, ainsi qu'une prise en compte, en conditions de terrain, le contexte éthologique (tels que la pratique courante du léchage[28] - [29], léchage inter-animaux notamment, qui entraîne l'absorption orale du médicaments par d'autres animaux, ce qui peut par exemple conduire à contaminer le lait d'une femelle allaitante non-traitée)[30].
Toxicité environnementale

50 % de ces nématodes sont mortellement paralysés par seulement 4 à 8 nanogrammes d'ivermectine par ml (et 50 % des variants résistants le sont pour des teneurs de 10 à 40 nanogrammes/ml)[31]
Depuis plusieurs décennies, l'ivermectine est largement diffusée dans les écopaysages agricoles via les animaux de rentes traités (y compris dans les élevage équins), ainsi que dans les espaces verts urbains et certains jardins privés via les excréments déposés ou enterrés par les chiens et chats traités. Il est expérimentalement démontré que durant plusieurs semaines à plusieurs mois, la molécule y reste mortellement toxique - à très faible dose - pour les insectes, acariens et de nombreux organismes aquatiques. Cette molécule pose de ce fait de graves problèmes en termes d'écotoxicologie, en particulier en diminuant le nombre et la diversité de la faune coprophage bénéfique (bousiers notamment) et secondairement la qualité du sol et le fonctionnement des écosystèmes[32]. En dégradant les fonctions écosystémiques des décomposeurs d'excréments, elle pourrait dégrader certains services écosystémiques[33], ainsi que les cycles écologiques (cycle du carbone, cycles d'autres éléments nutritifs), la productivité primaire ou encore augmenter l'émission agricole de gaz à effet de serre, et avoir des effets sanitaires induits sur des organismes non-cibles[34] ; par exemple, Sands et Wall ont montré (en 2016) que l'appauvrissement général des communautés de bousiers et des mouches coprophages altère et ralentit la décomposition et le recyclage des excréments. Il en résulte notamment une persistance et une disponibilité accrue de microbes pathogènes, et des stades parasitaires des helminthes vivant dans les excréments non traités[35] (d'animaux domestiques non-traités, et d'animaux sauvages y compris).
Une expérience récente (publication 2020) en mésocosmes pour la comparaison des coléoptères et des mouches dans des excréments exempts d'ivermectine a montré que les coléoptères recyclent dans le sol près de deux fois plus d'excréments que les mouches, et que les résidus d'ivermectine réduisaient considérablement l'élimination des excréments contaminés (-47 % par les coléoptères seuls) et - 32 % par l'ensemble « coléoptères + mouches »[34].
À titre d'exemple, l'INRA de Tours a montré que 50 % des variants sensibles du nématode Haemonchus contortus (ici un adulte, avec ses œufs, espèce-cible de l'Ivermectine) sont tués par seulement 4 à 8 nanogrammes d'ivermectine par ml, et 50 % des variants résistants le sont pour des teneurs de 10 à 40 nanogrammes/ml[31] - [36] ; l'ivermectine est un dérivé semi-synthétique d’une lactone macrocyclique qui paralyse mortellement les nématodes et arthropodes, par une hyperpolarisation de leurs cellules musculaires, due à la perturbation des canaux ioniques qui traversent leurs membranes cellulaires[37].
Molécule non-biodégradable
L'ivermectine est non biodégradable, et relativement persistante dans l'organisme et dans l'environnement.
- dans l'organisme, cette persistance (découverte par la science vétérinaire sur le modèle animal), est un atout thérapeutique, car elle autorise une dose orale unique ou deux doses/an pour contrôler l'endémie parasitose tropicale de l'onchocercose dans les villages africains concernés)[30] ;
- dans l'environnement, cette persistance devient un grave inconvénient, car les effets toxicologiques de la molécule persistent d'autant plus longtemps dans le milieu où les excréments sont rejetés (Boues d'épuration, lisiers, fumiers, composts de toilettes sèches, etc.).
L'INRA-Versaille a montré que dans un sol de type limon argileux, cette molécule est photodégradable à la surface du sol (sa demi-vie est alors de 21 jours en plein soleil)[31].
Mais elle persiste plus de 10 fois plus longtemps dans le sol à l'abri du soleil ; sa demi-vie y est alors de 240 jours[31].
Excréments rendus éco-toxiques



Couramment administrée aux bovins, ovins et chevaux presque partout dans le monde, l'ivermectine est majoritairement excrétée par voie fécale, et sous une forme principalement non métabolisée (forme active). C'est un problème écologique, mais qui pose aussi question quant aux effets de l'utilisation d'excréments humains provenant de personnes soignées à l'ivermectine, comme engrais, et alors que dans les pays pauvres, la défécation est communément pratiquée à l'extérieur, faute de toilettes. La cinétique de l'ivermectine et de ses sous-produits dans l'environnement à partir des excréments humains a fait l'objet d'études[38].
Peu toxique pour les espèces de mammifères l'ivermectine dispose pour eux d'une large marge de sécurité (hormis pour quelques espèces pour des raisons génétiques). Elle est au contraire hautement toxique pour de nombreux autres organismes de la faune non-ciblés par le médicament. Ces organismes en subissent notamment l'effet via l'élimination de la molécule par les excréments : c'est le cas de tous les nématodes, mais aussi les diptères, et les coléoptères coprophages (bousiers, considérés comme espèce-clé pour le recyclage des matières fécales dans le sol, et que l'on sait déjà souvent menacé par le surpâturage[39]). Ceci a été établi par de très nombreuses études, même si le laboratoire qui la commercialise a publié quelques études contradictoires[40].
L'ivermectine n'est pas dégradée dans l'organisme. Elle est essentiellement retrouvée intacte dans les bouses et crottins, à des taux restant élevés les jours qui suivent le traitement[41] puis la durée d'élimination dans les excréments des animaux traités dépend de la voie d'administration du médicament (intra-musculaire, pour-on, bolus) pour ensuite décroître entre 10 et 150 jours.
Selon des tests faits par l'INRA-Dijon, après 15 jours, aucun effet écotoxicologique de l'ivermectine n'a été observé sur les champignons ou les bactéries du sol à la dose de 250 ppm.
Une autre expérience, à l'INRA-Versailles a porté sur 4 souches de 4 types de champignons du sol : un deutéromycète (Fusarium oxysporum), un zygomycète (Mucor racemosus (en), un ascomycète (Fusarium solani) et un basidiomycète (Phanerochaete chrysosporium). Exposées à de l'ivermectine, aucune de ces souches n'a réduit sa croissance, indiquant une absence de toxicité aiguë entre 10-8 et 10-3 M, et l'expérience n'a pas mis en évidence de signe de toxicité chronique à la quatrième génération de champignon incubée en présence d’ivermectine à 10-5 M.
Ces 4 souches fongiques ont été cultivées dans en milieu liquide en présence d’ivermectine (taux de 10-5 M). Puis les spores de ces champignons ont été introduites dans un nouveau milieu contenant de l'ivermectine, les filaments mycéliens formés ont alors produit de nouvelles spores à leur tour cultivées dans un nouveau milieu. Après 4 cycles de culture, l'ivermectine n'a pas inhibé la sporulation des champignons sauf chez Fusarium oxysporum[31].
Une autre expérience a porté sur d'éventuels effets enzymatiques de l'ivermectine, ou de deux de ses produits de dégradation, chez le champignon Phanerochaete chrysosporium. Ce travail réalisé par l'INRA-Versailles montre qu'après 4, 8 et 12 jours de traitement par l’ivermectine (de 10-6 à 10-3 M), il n'y a pas de changement dans la production de peroxydases pour cette espèce.
Par contre, chez le champignon Trametes versicolor deux effets sont observés :
- augmentation de la production de laccase (une phénoloxydase) après 2 et 3 jours de traitement par l’ivermectine à 0,5 10-3M ;
- doublement de la production de laccases en présence de l’ivermectine mais aussi de son dérivé 8,9-Z. D'autre part, le dérivé 10,11-Z triple cette production (par rapport au témoin non traité).
Aucun effet n'a été constaté (par l'INRA) ni sur la nitrification de l'azote ammoniacal du sol (pour 50 ppm d'ivermectine) ; ni sur la cinétique de la minéralisation du 14C-Carbofuran (pour 10 ppm d'ivermectine)[31]. Selon des expériences faites par l'INRA-Dijon, dans le compost, l'ivermectine seule semble sans effets sur la biodégradation (y compris du diuron ou du glyphosate), mais elle semble cependant pouvoir agir synergiquement avec des détergents et/ou surfactants et alors accélérer la minéralisation du glucose[31].
Une étude (canadienne, de 3 ans), a démontré un effet (attraction d'insectes coprophages) pour l'ivermectine, mais en montrant qu'il existe aussi pour les autres médicaments endectocides[42] : en 2003 et 2004, au Canada, des chercheurs ont comparé les nombres et types d'insectes capturés dans deux types de « pièges à fosse », respectivement appâtés avec des bouses non-traitées ou traitées (7 jours avant, en application topique, par de la doramectine, de l'éprinomectine, de la moxidectine (en) ou de l'ivermectine). À chaque printemps et automne, des effets significatifs d'attraction (ou moindrement de répulsion de certains insectes) ont été détectés pour 27 taxons d'insectes (de 13 familles dans les trois ordres de Coléoptères, Diptères et Hyménoptères)[42]. Souvent le nombre d'insectes doublait dans les pièges dont l'appât était une bouse traitée et dans un cas il y a eu six fois plus d'insectes attirés. Onze cas d'attraction et 11 cas de répulsion ont été constatés pour la doramectine alors que l'éprinomectine repoussait plutôt les insectes (moins de captures dans 19 des 29 cas d'effets)[42]. L'ivermectine a eu un effet très attractif (captures accrues dans 17 des 25 cas) de même que la moxidectine (captures accrues captures dans 17 des 18 cas)[42].
En 2005, les mêmes chercheurs ont comparé le degré d'attractivité de bouses traitées à la doramectine (par rapport au même excrément témoin non-traité) selon le délai après traitement (3, 7 ou 14 jours après)[42]. Ils ont observé une différence significative globale d'attractivité aux jours 3, 7 et/ou 14, mais qui tend à décliner avec le temps. Les auteurs concluent que « les résidus endectocides peuvent affecter le nombre d'insectes attirés pour coloniser et pondre dans les excréments[42]. Par conséquent, l'émergence de leur progéniture à partir d'excréments colonisés sur le terrain de bovins non traités par rapport à ceux traités avec un endectocide ne devrait pas être utilisée comme une mesure de la toxicité des résidus en soi, mais plutôt comme une mesure de "l'activité des insectes" ». L'activité des excréments contaminés par l'ivermectine ou des molécules similaires envers une partie des insectes décomposeurs des excréments a pu induire de graves biais dans les évaluations ; les comptages d'insectes ne peuvent être qu'un indice composite de la toxicité des résidus, du nombre et de la composition des espèces d'insectes colonisateurs et des facteurs de mortalité[42].
En 2015, J.R Verdú et ses collègues ont montré que de faibles doses d'ivermectine causait des troubles sensoriels et locomoteurs chez les bousiers[43].
Une étude plus récente (2019) a testé à la fois en laboratoire, en condition semi-contrôlée et en plein air les effets sur deux espèces de bousier (Onthophagus landolti (en) et Canthon indigaceus (en)) de déjections provenant de vaches ayant reçu (administration sous-cutanée) une dose unique de 0,2 mg/kg de poids corporel, et collectés à 5, 14, 21 et 28 jours après traitement. Dans tous les cas les bouses contenant de l'ivermectine ont attiré plus de bousiers adultes[44].
Il ne semble pas y avoir eu d'études sur les effets sur les insectes des excréments de chats et de chiens traités par l'ivermectine
Toxicité pour les bousiers et autres coléoptères
_constans_Duftschmid%252C_1805_(15262726681).png.webp)
Depuis la fin des années 1990, la toxicité de l'ivermectine pour les bousiers et plus encore pour leurs larves était déjà largement démontrée pour les espèces tropicales et subtropicales (même quand l'ivermectine a été prescrite en injection sous-cutanée ; les larves d'un bousier tel que Diastellopalpus quinquedens sont significativement affectées au détriment de la biodégradabilité de la bouse)[45].
Et au début des années 2010, elle a été confirmée chez des bousiers de régions tempérées de l'hémisphère nord, et ce, à tous les stades de vie (œuf y compris) se déroulant dans l'excrément contaminé, par exemple chez Aphodius ater et Aphodius rufipes exposés à différents taux d'ivermectine dans les bouses. Globalement, plus la bouse contient de résidus d'ivermectine, plus la taille de la cohorte d'insectes pouvant potentiellement contribuer à la prochaine génération de coléoptères diminue[46].
En 2012, en laboratoire, des bouses contenant seulement 1,0 ppm d'ivermectine tuaient 50 % des adultes d'Euoniticellus intermedius (en) (bousier commun des régions d'élevage au Mexique, où l'on trouve au moins 17 espèces de bousiers[47]) ; et à 100 ppm, aucun adulte ne survivait[48]. Les ovaires des femelles exposées ne semblaient pas affectés, mais chez les mâles, la taille des testicules augmentait et la fécondité et le poids du couvain diminuaient[48]. Dès le taux de 0,01 ppm, la larve allongeait son temps de développement (de 0,5 fois) avant de se transformer en imago (stade adulte) ; et la capsule céphalique était plus étroite au troisième stade. Les auteurs notent qu'un développement anormalement long peut induire un décalage de phase dans le cycle d'activité de l'espèce, réduire le nombre d'individus et l'efficacité des services écosystémiques qu'ils fournissent[48].
Une étude a également noté que le nombre d'œufs pondus par femelle d'Aphodius rufipes diminue (légèrement) quand le taux d'ivermectine est plus élevé dans une bouse[46].
L'Unité de Zoogéographie de l'Université de Montpellier III a montré qu'aucune éclosion du bousier Aphodius constans n'a eu lieu dans les bouses de 15 bovins traités par un bolus d'ivermectine, et ce jusqu'à 143 jours après l'émission des bouses[31] ; alors que dans les bouses des 5 bovins non traités utilisés comme groupe-témoin : de 38 (au 4e jour) à 58 (au 143e jour) larves de ce coléoptères sont nées dans les bouses non traitées ; il a fallu en moyenne 143 jours pour que dans les bouses de bovins traités émergent enfin des larves, mais leur taux d'émergence était alors inférieur à ce qu'il était après seulement 4 jours dans les bouses de bovins non traités[31].
À cause de cette écotoxicité persistant le plus longtemps dans les bouses, le « bolus pour bovins » a perdu son autorisation de mise sur le marché (AMM) en France, en 2003[30] ; n'y demeurent (en 2009) qu'une pâte orale pour chevaux, une solution Pour-On et la solution injectable.
>Pour limiter les impacts négatifs de cette ivermectine sur la faune non-cible, certains auteurs conseillent de garder les animaux enfermés quelques jours après le traitement, ou de remplacer le traitement à l'ivermectine par des traitements anti-parasitaires moins toxiques (moxidectine (en), benzimidazolés), et/ou de limiter le nombre de traitements annuels grâce à des techniques d'élevage (et de lutte antiparasitaire) adaptées, reposant sur la rotation des pâtures[49].
Certains biais d'interprétation sont possibles. Ainsi :
- en 2020, il reste difficile de comparer entre elles les études d'effets d'antihelminthiques et autres endectocides sur la faune des déjections, en raison de protocoles expérimentaux différents et de principes actifs différents (éprinomectine, doramectine, ivermectine, moxidectine) ou de formulations différentes (injectable, pour-on, bouses dopées...)[50], d'autant que certains effets sur la dynamique de population des bousiers ne sont pas encore bien cernés parce que complexes et multifactoriels[46] ;
- certaines souches de bousiers (et d'autres invertébrés) sont devenues plus ou moins résistantes à l'ivermectine là où elle est depuis longtemps utilisée[46] ;
- des effets de saisonnalité sont induits par les dates de traitement des animaux (ex : les communautés de bousiers sont plus abondantes au Mexique de mai à juillet sur les sites où les bovins ne sont pas traités, et plus abondantes en mai-juin sur les sites traités (probablement parce que les contrôle médicamenteux des parasites s'y font début juillet)[47].
Une expérimentation sud-africaine s'est déroulée lors d'une saison (1993-1994) localement exceptionnellement pluvieuse. Dans ces conditions, l'ivermectine des déjections semblait suffisamment lessivée pour que la toxicité des bouse (à l'égard des bousiers) diminue beaucoup plus rapidement (en 3 mois) ; la pluviométrie est donc un facteur à prendre en compte dans les études d'impacts de l'ivermectine[51] ; - un phénomène de « piège écologique » aggrave les effets des résidus d'ivermectine présents dans les déjections bovines[52]. Ces résidus attirent en effet une partie des insectes colonisateurs de bouses (ou en repoussent d'autres), et ce durant une longue période, quelle que soit la guilde de coléoptères étudiée. Autrement dit : plus une bouse est insecticide (riche en restes d'ivermectine), plus elle attirera certains insectes qui s'en nourrissent ou en repoussera d'autres[52]. C'est ce qu'a montré une étude de 2 ans faites dans deux sites du sud de la France, sur des bouses collectées à différents moments après un traitement du bovin par l'ivermectine (4, 14, 42, 70 et 98 jours)[52]. Un observateur ne tenant pas compte du fait qu'un excrément issu d'un animal traité attire anormalement les bousiers adultes, pourrait faussement penser que l'ivermectine est « bonne » pour les bousiers ;
- les coprophages et nécrophages utilisent leur odorat ou la chémotaxie pour atteindre leur cible. Or un air humide porte les odeurs d'excréments bien plus loin qu'un air très sec, et l'excrément est bien plus odorant humide que déshydraté. Dans un cas signalé, les bouses traitées n'ont pas attiré de bousiers, mais l'auteur a souligné que dans cas, l'« appâtage » a eu lieu lors d'une grave sécheresse[52].
Divers auteurs ont attiré l'attention sur le danger d'une utilisation généralisée du bolus à base d'ivermectine, car il met potentiellement en danger la survie des bousiers et de leur progéniture[52]. Une étude récente (2019) a porté sur les bouses collectées dans 16 parcours bovins de ranchs de l'Est du Dakota du Sud[53]. 116 244 arthropodes appartenant) 172 morpho-espèces y ont été trouvés ; Les parcours utilisés par des voisins non traités à d'ivermectine abritaient une richesse en espèces, une diversité, une abondance d'espèces prédatrices et une abondance de bousiers plus importantes que ceux gérés de manière plus conventionnelle[53]. La quantité d'ivermectine dosée dans les bouses était négativement corrélée à l'abondance et à la diversité des bousiers ; or soulignent les auteurs, « la structure de la communauté des arthropodes des déjections est un trait-clé corrélé avec le cycle des nutriments, la suppression des ravageurs et la productivité des parcours pâturés par le bétail »[53]. D'autres chercheurs ont démontré un effet négatif sur la structure des populations de bousiers[54] - [55].
En 2003 en Argentine, ont été étudiés (en fin de printemps) les effets de bouses de bovins traités (soit par l'ivermectine soit par la doramectine) sur la colonisation et la biodégradation de ces excréments par deux groupes d'invertébrés : arthropodes et nématodes. Les bouses utilisées comme « pièges » ont été récupérées 3, 7, 16 et 29 jours après le traitement des bovins, et étudiées 7, 14, 21, 42, 100 et 180 jours après le dépôt sur le terrain d'expérience[56]. Les chercheurs y ont quantifié l'évolution des résidus du produit durant toute la période d'essai, tout en évaluant le nombre d'organismes colonisateurs et quelques indices de biodégradation (poids sec, taux de matière organique...)[56]. Les bouses traitées étaient globalement moins colonisées par les nématodes et par les arthropodes (l'étude incluait le suivi des diptères, collembole et acariens) mais dans ce contexte les auteurs n'ont pas observé de changement du nombre de Scarabaeidae adultes récupérés ni dans les proportions d'excréments enterrés et détruits par les grands bousiers ; ils confirment aussi une vitesse de dégradation de ces molécules très lente dans l'environnement (La contamination résiduelle reste élevée jusqu'à 180 jours par jour pour les deux molécules-mères ici testées ; ex : jusqu'à 13 ng/g (IVM) et 101 ng/g (DRM) retrouvés après 180 jours dans les fèces récupérées 27 jours après le traitement puis exposées à l'environnement local[56].
Toxicité pour les mollusques
Les effets de l'ivermectine ont été testée par l'INRA (UMR 188 de l'INRA-ENV Lyon), à diverses concentrations, sur une espèce-modèle de Mollusque d'eau douce, filtreur : la dreissène (Dreissena polymorpha, une espèce invasive réputée plutôt résistante à la pollution)[31].
L'expérience a conclu à l’existence d’« une réelle toxicité de l’ivermectine pour la dreissène »[31], et elle a mise en évidence un phénomène de forte bioaccumulation (dose-dépendant avec un facteur de 20 à 50) conduisant à la mort des dreissènes les plus contaminées (en termes de concentrations tissulaires). La bioaccumulation semblait plus élevée à concentration égale d'ivermectine dans milieu quand l'ivermectine était en solution aqueuse plutôt que récupérée par la moule dans les microparticules en suspension[31].
Toxicité pour les poissons
Peu de données semblent disponibles à ce sujet.
Des essais, accompagnés d'une évaluation toxicologique, ont par exemple été conduits par le CIRAD dans une ferme d'élevage de poissons d'ornement. L'essai consistait à tenter d'éradiquer les nématodes parasites du gendre Camallanus sp. chez deux espèces de poisson : le guppy (Poecilia reticulata) et Melanotaenia boesemani. Dans ce cas, les Camallanus sp. résistaient à l'isoquinoléine (Praziquantel®), et au trichlorfon (Dipterex®), mais ils étaient tués par l'ivermectine.
Cette expérimentation a montré que le dosage nécessaire diffère selon l'espèce de poisson traité, et que le guppie est très vulnérable à la toxicité de ce produit, de même certaines espèces de poissons arc-en-ciel.
Effets sur les nécrophages (et les carnivores ?)
En raison d'une forte rémanence dans les tissus des animaux traités (en particulier le foie (organe de détoxication) peut concentrer la molécule, de même que le tissu adipeux), l'ivermectine pourrait être une source de risque pour le consommateur et les carnivores sauvages ; la DJA (dose journalière admissible) a été fixée à 12 microgrammes par jour ; et la LMR (limite maximale de résidus) est de 8 microgrammes par kg[57].
Le danger est bien plus grand pour les nécrophages sauvages (vautours notamment).
Dans le lait
On s'est rendu compte dès la fin des années 1990[58] qu'aux doses posologiques indiquées par l'autorisation de mise sur le marché[59], une partie de l'ivermectine ingérée passait dans le lait, qui est donc aussi une voie d'élimination de l'ivermectine[60].
Ceci vaut quand l'ivermectine est délivrée en injection sous-cutanée ; elle passe alors dans le plasma[61] et en période d'allaitement, une partie en est retrouvée dans le lait[62].
Le lait d'ovins, caprins, bovins, ânes... peut être contaminé après un traitement[63]. Il a été recommandé de ne pas traiter les animaux en période de lactation, et 28 jours (en France et Azu Royaume-Uni dans les années 1980) avant une future période de lactation[61].
Au milieu des années 1980, il a été démontré que le lait maternel humain pouvait être contaminé par ce pesticide et médicament, car 20 à 40 millions d'humains étaient traitées par l'ivermectine dans le monde, essentiellement en zone tropicale[61]. Le degré de contamination est comparable à celui qu'on observe chez la vache et d'autres espèces de mammifères traités par ce produit. Chez la femme, la contamination est rapide (observée dès 12 h après le traitement) et perdure plusieurs semaines (encore détectable dans les 14 à 30 jours suivants après un pic qui a lieu dans les premières 48 h après le traitement)[61]. Environ 5 % de la dose administrée sera éliminée dans le lait maternel, qui acquiert alors des propriétés insecticides : le taux de mortalité de mouches domestiques nourries avec un échantillon de lait humain contaminé récolté 29 jours après le traitement est encore multiplié par deux, tant pour les mouches mâles que femelles[61].
Indications thérapeutiques en médecine humaine
L'ivermectine fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[64].
L'ivermectine est réglementée en Suisse et elle n'est délivrée que par certaines pharmacies.
La réputation de la molécule a été grevée par une étude parue dans The Lancet en 1997, décrivant 15 décès sur les 47 pensionnaires d’une Ehpad anglaise traités par ivermectine pour une épidémie de gale, or ces personnes avaient été enduites auparavant d'un badigeon de lindane, insecticide mortel pour les animaux, interdit en Europe depuis 2007[65].
Utilisations attestées
L’ivermectine est un antiparasitaire à large spectre. Il est principalement utilisé chez l'homme pour le traitement des maladies suivantes :
- l’onchocercose à Onchocerca volvulus ;
- la rosacée[66] traitée par une crème topique à 10 mg/g[67] ;
- des filarioses :
- la filariose lymphatique à Wuchereria bancrofti ;
- la loase (ou filariose à Loa loa) ;
- l'anguillulose (ou strongyloïdose) ;
- l'ascaridiose ;
- la trichocéphalose et l’oxyurose ;
- larva migrans cutanée ;
- la gale (Gale#Voie orale).
Utilisation potentielle contre les poux
La molécule serait également efficace contre la pédiculose du cuir chevelu (poux) tant par voie orale[68] qu'en lotion[69]. La molécule n'a pas d'autorisation de mise sur le marché en France pour cette indication[70].
Utilisation potentielle contre la Covid-19

L'intérêt de l'ivermectine pour traiter le COVID-19 est évalué depuis le début de la pandémie, avec quelques études qui ont pu sembler prometteuses[71] - [72] mais qui n'ont pas emporté le consensus scientifique; l'une d'entre elles ayant été jugée peu fiable et entachée du soupçon de conflit d'intérêts[73] tandis qu'une autre étude majeure a été retirée après la démonstration qu'elle avait été falsifiée[74].
Début 2021 les grandes agences sanitaires telles que la Food and Drug Administration[75], l'Agence européenne des médicaments[76] et l'Organisation mondiale de la santé[7] émettent des avis négatifs au sujet de l'utilisation de l'ivermectine pour traiter le COVID-19 en dehors des essais cliniques, l'OMS affirmant de surcroît[7] :
« Un groupe chargé de l’élaboration des orientations a été constitué en réponse à l’attention croissante que suscitait à l’échelle internationale le recours à l’ivermectine comme traitement potentiel contre la COVID-19. Ce groupe d’experts international indépendant se compose d’experts en soins cliniques dans diverses spécialités, d’un éthicien et de patients-partenaires.
Le groupe a examiné les données regroupées de 16 essais contrôlés randomisés portant au total sur 2 407 patients ambulatoires ou hospitalisés atteints de COVID-19. Il a conclu que les données selon lesquelles l’ivermectine permettrait de réduire la mortalité, la nécessité d’un recours à la ventilation mécanique, la nécessité d’une hospitalisation et la durée avant une amélioration clinique chez les patients COVID-19 étaient « très peu fiables », en raison de la petite taille des essais et des limites méthodologiques des données d’essai disponibles, notamment du faible nombre d’effets indésirables. »
Contre-indications
L’ivermectine est contre-indiquée chez les personnes présentant une hypersensibilité immédiate au médicament. Elle ne doit pas être prescrite à des mères allaitante quand le nourrisson a moins de trois mois (Reynolds, 1993).
Effets secondaires indésirables
Selon les données réunies en 2020 par Philip J. Cooper et Thomas B. Nutman[77], généralement à partir de la pratique de la médecine tropicale qui utilise le plus l'ivermectine chez l'humain, les effets adverses et indésirables (rarement graves) pouvant survenir à court terme à la suite de l'utilisation de ce médicament sont :
- dermatologiques, avec une réaction de Mazzotti (en) apparaissant parfois 2 à 4 jours après l'administration d'ivermectine chez les personnes infectées par Onchocerca volvulus[77]. Son alors associés un prurit et un œdème localisés accompagnés d'éruptions papuleuses ou d'une urticaire[77]. Parfois les effets sont plus systémiques, avec fièvre, hypotension orthostatique, arthralgie, myalgie et maux de tête. Prurit et éruptions maculopapuleuses ont aussi été signalées dans les 2 à 4 jours après le traitement de la gale par l'ivermectine[77].
- gastriques et intestinaux, se manifestant par des nausées et vomissements.
- hématologiques, caractérisés par un allongement du temps de prothrombine, et parfois des hématomes (même à la suite d'une unique dose orale d'ivermectine)[77], mais ces effets ne sont pas considérés comme importants[77].
- hépatiques, avec chez certains patients une hausse légère à modérée, mais temporaire du taux d'alanine aminotransférase[77].
- oculaires : Irritation légère de l'œil, a priori due à la présence de cadavres d'Onchocerca volvulus dans la cornée et dans la chambre antérieure de l'œil[77].
Indications thérapeutiques en médecine vétérinaire
Chiens
L’ivermectine est la principale substance utilisée contre la filaire du chien : une dose mensuelle prévient tout développement du parasite à l'étape tissulaire des microfilaires.
Certaines races de type-Colley sont plus sensibles à l'ivermectine. Les vétérinaires leurs prescrivent d'autres traitements préventifs de la filaire, car chez ces races la réaction aux avermectines est souvent mortelle. En revanche, la sélamectine (en), substitut chimique et artificiel des avermectines, et bien tolérée.
- Chez le colley et le berger des Shetland, elle est due à une mutation sur le gène MDR1 codant la glycoprotéine P[78] ; il existe un dépistage dans ces races.
- Chez le border, 3 mutations distinctes ont été identifiées, mais la plus fréquente est la même que pour les colleys et bergers des Shetland.
- Chez d'autres races comme le Skye terrier, il semblerait que ce soit une autre mutation du même gène qui est en cause, quand bien même l'administration d'ivermectine provoque chez cette race exactement les mêmes symptômes que chez le colley[79].
Des réactions létales à l'ivermectine ont été constatées dans les races suivantes :
- Colley ;
- Colley à poil court ;
- Berger des Shetland ;
- Border collie ;
- Berger australien ;
- Bobtail ;
- Berger blanc suisse ;
- Berger allemand ;
- Suomenlapinkoira ;
- Teckel ;
- Skye Terrier ;
- English Shepherd ;
- Whippet à poil long ;
- McNab (chien) (en), race de chien ;
- Wäller ;
- Silken Windhound ;
- Shiba inu.
Cette liste est incomplète, car tout chien croisé issu de ces races, et toute race ayant eu par le passé un apport de sang des races citées ci-dessus, peut être porteuse de la mutation rendant sensible à la molécule.
Chevaux
L’ivermectine est très répandue dans certains vermifuges pour les chevaux, avec des noms de marques commerciales comme Equimax, Equimectrin, Eqvalan, et Zimecterin. Elle est généralement administrée par voie orale sous forme d’une pâte déposée directement dans la bouche de l'animal par l'intermédiaire d'une seringue. L'ivermectine protège contre la plupart des parasites internes du cheval, y compris leur larves, excepté les vers plats.
Rongeurs
Le traitement le plus utilisé contre l’infestation des fourrures des rongeurs par les acariens est actuellement basé sur l'administration orale ou parentérale d’avermectines, une famille de lactones macrocycliques produites par la fermentation d’un micro-organisme tellurique le Streptomyces avermitilis. Ils ont une activité contre une large gamme de nématodes et d'arthropodes parasites des animaux domestiques à la concentration de 300 µg kg−1 ou moins.
À la différence des antibiotiques macrolides ou des polyènes (antifongiques), ils n’ont pas d'activité antibactérienne ni antifongique significative (Hotson, 1982).
Oiseaux
L’ivermectine est généralement utilisée contre les acariens chez les oiseaux, souvent pour des dermatoses squameuses de la face ou des pattes dues à un parasite, le Knemidokoptes (en). Dans de nombreux pays cette indication constitue une utilisation non conforme aux recommandations.
Émergence de résistances
Dès les années 1990, l’usage thérapeutique presque systématique des avermectines a comme inconvénient l'apparition de résistances chez les parasites-cibles, ce qui suggère de modérer l'utilisation de ces molécules (Clark, 1995).
Synergies
La recherche sur les synergies entre l'ivermectine (effet neurologique si elle franchit la barrière hématoencéphalique) et d'autres molécules antiparasitaires ou médicamenteuses a mis en évidence quelques synergies ; Ainsi :
- associée à la pipérazine, et au dichlorvos (souvent utilisés en association) la toxicité potentielle de l'ivermectine augmente, selon Toth (2000) ;
- les avermectines peuvent bloquer la sécrétion LPS-induite du facteur TNF (facteur onconécrosant), du NO (monoxyde d'azote), de la prostaglandine E2, et augmente la concentration intracellulaire de Ca2+ (Victorov, 2003). Une méthode efficace de réduction des ectoparasites qui soumettrait les animaux de laboratoire à moins de contraintes que l'administration par voie orale d'avermectine est certainement souhaitable.
- chez le chien Beagle, aux doses cliniques habituelles, le kétoconazole (administré à raison de 10 mg/kg durant 5 jours avant et après l'ivermectine, modifie la pharmacocinétique plasmatique de l'ivermectine (apportée par injection sous-cutanée unique à 0,05 mg/kg), de même pour son principal et premier métabolite[80]. La co-administration de ces deux produits augmente le taux plasmatique et le temps de séjour de l'ivermectine chez le chien, impliquant une exposition systémique accrue au produit[80].
Le kétoconazole ne modifie pas la production du métabolite de l'ivermectine, mais il semble inhiber l'élimination du médicament parental en interférant avec le transport de la P-gp[80].
Disponibilité dans le commerce
Le brevet de l’ivermectine a expiré. Son entrée dans le domaine public a permis la production de génériques et a encouragé son intégration dans la composition de plusieurs médicaments.
En France, plusieurs génériques existent en comprimés, comme Ivermectine Biogaran[81] 3 mg, ou Ivermectine Mylan, 3 mg[82]. Très bon marché à produire, une boite en générique de 4 comprimés à 6 mg d’ivermectine coûte, par exemple au Brésil , un peu plus de 4 euros (27 Reais) en mars 2021[83]. Si le prix en France est d'environ 8€, le prix varie aux États-Unis de 3,6$ à 4$[84].
Le laboratoire Galderma International commercialise la crème Soolantra[85] à 10 mg/g d'ivermectine contre la rosacée[86].
Notes et références
- « Fiche du composé Ivermectin », sur Alfa Aesar (consulté le ).
- (en) Gemma Sutton, James Bennett et Mark Bateman, « Effects of ivermectin residues on dung invertebrate communities in a UK farmland habitat », Insect Conservation and Diversity, vol. 7, no 1, , p. 64–72 (DOI 10.1111/icad.12030, lire en ligne, consulté le )
- Molécule du Stromectol ©
- Note du dictionnaire Vidal sur Mectizan ©
- « STROMECTOL », sur VIDAL (consulté le ).
- Note du dictionnaire Vidal sur Stromectol ©
- « L’OMS déconseille d’utiliser l’ivermectine pour traiter la COVID-19 en dehors des essais cliniques », sur https://www.who.int/, Organisation mondiale de la santé, (consulté le ).
- (en) Sneha Mordani, « Why HCQ and Ivermectin were removed from India’s Covid-19 treatment protocol », sur https://www.indiatoday.in/, India Today, (consulté le ).
- Dourmishev, A. L., Dourmishev, L. A. and Schwartz, R. A., Ivermectin: pharmacology and application in dermatology. Int J Dermatol, 44(12): 981-8, 2005.
- Aquilina, C., Viraben, R. and Sire, S., Ivermectin-responsive Demodex infestation during human immunodeficiency virus infection. A case report and literature review. Dermatology, 205(4): 394-7, 2002.
- « communiqué du comité Nobel » (consulté le )
- Cully et coll, 1994 ; Cully et coll, 1997, Dent et coll, 1997
- Dent et coll, 2000, Kane et coll, 2000
- Lerchner et coll, 2007
- Ludmerer et autres., 2002, Blackhall 2003
- MSD, 1988
- Schinkle et coll, 1994
- (en) R. Perez et C. Godoy, « Plasma Profiles of Ivermectin in Horses following Oral or Intramuscular Administration », sur Journal of Veterinary Medicine Series A, (ISSN 0931-184X, DOI 10.1046/j.1439-0442.2003.00531.x, consulté le ), p. 297–302
- Cours d'internat www.pharmaetudes.com/, « Antiprotozoaires Intestinaux », Antiprotozoaires et Antihelmintiques intestinaux, ? (lire en ligne [PDF])
- Solange Kiki-Mvouaka et Anne Lespine (dir.), Rôle de la P-glycoprotéine dans le devenir des lactones macrocycliques antiparasitaires chez l’animal, Université de Toulouse, , 120 p. (OCLC 690601323)
- R. A. Lovell, « Ivermectin and piperazine toxicoses in dogs and cats », The Veterinary Clinics of North America. Small Animal Practice, vol. 20, no 2, , p. 453–468 (ISSN 0195-5616, PMID 2180189, DOI 10.1016/s0195-5616(90)50038-8, lire en ligne, consulté le )
- Répertoire vétérinaire 2014 p. 59-65, consultable sur le site du C.B.I.P.
- « Extoxnet pip - abamectin », sur orst.edu (consulté le ).
- Merck Veterinary Manual : Ivermectin
- « vgl.ucdavis.edu/research/canin… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- (en) « Health & Safety Consultants London UK », sur Health & Safety Consultants UK (consulté le ).
- « vetmed.wsu.edu/depts-VCPL/ »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- David Bralet, « Influence du léchage sur la pharmacocinétique de l'ivermectine pour-on chez les bovins », (consulté le )
- Julien Clément, « Application d'ivermectine en pour-on : conséquences du léchage entre bovins sur les populations d'Ostertagia ostertagi et Cooperia oncophora », (consulté le )
- Michel Alvinerie, Pierre-Louis Toutain, Jean-François Sutra et Anne Lespine, Ecotoxicity of antiparasitics: optimization of the use of pharmaceutical forms of ivermectin and its analogues, INRAE, (lire en ligne)
- Pierre Galtier, Michel Alvinerie, Philippe Berny, Jean-Claude Fournier, Dominique Kerboeuf, et al.. Evaluation de l’impact éco-toxicologique résultant de l’usage de médicaments antiparasitaires en élevage extensif. 2nd Séminaire d’Ecotoxicologie de l’INRA, Sep 2002, Antibes, France. hal-01600135
- (en) José R. Verdú, Jorge M. Lobo, Francisco Sánchez-Piñero et Belén Gallego, « Ivermectin residues disrupt dung beetle diversity, soil properties and ecosystem functioning: An interdisciplinary field study », Science of The Total Environment, vol. 618, , p. 219–228 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2017.10.331, lire en ligne, consulté le )
- (en) Sarah A. Beynon, Warwick A. Wainwright et Michael Christie, « The application of an ecosystem services framework to estimate the economic value of dung beetles to the U.K. cattle industry », Ecological Entomology, vol. 40, no S1, , p. 124–135 (ISSN 1365-2311, DOI 10.1111/een.12240, lire en ligne, consulté le )
- (en) Bernadette Kavanaugh et Paul Manning, « Ivermectin residues in cattle dung impair insect-mediated dung removal but not organic matter decomposition », Ecological Entomology, vol. 45, no 3, , p. 671–678 (ISSN 1365-2311, DOI 10.1111/een.12838, lire en ligne, consulté le )
- (en) Bryony Sands et Richard Wall, « Dung beetles reduce livestock gastrointestinal parasite availability on pasture », Journal of Applied Ecology, vol. 54, no 4, , p. 1180–1189 (DOI 10.1111/1365-2664.12821, lire en ligne, consulté le )
- (en) Christian Mougin et J. C. Fournier, « Fate of ivermectin in soil and impact on micro-organisms », (consulté le ), p. 1 p.
- M. Develoux, « Ivermectine », Annales de Dermatologie et de Vénéréologie, vol. 131, no 6, Part 1, , p. 561–570 (ISSN 0151-9638, DOI 10.1016/S0151-9638(04)93668-X, lire en ligne, consulté le )
- Ramiro Picoli Nippes, Paula Derksen Macruz, Gabriela Nascimento da Silva et Mara Heloisa Neves Olsen Scaliante, « A critical review on environmental presence of pharmaceutical drugs tested for the covid-19 treatment », Process Safety and Environmental Protection: Transactions of the Institution of Chemical Engineers, Part B, vol. 152, , p. 568–582 (ISSN 0957-5820, PMID 34226801, PMCID 8243632, DOI 10.1016/j.psep.2021.06.040, lire en ligne, consulté le )
- Matteo Negro, Antonio Rolando et Claudia Palestrini, « The Impact of Overgrazing on Dung Beetle Diversity in the Italian Maritime Alps », Environmental Entomology, vol. 40, no 5, , p. 1081–1092 (ISSN 0046-225X, DOI 10.1603/EN11105, lire en ligne, consulté le )
- (en) Bruce A. Halley, William J.A. VandenHeuvel et Peter G. Wislocki, « Environmental effects of the usage of avermectins in livestock », Veterinary Parasitology, vol. 48, nos 1-4, , p. 109–125 (DOI 10.1016/0304-4017(93)90149-H, lire en ligne, consulté le )
- ex : l'ingestion de crottins par de jeunes chiens appartenant à l'une des races canines particulièrement sensibles à cette molécule peut leur être fatale CBIP vet
- (en) K. D. Floate, « Endectocide residues affect insect attraction to dung from treated cattle: implications for toxicity tests », Medical and Veterinary Entomology, vol. 21, no 4, , p. 312–322 (DOI 10.1111/j.1365-2915.2007.00702.x, lire en ligne, consulté le )
- José R. Verdú, Vieyle Cortez, Antonio J. Ortiz et Estela González-Rodríguez, « Low doses of ivermectin cause sensory and locomotor disorders in dung beetles », Scientific Reports, vol. 5, no 1, (ISSN 2045-2322, DOI 10.1038/srep13912, lire en ligne, consulté le )
- (en) Roger Iván Rodríguez-Vivas, Gertrudis del Socorro Basto-Estrella, Enrique Reyes-Novelo et Luis Carlos Pérez-Cogollo, « Onthophagus landolti and Canthon indigaceus chevrolati (Coleoptera: Scarabaeinae) are attracted to the feces of ivermectin-treated cattle in the Mexican tropics », Revista de Biología Tropical, vol. 67, no 1, , p. 254–265 (ISSN 0034-7744, DOI 10.15517/rbt.v67i1.32917, lire en ligne, consulté le )
- (en) C. Sommer, J. Grønvold, P. Holter et M. Madsen, « Dung burial activity and development of ivermectin exposed Diastellopalpus quinquedens in a field experiment », Entomologia Experimentalis et Applicata, vol. 66, no 1, , p. 83–89 (ISSN 1570-7458, DOI 10.1111/j.1570-7458.1993.tb00695.x, lire en ligne, consulté le )
- (en) Norma M. OâHEA, Laura Kirwan, Paul S. Giller et John A. Finn, « Lethal and sub-lethal effects of ivermectin on north temperate dung beetles, Aphodius ater and Aphodius rufipes (Coleoptera: Scarabaeidae) », Insect Conservation and Diversity, vol. 3, no 1, , p. 24–33 (DOI 10.1111/j.1752-4598.2009.00068.x, lire en ligne, consulté le )
- (en) Gertrudis S. Basto-Estrella, Roger I. Rodríguez-Vivas, Hugo Delfín-González et Enrique Reyes-Novelo, « Dung beetle (Coleoptera: Scarabaeinae) diversity and seasonality in response to use of macrocyclic lactones at cattle ranches in the mexican neotropics », Insect Conservation and Diversity, vol. 7, no 1, , p. 73–81 (ISSN 1752-4598, DOI 10.1111/icad.12035, lire en ligne, consulté le )
- (en) Magdalena Cruz Rosales, Imelda Martínez M, José López-Collado et Mónica Vargas-Mendoza, « Effect of ivermectin on the survival and fecundity of Euoniticellus intermedius (Coleoptera: Scarabaeidae) », Revista de Biología Tropical, vol. 60, no 1, , p. 333–345 (ISSN 0034-7744, lire en ligne, consulté le )
- Virlouvet G. 2005. Le Point Vétérinaire. 255. 42-45
- (en) Domhnall Finch, Henry Schofield, Kevin D. Floate et Laura M. Kubasiewicz, « Implications of Endectocide Residues on the Survival of Aphodiine Dung Beetles: A Meta‐Analysis », Environmental Toxicology and Chemistry, vol. 39, no 4, , p. 863–872 (ISSN 0730-7268 et 1552-8618, DOI 10.1002/etc.4671, lire en ligne, consulté le )
- (en) Kerstin Krüger et Clarke H. Scholtz, « Changes in the structure of dung insect communities after ivermectin usage in a grassland ecosystem. II. Impact of ivermectin under high-rainfall conditions », Acta Oecologica, vol. 19, no 5, , p. 439–451 (DOI 10.1016/S1146-609X(98)80049-0, lire en ligne, consulté le )
- (en) F. Errouissi et J.-P. Lumaret, « Field effects of faecal residues from ivermectin slow-release boluses on the attractiveness of cattle dung to dung beetles », sur Medical and Veterinary Entomology, (DOI 10.1111/j.1365-2915.2010.00891.x, consulté le ), p. 433–440
- (en) Jacob R. Pecenka et Jonathan G. Lundgren, « Effects of herd management and the use of ivermectin on dung arthropod communities in grasslands », Basic and Applied Ecology, vol. 40, , p. 19–29 (DOI 10.1016/j.baae.2019.07.006, lire en ligne, consulté le )
- Jorge Ari Noriega et Emilio Realpe, « Altitudinal Turnover of Species in a Neotropical Peripheral Mountain System: A Case Study With Dung Beetles (Coleoptera: Aphodiinae and Scarabaeinae) », Environmental Entomology, (ISSN 0046-225X et 1938-2936, DOI 10.1093/ee/nvy133, lire en ligne, consulté le )
- Kerstin Krüger et Clarke H. Scholtz, « Changes in the structure of dung insect communities after ivermectin usage in a grassland ecosystem. II. Impact of ivermectin under high-rainfall conditions », Acta Oecologica, vol. 19, no 5, , p. 439–451 (ISSN 1146-609X, DOI 10.1016/s1146-609x(98)80049-0, lire en ligne, consulté le )
- (en) V. H. Suarez, A. L. Lifschitz, J. M. Sallovitz et C. E. Lanusse, « Effects of ivermectin and doramectin faecal residues on the invertebrate colonization of cattle dung », Journal of Applied Entomology, vol. 127, no 8, , p. 481–488 (ISSN 0931-2048 et 1439-0418, DOI 10.1046/j.0931-2048.2003.00780.x, lire en ligne, consulté le )
- A. Azzi, « Thèse : Ivermectine : pharmacologie, toxicologie, efficacité clinique et impact sur l'environnement », (consulté le )
- Alvinerie, M., Sutra, J. F., Galtier, P., & Toutain, P. L. (1993). Cinetiques plasmatiques de l'ivermectine chez la vache. Faits nouveaux et hypotheses sur la presence de residus dans le lait. Recueil de Medecine Veterinaire, 169(4), 259-261.
- M. Alvinerie et J. F. Sutra, « Résidus d'ivermectine dans le lait chez la vache laitière traitée pendant la période de tarissement avec la posologie recommandée par l'autorisation de mise sur le marché », sur Revue de Médecine Vétérinaire, (consulté le ), p. 115
- Desperiez F (1988) Élimination de l'ivermectine par le lait: étude pharmacocinétique chez la vache laitière et signification toxicologique de ses résidus. Thèse. 88-TOU 3-4121.
- P. L. TOUTAIN, M. CAMPAN., P. GALTIER et M. ALVINERIE, « Kinetic and insecticidal properties of ivermectin residues in the milk of dairy cows », Journal of Veterinary Pharmacology and Therapeutics, vol. 11, no 3, , p. 288–291 (ISSN 0140-7783 et 1365-2885, DOI 10.1111/j.1365-2885.1988.tb00155.x, lire en ligne, consulté le )
- Alvinerie, M., Sutra, J. F., & Galtier, P. (1993). Ivermectin in goat plasma and milk after subcutaneous injection. Veterinary Research, 24(5), 417-421.
- Alvinerie M. Sutra J. F. Toutain P. L. « Résidus d'ivermectine dans le lait chez la vache laitière traitée pendant la période de tarissement avec la posologie recommandée par l'autorisation de mise sur le marché » Revue de médecine vétérinaire (ISSN 0035-1555) ; CODEN RVMVAH Source / Source 1997, vol. 148, no 2, p. 115-116 [2 page(s) ; École nationale vétérinaire de Toulouse, Toulouse, FRANCE (1937) Fiche INIST-CNRS
- (en) WHO Model List of Essential Medicines, 18th list, avril 2013
- https://www.headlice.org/news/1997/ivermectin-deaths.htm
- https://base-donnees-publique.medicaments.gouv.fr/affichageDoc.php?specid=69444281&typedoc=N
- https://www.lemoniteurdespharmacies.fr/actu/actualites/actus-medicaments/150901-soolantra-une-creme-anti-inflammatoire-dans-la-rosacee.html
- (en) Chosidow O, Giraudeau B, Cottrell J et al. « Oral ivermectin versus malathion lotion for difficult-to-treat head lice » N Engl J Med, 2010;362:896-905.
- (en) Pariser DM, Meinking TL, Bell M, Ryan WG, « Topical 0.5% Ivermectin lotion for treatment of head lice » N Engl J Med, 2012;367:1687-93.
- « Éliminer les poux c'est possible mais ça n'est pas autorisé », sur lepoint.fr, (consulté le )
- (en) Pierre Kory, Gianfranco Umberto Meduri, Joseph Varon, Jose Iglesias et Paul E. Marik, « Review of the Emerging Evidence Demonstrating the Efficacy of Ivermectin in the Prophylaxis and Treatment of COVID-19 », American Journal of Therapeutics, vol. 28, no 3, , e299-e318 (PMCID 8088823, DOI 10.1097/MJT.0000000000001377, lire en ligne)
-
(en) Catherine Offord, « Frontiers Removes Controversial Ivermectin Paper Pre-Publication », sur https://www.the-scientist.com/, The Scientist, (consulté le ) :
« a series of strong, unsupported claims based on studies with insufficient statistical significance, and at times, without the use of control groups. »
« Further, the authors promoted their own specific ivermectin-based treatment which is inappropriate for a review article and against our editorial policies. In our view, this paper does not offer an objective nor balanced scientific contribution to the evaluation of ivermectin as a potential treatment for COVID-19. »
-
(en) Melissa Davey, « Huge study supporting ivermectin as Covid treatment withdrawn over ethical concerns », sur https://www.theguardian.com/, The Guardian, (consulté le ) :
« “In their paper, the authors claim that four out of 100 patients died in their standard treatment group for mild and moderate Covid-19,” Lawrence said. “According to the original data, the number was 0, the same as the ivermectin treatment group. In their ivermectin treatment group for severe Covid-19, the authors claim two patients died, but the number in their raw data is four.” »
- (en) « Why You Should Not Use Ivermectin to Treat or Prevent COVID-19 », sur https://www.fda.gov/, Food and Drug Administration, (consulté le ).
- (en) « EMA advises against use of ivermectin for the prevention or treatment of COVID-19 outside randomised clinical trials », sur https://www.ema.europa.eu/, Agence européenne des médicaments, (consulté le ).
- (en) Hunter's Tropical Medicine and Emerging Infectious Diseases (lire en ligne)
- Le colley : MDR1, quand la génétique s'en mêle.
- http://www.skyeterrier.org/ivermectimstudy.htm
- C Hugnet, Anne Lespine, Roger Alvinerie (2007) Multiple oral dosing of ketoconazole increases dog exposure to ivermectin. Journal of Pharmacy and Pharmaceutical Sciences, Canadian Society for Pharmaceu- tical Sciences, 10 (3), p. 311-318. hal-02655765
- https://base-donnees-publique.medicaments.gouv.fr/extrait.php?specid=62026945
- https://www.vidal.fr/medicaments/gammes/ivermectine-mylan-87531.html
- https://www.creapharma.ch/medicaments-sommaire/ivermectine
- https://www.drugpatentwatch.com/p/drug-price/drugname/index.php?query=ivermectin
- https://www.drugpatentwatch.com/p/tradename/SOOLANTRA
- https://www.vidal.fr/actualites/16199-soolantra-premier-medicament-topique-a-base-d-ivermectine-dans-le-traitement-de-la-rosacee.html
Voir aussi
Bibliographie
- (en) U.S. National Library of Medicine. Hazardous Substances Databank. Bethesda, MD, 1995.10-9
- (en) Lankas, G. R and Gordon, L. R. « Toxicology » In Ivermectin and Abamectin, Campbell, W. C., Éd. Springer Verlag, New York, NY, 1989.10-142.
- (en) U.S. Environmental Protection Agency. Pesticide Fact Sheet Number 89.2: Avermectin B1. Office of Pesticides and Toxic Substances, Washington, DC, 1990.10-143
- Clark JM, 1995, with Scott JG, Campos F, Bloomquist JR, « Resistance to avermectins: extent, mechanisms, and management implications » Annu Rev Entomol. 40:1-30.
- Toth LA, 2000, with Oberbeck C, Straign CM, Frazier S, Rehg JE, « Toxicity evaluation of prophylactic treatments for mites and pinworms in mice » Contemp Top Lab Anim Sci. Mar;39(2):18-21.
- Viktorov AV, 2003, with Yurkiv VA, « Effect of ivermectin on function of liver macrophages » Bull Exp Biol Med. Dec;136(6):569-71.
- Cully, D.F., Vassilatis, D.K., Liu, K.K., Paress, P.S., Van der Ploeg, L.H., Schaeffer, J.M., Arena, J.P., 1994. « Cloning of an avermectin-sensitive glutamate-gated chloride channel from Caenorhabditis elegans » Nature. 371(6499):707-11.
- Cully, D.F., Paress, P.S., Liu, K.K., Schaeffer, J.M., Arena, J.P., 1996. « Identification of a Drosophila melanogaster glutamate-gated chloride channel sensitive to the antiparasitic agent avermectin » J.f Biol. Chem. 271(33):20 187-91.
- Dent, J.A., Davis, M. Wayne & Avery, L.A., 1997. « avril-15 encodes a chloride channel subunit that mediates inhibitory glutamatergic neurotransmission and ivermectin sensitivity in Caenorhabditis elegans » EMBO J. 16(19): 5867-5879.
- Dent, J.A., Smith, M., Vassilatis, D.K. and Avery, L., 2000. « The genetics of ivermectin resistance in Caenorhabditis elegans » Proc. Nat. Acad. Sci. U S A 97(6): 2674-2679.
- Dent JA, « Evidence for a diverse cys-loop ligand-gated ion channel superfamily in early bilateria » J Mol Evol. 2006;62:523-535.
- Kane, N.S., Hirschberg, B., Qian, S., Hunt, D., Thomas, B., Brochu, R., Ludmerer, S.W., Zheng, Y., Smith, M., Arena, J.P., Cohen, C.J., Schmatz, D., Warmke, J., Cully, D.F., 2000. « Drug-resistant Drosophila indicate glutamate-gated chloride channels are targets for the antiparasitics nodulisporic acid and ivermectin » Proc. Nat. Acad. Sci. U S A 97(25):13 949-54.
- Lerchner, W., Xiao, C., Nashmi, R., Slimko, E.M., van Trigt, L., Lester, H.A., and Anderson, D.J., 2007. « Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl− channel » Neuron. 54(1)1: 35-49.
- Ludmerer, S.W., Warren. V.A., Williams, B.S., Zheng, Y., Hunt, D.C., Ayer, M.B., Wallace, M.A., Chaudhary, A.G., Egan, M.A., Meinke, P.T., Dean, D.C., Garcia, M.L... Cully, D.F., Smith, M.M., 2002. « Ivermectin and nodulisporic acid receptors in Drosophila melanogaster contain both gamma-aminobutyric acid-gated Rdl and glutamate-gated GluCl alpha chloride channel subunits » Biochemistry. 41(20):6548-60.
- Schinkel, A.H. Smit, J.J., van Tellingen, O., Beijnen, J.H., Wagenaar, E., van Deemter, L., Mol, C.A., van der Valk, M.A., Robanus-Maandag, E.C., Riele, H.P.et al. 1994. « Disruption of the mouse mdr1a P-glycoprotein gene leads to a deficiency in the blood-brain barrier and to increased sensitivity to drugs » Cell. 77(4):491-502.
Liens externes
- Compendium suisse des médicaments : spécialités contenant Ivermectine
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) International Union of Pharmacology
- (en) Medical Subject Headings
- (en) National Drug File
- (en) NCI Thesaurus
- (en) PatientLikeMe

