Cachexie cancéreuse
La cachexie cancéreuse désigne un trouble du métabolisme provoqué par un cancer, qui provoque chez le patient une consomption (cachexie) et un amaigrissement. La cachexie cancéreuse est une complication fréquente des maladies cancéreuses, en particulier dans le cas de tumeurs malignes de l'appareil digestif, et qui a des conséquences défavorables sur l'évolution de la maladie, sur la qualité de vie et le pronostic, et qui peut parfois devenir par elle-même immédiatement une menace vitale. La cachexie cancéreuse est un facteur important de la haute mortalité des maladies cancéreuses[1] - [2].
Les causes moléculaires et biochimiques qui conduisent à une cachexie cancéreuse sont hautement complexes et pas encore complètement élucidées, voire comprises. Un rôle important dans la formation de ce syndrome est joué par des produits métaboliques de la tumeur elle-même, et par des messagers chimiques, qui sont formés dans le corps du patient comme conséquence de la maladie cancéreuse. À ceci s'ajoutent des facteurs psychologiques ainsi que des effets secondaires des traitements anticancéreux, qui peuvent conduire à une perte d'appétit du patient. Contrairement à la perte de poids par sous-alimentation, la perte de substance dans la cachexie cancéreuse ne se limite pas aux réserves de graisse, mais fait aussi diminuer la musculature squelettique.
Il n'y a pour l'instant pas de traitement curatif efficace. Toutes les approches thérapeutiques essayées jusqu'à présent ne sont que palliatives, c'est-à-dire uniquement aux fins d'atténuer la maladie.
Classement et définition
La plupart des auteurs préfèrent pour la cachexie cancéreuse le concept de syndrome. Cette désignation rend mieux compte de la situation que le classement comme maladie proprement dite[4]. Dans la littérature anglo-saxonne, on parle presque toujours de cancer cachexia syndrome (CCS) ou encore de cancer anorexia-cachexia syndrome (CACS). La cachexie est un mot-valise formé du grec κακὸς (kakos) = mauvais et de ἕξiς (hexis) = état[5] - [6].
En général, on décrit la cachexie comme un syndrome multifactoriel, qui s'attaque à toutes les parties du corps et qui peut être très simplement établi dans sa forme avancée par une perte massive de graisse subcutanée ainsi que de musculature squelettique[7]. Actuellement, il n'y a pas de définition stricte ou standardisée pour la cachexie ni pour la cachexie cancéreuse[8] - [9], ce qui a été réclamé bien souvent, la situation étant inadéquate en raison de la haute prévalence et de la gravité de ce syndrome[10]. La même chose est valable en ce qui concerne un classement de la gravité. Une des raisons pour cela est le manque de biomarqueurs fiables, avec lesquels on pourrait caractériser le diagnostic de cachexie cancéreuse avec des valeurs mesurables, et par là la classer. Par manque de classement, il n'y a pas pour l'instant aucun schéma de traitement adapté à la gravité du syndrome[7].
Pour les études cliniques, on a utilisé jusqu'à maintenant des définitions très différentes pour la cachexie cancéreuse, orientées par exemple vers la perte de masse corporelle en pourcentage, ou le passage sous une valeur donnée de l'indice de masse corporelle. Le manque d'une définition stricte rend beaucoup plus difficile la comparaison entre diverses études cliniques[7].
Selon la définition choisie, on trouve des pourcentages différents de patients cancéreux qui souffrent aussi de cachexie. Par exemple, on a analysé un groupe de 8 541 patients du cancer atteints de tumeurs solides, selon quatre critères différents. En prenant pour critère le diagnostic lié à la CIM-9, 2,4 % des patients auraient une cachexie cancéreuse. En élargissant aux classes CIM-9 de cachexie, d'anorexie, de perte de poids anormale ou de problèmes alimentaires, on aurait eu 5,5 %. Si l'on prend comme critère la prescription de médicaments comme le mégestrol, l'oxandrolone, la somatotropine ou le dronabinol, qui indiquent une médication contre la cachexie cancéreuse, on trouve 6,4 % des patients. Si le critère pour la cachexie cancéreuse est une perte de masse corporelle supérieure à 5 %, alors 14,7 % de ces patients du cancer auraient rempli le critère[11].
L'absence de définition de la cachexie a des effets négatifs sur le diagnostic et le traitement des patients atteints. De même, le développement et l'autorisation de médicaments potentiels en sont rendus plus difficiles. Les 13 et , on a proposé une nouvelle définition de la cachexie dans le cadre de la Cachexia Consensus Conference à Washington, D.C.. Selon cette définition la cachexie est « un syndrome métabolique complexe, causé par une maladie chronique et caractérisé par la perte de masse musculaire, avec ou sans perte de graisse. L'anorexie (perte de l'appétit), les inflammations, la résistance à l'insuline et une augmentation du catabolisme des protéines musculaires sont des symptômes secondaires d'une cachexie. Il faut distinguer de la cachexie, qui est reliée à une augmentation du taux de morbidité : la sous-alimentation, la perte de masse musculaire liée à l'âge, les dépressions primaires, la malabsorption (utilisation diminuée des nutriments) et l'hyperthyroïdie (fonctionnement exagéré de la glande thyroïde)[12]. »
Une recommandation récente définit une cachexie quand :
- la masse corporelle diminue de plus de 5 % en moins d'un an ;
- et simultanément au moins trois des cinq critères suivants sont réunis :
- perte de force musculaire,
- fatigue,
- anorexie,
- faible indice de masse non grasse,
- valeurs biochimiques anormales :
- valeurs élevées de biomarqueurs d'inflammation,
- anémie (Hb < 12 g/dl),
- basse valeur de l'albumine sérique.
Cependant, cette proposition de définition n'a pas encore été utilisée dans des études ni épidémiologiques ni cliniques[12].
Épidémiologie et importance en politique de santé
| Organe cancéreux | Incidence de la perte de poids |
| Pancréas | 83 % |
| Estomac | 83 % |
| Œsophage | 79 % |
| Tête-cou | 72 % |
| Côlon-rectum | 55 - 60 % |
| Bronches | 50 - 66 % |
| Prostate | 56 % |
| Sein | 10 - 35 % |
| Tous | moyenne 63 % Données de[13] |
Environ 50 % de tous les malades du cancer sont atteints au cours de leur maladie de cachexie cancéreuse[14]. La probabilité d'une cachexie cancéreuse y dépend très fortement du type de cancer[15]. Après le sepsis (infection générale), la cachexie cancéreuse est la cause la plus courante de décès en cas de maladie cancéreuse. Selon les auteurs, la proportion des cachexies cancéreuses dans les causes de décès de cancer oscille de 20 à 50 %[1] - [15] - [16] - [17] - [18] - [19] - [20]. La largeur de l'incertitude d'estimation des données de prévalence (nombre de cas dans une population) est causée par le manque déjà signalé de définition de la cachexie cancéreuse.
Le type de cancer joue un grand rôle dans la probabilité de survenue d'une cachexie cancéreuse. C'est ainsi que par exemple, environ 80 % des patients atteints d'un cancer du pancréas en meurent, et environ 30 à 50 % des patients avec un cancer dans le domaine du système digestif[15]. Dans le cas des tumeurs du pancréas, l'incidence d'une cachexie cancéreuse, avec 80 % au moment du diagnostic du cancer, est la plus élevée[21]. Dans le cas d'un cancer du système digestif (estomac-intestin), jusqu'à 85 % des malades peuvent subir une cachexie cancéreuse au cours de leur maladie[22]. Les cas de tumeurs solides donnent une probabilité nettement supérieure de cachexie cancéreuse que les maladies cancéreuses du système hématopoïétique (leucémies, syndromes myélodysplasiques et autres néoplasies hématologiques malignes)[23]. Une exception parmi les tumeurs solides est représentée par le cancer du sein. Dans ce cas, la probabilité de cachexie cancéreuse est significativement plus basse[23] - [24] - [25]. Le développement de la cachexie cancéreuse se déroule aussi, pour le même type de tumeur, très individuellement selon le patient. La cachexie cancéreuse peut être observée chez un malade donné dans tous les stades du développement du cancer, mais se trouve particulièrement fréquente au stade terminal de la maladie[1].
Les enfants et les personnes âgées sont particulièrement fréquemment touchés par la cachexie cancéreuse[23].
En valeur absolue, la cachexie cancéreuse est l'une des causes de décès les plus fréquentes. En Allemagne, une estimation grossière conduit à 50 000 décès par an par cachexie cancéreuse[26]. En raison du manque de définition de la cachexie cancéreuse et des pratiques usuelles d'établissement du certificat de décès, il n'y a pas de données statistiques disponibles.
Tableau clinique
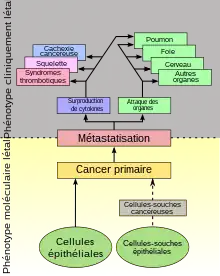
Une cachexie cancéreuse est essentiellement caractérisée par une perte de poids du patient, souvent liée avec une anorexie (perte d'appétit), des signes d'inflammation, une résistance à l'insuline et une destruction de la musculature squelettique[28] - [29]. Dans bien des cas, l'anorexie est un symptôme de la cachexie cancéreuse, cependant cette dernière peut se développer aussi en l'absence d'anorexie[11] - [30] - [31]. La survenue de l'anorexie accélère la progression de la cachexie cancéreuse[18].
Alors que chez les personnes en bonne santé, une perte de poids est compensée par une augmentation de l'appétit, et par suite par une prise de nourriture augmentée, ceci n'est pas le cas chez les malades cachexiques[23] - [25]. La cachexie cancéreuse provoque chez les malades atteints une faiblesse générale, une perte de force et une immobilité, ainsi qu'une fatigue, une perte de motivation et des dépressions[32] - [33] - [34], ce qui, à nouveau, conduit à une dégradation de la qualité de vie[35] - [36]. La qualité de vie estimée par les concernés eux-mêmes est compromise substantiellement par la cachexie cancéreuse[13] - [37]. Certains effets secondaires de la cachexie cancéreuse conduisent à une aggravation de ce syndrome par un effet de rétroaction (processus auto-amplificateur). Par exemple, la destruction des protéines musculaires conduit à une augmentation de la consommation d'énergie, ce qui à son tour conduit à une aggravation de la maladie[24]. La perte d'appétit et la nausée conduisent à une diminution de la prise de nourriture et renforcent par là aussi l'état catabolique[25]. La destruction des protéines est en fait limitée à la musculature squelettique. Les organes internes sont par contre à peine concernés. Ce trait distingue aussi le tableau de la cachexie cancéreuse et celui de la malnutrition, dans laquelle - après épuisement des réserves de graisse - les protéines sont décomposées, aussi bien les squelettiques que les viscérales. La masse du foie peut même chez les patients cachexiques augmenter notablement en raison des activités métaboliques accrues et de la production de protéines de phase aigüe[1] - [25].
Diagnostic
La première condition pour le diagnostic d'une cachexie cancéreuse est l'existence d'une maladie cancéreuse diagnostiquée avec sûreté[25]. Le diagnostic de la cachexie cancéreuse elle-même est très difficile dans la plupart des cas. Une perte de poids chez un patient du cancer n'est pas forcément une cachexie. Une série de facteurs psychologiques y jouent également un rôle, comme une atrésie ou une sténose du tractus digestif, qui peut être une conséquence de la croissance d'une tumeur. Des inflammations des muqueuses de la bouche (stomatite), de la sécheresse buccale ou des mycoses de la bouche (muguet buccal) sont des manifestations secondaires possibles d'un cancer, qui influencent négativement la prise d'aliments. Également, des mesures diagnostiques, ou avant tout thérapeutiques, en particulier la chimiothérapie ou la radiothérapie peuvent conduire à des pertes de poids par diminution de l'appétit. Même quand ces influences peuvent être exclues, il reste difficile de pratiquer un diagnostic certain[25] - [34]. Actuellement, les critères les plus importants pour l'établissement du diagnostic sont l'anamnèse et l'examen corporel du patient. Le poids corporel avant le début de la maladie y sert de référence[23]. Des recherches anthropométriques peuvent être entreprises pour le diagnostic de la cachexie cancéreuse. Celles-ci sont - outre la perte de poids déjà mentionnée - par exemple la mesure de la circonférence du bras ou l'épaisseur d'un pli de peau[25]. La bio-impédance permet de mesurer la masse hors graisse du patient[23]. Mais cette méthode n'est pas disponible dans bien des cliniques, et n'est pas encore établie comme standard diagnostique de la cachexie cancéreuse[25].
Certains paramètres de laboratoire peuvent être invoqués pour étayer le diagnostic. Leur pouvoir prédictif est cependant très limité par des modifications physiologiques - conditionnées par la maladie maligne de fond et certaines mesures thérapeutiques. Ce type de paramètre de laboratoire appuyant le diagnostic peut être le contenu en albumine sérique, souvent diminué dans le cas de la cachexie cancéreuse, mais qui peut être falsifié par des perturbations fonctionnelles du foie ou du rein, éventuellement provoquées par la maladie[23]. La concentration en protéine C réactive (CRP) peut souvent, à la suite d'une cachexie cancéreuse, être observée comme protéine de phase aigüe (PPA)[34]. D'autres PPA, biomarqueurs typiques d'inflammation, sont la transferrine, la transthyrétine et la ferroxidase[22]. Par ailleurs, des PPA peuvent être observées pendant la maladie cancéreuse en l'absence de cachexie, si bien que ces marqueurs ne sont pas une mesure sûre pour la pose d'un diagnostic de cachexie[22] - [25]. On peut aussi montrer dans le sang des patients des valeurs élevées de la concentration en glycérine et en catécholamines. La valeur élevée de la concentration en glycérine est due au catabolisme renforcé des graisses corporelles[1]. Un symptôme secondaire de la cachexie cancéreuse est souvent une anémie[29].
Au moment du diagnostic de cancer, dans environ 80 % des cas de cancers du système digestif supérieur, et 60 % des patients avec un cancer du poumon, on note une perte de poids importante (plus de 10 % en six mois)[14] - [18]. Dans bien des cas, c'est la perte de poids remarquée par le patient lui-même qui est le premier symptôme du cancer, qui est alors - sur la base de l'examen médical - diagnostiqué comme cause de la perte de poids[31] - [38] - [39].
Au moment du diagnostic du cancer, jusqu'à 50 % se plaignent d'anorexie, une forme de perte d'appétit et de sensation prématurée de satiété[1] - [40].
Pathogenèse (mode d'apparition)
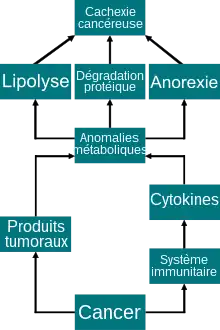
Une cachexie cancéreuse apparaît par un échange complexe, pas encore complètement éclairci dans ses détails, de produits métaboliques de la tumeur et de messagers chimiques, formés dans le corps du patient à la suite de la maladie cancéreuse. Ces corps provoquent un catabolisme, une mobilisation accélérée des graisses dans les tissus adipeux, un renforcement du catabolisme et un ralentissement de l'anabolisme des protéines dans la musculature squelettique, ainsi qu'une consommation d'énergie augmentée des cellules du corps (hypermétabolisme).
La cachexie cancéreuse implique un état inflammatoire chronique — semblable à celui d'une infection, d'une inflammation ou d'une blessure dans un tissu. Ce sont diverses cytokines inflammatoires, des prostaglandines, et de facteurs surexprimés par les cellules cancéreuses elles-mêmes. Toutes ces substances interviennent directement dans les circuits régulateurs périphériques et centraux de la prise de nourriture et du métabolisme, et sont donc capables de déclencher une atrophie musculaire[41] - [42]. En outre, d'autres facteurs interviennent, comme une prise de nourriture diminuée, une mauvaise digestion, une malabsorption, notamment à cause des sentiments dépressifs du patient. Aussi les perturbations du sens du goût ou du centre de la faim peuvent contribuer à la cachexie cancéreuse. Des saignements répétitifs, comme des ulcères ou des polypes dans le cas de cancers du système digestif, peuvent aussi amener à un surcroît de perte d'albumine dans le corps[43].
Cytokines
À partir d'une certaine taille de la tumeur, il s'installe une nécrose tumorale. Ceci signifie que le centre de la tumeur - sous-irrigué par le sang - voit mourir les cellules de la tumeur. Dans la décomposition de ces cellules tumorales, parmi d'autres, le facteur de nécrose tumorale TNFα (précédemment nommé cachexine, par référence à la cachexie)[44] - [45], et une série d'autres cytokines sont déversées. Ces substances perturbent avant tout les fonctions des hépatocytes (cellules du foie), et conduisent à un bilan négatif de l'azote. Le métabolisme devient déséquilibré dans le sens du catabolisme[46]. Les cytokines TNFα, interleukine 1, interleukine 6 et interféron-γ ont été dans diverses expériences identifiées comme médiateurs pour la perte de masse musculaire dans la cachexie cancéreuse. En fait, ces corps sont en principe capables de déclencher une cachexie. Par exemple, dans un modèle animal, un état de cachexie peut être provoqué par l'injection de TNFα. Le TNFα y provoque une dégradation de la graisse corporelle, et aussi celle de la musculature squelettique. Le TNFα y influence directement le système ubiquitine - protéasome, le système de décomposition des protéines le plus important à l'intérieur des cellules[47]. La formation de dérivés réactifs de l'oxygène (DRO) conduit à une expression renforcée du facteur de transcription NF-κB (Cf. schéma). Le TNFα diminue la synthèse des protéines en diminuant la phosphorylation du facteur d'initiation eIF4A, qui peut se lier plus fort à la EIF4EBP1 (protéine 1 de liaison du facteur d'initiation de traduction 4E) et réduit par là la proportion de l'eIF4A actif[48]. C'est pourquoi on a longtemps supposé que les cytokines citées, et particulièrement le TNFα étaient la cause principale du déclenchement d'une cachexie cancéreuse[49] - [50].
Dans les études sur les patients avec des cancers avancés et des cancers en phase terminale, il a été constaté cependant que chez les personnes concernées, il n'y a aucune sorte de corrélation entre la concentration de ces cytokines et la perte de poids ou l'anorexie[51]. Également, on n'a pas pu mettre en évidence des concentrations plus élevées de TNFα dans le sérum des malades du cancer - par rapport à celle des individus sains[52]. Chez les patients affectés par une cachexie provoquée par le SIDA[53] ou par une septicémie[54], le niveau plasmatique de ces cytokines est nettement élevé. Pour le rôle des cytokines comme déclencheurs de cachexie cancéreuse, on peut citer le fait que les cytokines peuvent inhiber l'enzyme lipoprotéine lipase. Cette inhibition fait que les adipocytes ne peuvent pas fabriquer de triglycérides (graisses), et donc pas les accumuler. De façon intéressante, on remarque que l'activité globale de la lipoprotéine lipase, et également la concentration de l'ARNm correspondant dans les tissus adipeux est identique chez les patients du cancer et chez les individus sains, tandis que celle de la lipase hormonosensible est environ deux fois plus élevée[52]. L'inhibition de la production de TNFα - comme approche thérapeutique - ne conduit à aucune amélioration de l'état de santé[48]. Sur la base de ces données, on part maintenant du fait que le TNFα, l'interleukine 1, l'interleukine 6 et l'interféron γ seraient en principe en position de déclencher une cachexie, comme dans le cas du SIDA ou de la septicémie, mais qu'ils ne sont pas le facteur principal dans le cas de la cachexie cancéreuse[55] - [56].
Métabolisme de la tumeur

Les tumeurs produisent des messagers chimiques cataboliques. Parmi ces messagers chimiques identifiés jusqu'à présent, les facteurs les plus importants dans la pathogenèse de la cachexie cancéreuse sont le facteur inducteur de protéolyse, et le facteur mobilisateur de lipides (FML)[41] - [57] - [58] - [59]. Ces facteurs effectuent des modifications neurohormonales et métaboliques complexes, pas encore complètement clarifiées, qui peuvent conduire à un échange catabolique et à un manque de nutriments[60].
Facteur mobilisateur de lipides (FML)
De l'urine de patients souffrant de cachexie cancéreuse, on a isolé pour la première fois au milieu des années 1990 un peptide que l'on ne trouve pas chez les patients cancéreux ne souffrant pas de perte de poids, et qui est capable de provoquer une lipolyse chez un modèle animal[58]. Ce peptide, nommé facteur mobilisateur de lipides agit directement sur les adipocytes et y stimule la lipolyse par un processus impliquant l'AMPc, qui se déroule par son mécanisme de façon semblable à celle des hormones lipolytiques[61]. Le FML est un homologue pesant 43 kDa de la protéine plasmatique liant le zinc, la glycoprotéine α-2 (ZAG)[57]. Si l'on injecte du FML à des souris, ces animaux perdent de la graisse corporelle, sans que la prise de nourriture en soit modifiée[62]. Le ZAG est surexprimé par les adipocytes univacuolaires du tissu gras blanc chez les souris cachexiques. Sur la base de la situation des données, on part actuellement du fait que le FML apporte une contribution importante au catabolisme des graisses corporelles[63] (Cf. schéma).
Facteur inducteur de protéolyse
Au milieu des années 1990, on a isolé chez des souris atteintes d'adénocarcinome MAC16 une glycoprotéine sulfatée de masse moléculaire de 24 kDa, qui conduit à une cachexie cancéreuse, en induisant un catabolisme de la musculature squelettique. Ce peptide, ultérieurement nommé Facteur inducteur de protéolyse (FIP) a aussi été trouvé dans l'urine de patients souffrant de cachexie cancéreuse. Par contre, on ne le trouvait pas chez les patients cancéreux sans perte de poids, ou chez des patients souffrant d'une perte de poids non provoquée par un cancer[64] - [65] - [66]. Ces résultats ont été confirmés dans une série d'autres expériences et études[67] - [68] - [69]. La présence de FIP indique la perte de poids par cachexie cancéreuse. NF-κB est l'intermédiaire pour une synthèse de protéine induite par FIP dans la musculature squelettique par une augmentation de eIF2 sur la sous-unité α de ce dernier[70]. Le blocage du récepteur de FIP ou de la cascade de signaux dans la musculature squelettique est considéré comme un point d'approche potentiel pour le traitement médicinal de la cachexie cancéreuse[48] (cf. schéma).
Dans des expériences sur animaux, on a pu montrer, à côté du catabolisme de la musculature squelettique[71] - [72] une production augmentée de Prostaglandine E2[73]. In vitro, le FIP se lie avec une très haute affinité dans le domaine nanomolaire au sarcolemme des cellules musculaires squelettiques de souris, de porc et d'homme, et aux myoblastes de la souris[74]. Le FIP est un marqueur potentiel pour le diagnostic de la cachexie cancéreuse[75] - [76]. La fonction du FIP dans la cachexie cancéreuse de l'homme n'est pas jugée de la même manière par tous les groupes de travail, et fait l'objet de discussions très controversées. Dans certaines études, on a obtenu des résultats contraires aux données précédentes. Et également, on n'a pas pu trouver de corrélation entre présence ou absence de FIP et pronostic d'un patient[77].
Anorexie
Pendant longtemps, on est parti de l'hypothèse que la sous-alimentation et la perte de poids chez beaucoup de patients du cancer étaient les conséquences de la seule perte de l'appétit (anorexie)[78]. La perte de l'appétit peut être due à des obstructions (resserrements, occlusions) du tube digestif dues à la tumeur, des douleurs, des effets secondaires de la thérapie du cancer, des nausées ou des modifications du sens du goût. Comme l'anorexie peut survenir chez les patients cancéreux aussi en l'absence de ces symptômes, ou après leur traitement, on suppose que des modifications provoquées par la tumeur peuvent provoquer la perte d'appétit[79]. L'indice de masse corporelle (IMC) des malades cancéreux est corrélé comme chez les individus sains avec la concentration de leptine. C'est-à-dire que pour une grande valeur de l'IMC, on mesure une grande concentration de leptine dans le sérum. La leptine est une substance sémiochimique importante, produite par les adipocytes, qui limite la survenance de la sensation de faim. Certaines cytokines peuvent influencer la production de leptine dans les adipocytes. Chez les patients cancéreux dans un stade avancé, la concentration dans le sérum de la cytokine interleukine 6 (IL6) est significativement augmentée, ce qui conduit chez les patients concernés à une diminution du niveau de leptine dans le sang. Le taux de létalité chez les patients avec de hautes concentrations en IL6 et par suite des taux de leptine particulièrement bas, est significativement augmenté[80] - [81]. À côté de la modification de la production de leptine, l'activité de l'enzyme Acide gras synthase (FAS, acronyme anglais)[82] et de celle l'hormone mélanotrope (MSH)[83] jouent apparemment un rôle important dans l'anorexie[79].
Si l'on traite la perte d'appétit pendant un cancer par médicaments, ou par des substances qui stimulent l'appétit, ou par nourriture artificielle (par voie entérale ou parentérale), il n'y a aucune amélioration du métabolisme par augmentation de l'anabolisme (augmentation de la masse corporelle) ou par diminution du catabolisme (perte de masse)[79] - [84] - [85] - [86]. Les prises de poids mesurables obtenues par l'administration de substances stimulant l'appétit se limitent à l'augmentation du tissu gras et à l'incorporation d'eau dans le mésenchyme des patients cachexiques traités. La masse musculaire n'est qu'à peine renforcée[87] - [88].
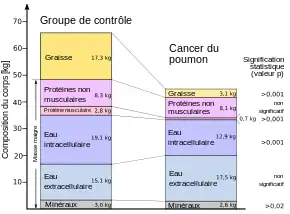
Au contraire de l'anorexie, où la masse corporelle hors graisse (masse maigre) reste largement conservée, dans la cachexie cancéreuse, la musculature squelettique est aussi diminuée. Jusqu'à 80 % du tissu gras et de la musculature squelettique peuvent disparaître. Par exemple, chez les patients atteints de cancer du poumon, qui ont perdu 30 % de la masse initiale de leur corps à cause de la maladie, la perte de poids provient d'une réduction de 85 % de la graisse et de 75 % des protéines des muscles squelettiques[27].
L'anorexie est un symptôme supplémentaire - qui accompagne très souvent la cachexie cancéreuse - résultant d'une perturbation du signal de l'appétit, mais elle n'est pas responsable de la perte massive de protéine musculaire pendant le cancer[18] - [21] - [42]. Dans l'espace linguistique anglo-saxon le concept de Cancer Anorexia-Cachexia Syndrome (CACS) s'est établi à la place du concept de Cancer Cachexia[89].
Effets directs de la tumeur
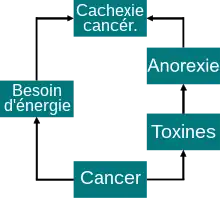
Selon le modèle dépassé de survenue de la cachexie cancéreuse, on partait du fait que le besoin d'énergie augmenté par la tumeur était pour l'essentiel responsable de ce syndrome. Cette thèse a été généralement reconnue jusque dans les années 1980[90] - [91] - [92], et est encore maintenant largement répandue dans la population - mais on ne peut plus la soutenir sous cette forme. Des tumeurs très grosses peuvent provoquer un besoin de nourriture augmenté chez les patients concernés. Mais ce besoin augmenté n'est pas la cause de la cachexie cancéreuse.
Une cachexie cancéreuse peut survenir indépendamment de la dimension et de l'extension de la tumeur, et indépendamment du fait qu'il y ait des métastases[11]. Le risque de survenue d'une cachexie cancéreuse est clairement plus dépendant du type de maladie cancéreuse que par exemple de la dimension de la tumeur, de sa localisation ou du degré de métastases. La cachexie peut être observée pour certains types de tumeurs dès un volume de 5 cm3, tandis que pour d'autre carcinomes, de grandes tumeurs ne déclenchent pas de cachexie. Ceci est une indication de ce que les tumeurs cachexiques présentent un expression génétique modifiée, qui permet aux cellules cancéreuses de produire des protéines lipolytiques (dégradant les graisses) et protéolytiques (dégradant les protéines), qui permettent la cachexie[88].
Dans une série d'études diverses, on a cherché si le métabolisme de base (resting energy expenditure, REE) des patients cachexiques est augmenté. Les données sont en partie contradictoires, voire sans causalité significative (voir effet placebo)[93]. Les recherches montrent pour certaines un métabolisme de base augmenté[94] - [95], pour d'autres l'exact contraire[90], voire un métabolisme de base inchangé[96], si bien que pour l'instant on ne dispose d'aucun résultat assuré à ce sujet[14].
Pour des tumeurs assez grandes, une consommation supplémentaire en énergie jusqu'à 300 kcal/j peut survenir. Les tumeurs consomment de grandes quantités de glucose, qui, compte tenu des conditions anaérobies au sein de la tumeur, est dégradé en lactate. Le lactate est retransformé dans le foie en glucose par le cycle de Cori (Cf. schéma). Ce processus est très consommateur d'énergie. Chez les individus sains, la fraction du glucose récupéré par le cycle de Cori est environ de 20 %, tandis que chez les patients cachexiques, il s'élève à 50 % environ. Ceci correspond alors à une fraction de 60 % de la production totale de lactate[97]. Ce besoin supplémentaire en énergie n'est certes pas la cause de la cachexie cancéreuse, mais un aspect important pour l'alimentation du patient[88].
Thérapeutique et approches thérapeutiques futures
Pour l'instant, il n'existe aucun médicament autorisé par la FDA ou par l'EMA pour la thérapeutique de la cachexie cancéreuse[98]. Quelques compléments alimentaires, ainsi que des médicaments autorisés pour d'autres indications (Off-label use) sont parfois utilisés pour le traitement. Leur utilisation est purement palliative. On ne connaît pas actuellement de traitement directement curatif. La guérison n'est possible que quand le cancer provoquant la cachexie cancéreuse est éliminé (traitement indirect). Ceci serait la thérapeutique la plus efficace de la cachexie cancéreuse[99]. Comme la cachexie cancéreuse ne survient généralement qu'à un stade avancé de l'évolution du cancer, les chances d'une guérison du cancer, et par là, de la cachexie, sont généralement très faibles. Dans bien des cas, la guérison de la maladie de fond « cancer » par des mesures thérapeutiques n'est plus possible. Les patients concernés sont résistants à la thérapeutique, ils ont dépassé la thérapeutique. Le but réel de la thérapeutique dans le cas de la cachexie cancéreuse est d'améliorer significativement la qualité de vie du patient en cause. En outre, on peut allonger le temps de vie global, et renforcer le corps pour des mesures thérapeutiques contre le cancer (opération, chimiothérapie, radiothérapie).
Les mesures actuellement établies pour le traitement de la cachexie cancéreuse sont insuffisamment efficaces, si bien que leurs succès sont très modestes. Les causes en sont d'une part une connaissance insuffisante sur la pathogenèse de la cachexie cancéreuse[100] et d'autre part la multiplicité des facteurs qui influencent cette pathogenèse. À cause de ce second aspect, on part du fait qu'il n'y aura pas - même à l'avenir - d'approche thérapeutique universelle pour résoudre le problème. Bien plus, il s'avère nécessaire de combiner ensemble plusieurs types de traitements[101] - [102]. Certains oncologues envisagent les thérapeutiques cancérologiques futures combinées avec une thérapeutique contre l'anorexie et la cachexie cancéreuse dès le début du diagnostic de cancer. On se promet par là des effets de synergie qui se manifestent tant par un meilleur taux d'action de la thérapeutique anticancéreuse que par une qualité de vie bien améliorée[1].
Augmentation de la prise de nourriture et stimulation de l'appétit
La mesure thérapeutique la plus immédiate est l'augmentation de la prise de nourriture par le patient. Même si l'on peut surmonter le manque d'appétit du patient et si l'on peut remplir mieux que nécessaire le besoin en aliments - éventuellement par une alimentation artificielle avec des aliments à haut contenu énergétique - ces mesures seules ne conduisent pas à une augmentation de la masse corporelle hors graisse et eau. La destruction catabolique des protéines dans la musculature squelettique ne peut pas être arrêtée par ces mesures, et encore moins être inversée[21] - [24] - [25] - [103] - [104]. L'administration de substances uniquement apéritives ne peut pas non plus empêcher la dégradation catabolique.
Ghréline
La ghréline ((en) Growth Hormone Release Inducing, avec une référence à la racine indo-européenne ghre = grow, croître) est une hormone peptidique apéritive composée de 28 acides aminés. Elle est formée dans la muqueuse stomacale à partir du précurseur protéique composé de 117 acides aminés par modification post-traductionnelle. Elle est actuellement la seule hormone identifiée circulant dans le corps humain et stimulant l'appétit[103]. La ghréline stimule la sécrétion du neuropeptide Y (NPY), qui influence notamment la faim et la motilité du système digestif.
Dans des expériences précliniques avec des organismes modèles, on a eu des résultats très prometteurs avec le traitement de souris cachectiques par la ghréline. La stimulation de l'appétit et une augmentation de la prise de nourriture ont pu être démontrés[105] - [106]; et aussi l'augmentation de la masse musculaire[107] - [108]. En outre, des effets positifs surprenants ont été notés contre les perturbations digestives[109] et les vomissements[110] pendant des chimiothérapies simultanées[111].
La ghréline peut être administrée par voie sous-cutanée ou intraveineuse. En général, elle est bien supportée. On ne connaît pratiquement pas d'effets secondaires. La croissance de la tumeur n'est pas stimulée par la prise de ghréline[111]. Cependant, chez un modèle animal, ainsi que dans les premiers tests chez l'être humain, on a constaté une résistance à la ghréline après des prises répétées[106], que l'on a pu compenser en augmentant les doses. Le mécanisme de la résistance est voisin de celui de la résistance à l'insuline[112]. Les dangers d'un diabète sucré à la suite de la prise de ghréline pendant une longue période sont aussi discutés[113].
La ghréline se trouve encore en essais cliniques. La démonstration de l'efficacité chez l'homme avec l'indication de cachexie cancéreuse (phase III réussie) n'est pas encore faite. Ce n'est qu'après que pourront avoir lieu l'autorisation, puis l'introduction sur le marché.
Mégestrol
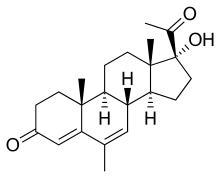
Le mégestrol est une hormone sexuelle du groupe des progestérones. Cette substance a un effet orexigène (apéritif) démontré. En 1993 la FDA a autorisé le mégestrol pour le traitement de l'anorexie, de la cachexie ou de perte de poids inexplicable chez les patients atteints de SIDA. Il n'y a pas d'autorisation pour les malades du cancer souffrant de cachexie. Ce médicament est bien supporté et ne présente que peu d'effets secondaires. Le mécanisme de la stimulation de l'appétit n'est pas encore clair. Il est prouvé que le mégestrol augmente l'appétit de patients souffrant de cachexie cancéreuse et qu'une prise de poids s'ensuit[114] - [115]. Cependant, on n'a pas pu démontrer d'amélioration significative de la qualité de vie pendant les recherches faites jusqu'à présent[36] - [103]. Le temps de survie n'a pas été augmenté par rapport à des patients qui recevaient un placebo[116].
En présence d'anorexie sans cachexie, le mégestrol est efficace. Par contre, dans le cas de patients cachectiques, la prise de poids est due à l'augmentation du tissu gras et au stockage d'eau dans le mésenchyme. L'effet souhaité d'augmentation de la masse musculaire squelettique n'a cependant pas lieu[87] - [103] - [117].
Cannabinoïdes
Les cannabinoïdes endogènes ont chez l'homme une action stimulante pour l'appétit. On connaît depuis l'Antiquité le même effet de la part des cannabinoïdes végétaux, par exemple celui du chanvre (cannabis sativa)[118]. L'effet apéritif du Δ9-tétrahydrocannabinol (THC), le principal principe actif du cannabis sativa, et le THC partiellement synthétique dronabinol, ont démontré leur effet stimulant de l'appétit[119] - [120]. Ces substances utilisées comme médicaments pour la thérapeutique de l'anorexie et de la cachexie des malades du SIDA, sont autorisées aux États-Unis comme antiémétiques pour les cancers[121].
Cependant, dans une vaste étude de phase III randomisée, multicentrique et contrôlée par placebos sur 289 patients, on n'a pas pu montrer dans une période de six semaines de différence entre le lot avec THC et le lot avec placebo concernant l'appétit, la nausée, l'humeur ou la qualité de vie[122]. D'autres études comparatives aboutissent à des résultats semblables[103] - [123].
D'autres stimulants de l'appétit ou antagonistes de la sérotonine ont aussi montré dans des essais cliniques qu'ils ne peuvent pas enrayer la perte de poids progressive relative à une cachexie cancéreuse[124].
Inhibition des protéines de phase aigüe ou de leurs marqueurs sémiochimiques
Les protéines de phase aigüe (PPA) sont produites avant tout dans le foie pendant des réactions d'inflammation aigüe ou chronique, et déversées dans la circulation sanguine. La production de PPA est stimulée pour l'essentiel par des marqueurs sémiochimiques comme le facteur de nécrose tumorale α (TNFα) et l'interleukine 6 (IL6). Les protéines de phase aigüe sont notamment la protéine C réactive (CRP) ainsi que diverses protéines de transport et de complément. Les PPA agissent notamment sur le système nerveux central et y agissent sur l'appétit, les habitudes alimentaires et le métabolisme (cf. schéma). On ne sait pas encore précisément quelle PPA agit, comment et où, et cela fait l'objet de recherches à l'heure actuelle[125]. La production de PPA est spécialement augmentée dans le cas de cancers du pancréas, du poumon, de l'œsophage ou des reins[24]. Une approche thérapeutique pour le traitement de la cachexie cancéreuse consiste à inhiber les PPA ou les sémiochimiques déclenchant la production de PPA dans le foie.
Anti-inflammatoire non stéroïdien
Les combinaisons à action anti-inflammatoire, comme les anti-inflammatoires non stéroïdiens (AINS), ibuprofène ou indométacine, bloquent de façon non spécifique les protéines de phase aigüe. Tant sur modèle animal[126] que chez les patients atteints d'un cancer du pancréas ou un cancer du côlon, le métabolisme des protéines peut être influencé de façon positive. Avec l'indométacine, le temps de survie a été augmenté significativement[24] - [25]. Outre ces approches non spécifiques pour l'inhibition des protéines de phase aigüe, on recherche l'inhibition de PPA définies - ou des sémiochimiques qui suscitent la production de la PPA. Un exemple pour cela est l'inhibition de l'IL6[127]. Les essais faits jusqu'à présent n'ont cependant pas eu de succès[25].
Inhibiteurs stéroïdiens de l'inflammation
Les inhibiteurs stéroïdiens de l'inflammation, comme le glucocorticoïde prednisolone, présentent des résultats positifs dans les études cliniques[128]. Les glucocorticoïdes ont souvent été administrés pour le traitement de la cachexie cancéreuse. L'effet secondaire de prise de poids, souvent indésirable, des glucocorticoïdes sont justement souhaitables dans le cas de cette application. La prednisolone et la dexaméthasone élèvent significativement l'appétit des patients et améliorent donc leur qualité de vie. En outre, l'effet d'inhibition de l'inflammation inhibe les cytokines[129]. Mais l'effet des glucocorticoïdes n'est que de courte durée, et l'état de la musculature squelettique n'est pas amélioré par l'administration de glucocorticoïdes. Le temps de vie global est significativement élevé par rapport à l'administration de placebos[128]. Les effets secondaires des glucocorticoïdes, comme les nausées, les douleurs, la rétention d'eau, la faiblesse et la résistance à l'insuline, voire l'ostéoporose et l'immunosuppression sont cependant si importants que l'avantage thérapeutique est très discutable[24] et sujet à controverses. Pour le traitement de la cachexie cancéreuse, les glucocorticoïdes ne sont pas établis[25] - [129].
Inhibiteurs du TNFα (thalidomide)
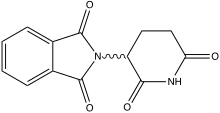
Les essais d'approche par inhibition du TNFα paraissent plus prometteurs[130] - [131]. La thalidomide est un antagoniste du TNFα[132] et du TGF-β[133]. Dans un modèle animal[133] ainsi que dans les premiers essais cliniques, on a obtenu des résultats positifs[134]. Par exemple, l'administration de thalidomide a conduit chez 8 patients sur 10 atteints d'un cancer de l'œsophage inopérable à une augmentation de la masse grasse et de la masse corporelle hors eau[25] - [104]. Chez les patients atteints de cancer du pancréas, la perte de masse de la musculature squelettique a été ralentie de manière significative[135]. Cependant, le temps de survie des patients traités à la thalidomide n'a pas pu être allongé, par rapport à celui d'un groupe placebo, bien que chez de nombreux patients atteints de cancer du pancréas, la cachexie cancéreuse soit la cause immédiate de décès[49]. La thalidomide et d'autres inhibiteurs ont été testés dans une série d'études cliniques contrôlées pour la thérapeutique de la cachexie cancéreuse, mais leur efficacité thérapeutique laisse encore à désirer.
Inhibition de l'activité des protéasomes
La destruction des protéines dans la musculature squelettiques résulte — indépendamment des sémiochimiques déclencheurs — du système ubiquitine-protéasome. Un point d'approche thérapeutique est donc de réduire l'activité du protéasome[136]. Plusieurs inhibiteurs de protéasome sont en cours d'essais cliniques. Le premier autorisé aux États-Unis et dans la Communauté Européenne, le bortézomib, est efficace contre le myélome multiple.
Acide β-hydroxy β-méthylbutyrique
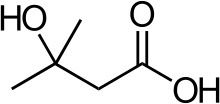
L'acide β-hydroxy β-méthylbutyrique (HMB) est un produit du métabolisme de l'acide aminé essentiel leucine. Environ 5 % de la leucine digérée est métabolisée en HMB[137]. Le HMB est proposé comme complément alimentaire et présente dans le corps humain notamment pour une activité anabolique[138], anti-catabolique[139], et lipolytique[140]. Le HMB est pour cela pris par de nombreux culturistes, ou athlètes de force ou d'endurance, pour augmenter légalement la masse musculaire ou la capacité de performance[137]. Chez des athlètes entraînés, cependant, on ne peut mesurer d'augmentation des performances ni pour des efforts aérobies, ni pour des efforts anaérobies par ingestion de HMB[141] - [142].
Dans le cas du modèle animal de la souris cachectique, il a été montré que la destruction des protéines est réduite, ainsi que l'augmentation de la masse musculaire est stimulée[143] - [144]. Si l'on administre aux animaux-tests du HMB en même temps que du PIF, qui stimule le système ubiquitine-protéasome, l'action du PIF est complètement compensée par le HMB[145] - [146]. Apparemment, le HMB y agit sur la régulation de l'expression de NF-κB, qui est produit moins abondamment par les cellules[147]. Le mécanisme d'augmentation de la masse protéique résulte du récepteur mTOR, dont la phosphorylation est apparemment stimulée par le HMB[148].
Une série d'études cliniques sur des sujets sains, entraînés et non entraînés, ont été conduits avec le HMB. Les résultats sont partiellement contradictoires[149] - [150]. Il y a néanmoins des points d'appui conclusifs pour le fait que l'administration de HMB contre la cachexie cancéreuse pourrait être une forme thérapeutique future efficace[137]. Dans une étude sur des patients cachectiques, on a démontré une augmentation de la masse corporelle maigre par l'administration de HMB combiné avec les acides aminés arginine et glutamine[151]. Dans une étude de phase III en double aveugle contrôlée par placebo sur 472 patients, la masse corporelle maigre des patients qui avaient reçu du HMB en même temps que de l'arginine et de la glutamine, a augmenté. Cependant, seuls 37 % des patients sont arrivés à la fin de l'étude, si bien que les buts primaire et secondaire de l'étude n'ont pas pu être atteints, et par suite aucune preuve de l'efficacité du HMB pour le traitement de la cachexie cancéreuse n'a pu être apportée[152]. D'autres études, à support large sont nécessaires pour apporter la preuve de l'efficacité[137].
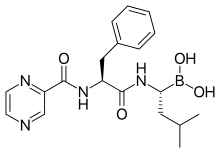
Bortézomib
Le bortézomib est un inhibiteur du protéasome autorisé pour le traitement du myélome multiple. Ce composé n'a montré aucune action suffisante dans des études cliniques destinées à trouver un retard, voire un arrêt, de la destruction protéolytique des muscles dans la cachexie cancéreuse[101] - [153].
Acide eicosapentaénoïque
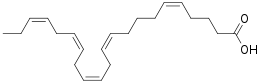
L'acide eicosapentaénoïque, souvent abrégé en EPA (de l'anglais EicosaPentaenoic Acid) est un acide gras plusieurs fois insaturé de la classe des oméga-3. C'est un des composés essentiels de certaines huiles de poisson, particulièrement de poissons gras. L'EPA a des propriétés anti-inflammatoires et est le seul complément alimentaire susceptible d'avoir une influence sur le protéasome, par divers mécanismes. L'activité du protéasome, qui décompose en fragments les protéines au sein des cellules du corps, est diminuée par l'EPA. La décomposition des protéines musculaires devrait pouvoir être réduite — d'après le modèle d'action[154]. Dans les premières études sur les patients atteints de cancer du pancréas, la perte de poids cachexiques a pu être diminuée[155]. Pendant ces études, l'EPA a été bien toléré par les patients, sans effets secondaires significatifs[156]. Ce succès n'a pas pu être répété dans trois études en double aveugle, sur un vaste échantillon, randomisées et contrôlées par placebo[103] - [157] - [158] - [159] - [160]. Avec le modèle animal de la souris, on n'a pu mettre en évidence aucune influence de l'EPA sur la synthèse des protéines[161].
Insuline
L'hormone insuline est un puissant régulateur de la circulation des protéines dans le corps[162]. L'administration d'insuline peut stimuler la prise de glucides par les patients cachectiques. Dans une étude clinique, les patients atteints de divers cancers ont augmenté leur masse corporelle, cependant essentiellement par une proportion augmentée de la masse grasse. La masse hors graisse est restée inchangée. La croissance des cancers n'a pas été influencée par l'administration d'insuline, et le temps de survie a été légèrement augmenté par rapport au groupe témoin[163].
Sulfate d'hydrazine
Le sulfate d'hydrazine était l'un des premiers médicaments employé contre la cachexie cancéreuse[164]. Ce composé est un inhibiteur de la néoglucogenèse[165], c'est-à-dire la formation de glucose dans le corps à partir de composés non glucidiques. Le sulfate d'hydrazine y désactive l'enzyme phosphoénolpyruvate carboxykinase. Dans les premières études cliniques, on a pu établir chez des patients traités à un stade tardif de la maladie une meilleure tolérance au glucose, une circulation diminuée du glucose, une prise de nourriture augmentée, et une stabilisation, voire un accroissement du poids corporel. Les effets secondaires indésirables y étaient faibles[166] - [167]. L'intention d'administration de sulfate d'hydrazine partait alors de l'hypothèse qu'une glucogénèse incontrôlée était en lien étroit avec la cachexie cancéreuse[168].
Dans des études ultérieures, il a été établi que l'administration de sulfate d'hydrazine pour la thérapeutique de la cachexie cancéreuse est sans effet[101], ce qui a depuis rendu cette approche obsolète.
Thérapie génique
La follistatine et la myostatine sont deux protéines propres au corps, qui contrôlent la croissance des muscles. Alors que la follistatine stimule la croissance des muscles, la myostatine a l'effet exactement opposé. Ces deux composés forment le système de commande contrôlant la croissance des muscles chez les mammifères. L'administration ou la surexpression cellulaire de la follistatine, ou l'inhibition de la myostatine, ou l'arrêt du gène codant la myostatine, sont des approches thérapeutiques potentielles de la cachexie cancéreuse. Avec ces approches il pourrait être possible de lutter contre la destruction de la masse musculaire lors de la cachexie cancéreuse[169]. Des premiers succès ont pu être atteints chez modèle animal. Cette approche thérapeutique se trouve encore en phase préclinique et sera — même après une démonstration de son efficacité — encore éloignée de nombreuses années de son autorisation comme médicament.
Pronostic
Le degré de gravité d'une cachexie cancéreuse est inversement corrélé au temps de vie moyen d'un patient cancéreux. C'est-à-dire que plus une cachexie cancéreuse est marquée, plus le temps de vie du patient est court. Fondamentalement, une cachexie cancéreuse est reliée à un mauvais pronostic pour le patient[170]. Une perte de poids pendant une maladie cancéreuse est un facteur pronostic autonome[84]. Une cachexie cancéreuse élève la probabilité de complications postopératoires[171] et a aussi une influence négative sur le succès d'une chimiothérapie. Des patientes affectées de cancer du sein sans cachexie cancéreuse répondent en moyenne 2,5 fois mieux à une chimiothérapie que les patientes affectées de cachexie cancéreuse[31]. Même une perte relativement faible de masse corporelle, comme inférieure à 5 % peut détériorer sensiblement le pronostic[1].
La chance de guérison ne réside que dans celle de la guérison de la maladie cancéreuse provoquant la cachexie cancéreuse[172].
Bibliographie
Livres spécialisés
- (de) D. S. Ettinger (dir.), Supportive Care in Cancer Therapy, Verlag Springer, (ISBN 978-1-58829-941-3 et 1-58829-941-4)
- (en) K. G. Hofbauer et al., Pharmacotherapy of cachexia, Boca Raton, Verlag Auerbach, , 590 p. (ISBN 0-8493-3379-2)
- (de) A. P. Löser, Ambulante Pflege bei Tumorpatienten, Schlütersche Verlag, (ISBN 3-87706-479-5), p. 195 sq
- (en) G. Mantovani, Cachexia and wasting : a modern approach, Verlag Springer, (ISBN 88-470-0471-3)
- (en) J. A. Norton et al., Surgery : basic science and clinical evidence, Verlag Springer, (ISBN 978-0-387-30800-5 et 0-387-30800-8), p. 2123 sq
Articles de revue
- (de) « Krebs: Starker Gewichtsverlust verhindert Heilung », sur Informationsdienst Wissenschaft, (consulté le )
- (en) B. Seruga et al., « Cytokines and their relationship to the symptoms and outcome of cancer », Nat Rev Cancer, vol. 8, , p. 887-899 (PMID 18846100)
- (en) S. Al-Majid et H. Waters, « The biological mechanisms of cancer-related skeletal muscle wasting: the role of progressive resistance exercise », Biol Res Nurs, vol. 10, , p. 7–20 (PMID 18705151)
- (en) A. Jatoi, « Weight loss in patients with advanced cancer: effects, causes, and potential management », Curr Opin Support Palliat Care, vol. 2, , p. 45–48 (PMID 18685394)
- (en) J. M. Argilés et al., « Mechanisms to explain wasting of muscle and fat in cancer cachexia », Curr Opin Support Palliat Care, vol. 1, , p. 293–298 (PMID 18685378)
- (en) M. L. Hardy, « Dietary supplement use in cancer care: help or harm », Hematol Oncol Clin North Am, vol. 22, , p. 581–617 (PMID 18638690)
- (en) K. D. Hall et V. E. Baracos, « Computational modeling of cancer cachexia », Curr Opin Clin Nutr Metab Care, vol. 11, , p. 214–221 (PMID 18403915)
- (en) N. Bennani-Baiti et M. P. Davis, « Cytokines and cancer anorexia cachexia syndrome », Am J Hosp Palliat Care, vol. 25, , p. 407–411 (PMID 18403577)
- (en) A. Lelbach et al., « Current perspectives of catabolic mediators of cancer cachexia », Med Sci Monit, vol. 13, , RA168–173 (PMID 17767131)
- (en) M. Bossola et al., « Novel treatments for cancer cachexia », Expert Opin Investig Drugs, vol. 16, , p. 1241–1253 (PMID 17685872)
- (en) J. L. Ryan et al., « Mechanisms of cancer-related fatigue », Oncologist, vol. 12, , p. 22–34 (PMID 17573453)
- (de) Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), « Ernährung für Krebspatienten: Was tun bei Gewichtsverlust oder Mangelernährung? », (consulté le )
- (en) M. S. Boddaert et al., « On our way to targeted therapy for cachexia in cancer? », Curr Opin Oncol, vol. 18, , p. 335–340 (PMID 16721127)
- (en) J. M. Argilés et al., « Cytokines as mediators and targets for cancer cachexia », Cancer Treat Res, vol. 130, , p. 199–217 (PMID 16610709)
- (en) J. M. Argilés et al., « Mediators involved in the cancer anorexia-cachexia syndrome: past, present, and future », Nutrition, vol. 21, , p. 977–985 (PMID 16043325)
- (en) J. M. Argilés et al., « Cytokines in the pathogenesis of cancer cachexia », Curr Opin Clin Nutr Metab Care, vol. 6, , p. 401–406 (PMID 12806213)
- (en) H. Rubin, « Cancer cachexia: its correlations and causes », PNAS, vol. 100, , p. 5384–5389 (PMID 12702753)
- (en) B. Gagnon et E. Bruera, « A review of the drug treatment of cachexia associated with cancer », Drugs, vol. 55, , p. 675–688 (PMID 9585863)
- (en) « Complications of Cancer and its Treatment: 144. Cancer Anorexia and Cachexia » (consulté le )
- (de) « Was ist eine Tumorkachexie? », sur tumorkachexie.com (consulté le )
- (de) « Abbildung eines Kachexie-Patienten » (consulté le )
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Tumorkachexie » (voir la liste des auteurs).
- (en) M. J. Tisdale, « Cachexia in cancer patients », Nat Rev Cancer, vol. 2, , p. 862-871 (PMID 12415256)
- (en) J. Inagaki et al., « Causes of death in cancer patients », Cancer, vol. 33, , p. 568–573 (PMID 4591273)
- (de) R. D. Lohberg et al. (Art. de revue), « The lethal phenotype of cancer: the molecular basis of death due to malignancy », CA Cancer J Clin, vol. 57, , p. 225–241 (PMID 17626119, lire en ligne) (consulté le 11/12/2014)
- (en) A. M. Lindsey, « Cancer cachexia: effects of the disease and its treatment », Semin Oncol Nurs, vol. 2, , p. 19–29 (PMID 3513270)
- (de) R. Wahrig-Burfeind, WAHRIG Fremdwörterlexikon, Bertelsmann Lexikon Verlag, , 1088 p. (ISBN 978-3-577-09030-8 et 3-577-09030-8)
- (en) T. Ohnuma, « Complications of Cancer and its Treatment », dans D. W. Kufe et al., Holland-Frei Cancer Medicine, Hamilton, Ontario, Verlag B. C. Decker Inc, , 6e éd. (ISBN 1-55009-213-8, lire en ligne), Sect. 38 : Complication of Cancer and its Treatment, chap. 144 : Cancer Anorexia and Cachexia, p. 2425–2441 (consulté le 11/12/2014)
- (en) K. C. Fearon (Art. de revue), « Cancer cachexia: developing multimodal therapy for a multidimensional problem », Eur J Cancer, vol. 44, , p. 1124–1132 (PMID 18375115)
- (en) J. Springer et al., « The need for a standardized definition for cachexia in chronic illness », Nat Clin Pract Endocrinol Metab, vol. 2, , p. 416–417 (PMID 16932326)
- (en) K. C. Fearon et al. (Art. de revue), « Definition of cancer cachexia: effect of weight loss, reduced food intake, and systemic inflammation on functional status and prognosis », American Journal of Clinical Nutrition, vol. 83, , p. 1345–1350 (PMID 16762946, lire en ligne) (consulté le 11/12/2014)
- (en) M. Lainscak et al. (Art. de revue), « How does cachexia influence survival in cancer, heart failure and other chronic diseases? », Curr Opin Support Palliat Care, vol. 1, , p. 299–305 (PMID 18685379)
- (en) K. M. Fox et al., « Estimation of Cachexia among Cancer Patients Based on Four Definitions », J Oncol:693458, (PMID 19587829)
- (en) W. J. Evans et al., « Cachexia: a new definition », Clinical Nutrition, vol. 27, , p. 793-799 (PMID 18718696)
- (en) A. Laviano et al., « Therapy Insight: cancer anorexiacachexia syndrome when all you can eat is yourself », Nature Clinical Practice Oncology, vol. 2, , p. 158–165 (PMID 16264909)
- (en) D. E. Rivadeneira, « Nutritional support of the cancer patient », CA Cancer J Clin, vol. 48, , p. 69–80 (PMID 9522822, lire en ligne) (consulté le 11/12/2014)
- (en) J. A. Palesty et S. J. Dudrick (Art. de revue), « What we have learned about cachexia in gastrointestinal cancer », Dig Dis, vol. 21, , p. 198–213 (PMID 14571093)
- (de) G. Ollenschläger, « Ernährungsprobleme in der Palliativmedizin », dans E. Aulbert und D. Zech, Lehrbuch der Palliativmedizin, Verlag Schattauer, (ISBN 3-7945-2361-X), p. 556–565
- (en) L. Stepp et T. S. Pakiz (Art. de revue), « Anorexia and cachexia in advanced cancer », Nurs Clin North Am, vol. 36, , p. 735–744 (PMID 11726350)
- (en) E. Bruera (Art. de revue), « ABC of palliative care: anorexia, cachexia, and nutrition », BMJ, vol. 315, , p. 1219–1222 (PMID 9393230)
- (en) S. Warren, « The immediate causes of death in cancer », American Journal of Medical Science, vol. 184, , p. 610–616
- (en) N. J. Espat (Art. de revue), « Cytokine-mediated alterations in host metabolism prevent nutritional repletion in cachectic cancer patients », J Surg Oncol, vol. 58, , p. 77–82 (PMID 7844987)
- (en) G. Uomo et al. (Art. de revue), « Anorexia-Cachexia Syndrome in Pancreatic Cancer: Recent Development in Research and Management », J Pancreas, vol. 7, , p. 157–162 (PMID 16525199, lire en ligne) (consulté le 11 décembre 2014)
- (en) C. Deans et S. J. Wigmore, « Systemic inflammation, cachexia and prognosis in patients with cancer », Curr Opin Clin Nutr Metab Care, vol. 8, , p. 265–269 (PMID 15809528)
- (en) A. Inui (Art. de revue), « Cancer anorexia-cachexia syndrome: current issues in research and management », CA Cancer J Clin, vol. 52, , p. 72–91 (PMID 11929007, lire en ligne) (consulté le 11 décembre 2014)
- (en) K. C. H. Fearon et A. G. W. Moses, « Cancer cachexia », Int J of Cardiology, vol. 85, , p. 73–81 (PMID 12163211)
- (de) S. Zimmer, Phänotypische Charakterisierung von Gewichtsabnahme und Appetitveränderungen bei Tumorpatienten : Dissertation, Philipps-Universität Marburg, , PDF, 466 kB (lire en ligne) (consulté le 11/12/2014)
- (de) S. Blanke, Einfluss einer nutritiven oralen Supportivtherapie auf den Ernährungszustand von Tumorpatienten einer strahlentherapeutischen Abteilung : Dissertation, Medizinische Fakultät der Charité, (lire en ligne) (consulté le 11 décembre 2014)
- (en) K. C. H. Fearon (Art. de revue), « The mechanisms and treatment of weight loss in cancer », Proc Nutr Soc, vol. 51, , p. 251–265 (PMID 1438334)
- (en) K. F. Giordano et A. Jatoi (Art. de revue), « The cancer anorexia/weight loss syndrome: therapeutic challenges », Current Oncology Reports, vol. 7, , p. 271–276 (PMID 15946586)
- (en) J. M. Argiles et al. (Art. de revue), « Muscle wasting in cancer and ageing: cachexia versus sarcopenia », Advances in Gerontology, vol. 18, , p. 39–54 (PMID 16676797)
- (en) P. O’Gorman et al., « Longitudinal study of weight, appetite, performance status, and inflammation in advanced gastrointestinal cancer », Nutr Cancer, vol. 35, , p. 127–129 (PMID 10693165)
- (en) W. D. Dewys et al., « Prognostic effect of weight loss prior to chemotherapy in cancer patients : Eastern Cooperative Oncology Group », Am J Med, vol. 69, , p. 491–497 (PMID 7424938)
- (en) H. Iwagaki et al., « Cancer cachexia and depressive states: a neuro-endocrine-immunological disease? », Acta medica Okayama, vol. 51, , p. 233–236 (PMID 9284972)
- (en) D. R. Brown, « Weight loss is not associated with hyperleptinemia in humans with pancreatic cancer », J Clin Endocrinol Metab, vol. 86, , p. 162–166 (PMID 11231995, lire en ligne) (consulté le 11/12/2014)
- (en) N. Mac Donald et al., « Understanding and managing cancer cachexia », J Am Coll Surg, vol. 197, , p. 143–161 (PMID 12831935)
- (en) D. L. Marks, « Role of Central Melanocortin System in Cachexia », Cancer Research, vol. 61, , p. 1432–1438 (PMID 11245447, lire en ligne) (consulté le 11/12/2014)
- (en) E. G. Berenstein et Z. Ortiz, « Megestrol acetate for the treatment of anorexia-cachexia syndrome », Cochrane Database Syst Rev, vol. 2, , p. CD004310 (PMID 15846706)
- (en) P. Ravasco, « Cancer: disease and nutrition are key determinants of patients’ quality of life », Support Care Cancer, vol. 12, , p. 246–252 (PMID 14997369)
- (en) K. Fearon et al. (Art. de revue), « Pancreatic Cancer as a Model: Inflammatory Mediators, Acute Phase Response and Cancer Cachexia », World J Surgery, vol. 23, , p. 584–588 (PMID 10227928)
- (en) M. Tisdale, « Biomedicine: Protein Loss in Cancer Cachexia », Science, vol. 289, (PMID 11041796)
- (de) G. Zurcher, « Anorektisches Syndrom », Z Gastroenterology, vol. 40, , p. 71–75 (PMID 11930295)
- (de) R. Meier, « Pathogenese der Tumorkachexie », Schweizer Zeitschrift für Ernährungsmedizin, vol. 4, (lire en ligne [PDF, 110 kB]) (consulté le 11/12/2014)
- (en) M. J. Tisdale (Art. de revue), « Mechanisms of cancer cachexia », Physiol Rev, vol. 89, , p. 381–410 (PMID 19342610)
- (de) W. Böckler et al., Pathologie : mit über 200 Tabellen, Urban & Fischer Verlag, , 1362 p. (ISBN 978-3-437-42382-6 et 3-437-42382-7, présentation en ligne), p. 211
- (en) A. S. Khan et S. Malik (Art. de revue), « Cachectin/tumor necrosis factor », J Pak Med Assoc, vol. 46, , p. 137–140 (PMID 8991374)
- (en) M. D. Barber et al., « Disordered Metabolic Response with Cancer and its Management », World Journal of Surgery, vol. 24, , p. 681–689 (PMID 10773120)
- (de) A. Roessner, Allgemeine Pathologie und Grundlagen der speziellen Pathologie, Urban & Fischer Verlag, , 544 p. (ISBN 978-3-437-41541-8 et 3-437-41541-7, présentation en ligne), p. 253
- (de) H. Dreger, Suppression der Hypertrophie kardialer Myozyten durch Inhibition des Ubiquitin-Proteasom-Systems : Dissertation, Medizinische Fakultät Charité der Humboldt-Universität zu Berlin, (lire en ligne) (consulté le 11/12/2014)
- (en) M. J. Tisdale (Art. de revue), « Catabolic mediators of cancer cachexia », Curr Opin Support Palliat Care, vol. 2, , p. 256–261 (PMID 19069310)
- (en) M. Stroud (Art. de revue), « Thalidomide and cancer cachexia: old problem, new hope? », Gut, vol. 54, , p. 447–448 (PMID 15753523)
- (en) E. J. Ramos et al. (Art. de revue), « Cancer anorexia-cachexia syndrome: cytokines and neuropeptides », Curr Opin Clin Nutr Metab Care, vol. 7, , p. 427–434 (PMID 15192446)
- (en) M. Maltoni et al., « Serum levels of tumour necrosis factor alpha and other cytokines do not correlate with weight loss and anorexia in cancer patients », Support Care Cancer, vol. 5, , p. 130–135 (PMID 9069613)
- (en) M. P. Thompson et al., « Increased expression of the mRNA for the hormone-sensitive lipase in adipose tissue of cancer patients », Biochim Biophys Acta, vol. 1180, , p. 236–242 (PMID 8422428)
- (en) C. J. Horvath et al., « Effect of simian immunodeficiency virus infection on tumour necrosis factor-a production by alveolar macrophages », Lab Invest, vol. 65, , p. 280-6. (PMID 1890808)
- (en) A. Waage et al., « Detection of tumour necrosis factor-like cytotoxicity in serum from patients with septicaemia but not from untreated cancer patients », Scand J Immunol, vol. 24, , p. 739-43. (PMID 3798026)
- (en) M. J. Tisdale, Proteolysis-Inducing Factor in Cancer Cachexia. In : Cachexia and Wasting : A Modern Approach, Verlag Springer, (DOI 10.1007/978-88-470-0552-5), p. 483-8.
- (en) M. J. Tisdale (Art. de revue), « Biology of cachexia », J Natl Cancer Inst, vol. 89, , p. 1763-73. (PMID 9392617)
- (en) P. T. Todorov et al., « Purification and characterization of a tumor lipid-mobilizing factor », Cancer Res, vol. 58, , p. 2353–2358 (PMID 9622074, lire en ligne) (consulté le 11/12/2014)
- (en) T. M. McDevitt et al., « Purification and characterization of a lipid-mobilizing factor associated with cachexia-inducing tumors in mice and humans », Cancer Res, vol. 55, , p. 1458–1463 (PMID 7882353)
- (de) B. Fröhlich et al., « Einfluss von lipid-mobilising factor (LMF) auf die Entwicklung der Tumorkachexie in vivo », Z Gastroenterol, vol. 43, , p. 227–228
- (de) E. Aulbert, Lehrbuch der Palliativmedizin, Verlag Schattauer, , 1423 p. (ISBN 978-3-7945-2361-0 et 3-7945-2361-X, présentation en ligne), p. 309
- (en) S. Khan et M. J. Tisdale, « Catabolism of adipose tissue by a tumour-produced lipid-mobilising factor », Int J Cancer, vol. 80, , p. 444–447 (PMID 9935188)
- (en) A. Laviano, Cachexia and Wasting : A Modern Approach : Lipid Mobilising Factor in Cancer Cachexia, Verlag Springer, (DOI 10.1007/978-88-470-0552-5), p. 489–493
- (en) C. Bing et al., « Zinc-alpha2-glycoprotein, a lipid mobilizing factor, is expressed in adipocytes and is up-regulated in mice with cancer cachexia », PNAS, vol. 101, , p. 2500–2505 (PMID 14983038)
- (en) P. T. Todorov et al., « Characterization of a cancer cachectic factor », Nature, vol. 379, , p. 739–742 (PMID 8602222)
- (en) P. T. Todorov et al., « Structural analysis of a tumor-produced sulfated glycoprotein capable of initiating muscle protein degradation », J Biol Chem, vol. 272, , p. 12279–12288 (PMID 9139670, lire en ligne) (consulté le 11/12/2014)
- (en) P. T. Todorov, « Induction of muscle protein degradation and weight loss by a tumor product », Cancer Res, vol. 56, , p. 1256–1261 (PMID 8640810, lire en ligne) (consulté le 11 décembre 2014)
- (en) M. L. Williams et al., « The relationship between a urinary cachectic factor and weight loss in advanced cancer patients », Cancer Invest, vol. 22, , p. 866–870 (PMID 15641484)
- (en) R. Cabal-Manzano et al., « Proteolysis-inducing factor is expressed in tumours of patients with gastrointestinal cancers and correlates with weight loss », Br J Cancer, vol. 84, , p. 1599–1601 (PMID 11401311)
- (en) P. T. Todorov et al., « Role of a proteolysis-inducing factor (PIF) in cachexia induced by a human melanoma (G361) », Br J Cancer, vol. 80, , p. 1734–1737 (PMID 10468289)
- (en) S. M. Wyke et M. J. Tisdale, « NF-kappaB mediates proteolysis inducing factor induced protein degradation and expression of the ubiquitin-proteasome system in skeletalmuscle », Br J Cancer, vol. 92, , p. 711–721 (PMID 15714207)
- (en) M. J. Lorite et al., « Mechanism of muscle protein degradation induced by a cancer cachectic factor », Br J Cancer, vol. 78, , p. 850–856 (PMID 9764574)
- (en) M. J. Lorite et al., « Induction of muscle protein degradation by a tumour factor », Br J Cancer, vol. 76, , p. 1035-1040 (PMID 9376263)
- (en) P. Cariuk et al., « Induction of cachexia in mice by a product isolated from the urine of cachectic cancer patients », Br J Cancer, vol. 76, , p. 606–613 (PMID 9303359)
- (en) P. T. Todorov et al., « Identification and characterization of a membrane receptor for proteolysis-inducing factor on skeletal muscle », Cancer Res, vol. 67, , p. 11419–11427 (PMID 18056470, lire en ligne) (consulté le 11/12/2014)
- (en) N. Teich et al., « The presence of the proteolysis-inducing factor in urine does not predict the malignancy of a pancreatic tumour », BMC Gastroenterol, vol. 5, , p. 20 (PMID 15969757)
- (de) J. Ockenga et al., « Tumoranorexie – Tumorkachexie in der Gastroenterologie: Standards und Visionen », Z Gastroenterol, vol. 40, , p. 929–936 (DOI 10.1055/s-2002-35411)
- (en) B. M. Wieland, « Is there a human homologue to the murine proteolysis-inducing factor? », Clin. Cancer Res., vol. 13, , p. 4984–4992 (PMID 17785548, lire en ligne) (consulté le 11/12/2014)
- (en) M. J. Tisdale (Art. de revue), « Cancer anorexia and cachexia », Nutrition, vol. 17, , p. 438-442 (PMID 11377146)
- (de) S. Priepke, Lebensmittelpräferenzen bei Patienten mit gastrointestinalen Tumoren : Dissertation, Humboldt-Universität zu Berlin, Universitätsklinikum Charité, (lire en ligne) (consulté le 11/12/2014)
- (en) G. Mantovani et al., « Serum values of proinflammatory cytokines are inversely correlated with serum leptin levels in patients with advanced stage cancer at different sites », J Mol Med, vol. 79, , p. 406–414 (PMID 11466563)
- (en) G. Mantovani et al., « Serum Levels of Leptin and Proinflammatory Cytokines in Patients with advanced-stage Cancer at different Sites », J Mol Med, vol. 78, , p. 554–561 (PMID 11199328)
- (en) F. Rossi Fanelli et A. Laviano, « Cancer anorexia: a model for the understanding and treatment of secondary anorexia », International Journal of Cardiology, vol. 85, , p. 67–72 (PMID 12163210)
- (en) S. Forbes et al., « Integrated control of appetite and fat metabolism by the leptin-proopiomelanocortin pathway », PNAS, vol. 98, , p. 4233–4237 (PMID 11259669)
- (en) D. Heber et N. Tchekmedyian (Art. de revue), « Pathophysiology of cancer: hormonal and metabolic abnormalities », Oncology, vol. 49, , p. 28–31 (PMID 1461623)
- (en) K. Nelson, « The Cancer-Anorexia-Cachexia Syndrome », Seminars in Oncology, vol. 27, , p. 64–69 (PMID 10697022)
- (de) O. Selberg, « Ursachen und Charakteristika der Tumorkachexie-Perspektiven einer ernährungsmedizinischen Behandlung », Ernährungsumschau, vol. 47, , p. 298–303
- (en) C. L. Loprinzi et al., « Body composition changes in patients who gain weight while receiving megestrol acetate », J Clin Oncol, vol. 11, , p. 152–154 (PMID 8418227, lire en ligne) (consulté le 11/12/2014)
- (en) M. J. Tisdale (Art. de revue), « Molecular pathways leading to cancer cachexia », Physiology, vol. 20, , p. 340–348 (PMID 16174873, lire en ligne) (consulté le 11/12/2014)
- (en) R. Patarca-Montero, Handbook of cancer-related fatigue, Haworth Press Inc, (ISBN 0-7890-2168-4), p. 106
- (en) J. M. Arbeit, « Resting energy expenditure in controls and cancer patients with localized and diffuse disease », Ann Surg, vol. 199, , p. 292–298 (PMID 6703790)
- (en) A. Theologides (Art. de revue), « Cancer cachexia », Cancer, vol. 43, , p. 2004–2012 (PMID 376104)
- (en) H. Munro, « Tumor-host competition for nutrients in the cancer patient », J Am Diet Assoc, vol. 71, , p. 380–384 (PMID 908798)
- (en) D. T. Dempsey et al., « Energy expenditure in malnourished gastrointestinal cancer patients », Cancer, vol. 53, , p. 1265–1273 (PMID 6692317)
- (en) D. M. Russell et al., « Effects of total parenteral nutrition and chemotherapy on the metabolic derangements in small cell lung cancer », Cancer Res, vol. 44, , p. 1706–1711 (PMID 6322985, lire en ligne) (consulté le 11/12/2014)
- (en) I. Warnold et al., « Energy balance and body composition in cancer patients », Cancer Res, vol. 38, , p. 1801–1807 (PMID 647689) (consulté le 11/12/2014)
- (en) D. T. Hansell et al., « The relationship between resting energy expenditure and weight loss in benign and malignant disease », Ann Surg, vol. 203, , p. 240–245 (PMID 3082302)
- (en) C. P. Holroyde et al., « Altered glucose metabolism in metastatic carcinoma », Cancer Res, vol. 35, , p. 3710–3714 (PMID 1192429, lire en ligne) (consulté le 11/12/2014)
- (en) M. Lainscak et al., « Cachexia: common, deadly, with an urgent need for precise definition and new therapies », The American Journal of Cardiology, vol. 101, , p. 8–10 (PMID 18514632)
- (en) P. Geels et al., « Palliative effect of chemotherapy: objective tumor response is associated with symptom improvement in patients with metastatic breast cancer », J Clin Oncol, vol. 18, , p. 2395−2405 (PMID 10856099, lire en ligne) (consulté le 11/12/2014)
- (en) M. Muscaritoli, « Therapy of muscle wasting in cancer: what is the future? », Curr Opin Clin Nutr Metab Care, vol. 7, , p. 459−466 (PMID 15192450)
- (en) G. Mantovani et C. Madeddu ((Preprint électronique)), « Cancer cachexia: medical management », Support Care Cancer, (PMID 19688225)
- (en) G. Mantovani et al., « Randomized phase III clinical trial of five different arms of treatment for patients with cancer cachexia: interim results », Nutrition, vol. 24, , p. 305–313 (PMID 18262758)
- (en) M. Bossola et al. (Art. de revue), « Novel treatments for cancer cachexia », Expert Opin Investig Drugs, vol. 16, , p. 1241–1253
- (en) Z. H. Khan et al., « Oesophageal cancer and cachexia: the effect of short-term-treatment with thalidomide on weight loss and lean body mass », Aliment Pharmacol Ther, vol. 17, , p. 677–682 (PMID 12641516)
- (en) T. Hanada et al., « Anti-cachectic effect of ghrelin in nude mice bearing human melanoma cells », Biochem Biophys Res Commun, vol. 301, , p. 275–279 (PMID 12565855)
- (en) W. Wang et al., « Effects of ghrelin on anorexia in tumor-bearing mice with eicosanoid-related cachexia », Int J Oncol, vol. 28, , p. 1393–1400 (PMID 16685441, lire en ligne) (consulté le 11 décembre 2014)
- (en) M. D. DeBoer (Art. de revue), « Emergence of ghrelin as a treatment for cachexia syndromes », Nutrition, vol. 24, , p. 806–814 (PMID 18725076)
- (en) M. D. DeBoer et al., « Ghrelin treatment causes increased food intake and retention of lean body mass in a rat model of cancer cachexia », Endocrinology, vol. 148, , p. 3004–3012 (PMID 17347304, lire en ligne) (consulté le 11 décembre 2014)
- (en) Y. L. Liu et al., « Ghrelin alleviates cancer chemotherapy-associated dyspepsia in rodents », Cancer Chemother Pharmacol, vol. 58, , p. 326–333 (PMID 16435157)
- (en) J. A. Rudd et al., « Anti-emetic activity of ghrelin in ferrets exposed to the cytotoxic anti-cancer agent cisplatin », Neurosci Lett, vol. 392, , p. 79–83 (PMID 16182445)
- (en) F. Strasser et al., « Safety, tolerability and pharmacokinetics of intravenous ghrelin for cancer-related anorexia/cachexia: a randomised, placebo-controlled, double-blind, double-crossover study », British Journal of Cancer, vol. 98, , p. 300–308 (PMID 18182992, lire en ligne)
- (en) J. M. Garcia et al., « Active ghrelin levels and active to total ghrelin ratio in cancer-induced cachexia », J Clin Endocrinol Metab, vol. 90, , p. 2920–2926 (PMID 15713718, lire en ligne) (consulté le 11 décembre 2014)
- (en) W. W. Cheung et R. H. Mak, « Ghrelin and its analogues as therapeutic agents for anorexia and cachexia in end-stage renal disease », Kidney Int, vol. 76, , p. 135–137 (PMID 19564855)
- (en) T. A. Splinter, « Cachexia and cancer: a clinician’s view », Ann Oncol, vol. 3, , p. 25–27 (PMID 1382553)
- (en) A. P. Lopez et al. (Art. de revue), « Systematic review of megestrol acetate in the treatment of anorexia-cachexia syndrome », J Pain Sympt Manag, vol. 27, , p. 360–369 (PMID 15050664)
- (en) W. Leśniak et al. (Art. de revue), « Effects of megestrol acetate in patients with cancer anorexia-cachexia syndrome – a systematic review and meta-analysis », Pol Arch Med Wewn, vol. 118, no 11, , p. 636–644 (PMID 19140567, lire en ligne) (consulté le 12 décembre 2014)
- (en) T. Yavuzsen et al. (Art. de revue), « Systematic review of the treatment of cancer-associated anorexia and weight loss », J Clin Oncol, vol. 23, , p. 8500–8511 (PMID 16293879, lire en ligne) (consulté le 12 décembre 2014)
- (en) R. Mechoulam (dir.), Cannabinoids as Therapeutic Agents, CRC Press, (ISBN 0-8493-5772-1)
- (en) E. Fride, « Cannabinoids and feeding: the role of the endogenous cannabinoid system as a trigger for newborn suckling », J Cannabis Ther, vol. 2, , p. 51–62
- (en) E. Fride et al. (Art. de revue), « Endocannabinoids and food intake: newborn suckling and appetite regulation », Adulthood Exp Biol Med, vol. 230, , p. 225–234 (PMID 15792943, lire en ligne) (consulté le 12 décembre 2014)
- (en) E. M. Berry et R. Mechoulam (Art. de revue), « Tetrahydrocannabinol and endocannabinoids in feeding and appetite », Pharmacol Ther, vol. 95, , p. 185–190 (PMID 12182965)
- (en) F. Strasser et al., « Comparison of orally administered cannabis extract and delta-9-tetrahydrocannabinol in treating patients with cancer-related anorexia-cachexia syndrome. A multicenter, Phase III, randomized, double-blind, placebo-controlled clinical trial from the Cannabis-In-Cachexia-Study-Group », J Clin Oncol, vol. 24, , p. 3394–3400 (PMID 16849753, lire en ligne) (consulté le 12 décembre 2014)
- (en) A. Jatoi et al., « Dronabinol versus megestrol acetate versus combination therapy for cancer-associated anorexia: a North Central Cancer Treatment study », J Clin Oncol, vol. 20, , p. 567–573 (PMID 11786587, lire en ligne) (consulté le 12 décembre 2014)
- (en) M. J. Tisdale (Art. de revue), « Clinical anticachexia treatments », Nutr Clin Pract, vol. 21, , p. 168–174 (PMID 16556927)
- (en) J. R. Nicholson et al., « Peripheral administration of a melanocortin 4-receptor inverse agonist prevents loss of lean body mass in tumor-bearing mice », J Pharmacol Exp Ther, vol. 317, , p. 771−777 (PMID 16436498, lire en ligne) (consulté le 12 décembre 2014)
- (en) D. O. McCarthy et al., « Indomethacin and ibuprofen preserve gastrocnemius muscle mass in mice bearing the colon-26 adenocarcinoma », Res Nurs Health, vol. 27, , p. 174−184 (PMID 15141370)
- (en) M. Trikha et al., « Targeted anti-interleukin-6 monoclonal antibody therapy for cancer: a review of the rationale and clinical evidence », Clin Cancer Res, vol. 9, , p. 4653−4665 (PMID 14581334, lire en ligne) (consulté le 12 décembre 2014)
- (en) K. Lundholm et al., « Anti-inflammatory treatment may prolong survival in undernourished patients with metastatic solid tumors », Cancer Res, vol. 54, , p. 5602−5606 (PMID 7923204, lire en ligne) (consulté le 12 décembre 2014)
- (en) S. von Haehling et al. (Art. de revue), « Cachexia: a therapeutic approach beyond cytokine antagonism », Int Jour Of Cardiology, vol. 85, , p. 173−183 (PMID 12163222)
- (en) V. Eleutherakis-Papaiakovou et al. (Art. de revue), « Thalidomide in cancer medicine », Ann Oncol, vol. 15, , p. 1151−1160 (PMID 15277253, lire en ligne) (consulté le 12 décembre 2014)
- (en) E. Bruera et al., « Thalidomide in patients with cachexia due to terminal cancer: preliminary report », Ann Oncol, vol. 10, , p. 857–859 (PMID 10470435, lire en ligne) (consulté le 12/12/2014)
- (en) E. Esposito et S. Cuzzocrea, « TNF-alpha as a therapeutic target in inflammatory diseases, ischemia-reperfusion injury and trauma », Curr Med Chem, vol. 16, , p. 3152−3167 (PMID 19689289)
- (en) K. H. Liu et al., « Thalidomide attenuates tumor growth and preserves fast-twitch skeletal muscle fibers in cholangiocarcinoma rats », Surgery, vol. 143, , p. 375−383 (PMID 18291259)
- (en) D. Tassinari et al., « Thalidomide in the treatment of cancer cachexia », J Palliat Care, vol. 24, , p. 187−189 (PMID 18942570)
- (en) J. N. Gordon et al., « Thalidomide in the treatment of cancer cachexia: a randomised placebo controlled trial », Gut, vol. 54, , p. 540−545 (PMID 15753541)
- (en) M. J. Tisdale (Art. de revue), « The ubiquitin-proteasome pathway as a therapeutic target for muscle wasting », J Support Oncol, vol. 3, , p. 209–217 (PMID 15915823)
- (en) G. J. Wilson et al. (Art. de revue), « Effects of beta-hydroxy-beta-methylbutyrate (HMB) on exercise performance and body composition across varying levels of age, sex, and training experience: A review », Nutr Metab (Lond), vol. 5, (PMID 18173841)
- (en) E. Jowko et al., « Creatine and β-hydroxy-β-methylbutyrate (HMB) additively increase lean body mass and muscle strength during a weight-training program », Nutr, vol. 17, , p. 558–566 (PMID 11448573, DOI 10.1016/S0899-9007(01)00540-8)
- (en) A. E. Knitter et al., « Effects of β-hydroxy-β-methylbutyrate on muscle damage after a prolonged run », J Appl Physiol, vol. 89, , p. 1340–1344 (PMID 11007567, lire en ligne) (consulté le 12 décembre 2014)
- (en) P. M. Gallagher et al., « β-hydroxy-β-methylbutyrate ingestion, part I: Effects on strength and fat free mass », Med Sci Sports Exerc, vol. 32, , p. 2109–2115 (PMID 11128859, DOI 10.1097/00005768-200012000-00022)
- (en) D. M. O'Connor et M. J. Crowe, « Effects of beta-hydroxy-beta-methylbutyrate and creatine monohydrate supplementation on the aerobic and anaerobic capacity of highly trained athletes », J Sports Med Phys Fitness, vol. 43, , p. 64–68 (PMID 12629464)
- (en) T. Palisin et J. J. Stacy (Art. de revue), « Beta-hydroxy-beta-Methylbutyrate and its use in athletics », Curr Sports Med Rep, vol. 4, , p. 220–223 (PMID 16004832)
- (en) M. J. Tisdale et S. A. Beck (Art. de revue), « Cancer cachexia », Int J Pancreatol, vol. 7, , p. 141–150 (PMID 2081920)
- (en) H. J. Smith et al., « Attenuation of proteasome-induced proteolysis in skeletal muscle by β-hydroxy-β-methylbutyrate in cancer-induced muscle loss », Cancer Res, vol. 65, , p. 277–283 (PMID 15665304, lire en ligne) (consulté le 12 décembre 2014)
- (en) H. J. Smith et al., « Mechanism of the attenuation of proteolysis-inducing factor stimulated protein degradation in muscle by β-hydroxy-β-methylbutyrate », Cancer Res, vol. 64, , p. 8731–8735 (PMID 15574784, lire en ligne) (consulté le 12 décembre 2014)
- (en) H. L Eley et al., « Signaling pathways initiated by beta-hydroxy-beta-methylbutyrate to attenuate the depression of protein synthesis in skeletal muscle in response to cachectic stimuli », Am J Physiol Endocrinol Metab, vol. 293, no 4, , E923–E931 (PMID 17609254, lire en ligne) (consulté le 12 décembre 2014)
- (en) Nunes EA, Kuczera D, Brito GA, Bonatto SJ, Yamazaki RK, Tanhoffer RA, Mund RC, Kryczyk M, Fernandes LC, « Beta-hydroxy-beta-methylbutyrate supplementation reduces tumor growth and tumor cell proliferation ex vivo and prevents cachexia in Walker 256 tumor-bearing rats by modifying nuclear factor-kappaB expression », Nutr Res, vol. 28, no 7, , p. 487-93. (PMID 19083450, DOI 10.1016/j.nutres.2008.04.006)
- (en) H. L. Eley et al., « Attenuation of depression of muscle protein synthesis induced by lipopolysaccharide, tumor necrosis factor, and angiotensin II by β-hydroxy-β-methylbutyrate », Am J Physiol Endocrinol Metab, vol. 295, , E1409–E1416 (PMID 18854427, DOI 10.1152/ajpendo.90530.2008) (consulté le 12 décembre 2014)
- (en) Gabriel J Wilson et al. (Table 1), « Studies which support the efficacy of HMB supplementation in varying populations », Nutr Metab (Lond), vol. 5, (PMID 18173841, DOI 10.1186/1743-7075-5-1, lire en ligne) (consulté le 12 décembre 2014)
- (en) Gabriel J Wilson et al. (Table 2), « Studies which do not support the efficacy of HMB supplementation in varying populations », Nutr Metab (Lond), vol. 5, (PMID 18173841, DOI 10.1186/1743-7075-5-1, lire en ligne) (consulté le 12 décembre 2014)
- (en) P. E. May et al., « Reversal of cancer-related wasting using oral supplementation with a combination of beta-hydroxy-beta-methylbutyrate, arginine and glutamine », Am J Surg, vol. 181, , p. 471–479 (PMID 11975938)
- (en) L. Berk, « A randomized, double-blind, placebo-controlled trial of a beta-hydroxyl beta-methyl butyrate, glutamine, and arginine mixture for the treatment of cancer cachexia (RTOG 0122) », Support Care Cancer, vol. 16, , p. 1179–1188 (PMID 18293016)
- (en) C. Madeddu et G. Mantovani (Art. de revue), « An update on promising agents for the treatment of cancer cachexia », Curr Opin Support Palliat Care, vol. 3, , p. 258–262 (PMID 19667995)
- (en) A. S. Whitehouse et al., « Mechanism of attenuation of skeletal muscle protein catabolism in cancer cachexia by eicosapentaenoic acid », Cancer Res, vol. 61, , p. 3604–3609 (PMID 11325828, lire en ligne) (consulté le 12 décembre 2014)
- (en) M. D. Barber et al., « The effect of an oral nutritional supplement enriched with fish oil on weight-loss in patients with pancreatic cancer », Br J Cancer, vol. 81, , p. 80–86 (PMID 10487616, lire en ligne) (consulté le 13 décembre 2014)
- (en) S. J. Wigmore et al., « Effect of oral eicosapentaenoic acid on weight loss in patients with pancreatic cancer », Nutr Cancer, vol. 36, , p. 177–184 (PMID 10890028)
- (en) A. Jatoi et al., « An eicosapentaenoic acid supplement versus megestrol acetate versus both in patients with cancer-associated wasting: a North Central Cancer Treatment Group and National Cancer Institute of Canada colaborative efforts », J Clin Oncol, vol. 22, , p. 2469–2476 (PMID 15197210, lire en ligne) (consulté le 12 décembre 2014)
- (en) K. C. Fearon et al., « Double-blind, placebo controlled, randomised study of eicosapentaenoic acid diester in patients with cancer cachexia », J Clin Oncol, vol. 24, , p. 3401–3407 (PMID 16849754, lire en ligne) (consulté le 12 décembre 2014)
- (en) K. C. Fearon et al., « Effect of a protein and energy dense N-3 fatty acid enriched oral supplement on loss of weight and lean tissue in cancer cachexia: a randomised double blind trial », Gut, vol. 52, , p. 1479–1486 (PMID 12970142)
- (en) C. Persson et al., « Impact of fish oil and melatonin on cachexia in patients with advanced gastrointestinal cancer: a randomized pilot study », Nutrition, vol. 21, , p. 170–178 (PMID 15723745)
- (en) H. J. Smith, « Effect of eicosapentaenoic acid, protein and amino acids on protein synthesis and degradation in skeletal muscle of cachectic mice », Br J Cancer, vol. 91, , p. 408–412 (PMID 15213711, lire en ligne) (consulté le 12 décembre 2014)
- (en) M. J. Heslin et al., « Effect of systemic hyperinsulinemia in cancer patients », Cancer Res, vol. 52, , p. 3845–3850 (PMID 1617658, lire en ligne) (consulté le 12 décembre 2014)
- (en) K. Lundholm et al., « Insulin Treatment in Cancer Cachexia: Effects on Survival, Metabolism, and Physical Functioning », Clin Cancer Res, vol. 13, , p. 2699–2706 (PMID 17473202, lire en ligne) (consulté le 12 décembre 2014)
- (en) J. Gold, « Anabolic profiles in late-stage cancer patients responsive to hydrazine sulfate », Nutr Cancer, vol. 3, , p. 13–19 (PMID 7050921)
- (en) B. Grubbs et al., « Total parenteral nutrition and inhibition of gluconeogenesis on tumor-host responses », Oncology, vol. 36, , p. 216–223 (PMID 113715)
- (en) J. Gold (Art. de revue), « Hydrazine sulfate: a current perspective », Nutr Cancer, vol. 9, , p. 59–66 (PMID 3104888)
- (en) R. T. Chlebowski et al., « Influence of hydrazine sulfate on abnormal carbohydrate metabolism in cancer patients with weight loss », Cancer Res, vol. 44, , p. 857–861 (PMID 6692384, lire en ligne) (consulté le 12 décembre 2014)
- (en) I. L. Cameron, « Effect of total parenteral nutrition on tumor-host responses in rats », Cancer Treat Rep, vol. 65, , p. 93–99 (PMID 6809328)
- (en) S. J. Lee, « Quadrupling Muscle Mass in Mice by Targeting TGF-β Signaling Pathways », PLoS ONE, vol. 2, , e789 (PMID 17726519, DOI 10.1371/journal.pone.0000789, lire en ligne) (consulté le 12 décembre 2014)
- (en) J. M. Argiles et al. (Art. de revue), « Cancer cachexia: the molecular mechanisms », Int J Biochem Cell Biol, vol. 35, , p. 405409 (PMID 12565701)
- (en) P. Schlag et C. Decker-Baumann (Art. de revue), « Strategies and needs for nutritional support in cancer surgery », Recent Results Cancer Res, vol. 121, , p. 45–52 (PMID 1907017)
- (de) F. Dombrowski et al., Allgemeine Pathologie, Urban & Fischer Verlag, (ISBN 3-437-21290-7), p. 19