Cancer du rein
Le cancer du rein est un cancer relativement rare, se développant à partir des cellules rénales. Les symptômes peuvent inclure la présence de sang dans les urines, une masse dans l'abdomen ou des douleurs au dos[1] - [2] - [3]. De la fièvre, une perte de poids et de la fatigue peuvent également apparaître[1] - [2] - [3]. Les complications peuvent inclure la propagation aux poumons ou au cerveau[4].
| Traitement | Néphrectomie |
|---|---|
| Médicament | Vinblastine, lomustine, axitinib, nivolumab, pazopanib, temsirolimus, bevacizumab, sunitinib, évérolimus, sorafénib, acide zolédronique monohydraté (d), cabozantinib, erlotinib et lenvatinib |
| Spécialité | Oncologie et urologie |
| CISP-2 | U75 |
|---|---|
| CIM-10 | C64 |
| Patient UK | Renal-cancer |
![]() Mise en garde médicale
Mise en garde médicale
Les principaux types de cancer du rein sont le carcinome des cellules rénales (CCR), le carcinome à cellules transitionnelles (CCT) et la tumeur de Wilms[5]. Le CCR représente environ 80 % des cancers du rein et le CCT la plupart des autres[6]. Les facteurs de risque du CCR et du CCT sont le tabagisme, certains analgésiques, un cancer de la vessie antérieur, le surpoids, l'hypertension, certains produits chimiques et les antécédents familiaux. Les facteurs de risque de la tumeur de Wilms comprennent les antécédents familiaux[1] - [2] et certains troubles génétiques tels que le syndrome de WAGR[3]. Le diagnostic peut être suspecté sur la base des symptômes, des analyses d'urine et de l'imagerie médicale[1] - [2] - [3]. Il est confirmé par une biopsie des tissus[1] - [2] - [3].
Le traitement peut inclure la chirurgie, la radiothérapie, la chimiothérapie, l'immunothérapie et la thérapie ciblée[1] - [2] - [3]. Le cancer du rein a touché environ 403 300 personnes et entraîné 175 000 décès dans le monde en 2018[7]. L'apparition du cancer se produit généralement après l'âge de 45 ans[8]. Les hommes sont plus souvent touchés que les femmes. Le taux de survie global à cinq ans est de 75 % aux États-Unis, 71 % au Canada, 70 % en Chine et 60 % en Europe[8] - [9] - [10] - [11]. Pour les cancers confinés au rein, le taux de survie à cinq ans est de 93 %, s'il s'est propagé aux ganglions lymphatiques environnants, il est de 70 % et s'il s'est largement répandu, il est de 12 %[8].
Épidémiologie
Il s'agit du neuvième cancer en termes de fréquence, de par le monde, avec plus de 330 000 nouveaux cas en 2012[12]. L'incidence est plus élevée et en augmentation régulière dans les pays industrialisés, partiellement du fait de l'amélioration des techniques diagnostiques[12].
L’âge moyen de survenue est 62 ans et plus de 80 % des patients ont plus de 50 ans au moment du diagnostic.
Le cancer du rein est deux fois plus fréquent chez l'homme que chez la femme (sex-ratio : 2,1/1)
En France, le cancer du rein représente 2 à 3 % de l'ensemble des cancers[13]. En 2000, on a dénombré plus de 8 000 nouveaux cas de cancer du rein.
Facteurs de risque
Les principaux facteurs de risque du cancer du rein sont le tabac et l'hypertension artérielle. Les autres facteurs connus sont :
- L'exposition aux dérivés du pétrole, des métaux lourds et de l'amiante[13]
- Travail dans l’industrie sidérurgique
- Obésité
Certaines formes sont familiales comme lors d'une maladie de von Hippel-Lindau, d'un syndrome de Birt-Hogg-Dubé, d'une leioyomatose familiale ou d'une sclérose tubéreuse de Bourneville.
Il existe une participation génétique, la mutation de plusieurs gènes pouvant favoriser son apparition : VHL, PBRM1, BAP1, SETD2, TCEB1 et KDM5C[14].
Les facteurs qui augmentent le risque de cancer du rein sont le tabagisme, l'hypertension artérielle, l'obésité, certains allèles de gènes, des antécédents familiaux de cancer du rein, une maladie rénale nécessitant une dialyse, une infection par l'hépatite C et un traitement antérieur pour un cancer des testicules ou un cancer du col de l'utérus[15] - [16].
D'autres facteurs de risque possibles, tels que les calculs rénaux, font également l'objet de recherches[17] - [18]. Certaines études ont établi un lien entre l'utilisation régulière d'AINS, tels que l'ibuprofène et le naproxène, et une augmentation du risque de cancer du rein pouvant atteindre 51 %. Une méta-analyse de 2014, a constaté que l'acétaminophène et les AINS sans aspirine sont associés à un risque significatif de développer un cancer du rein[19]. L'utilisation d'acétaminophène hors prescription sur une durée supérieur à 10 ans est particulièrement corrélée au risque de cancer du rein[20].
Un étude de 2010 rapporte une accumulation de preuves suggérant un rôle étiologique dans le carcinome des cellules rénales de l'activité physique, de la consommation d'alcool, de l'exposition professionnelle au trichloréthylène avec une parité élevée chez les femmes, mais souligne que des recherches supplémentaires sont nécessaires pour déterminer les effets précis de ces facteurs sur le risque[21].
Environ 25 à 30 % des cancers du rein sont attribués au tabagisme[16]. Les fumeurs ont un risque 1,3 fois plus élevé de développer un cancer du rein que les non-fumeurs. De plus, il existe une augmentation du risque de développement du cancer en fonction de la dose. Les hommes qui fument plus de 20 cigarettes par jour ont un risque deux fois plus élevé. De même, les femmes qui fument plus de 20 cigarettes par jour ont un risque 1,5 fois plus élevé que les non-fumeurs. Après 10 ans d'arrêt du tabac, on observe une réduction substantielle du risque de développer un cancer du rein[22].
Une consommation accrue de légumes et de vitamine C est inversement associée à l'incidence du carcinome à cellules rénales, mais le niveau de preuve n'est pas solide[23]. Une consommation modérée d'alcool peut être bénéfique pour les Européens et les Nord-Américains, et les légumes crucifères peuvent être bénéfiques pour les Nord-Américains[23].
Diagnostic
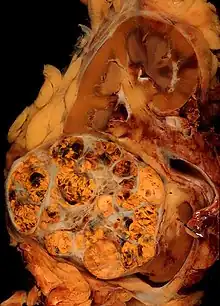
Beaucoup de cancers du rein sont aujourd'hui de diagnostic fortuit sur une imagerie rénale (environ 70%[14]). D'autres diagnostics sont portés sur des signes loco-régionaux (sang dans les urines ou hématurie, douleur ou masse lombaire) ou généraux (fièvre). La présence d'un syndrome paranéoplasique est fréquent, par production, par la tumeur, de composants à activité hormonale ou de cytokines.
Lorsqu'on suspecte un cancer du rein, il faut réaliser des examens complémentaires et un bilan d'extension. (cf arbre diagnostic en cours de réalisation).
Clinique
Les symptômes peuvent être généraux :
- Céphalées, hypertension artérielle
- Signe en faveur d'un syndrome paranéoplasique, en particulier hypercalcémie
- Fièvre inexpliquée
- Altération de l'état général : l'état général du patient sera évalué par une échelle standardisée (ECOG, OMS, Karnofsky).
Ils peuvent être loco-régionaux :
- Hématurie macroscopique, totale, spontanée, indolore et intermittente
- Douleur lombaire d'origine tumorale ou de colique néphrétique par migration de caillot
- Masse lombaire qui apparait tardivement
La triade classique associant hématurie, douleur lombaire et masse lombaire n'est retrouvée que dans 10 % des cas.
Examens complémentaires
L'examen fondamental pour le diagnostic est le scanner abdominal. L'examen visualise la tumeur, ses rapports avec les organes adjacents ainsi que la présence ou non de métastases, tout au moins abdominales. L'examen est suffisamment discriminant pour conduire directement à une chirurgie rénale. Le diagnostic positif de cancer du rein sera ensuite porté sur l'examen de la pièce opératoire. Le bilan diagnostic initial permet de déterminer l'extension de la tumeur, la présence de métastase et donc de définir une stratégie thérapeutique précise. Une IRM abdominale est parfois utile pour préciser l'extension de la lésion dans la loge rénale et déterminer la présence éventuelle d'un caillot tumoral dans la veine rénale et la veine cave inferieure.
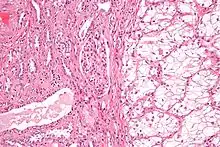
Anatomopathologie
Elle est basée essentiellement sur l'examen anatomopathologique de la pièce chirurgicale d'exérèse, la biopsie n'ayant que peu d'utilité. La classification anatomo-pathologique des tumeurs du rein est la classification UICC.
Tumeurs malignes du rein
90 % des cancers du rein sont des carcinomes à cellules rénales, répartis en différents types histologiques[13] :
- Carcinome à cellules claires du rein (80 à 90 %)
- Carcinome papillaire subdivisé en Carcinome papillaire de type 1 et Carcinome papillaire de type 2[24] (10 à 15 %)
- Carcinome à cellules chromophobes (4 à 5 %)
- Carcinome des tubes collecteurs
- Carcinome inclassable
Autres types de tumeur malignes
Les autres types de tumeurs malignes retrouvées dans le rein sont les sarcomes (voir Sarcome à cellules claires du rein), les lymphomes ou d'exceptionnelles métastases.
Tumeur bénigne du rein
- Adénome oncocytaire (oncocytome)
- Adénome papillaire
- Adénome métanéphrique
- Angiomyolipome
- Autres types de tumeur bénigne
Classification TNM des carcinomes rénaux
À l'issue du bilan initial, l'extension de la tumeur est évaluée selon la classification TNM de 1997.
- T (Tumeur)
- Tx non déterminée
- T0 pas de tumeur
- T1 limitée au rein et < 7 cm
- T1a < 4 cm
- T1b > 4 et < 7 cm
- T2 limitée au rein et > 7 cm
- T3
- T3a envahissement de la graisse périrénale et/ou de la surrénale
- T3b envahissement de la veine rénale et/ou de la veine cave sous-diaphragmatique
- T3c envahissement de la veine cave sus-diaphragmatique
- T4 franchissement du fascia de Gerota
- N (Adénopathies régionales)
- Nx non déterminé
- N0 pas de métastase ganglionnaire
- N1 métastase au niveau d'un ganglion unique
- N2 métastases au niveau de plusieurs ganglions
- M (Métastases à distance)
- Mx non déterminé
- M0 pas de métastase
- M1 métastase(s) à distance
Pronostic
Le pronostic du cancer du rein au moment du diagnostic dépend du stade TNM, du grade de Furhman (qui distingue 4 grades selon la taille du noyau et du nucléole), de l'état général du patient et de l'invasion des parois vasculaires. Lorsque les métastases apparaissent secondairement, après une première prise en charge du cancer à un stade localisé, le pronostic dépend de l'état général du patient, le délai entre la néphrectomie initiale et la rechute et le nombre de sites métastatiques.
En 2007, les taux de survie était les suivant[13]:
- T1T2N0M0 = 45 % (survie à 5 ans 65 %)
- T3 = 25 % (survie à 5 ans 40 %)
- T4 et/ou N1N2 et/ou M1 = 30 % (survie à 5 ans 10 %)
Les métastases sont d'autant plus fréquentes que le patient est jeune, concernant surtout les poumons, les os, le foie, le cerveau[25].
La thrombose de la veine rénale pouvant remonter jusqu'à la veine cave inférieure, voire jusqu'à l'atrium droit, se voit dans 10 % des cas[14].
Traitement
La prise en charge des cancers rénaux a fait l'objet de la publication de plusieurs recommandations. Celles de l'European Association of Urology ont été mises à jour en 2015[26]. Celles du National Comprehensive Cancer Network datent de 2015[27]. Celles de l'American Urological Association datent de 2013[28]. la radiothérapie et la chimiothérapie cytotoxique sont peu efficaces[29].
Modalités thérapeutiques
Le traitement du cancer du rein est multimodal, il repose sur les traitements locaux (chirurgie, radiofréquence et cryoablation) et les traitements généraux (thérapies ciblées et immunothérapie)
Traitement chirurgical du cancer du rein
Le traitement curatif du cancer du rein est basé sur la chirurgie qui consiste à assurer l'exérèse du rein porteur de la tumeur. Ce geste est appelé : néphrectomie. Elle peut être pratiquée par voie chirurgicale à ciel ouvert ou par laparoscopie. La glande surrénale peut être laissée en place ou enlevée dans le même temps.
La néphrectomie peut être radicale et totale, ou partielle pour conserver une partie du parenchyme rénal normal. Initialement réservée aux cancers du rein sur rein unique, la néphrectomie partielle a vu ses indications élargies progressivement. Cette tumorectomie peut être faite de manière chirurgicale conventionnelle, par radiofréquence ou par cryothérapie.
Traitement médical du cancer du rein
En cas de situation métastatique le traitement a été longtemps limité à l'immunothérapie par l'interféron alpha et/ou l'interleukine 2, avec un taux de réponse faible[30]. Plus récemment (2005-2006), les traitements anti-angiogéniques, s'opposant au développement de la néo-angiogenèse, ont révolutionné la prise en charge des patients. Depuis, ce sont les thérapeutiques ciblés (essentiellement des inhibiteurs de tyrosine kinase) qui sont essentiellement utilisés, avec une efficacité démontrée mais restant modérée, avec un taux de rémission complète de l'ordre de 1%[31].
Thérapeutiques ciblées
Beaucoup d'essais cliniques de par le monde sont en cours pour essayer de combiner entre eux les principaux traitements, pour tirer bénéfice de leurs modes d'actions respectifs, mais également pour les positionner en post-opératoire (traitement adjuvant) ou en pré-opératoire (traitement néo-adjuvant).
Bévacizumab
Les tout premiers résultats, rompant avec des années de stagnation, ont été obtenus avec le bévacizumab (Avastin) (anticorps bloquant dirigé contre le VEGF), utilisable aussi dans les cancers du colon, du sein et du poumon, tous au stade de métastases. Comparé à l'interféron seul, l'association bévacizumab-interféron double le temps de survie sans progression. celui-ci passe de 5 à 10 mois[32]. Le bévacizumab a obtenu son AMM dans le cancer du rein avancé et/ou métastatique le (voir site emea)
Sorafenib
Le sorafenib (nom commercial Nexavar), inhibiteur de plusieurs Tyrosine kinases: RAF, PDGFR, VEGFR2 & VEGFR3 et c-Kit/CD117, est le premier à avoir été disponible par voie orale, en en France, après avoir démontré, dans une large étude le comparant à l'interferon-alpha (IFNA), une supériorité sans équivoque, et un grand nombre de maladies métastatiques stabilisées. Le sorafenib a obtenu en France l'Autorisation de Mise sur le Marché dans "le traitement du carcinome rénal avancé après échec d’un traitement à base d’interféron alfa ou d’interleukine 2 ou chez des patients pour lesquels ces traitements sont considérés comme inadaptés". Dans la mesure où aucune étude n'a jamais démontré de supériorité nette, en gain de survie globale par exemple, des cytokines, il est aisé de les considérer comme inadaptées et de pouvoir, ainsi, prescrire le sorafenib sans attendre l'échec (qui n'est pas forcément immédiat ni constant, c'est là toute la difficulté des choix thérapeutiques) d'un traitement par interferon[33].
Sunitinib
Le sunitinib (nom commercial : Sutent) inhibe différents récepteurs tyrosine kinases : PDGFR, VEGFR, c-Kit, RET, CSF-1R, FLT3 et entraîne notamment un taux de réponses objectives en première ligne proche de 50 %, une augmentation de la survie sans progression de la maladie et probablement un gain de survie en comparaison des traitements antérieurs[34]. Le sunitinib a obtenu l'autorisation de mise sur le marché en France dans « le traitement des cancers du rein avancés et/ou métastatiques » le [35].
Temsirolimus
Le temsirolimus (nom commercial Torisel) est un inhibiteur de la mammalian target of rapamycin (mTor), autre cible privilégiée de la voie intracellulaire conduisant à la prolifération cellulaire, l'invasion tumorale, la néoangiogénèse. Le temsirolimus est la seule molécule disponible qui ait démontré une activité statistiquement significative par rapport à l’interféron, chez les malades souffrant d'un cancer du rein métastatique de mauvais pronostic (selon la classification de Motzer)[36]. Il est également le seul, pour le moment, à démontrer cet avantage en termes de survie globale.
Évérolimus
L'évérolimus (Afinitor, Zortress), disponible pour les patients en échec d'une première ligne de traitement par thérapie ciblée, est issu de la même famille de molécules ciblant la voie mTOR. L'essai Record-1, présenté en 2008 au congrès de l'American Society of Clinical Oncology (ASCO), a montré une supériorité (en termes de survie sans progression) de l'évérolimus versus placebo, pour les patients dont la maladie évoluait malgré un traitement initial par sunitinib, bevacizumab ou autre[37].
Pazopanib
Le pazopanib (nom commercial : Votrient) est une molécule autorisée à prescription aux États-Unis dans les cancers du rein métastatiques après la présentation d'une étude randomisée versus placebo[38] (ce qui a été largement critiqué, à l'heure où beaucoup de molécules auraient pu servir de comparateur, mais l'essai avait été construit avant la mise à disposition du sunitinib et du sorafenib, en particulier dans certains pays, incluant, de ce fait, bon nombre de malades dans ce protocole). L'efficacité semble similaire à celle des principaux inhibiteurs de tyrosine kinase, et la tolérance meilleure, mais seulement par le jeu de comparaisons indirectes. Un essai comparant sunitinib et pazopanib, avec cross-over obligatoire, montre que ce dernier est mieux toléré, avec une meilleure qualité de vie[39].
Axitinib
L'axitinib semble produire un taux de réponse et de survie sans progression plus importants que ses devancières[40].
Girentuximab
Girentuximab est un anticorps monoclonal chimérique utilisée dans le traitement du carcinome à cellules rénales (CCR).
À action immununologique
L'association nivolumab et ipilimumab est plus efficace que le sunitinib dans le cancer du rein évolué[41].
Traitement du cancer du rein localisé
Le traitement du cancer du rein localisé repose sur la chirurgie.
Traitement du cancer du rein métastatique
Lorsque les métastases sont découvertes au moment du diagnostic (métastases synchrones), il est justifié de réaliser la néphrectomie, si cette chirurgie n'est pas trop délabrante. Plusieurs études ont en effet démontré l'intérêt de l'ablation de la tumeur primitive dans ce contexte. Il existe des observations rares de régression spontanée des métastases pulmonaires chez certains patients. Toutefois, l'intérêt de la néphrectomie chez le patient métastatique n'a jamais été comparé aux traitements antiangiogéniques. Ainsi, un essai européen sera prochainement ouvert, comparant en deux bras sunitinib seul vs sunitinib + néphrectomie pour les patients avec un carcinome à cellules claires.
Il faut toujours discuter d'une exérèse chirurgicale des métastases chez un patient en bon état général, avec une maladie d'évolution lente et des sites métastatiques accessibles à la chirurgie. En effet, seul le traitement chirurgical du cancer du rein métastatique semble permettre, dans un nombre limité de cas, de guérir ce cancer. Le traitement médical ne permet que de ralentir l'évolution de la maladie.
En l'absence de possibilité de traitement curatif, le traitement du cancer du rein métastatique repose sur un traitement médical. Par exemple, en première ligne :
- bevacizumab (I.V.) + interféron (sous-cutané)
- sunitinib (oral)
- temsirolimus (I.V.) en particulier pour les patients de mauvais pronostic (cf. critères de Motzer)
en deuxième ligne, après échec de l'interféron :
- sorafénib (oral)
en deuxième ligne de traitement après échec d'une thérapie ciblée :
- everolimus (oral)
- cabozantinib (oral) en cours de test en 2015[42].
Suivi des patients
Les patients opérés pour un cancer du rein doivent être suivis durant 10 ans, chaque 6 mois pendant 5 ans, puis chaque année les années suivantes. Cette surveillance doit être clinique, biologique et radiologique.
Notes et références
- « Renal Cell Cancer Treatment », sur National Cancer Institute, (consulté le )
- « Transitional Cell Cancer (Kidney/Ureter) Treatment », sur National Cancer Institute, (consulté le )
- « Wilms Tumor and Other Childhood Kidney Tumors Treatment », sur National Cancer Institute, (consulté le )
- Marilyn S. Sommers et Ehriel Fannin, Diseases and Disorders: A Nursing Therapeutics Manual, F.A. Davis, (ISBN 9780803644878, lire en ligne), p. 657
- « Kidney Cancer », sur National Cancer Institute, (consulté le )
- (nl) Mulders PF, Brouwers AH, Hulsbergen-van der Kaa CA, van Lin EN, Osanto S, de Mulder PH, « [Guideline 'Renal cell carcinoma'] », Ned Tijdschr Geneeskd, vol. 152, no 7, , p. 376–80 (PMID 18380384)
- « Cancer today », sur IARC (consulté le )
- « Cancer of the Kidney and Renal Pelvis - Cancer Stat Facts », sur SEER (consulté le )
- (en) « Survival statistics for kidney cancer - Canadian Cancer Society », sur www.cancer.ca (consulté le )
- « European Network of Cancer Registeries »
- (en) Hongmei Zeng, Wanqing Chen, Rongshou Zheng, Siwei Zhang, John S Ji, Xiaonong Zou, Changfa Xia, Kexin Sun, Zhixun Yang, He Li et Ning Wang, « Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries », The Lancet Global Health, vol. 6, no 5, , e555–e567 (PMID 29653628, DOI 10.1016/S2214-109X(18)30127-X
 )
) - Jonasch E, Gao J, Rathmell WK, Renal cell carcinoma, BMJ, 2014;349:g4797
- Revue prescrire no 283, mai 2007
- Capitanio U, Montorsi F, Renal cancer, Lancet, 2016;387:894–906
- Rana Tahbaz, Marianne Schmid et Axel S. Merseburger, « Prevention of kidney cancer incidence and recurrence: lifestyle, medication and nutrition », Current Opinion in Urology, vol. 28, no 1, , p. 62–79 (ISSN 1473-6586, PMID 29059103, DOI 10.1097/MOU.0000000000000454, S2CID 25998957)
- (en) « Kidney Cancer - Risk Factors and Prevention », sur Cancer.Net, (consulté le )
- W Cheungpasitporn, Thongprayoon C, O'Corragain OA, Edmonds PJ, Ungprasert P, Kittanamongkolchai W et Erickson SB, « The Risk of Kidney Cancer in Patients with Kidney Stones: A Systematic Review and Meta-analysis », QJM, vol. 108, no 3, , p. 205–12 (PMID 25208892, DOI 10.1093/qjmed/hcu195
 )
) - « Risks and causes of kidney cancer »,
- (en) Toni K. Choueiri, Youjin Je et Eunyoung Cho, « Analgesic use and the risk of kidney cancer: A meta-analysis of epidemiologic studies », International Journal of Cancer, vol. 134, no 2, , p. 384–396 (ISSN 1097-0215, PMID 23400756, PMCID PMC3815746, DOI 10.1002/ijc.28093, lire en ligne, consulté le )
- Sara Karami, Sarah E. Daughtery, Kendra Schwartz et Faith G. Davis, « Analgesic use and risk of renal cell carcinoma: A case-control, cohort and meta-analytic assessment », International Journal of Cancer, vol. 139, no 3, , p. 584–592 (ISSN 1097-0215, PMID 27009534, PMCID 6896985, DOI 10.1002/ijc.30108, lire en ligne, consulté le )
- (en) Wong-Ho Chow, Linda M. Dong et Susan S. Devesa, « Epidemiology and risk factors for kidney cancer », Nature Reviews Urology, vol. 7, no 5, , p. 245–257 (ISSN 1759-4820, DOI 10.1038/nrurol.2010.46, lire en ligne, consulté le )
- Jay D. Hunt, Olga L. van der Hel, Garnett P. McMillan, Paolo Boffetta et Paul Brennan, « Renal cell carcinoma in relation to cigarette smoking: meta-analysis of 24 studies », International Journal of Cancer, vol. 114, no 1, , p. 101–108 (ISSN 0020-7136, PMID 15523697, DOI 10.1002/ijc.20618
 , S2CID 10136386)
, S2CID 10136386) - Zhanchen Liao, Zhitao Fang, Siqi Gou et Yong Luo, « The role of diet in renal cell carcinoma incidence: an umbrella review of meta-analyses of observational studies », BMC medicine, vol. 20, no 1, , p. 39 (ISSN 1741-7015, PMID 35109847, PMCID 8812002, DOI 10.1186/s12916-021-02229-5, lire en ligne, consulté le )
- (en) Klatte T, Pantuck AJ, Said JW et al. « Cytogenetic and molecular tumor profiling for type 1 and type 2 papillary renal cell carcinoma » Clin. Cancer Res.. 2009;15:1162-9.
- Bianchi M, Sun M, Jeldres C et al. Distribution of metastatic sites in renal cell carcinoma: a population-based analysis, Ann Oncol, 2012;23:973–980
- Ljungberg B, Bensalah K, Canfield S et al. Guidelines on renal cell carcinoma, update, Eur Urol, 2015;67:913-24
- Motzer RJ1, Jonasch E1, Agarwal N et al. Kidney cancer, version 3.2015, J Natl Compr Canc Netw, 2015;13:151-9
- Donat SM, Diaz M, Bishoff JT et al. Follow-up for Clinically Localized Renal Neoplasms: AUA Guideline, J Urol, 2013;190:407-16
- Choueiri TK, Motzer RJ, Systemic therapy for metastatic renal-cell carcinoma, N Engl J Med, 2017;376:354-366
- Klapper JA, Downey SG, Smith FO et al. High-dose interleukin-2 for the treatment of metastatic renal cell carcinoma: a retrospective analysis of response and survival in patients treated in the surgery branch at the National Cancer Institute between 1986 and 2006, Cancer, 2008;113:293-301
- Curti BD, Immunotherapy in advanced renal cancer — Is cure possible?, N Engl J Med, 2018;378:1344-1345
- Abstract ASCO 2007
- Avis du 26 septembre 2006 de la commission de transparence de l'HAS
- Motzer RJ, Hutson TE, Tomczak P et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma, J Clin Oncol, 2009;27:3584-3590
- Avis du 23 mai 2007 de la commission de transparence de l'HAS
- Hudes G, Carducci M, Tomczak P et als. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma, N Engl J Med, 2007;356:2271-81
- (en) Motzer RJ, Escudier B, Oudard S, Ravaud A et al. Record-1 Study Group. et al., « Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial », Lancet, vol. 372, no 9637, , p. 449-56. (PMID 18653228, DOI 10.1016/S0140-6736(08)61039-9)
- Sternberg CN, Davis ID, Mardiak J et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial, J Clin Oncol, 2010;28:1061–1068
- Escudier B, Porta C, Bono P et al. Randomized, controlled, double-blind, cross-over trial assessing treatment preference for pazopanib versus sunitinib in patients with metastatic renal cell carcinoma: PISCES Study, J Clin Oncol, 2014;32:1412–1418
- Rini BI, Escudier B, Tomczak P et al. Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial, Lancet, 2012;378:1931-9
- Motzer RJ, Tannir NM, McDermott DF et al. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma, N Engl J Med, 2018;378:1277-1290
- Conférence de presse Exelixis - {date|20|juillet|2015
Voir aussi
Bibliographie
- « Some Chemicals that Cause Tumours of the Kidney or Urinary Bladder in Rodents and Some Other Substances », IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 73 (1999).
Articles connexes
Liens externes
- Recommandations de la Société française d'urologie
- Recommandations 2005 pour le suivi
- Rapport de l'InVS sur l'évolution de 1978 à 2000
- Site pour patients de la ligue suisse contre le cancer
- Site pour patients de la ligue française contre le cancer
- Site pour patients de la ligue canadienne contre le cancer