Cancer du pancréas
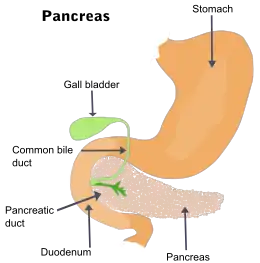
Le cancer du pancréas, ou adénocarcinome pancréatique, est un cancer de la glande pancréatique (située derrière l’estomac et qui sécrète les enzymes digestives).
| Symptômes | Douleur abdominale, ictère, pancréatite aiguë, anorexie et syndrome de Trousseau |
|---|
| Médicament | Octréotide, docétaxel, tamoxifène, irinotécan, ifosfamide, 5-Fluorouracile, streptozotocine, chlorhydrate de doxorubicine (en), sunitinib, sucrosofate (d) et erlotinib |
|---|---|
| Spécialité | Oncologie et gastro-entérologie |
| CISP-2 | D76 |
|---|---|
| CIM-10 | C25 |
| CIM-9 | 157.9 |
| OMIM | 260350 |
| DiseasesDB | 9510 |
| MedlinePlus | 000236 |
| eMedicine | 280605 |
| MeSH | D010190 |
![]() Mise en garde médicale
Mise en garde médicale


Ces données proviennent des registres nationaux du cancer de France (FRANCIM, qui ne couvrent pas tout le pays)[1]. Attention, sur le graphique les intervalles entre années ne sont pas réguliers

Relativement rare (1,8 % des cancers en France en 2011, soit 9 040 nouveaux cas cette année-là) mais son incidence semble en augmentation récente[2]. Des prédispositions génétiques familiales existent mais n'expliquent que 5 à 10 % des cas. D'autres facteurs de risque sont le tabagisme et la consommation d'alcool, la consommation de viande transformée et, chez les hommes, de viande rouge[3], et probablement l’obésité, un régime alimentaire riche en glucides et en viande et pauvre en fruits et légumes, de même que la pancréatite chronique[4] (qui a peut-être les mêmes causes).
Il en existe deux catégories, selon la partie du pancréas touchée. Cette glande est double, avec :
- une partie exocrine qui sécrète les enzymes digestives ;
- une partie endocrine dont le rôle est hormonal (plusieurs hormones importantes dont l'insuline y sont synthétisées et distribuées).
C'est cette seconde partie qui est le plus souvent et de plus en plus touchée par le cancer (il y est 20 fois plus fréquent que dans la partie exocrine[4] ; on peut alors aussi parler de cancer hormonal).
On le différencie des tumeurs neuroendocrines du pancréas, qui sont un autre type de cancer, dont la présentation est radicalement différente, mais aussi des ampullomes et des cystadénocarcinomes (en). C'est l'un des cancers les plus redoutés.
Incidence et mortalité
| taux pour 100 000 personnes |
Incidence | Mortalité | ||
|---|---|---|---|---|
| Pays | H | F | H | F |
| Finlande | 13,0 | 9,9 | 12,8 | |
| Suède | 9,8 | |||
| Suisse | 11,3 | 7,6 | 11,8 | 7,8 |
| Union Européenne | 9,7 | 6,5 | 10,7 | 7,3 |
| France | 8,0 | 4,2 | ||
| Luxembourg | 8,3 | |||
| Portugal | 4,9 | |||
| Pays de l'UE où le taux est le plus élevé | 11,1 |
|---|---|
| Pays de l'UE où le taux est le moins élevé | 7,6 |
L'incidence, dans le monde, varie entre 1 et 10 cas pour 100 000 personnes, reste globalement stable dans le temps mais en croissance dans les pays développés[6]. En 2008 le nombre de cas de cancer du pancréas dans le monde a été estimé à 278 684 (tous sexes confondus), avec un nombre de décès de 266 669 par an (Globocan, 2008).
Alors que d'autres cancers comme celui du larynx ont beaucoup diminué en France (et dans d'autres pays), les cancers du pancréas, de 1980 à 2005 ont eu une incidence qui a significativement augmenté (+ 3,8 % chez les femmes, + 2,0 % chez les hommes). L'âge moyen du diagnostic du cancer du pancréas se situe vers 70 ans (INCA, 2012)[4].
Il touche presque deux fois plus souvent l'homme que la femme (sex ratio de 1,8) avec une incidence (en moyenne taux de 7,7 pour l'homme contre 4,7 cas pour 100 000 chez la femme) qui augmente à partir de 50 ans (pic de fréquence à 75 ans pour l'homme, 80 ans pour la femme)[7].
On relève, en France en 2010, 10 140 cas de cancer du pancréas (tous types confondus, soit 3 % de tous les cancers et 10 % des cancers digestifs) avec une mortalité sensiblement équivalente, apparaissant généralement après 50 ans[8]. Toutes les tumeurs ne sont pas opérables, et les complications post-opératoires restent importantes, si bien qu'il reste un des cancers dont le taux de survie est le plus faible (< 5 % à 5 ans)[9].
Mortalité
Une légère diminution de l'incidence et de la mortalité est notée dans les pays du nord de l'Europe entre 1971 et 2000 en ce qui concerne les hommes (mais reste stable chez les femmes)[10].
En France, de 1980 à 2010, la mortalité a légèrement augmenté, et proportionnellement plus chez les femmes que chez les hommes (qui restent les plus touchés mais avec un écart diminuant entre hommes et femmes)[1].
Facteurs de risque
Les facteurs favorisants connus sont une pancréatite chronique (post-alcoolique, tropicale, ou dans le cadre d'une mucoviscidose), la consommation de viande rouge[3] est statistiquement associée à une augmentation du risque chez l’homme mais pas chez la femme, semble-t-il[11] - [12], certaines études concluant à l'absence d'augmentation du risque chez la femme[13], la consommation de viande transformée (une augmentation de consommation de viande transformée de 50 g par jour est associée à un risque accru de cancer du pancréas de 19 %[13] certainement en raison des nitrites et des composés N-nitroso utilisés pour la conservation) et le tabagisme[14] pour lequel il existe une relation entre la dose, la durée d'exposition et le risque de cancer du pancréas[15] ; le risque diminue à l'arrêt de l'intoxication et est équivalent à celui d'un non-fumeur après 15 ans d'arrêt. L'obésité est également un facteur de risque[16].
Des formes familiales existent[17] - [18] mais n'expliquent que 5 à 10 % des cas. Plusieurs mutations sur certains gènes favoriseraient la survenue de ce cancer : BRCA2, PALB2, ATM, CDKN2A[19].
Comme pour plusieurs autres types de cancer, des troubles du métabolisme ou du catabolisme des polyamines pourraient être en cause[20]. Ils sont étudiés depuis quelques années, notamment sur des animaux de laboratoire génétiquement modifiés pour présenter de tels troubles.
Prévention
D'après une revue générale, « les régimes à base de plantes, ainsi que la consommation de fruits et légumes plus élevés, de céréales entiers et de noix, ont été associés aux preuves les plus solides et les plus cohérentes, aucune méta-analyse ne signalant d'effets négatifs. Des preuves convaincantes d'un risque réduit ont également été rapportées pour les régimes alimentaires sains/prudents, bien qu'elles ne soient pas confirmées dans toutes les méta-analyses trouvées. L'Indice inflammatoire alimentaire, les régimes alimentaires occidentaux et les régimes alimentaires malsains ont engendré une tendance à des effets néfastes sur le risque de cancer du pancréas, mais ont montré des différences notables en termes de qualité et de solidité des preuves apportées »[21].
Symptômes
Ils varient selon la localisation du cancer :
- si le cancer est situé sur la tête du pancréas (60-70 % des cas[6]), il crée un obstacle des voies biliaires responsable d'une dilatation rapide de la vésicule biliaire, d’un ictère (par rétention biliaire) et d’un prurit (démangeaison) causé par l'ictère[22] ;
- si le cancer concerne la queue ou du corps du pancréas (20 à 25 % des cas[6]), le tableau clinique est dominé par des douleurs épigastriques transfixiantes (irradiantes vers les lombes), accompagnées d'une masse épigastrique.
D'autres signes sont une altération parfois importante de l'état général (asthénie, anorexie, amaigrissement), une occlusion haute par compression ou envahissement de l'estomac ou du duodénum, une hépatomégalie irrégulière secondaire à un envahissement métastatique du foie.
Enfin, la destruction du pancréas peut entraîner une insuffisance pancréatique exocrine (malabsorption et diarrhée) et endocrine (diabète).
Diagnostic
Le diagnostic repose sur la biopsie pancréatique ou hépatique en cas de métastases. Cette biopsie peut être réalisée par voie transcutanée, au cours d'une fibroscopie gastroduodénale ou pendant la chirurgie.
Un dosage de l'ACE et du CA 19.9 peut orienter vers un adénocarcinome ; des dosages hormonaux peuvent caractériser une tumeur endocrine.
Dans les années 2010 la détection de la mésothéline sanguine était une piste prometteuse pour le dépistage de ce type de cancer[23] - [24] - [25] - [26]. Cependant, cette molécule (biomarqueur) est également physiologiquement synthétisée par le tissu ovarien, mésothélial et pancréatique. Ainsi, la très faible spécificité du test dans le diagnostic précoce le rend encore peu utile en pratique courante.
Mi-2017, la revue Science Translational Medicine annonce un nouveau test sanguin de détection précoce de ce cancer[27]. Ce test réagit à la présence de deux biomarqueurs sanguins :
- la thrombospondine-2 (THBS2) ;
- le CA 19.9 (présent au dernier stade du cancer du pancréas).
Lors des essais, il a permis d'identifier systématiquement et correctement tous les stades du cancer[27].
En 2022, un nouvel algorithme associant un dosage du CA 19.9 couplé à la mesure de la signature de 8 biomarqueurs sanguins a permis la détection précoce d'adénocarcinome du pancréas (spécificité 99 %, sensibilité 92 %) grâce à un simple prélèvement sanguin. Ce test reste sensible chez les patients Lewis nul, ce qui n'était pas possible avec les tests antérieurs[28].
Imagerie

Elle vise à évaluer la taille et la localisation de la tumeur, et celles d'éventuelles métastases ganglionnaires, hépatiques, ou péritonéales.
On étudie également les rapports avec la veine porte.
Le scanner abdominal avec injection d'un produit de contraste iodé reste l'examen de référence. Il permet de mieux juger de l'extension locale et de l'existence de métastases, en particulier sur le foie et de juger ainsi de l'opérabilité[29].
L'échographie n'est pas la technique de référence pour visualiser le pancréas, organe profondément enfoui dans l'abdomen et dont l'observation est gênée par l'interposition des gaz digestifs. Cet examen reste cependant fréquemment de première intention dans l'exploration de douleurs abdominales. Il permet de découvrir un nombre notable de tumeurs du pancréas. Sa sensibilité est de 75 %, inférieure à celle du scanner[30]. Une échographie normale ne suffit donc pas à écarter le diagnostic de cancer pancréatique.
L'IRM a une sensibilité intermédiaire entre le scanner et l'échographie[30].
L'endoscopie permet de glisser un tube dans le duodénum jusqu'à l'émergence du canal pancréatique. Une injection à ce niveau d'un produit de contraste avec radiographie permet de faire une cholangiopancréatographie. Ce dernier examen peut occasionnellement détecter un rétrécissement sur l'un des canaux, pouvant témoigner d'une tumeur compressive. Cet examen a cependant un faible rendement au niveau diagnostic. En couplant l'endoscope avec une sonde d'échographie, on obtient une échoendoscopie. Cet examen a une très bonne sensibilité pour détecter des tumeurs, même de petite taille[31]. Cet examen permet également d'effectuer une biopsie dirigée.
Biologie
Le CA 19.9 est le marqueur le plus intéressant, essentiellement dans l'évaluation de l'efficacité du traitement (taux qui s'effondre) et pour la détection d'une récidive (taux qui augmente). Il est, par contre, peu utilisé dans le dépistage systématique, son élévation n'étant pas spécifique du cancer du pancréas[32]. Des études[33] ont montré la présence d'un biofilm, bactérien (Bacteroides, Gammaproteobacteria, Firmicutes, et Clostridium lituseburense) associé à la formation d'un adenocarcinome.
Anatomopathologie
La biopsie peut être chirurgicale. Elle peut être faite également lors d'une fibroscopie œsogastroduodénale, guidée par échoendoscopie.
L'adénocarcinome pancréatique peut présenter plusieurs formes histologiques :
- l'adénocarcinome ductulaire qui représente 90 % de l'ensemble des cas et 70 % des cancers de la « tête du pancréas » ;
- le cystadénocarcinome mucineux de meilleur pronostic ;
- le carcinome intra-ductulaire mucineux, également de meilleur pronostic ;
- l'adénocarcinome acinaire.
Il existe aussi des tumeurs kystiques du pancréas pouvant dégénérer (cystadénocarcinome) ou des tumeurs des canaux excréteurs du pancréas (TIPMP).
Diagnostic différentiel
Il existe des cancers du pancréas endocrines (très rares : vingt fois moins fréquents que les exocrines), révélés par leur sécrétion hormonale, donnant alors : un insulinome, glucanome, VIPome… Les tumeurs, souvent très petites, sont alors difficiles à localiser et à réséquer. Un ampullome (tumeur de l'ampoule de Vater) peut donner une symptomatologie identique à l'adénocarcinome de la tête, mais il s'agit d'une tumeur des voies biliaires, de bien meilleur pronostic. De même, un cholangiocarcinome du bas cholédoque peut être confondu avec un cancer du pancréas. Le pronostic est très sombre.
Classifications
La classification TNM (UICC 2002)
T (Tumeur)
- Tx Renseignements insuffisants pour classer la tumeur primitive
- T0 Pas de signe de tumeur primitive
- Tis Carcinome in situ
- T1 Tumeur limitée au pancréas, < 2 cm dans son plus grand diamètre
- T2 Tumeur limitée au pancréas, > 2 cm dans son plus grand diamètre
- T3 Tumeur étendue directement à n'importe lequel des organes suivants : duodénum, canal biliaire, tissu péripancréatique.
- T4 Tumeur étendue directement à n'importe lequel des organes suivants : estomac, rate, côlon, gros vaisseaux adjacents
N (Adénopathies régionales)
- Nx Renseignements insuffisants pour classer les adénopathies régionales
- N0 Pas de métastase ganglionnaire régionale
- N1 Envahissement des ganglions lymphatiques régionaux
- N1a Envahissement d'un seul ganglion
- N1b Envahissement de plusieurs ganglions
M (Métastases à distance)
- Mx Renseignements insuffisants pour classer les métastases à distance
- M0 Pas de métastase à distance
- M1 Présence de métastase(s) à distance
Vers une classification sur des bases génomiques
À partir de l'étude génétique de 456 adénocarcinomes canalaires pancréatiques avérés, des analyses génomiques ont montré que des mutations sur 32 gènes pouvaient être en cause. Ce travail a aussi récemment permis d'identifier plusieurs sous-types moléculaires du cancer du pancréas, ce qui pourrait permettre à l'avenir de mieux cibler les traitements anticancéreux à appliquer à chaque sous-type de ce cancer[34].
Évolution
Le cancer du pancréas est une tumeur de très mauvais pronostic.
Les métastases les plus fréquentes apparaissent au niveau du foie, de l'abdomen et des poumons[6].
Lorsque le diagnostic de cancer de pancréas est porté, la chance de survie à 5 ans est de 1 à 5 %. 20 % des patients opérés de façon complète sont vivants à 5 ans. En revanche, pour les patients non opérables et métastatiques, la survie médiane est de 6 mois et la survie à 5 ans est nulle. Le décès est la conséquence d'une dissémination métastatique dans 70 % des cas et de l'extension locale dans 30 % des cas[6].
Rôle du microbiote ?
On a récemment montré que des tumeurs ou cancers peuvent avoir leur propre microbiote[35].
Une étude récente[36] (2019) laisse penser que ce microbiote tumoral pourrait influencer les chances de survie du patient. Les patients survivant plus longtemps ont un microbiote tumoral « plus divers et contient des microbes qui sont considérés comme plus bénéfiques pour notre santé » et il semble associé à une meilleure activation du système immunitaire autour de la tumeur, activation susceptible de freiner la croissance de la tumeur, voire de bloquer sa croissance.
Selon Florencia McAllister & al. (2019) le microbiote pourrait offrir une certaine protection, probablement transmissible. Son équipe a prélevé un échantillon de microbiote intestinal (matière fécale) chez des porteurs de cancer du pancréas et chez des patients guéris de ce cancer, ainsi que chez des personnes saines (échantillon témoin, sans cancer).
Ces prélèvements ont été transférés à des souris de laboratoire porteuses d'un cancer pancréatique. Résultat : celles dont le microbiote a été ensemencé par des échantillons de microbiote intestinal provenant de survivants humains au cancer ont présenté une réponse immunitaire plus élevée, et leurs tumeurs étaient plus petites que dans le cas des souris ayant reçu un microbiote normal ou venant de patients cancéreux. Les auteurs ont aussi noté que le microbiote intestinal des souris ainsi traitées a évolué en ressemblant plus au microbiote tumoral des patients survivant mieux et plus longtemps au cancer du pancréas. On ignore encore si c'est la seule réponse immunitaire qui est protectrice ou si c'est le microbiote intestinal lui-même (le microbiote tumoral n'étant alors qu'un simple biomarqueur, qui pourrait cependant indiquant les chances de survie d'un patient).
Traitement
Compte tenu de la gravité du pronostic, il est légitime d'envisager un traitement agressif chez les patients en bon état général pour lesquels un traitement chirurgical optimal est possible. Lorsque le patient n'est pas opérable (mauvais état général, lésion non opérable, métastases) la qualité de vie doit être préservée le plus longtemps possible. Les soins de support ont alors une place prépondérante.
Chirurgie
La chirurgie était le traitement de première intention pour une tumeur n'excédant pas un certain volume et ne présentant pas de métastase ou de contact trop intime avec la veine porte et les autres vaisseaux. Mais la localisation de cette tumeur fait qu'elle n'est pas facile d'accès (beaucoup de veines sont derrière). Par ailleurs, des protocoles récents montrent un avantage à pratiquer une radiochimiothérapie pré et post opératoire dans des cas sélectionnés. L'exérèse n'est possible que dans 20 % des cas[6]. La rechute locorégionale survient cependant dans 70 à 80 % des cas. La chirurgie d'exérèse de la tête du pancréas (duodénopancréatectomie céphalique, le préfixe duodéno- signalant l'ablation d'une partie du duodénum) est lourde, du fait des rapports veineux, digestifs et biliaires. Elle ne peut être proposée qu'à un patient en bon état général, en l'absence ou la présence modérée de tare respiratoire ou cardiaque. Pour les tumeurs de la queue du pancréas, la chirurgie de référence est la splénopancréatectomie caudale (le préfixe spléno- signalant l'ablation de la rate, souvent trop proche du pancréas pour être conservée). Enfin, l'ablation complète du pancréas est la duodénopancréatectomie totale.
Dans le cas où aucune chirurgie curative n'est possible, on préférera, au besoin, une chirurgie palliative visant à traiter les symptômes, en permettant l'écoulement de la bile et du bol alimentaire : double dérivation bilio-digestive. Ces dérivations sont de plus en plus souvent réalisées par voie endoscopique, avec mise en place d'endoprothèses biliaires et duodénales.
Radiothérapie ou radiochimiothérapie
En cas de tumeur évoluée, la radiochimiothérapie est utilisée soit après la chirurgie soit à la place de celle-ci. La radiothérapie délivre 45 à 50 Gy en 5 à 6 semaines et est associée au 5-FU continu à faible dose. Utilisée à la suite de la chirurgie, en situation adjuvante, la radiochimiothérapie permet une diminution des rechutes locales mais le gain en survie reste faible[37]. Cette stratégie est controversée à l'heure actuelle, d'autres études la trouvant en effet délétère pour la survie[38].
Chimiothérapie
La chimiothérapie est utilisée en complément des traitements symptomatiques (chirurgie de dérivation, nutrition, traitements antalgiques, soutien psychologique). Les produits utilisés sont essentiellement la gemcitabine[39], et dans une moindre mesure, le 5-FU, le cisplatine et l'oxaliplatine. Dans les maladies métastatiques, l'effet palliatif est démontré pour la gemcitabine et la combinaison 5-FU et cisplatine. Le paclitaxel (Taxane) est un poison du fuseau. Il permet sous sa forme NAB (Abraxane) d'améliorer l'efficacité de ce médicament en le vectorisant mieux vers la tumeur augmentant ainsi la concentration de Paclitaxel dans la tumeur[40].
En situation adjuvante, c’est-à-dire après une chirurgie à visée curative, la chimiothérapie permet de réduire le risque de récidive, de retarder celle-ci et d'améliorer la qualité de vie en atténuant les symptômes de la maladie.
Les protocoles de chimiothérapie validés dans le cancer du pancréas sont :
- Folfirinox
- Oxaliplatine 85 mg m−2
- J1 + irinotécan 180 mg m−2
- J1 + LV 400 mg m−2
- J1 suivi de 5FU 400 mg m−2
- Bolus J1 et J2,400 mg m−2 46h en perfusion continue 2 fois par mois
- Abraxane/Gemcitabine [41]
- Abraxane 125 mg m−2
- J1 + Gemcitabine 1 000 mg m−2
- J8 + Gemcitabine 1 000 mg m−2
- J15 + Gemcitabine 1 000 mg m−2
- Gemcitabine
- Gemcitabine 1 000 mg m−2 hebdomadaire 7 semaines sur 8 puis 3 semaines sur 4
- Cisplatine - LV5FU2 simplifié
- Cisplatine 50 mg m−2
- Acide Folinique 400 mg m−2
- 5FU 400 mg m−2 à J1
- 5FU 2 400 mg m−2 pendant 44 heures
- Gemcis
- Gemcitabine [/b] 1 000 mg m−2
- Cisplatine [/b] 25 mg m−2
- J1, J8, J15 reprise à J28
- Gemox
- Gemcitabine 1 000 mg m−2 à J1
- Oxaliplatine 100 mg m−2 à J2
- J1 = J14
Stratégies thérapeutiques
Les stratégies thérapeutiques présentées ici sont inspirées du référentiel de la Fédération française de cancérologie digestive de 2005. Les modes de traitement peuvent varier d'un pays à l'autre et d'une région à l'autre.
Tumeur résécable
Pour des tumeurs de petite taille, chez des patients en mesure de supporter une chirurgie d'exérèse à visée curative, le traitement de référence est une chirurgie à visée curative de type duodénopancréatectomie céphalique pour les tumeurs de la tête du pancréas et une splénopancréatectomie caudale pour les lésions de la queue du pancréas. Le traitement adjuvant dépendra de la qualité de la résection.
- En cas de résection complète avec des marges suffisantes (résection R0), le traitement adjuvant comprendra une chimiothérapie LV5FU2 pendant 6 mois.
- En cas de résection incomplète microscopique (R1) ou macroscopique (R2) le traitement adjuvant comprendra soit une chimiothérapie de type 5FU-cisplatine ou gemcitabine pendant six mois soit une radio-chimiothérapie.
Tumeur non opérable
Si la tumeur n'est pas résécable d'emblée mais qu'il est probable qu'un traitement par radiothérapie ou chimiothérapie permettra de réduire suffisamment la tumeur pour la rendre opérable, il est possible de commencer le traitement, dit « néoadjuvant », par une association radiochimiothérapie (avec 5FU-cisplatine) et de réévaluer par la suite l'opérabilité de la lésion. Dans un tiers des cas, une chirurgie curative peut être effectuée, aboutissant à une survie plus prolongée[42]. Si la lésion n'est absolument pas opérable, le choix est possible entre une chimiothérapie seule, une association de radiochimiothérapie ou une chimiothérapie suivie d'une association de radiochimiothérapie pour les patients dont la tumeur a diminué sous chimiothérapie.
Tumeur métastatique
1re ligne[43] : Folfirinox, gemcitabine ou 5FU-cisplatine
2e ligne : gemcitabine, Gemox, 5FU-cisplatine ou Folfox en fonction de la première ligne.
Essais thérapeutiques
Les essais de phase III dans le cancer du pancréas avancé ont été pour la plupart infructueux[44].
Immunothérapie, thérapie ciblée, thérapie ciblée sur les macrophages, vaccins contre le cancer, etc[45] - [46] - [47] - [19].
Recherche et prospective
La NOAA a annoncé mi-2017 que des extraits d'une éponge du genre Latrunculia (Latrunculia austini) prélevée en Alaska contiennent des molécules se montrant en laboratoire capables de lutter contre les cellules tumorales du cancer du pancréas[48] - [49]. La récolte des éponges est délicate car elles vivent dans les profondeurs des océans et les composés anticancéreux n'existent qu'en faibles quantités[50]. En 2022, un projet de recherche de 4 ans financé par le National Institutes of Health débute[51].
De manière plus générale, la communauté scientifique étudie de nombreux autres composés d'origines marines aux potentiels propriétés anticancéreuse[52].
Notes et références
- Binder-Foucard F & al. (2013) Estimation nationale de l’incidence et de la mortalité par cancer en France entre 1980 et 2012. Partie 1 – Tumeurs solides. Saint-Maurice (Fra) : Institut de veille sanitaire, 2013. 122 p. | (ISBN 978-2-11-138316-6 et 978-2-11-138317-3) (ISSN 1956-6964)
- Buscail L (2017) Cancer du pancréas : mais que se passe-t-il ? Hépato-Gastro & Oncologie Digestive 1(1) (résumé)
- Larsson SC1, Håkanson N, Permert J& Wolk A (2006) Meat, fish, poultry and egg consumption in relation to risk of pancreatic cancer: a prospective study. |Int J Cancer. juin 1;118(11):2866-70 (résumé)
- Monnereau A & al. (2013) "" Estimation nationale de l’incidence des cancers en France entre 1980 et 2012 ; Étude à partir des registres des cancers du réseau Francim Partie 2 – Hémopathies malignes
- [PDF]Le registre genevois des tumeurs
- Ryan DP, Hong TS, Bardeesy N, Pancreatic adenocarcinoma, N Engl J Med, 2014;371:1039-1049
- Cancers digestifs : pancréas, rectum, Éditions John Libbey Eurotext, , p. 19
- Le cancer du pancréas sur le site de l'Inserm lire en ligne
- William Berrebi, Hépatologie, gastro-entérologie, De Boeck Secundair, , p. 407
- In Acta Oncologica, Kartheeban Nagenthiraja, Marianne Ewertz, Gerda Engholm and Hans H. Storm. Incidence and mortality of pancreatic cancer in the Nordic countries 1971–2000. 2007, Vol. 46, No. 8, Pages 1064-1069 (doi:10.1080/02841860701381234) lire en ligne
- Zhao Z1, Yin Z2, Pu Z3, Zhao Q4 (2017), Association Between Consumption of Red and Processed Meat and Pancreatic Cancer Risk: A Systematic Review and Meta-analysis| Clin Gastroenterol Hepatol. |avril|15(4):486-493.e10. doi: 10.1016/j.cgh.2016.09.143. Epub 2016 Sep 28 (résumé).
- Zhao Z1, Yin Z2, Pu Z3, Zhao Q (2016) Association Between Consumption of Red and Processed Meat and Pancreatic Cancer Risk: A Systematic Review and Meta-analysis| Clin Gastroenterol Hepatol. | avril|15(4):486-493.e10. doi: 10.1016/j.cgh.2016.09.143. Epub 2016 Sep 28 (résumé).
- (en) A. Wolk et S. C. Larsson, « Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies », British Journal of Cancer, vol. 106, no 3, , p. 603–607 (ISSN 1532-1827, DOI 10.1038/bjc.2011.585, lire en ligne, consulté le )
- (en) Batty GD, Kivimaki M, Morrison D. et al. « Risk factors for pancreatic cancer mortality: extended follow-up of the original Whitehall Study » Cancer Epidemiol Biomarkers Prev. 2009;18:673-675.
- Tom I. Lund Nilsen, Lars J. Vatten : A prospective study of lifestyle factors and the risk of pancreatic cancer in Nord-Trøndelag, Norway. Cancer Causes & Control, juillet 2000, Volume 11, no 7, pp. 645-652. lire en ligne
- (en) Li D, Morris JS, Liu J. et al. « Body Mass Index and risk, age of onset, and survival in patients with pancreatic cancer » JAMA 2009;301:2553-62.
- (en) Shi C, Hruban RH, Klein AP. « Familial pancreatic cancer » Arch Pathol Lab Med. 2009;133:365-74.
- (en) Klein AP, Brune KA, Petersen GM et al. « Prospective risk of pancreatic cancer in familial pancreatic cancer kindreds » Cancer Res, 2004;64:2634-2638
- Ghiorzo P, Genetic predisposition to pancreatic cancer, World J Gastroenterol, 2014;20:10778-10789
- Alhonen, L., Parkkinen, J. J., Keinänen, T., Sinervirta, R., Herzig, K. H., & Jänne, J. (2000) “Activation of polyamine catabolism in transgenic rats induces acute pancreatitis” ; Proc. Natl. Acad. Sci. USA 2000 97: 8290-8295 (résumé).
- Vincenza Gianfredi, Pietro Ferrara, Monica Dinu et Mariateresa Nardi, « Diets, Dietary Patterns, Single Foods and Pancreatic Cancer Risk: An Umbrella Review of Meta-Analyses », International Journal of Environmental Research and Public Health, vol. 19, no 22, , p. 14787 (ISSN 1660-4601, PMID 36429506, PMCID 9691178, DOI 10.3390/ijerph192214787, lire en ligne, consulté le )
- Porta M, Fabregat X, Malats N et al. Exocrine pancreatic cancer: symptoms at presentation and their relation to tumour site and stage, Clin Transl Oncol, 2005;7:189-197
- (en) « Top Honors Awarded at Intel ISEF 2012 », Intel
- (en) Joe Burris, « North County student wins Intel Science Fair's top prize », The Baltimore Sun,
- (en) « US teen invents advanced cancer test using Google » page BBC News sur Andraka, 20 août 2012.
- AFP & Science et Avenir (2017), Un nouveau test sanguin offre l'espoir de détecter tôt un cancer du pancréas, le 13.07.2017
- (en-US) Randall E. Brand, Jan Persson, Svein Olav Bratlie et Daniel C. Chung, « Detection of Early-Stage Pancreatic Ductal Adenocarcinoma from blood samples: Results of a multiplex biomarker signature validation study », Clinical and Translational Gastroenterology, , p. 10.14309/ctg.0000000000000468 (ISSN 2155-384X, DOI 10.14309/ctg.0000000000000468, lire en ligne, consulté le )
- (en) Karmazanovsky G, Fedorov V, Kubyshkin V, Kotchatkov A. « Pancreatic head cancer: accuracy of CT in determination of resectability » Abdom Imaging 2005;30:488-500.
- (en) Bipat S, Phoa SS, van Delden OM, Bossuyt PM, Gouma DJ, Laméris JS et al. Ultrasonography, computed tomography and magnetic resonance imaging for diagnosis and determining resectability of pancreatic adenocarcinoma: a meta-analysis, J Comput Assist Tomogr, 2005;29:438-45
- (en) DeWitt J, Deveraux B, Chriswell M, McGreevy K, Howard T, Imperiale TF. et al. « Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer » Ann Intern Med. 2004;141:753-63.
- (en) M Hidalgo. « Pancreatic cancer » N Eng J Med. 2010;362:1605-17.
- "Nbci, 2005:Bacterial biofilm within diseased pancreatic and biliary tracts"
- Peter Bailey & al. (2016) Genomic analyses identify molecular subtypes of pancreatic cancer ; Nature ; doi:10.1038/nature16965mis en ligne le (résumé)
- Nicolas Gutierrez C, « Les tumeurs pancréatiques ont leur propre microbiote ! », sur Sciences et Avenir, (consulté le )
- (en) Erick Riquelme, Yu Zhang, Liangliang Zhang et Maria Montiel, « Tumor Microbiome Diversity and Composition Influence Pancreatic Cancer Outcomes », Cell, vol. 178, no 4, , p. 795–806.e12 (PMID 31398337, PMCID PMC7288240, DOI 10.1016/j.cell.2019.07.008, lire en ligne, consulté le )
- (en) Klinkenbijl JH, Jeekel J, Sahmoud T et al. « Adjuvant radiotherapy and 5-fluorouracil after curative resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group », Ann Surg. 1999;230:776-782.
- (en) Neoptolemos JP, Stocken DD, Friess H et al. « A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer », N Engl J Med. 2004;350:1200-1210.
- (en) Burris HA III, Moore MJ, Andersen J. et al. « Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial » J Clin Oncol. 1997;15:2403-13.
- Étude MPACT
- Avis de la Commission de Transparence de l'HAS
- (en) Gillen S, Schuster T, Meyer zum Büschenfelde C, Friess H, Kleeff J. « Preoperative/Neoadjuvant Therapy in Pancreatic Cancer: A Systematic Review and Meta-analysis of Response and Resection Percentages » PLoS Med. 2010;7(4):e1000267. DOI 10.1371/journal.pmed.1000267
- Yuki Takumoto, Yuriko Sasahara, Hiroto Narimatsu et Manabu Akazawa, « Comparative Outcomes of First-Line Chemotherapy for Metastatic Pancreatic Cancer Among the Regimens Used in Japan: A Systematic Review and Network Meta-analysis », JAMA network open, vol. 5, no 1, , e2145515 (ISSN 2574-3805, PMID 35099549, PMCID 8804927, DOI 10.1001/jamanetworkopen.2021.45515, lire en ligne, consulté le )
- Ramya Thota, Anirban Maitra et Jordan D. Berlin, « Preclinical Rationale for the Phase III Trials in Metastatic Pancreatic Cancer: Is Wishful Thinking Clouding Successful Drug Development for Pancreatic Cancer? », Pancreas, vol. 46, no 2, , p. 143–150 (ISSN 1536-4828, PMID 28085753, PMCID 5242389, DOI 10.1097/MPA.0000000000000753, lire en ligne, consulté le )
- Caitlyn Smith, Wei Zheng, Jixin Dong et Yaohong Wang, « Tumor microenvironment in pancreatic ductal adenocarcinoma: Implications in immunotherapy », World Journal of Gastroenterology, vol. 28, no 27, , p. 3297–3313 (ISSN 2219-2840, PMID 36158269, PMCID 9346457, DOI 10.3748/wjg.v28.i27.3297, lire en ligne, consulté le )
- Qiu-Yu Jiang, Zhi-Xue Chen, Si Zhang et Ru-Yi Xue, « Future therapies for pancreatic carcinoma: Insights into cancer precision medicine », World Journal of Gastroenterology, vol. 28, no 22, , p. 2523–2526 (ISSN 2219-2840, PMID 35979258, PMCID 9258281, DOI 10.3748/wjg.v28.i22.2523, lire en ligne, consulté le )
- Manish Manrai, T. V. S. V. G. K. Tilak, Saurabh Dawra et Sharad Srivastava, « Current and emerging therapeutic strategies in pancreatic cancer: Challenges and opportunities », World Journal of Gastroenterology, vol. 27, no 39, , p. 6572–6589 (ISSN 2219-2840, PMID 34754153, PMCID 8554408, DOI 10.3748/wjg.v27.i39.6572, lire en ligne, consulté le )
- Rooper, C., Stone, R., Etnoyer, P., Conrath, C., Reynolds, J., Greene, H. G., ... & Demopoulos, A. (2017). Deep-Sea Coral Research and Technology Program: Alaska Deep-Sea Coral and Sponge Initiative Final Report.
- Gevers L (2017) Une éponge verte d'Alaska contre le cancer du pancréas ; le 31.07.2017
- (en) NOAA Fisheries, « Cancer-Fighting Green Sponge Brings More Than Just Good Luck! | NOAA Fisheries », sur NOAA, (consulté le )
- (en-US) « New grant will help develop anti-cancer properties of Aleutian sponge », sur pharmacy.musc.edu (consulté le )
- Dario Matulja, Filip Vranješević, Maria Kolympadi Markovic et Sandra Kraljević Pavelić, « Anticancer Activities of Marine-Derived Phenolic Compounds and Their Derivatives », Molecules (Basel, Switzerland), vol. 27, no 4, , p. 1449 (ISSN 1420-3049, PMID 35209235, PMCID 8879422, DOI 10.3390/molecules27041449, lire en ligne, consulté le )
Voir aussi
Bibliographie
- Binder-Foucard F & al. (2013) Estimation nationale de l’incidence et de la mortalité par cancer en France entre 1980 et 2012. Partie 1 – Tumeurs solides. Saint-Maurice (Fra) : Institut de veille sanitaire, 2013. 122 p. | (ISBN 978-2-11-138316-6 et 978-2-11-138317-3) (ISSN 1956-6964)
Articles connexes
Liens externes
- Ressources relatives à la santé :
- Orphanet
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notice dans un dictionnaire ou une encyclopédie généraliste :