Fluorouracile
Le fluorouracile (prononciation : « fluoro-uracile ») ou, selon la DCI, fluorouracil, ou encore 5-fluorouracile (abréviation : 5-FU), est un médicament utilisé dans le traitement de certains cancers. Il appartient à la classe des médicaments antimétabolites, sous-classe des analogues de la pyrimidine. Il fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[3].
| Fluorouracile | |
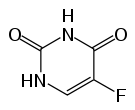  Structure chimique du fluorouracile |
|
| Identification | |
|---|---|
| Nom UICPA | 5-fluoro-2,4(1H,3H)-pyrimidinedione |
| No CAS | |
| No ECHA | 100.000.078 |
| No CE | 200-085-6 |
| Code ATC | L01 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs presque inodores |
| Propriétés chimiques | |
| Formule | C4H3FN2O2 [Isomères] |
| Masse molaire[1] | 130,077 2 ± 0,004 4 g/mol C 36,93 %, H 2,32 %, F 14,61 %, N 21,54 %, O 24,6 %, |
| pKa | 8,02 |
| Propriétés physiques | |
| T° fusion | 283 °C décomposition |
| T° ébullition | 190 à 200 °C (0,1 mmHg) |
| Solubilité | 11,1 g·L−1 dans l'eau à 22 °C. 12,2 g·L−1 dans l'eau à 20 °C. 2,9 g·L−1 éthanol à 20 °C. Soluble dans DMSO. Facilement soluble dans des solutions aqueuses alcalines |
| Précautions | |
| Directive 67/548/EEC | |
 Xn |
|
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] | |
| Écotoxicologie | |
| DL50 | 115 mg·kg−1 souris oral 81 mg·kg−1 souris i.v. 169 mg·kg−1 souris s.c. 100 mg·kg−1 souris i.p. |
| Données pharmacocinétiques | |
| Métabolisme | Intracellulaire et hépatique |
| Demi-vie d’élim. | 5-20 min. |
| Excrétion |
Rénale et par les poumons |
| Considérations thérapeutiques | |
| Voie d’administration | parentérale ou topique |
| Grossesse | chimiothérapie : Médicament dangereux pour l'embryon et le fœtus Une contraception doit être envisagée chez les femmes en âge de procréer. |
| Précautions | Statut légal en Belgique : sous ordonnance, y compris les formes topiques |
| Unités du SI et CNTP, sauf indication contraire. | |
Historique
Charles Heidelberger, professeur à l'université du Wisconsin, a étudié la toxicité de l'atome de fluor dans l'acide fluoracétique et découvert que celui-ci bloquait une enzyme vitale pour le métabolisme cellulaire. Heidelberger voulut alors incorporer cet atome dans les pyrimidines, formant les bases de l'ADN et collabora avec la firme Hoffmann-La Roche, qui synthétisa le fluorouracile en 1957. Des études cliniques confirmèrent l'intérêt du composé pour lutter contre les tumeurs gastroduodénales[4].
Mécanisme d'action
L'uracile intervient dans la biosynthèse des acides nucléiques à deux niveaux :
- Il est incorporé dans l'ARN sous forme d'UTP (uridine triphosphate) ;
- Il constitue la source principale de TTP (thymidine triphosphate) incorporée dans l'ADN. La thymidylate synthase est la seule enzyme qui permet la biosynthèse de ce nucléotide.
Le fluorouracile doit être métabolisé dans la cellule pour être actif en subissant les mêmes réactions enzymatiques que les nucléotides normaux. Il agit principalement sur la synthèse d'ADN sous forme de 5-FdUMP (5 fluorodésoxyuracile monophosphate) en bloquant l'activité de la thimidylate synthase. De plus, un autre de ses métabolites (le 5-FUTP) a la capacité de s'incorporer dans les divers types d'ARN. La transcription se fera de manière erronée.
Indications
Le Fluorouracile est utilisé pour traiter des carcinomes touchant essentiellement le système digestif ou l'appareil reproducteur féminin :
- Adénocarcinomes digestifs évolués ;
- Cancers colorectaux après résection en situation adjuvante (pour compléter l'effet de la chirurgie) ;
- Adénocarcinomes mammaires après traitement locorégional ou lors des rechutes ;
- Adénocarcinomes ovariens ;
- Carcinomes épidermoïdes des voies aérodigestives supérieures et œsophagiennes.
Pharmacocinétique
En tant qu'analogue de la pyrimidine, le fluorouracile est transformé au sein de la cellule en différents métabolites cytotoxiques qui seront incorporés dans l'ADN et l'ARN, induisant au bout du compte l'arrêt du cycle cellulaire et l'apoptose.
| Fluorouracil (parentéral) | |
| Informations générales | |
|---|---|
| Princeps |
|
| Classe | Antimétabolite |
| Identification | |
| No CAS | |
| No ECHA | 100.000.078 |
| Code ATC | L01BC02 |
| DrugBank | 00544 |
Formes topiques
Traitement local dans certaines kératoses et tumeurs cutanées.
| Fluorouracile (topique) | |
| Informations générales | |
|---|---|
| Princeps |
|
| Identification | |
| No CAS | |
| No ECHA | 100.000.078 |
| Code ATC | L01BC02 |
| DrugBank | 00544 |
Prodrogue
La capécitabine est une prodrogue qui est convertie en 5-fluorouracile dans les tissus. Elle peut être administrée par voie orale.
Études cliniques
En 1989, un groupe canadien montre un gain de survie dans le cancer colorectal métastatique en associant le fluorouracile et son antidote, l'acide folinique, aussi appelé leucovorine, par rapport au bolus de fluorouracile seul[5]. En 1990, une étude américaine montre, chez les patients atteints d'un cancer colique de stade III et traités par fluorouracile et lévomisole, une survie globale à 5 ans améliorée[6]. En 1997, Gramont el al., de l'hôpital Saint-Antoine, à Paris, montrent la supériorité de la perfusion de fluorouracile sur le bolus[7]. Au milieu des années 1990, l'introduction de l'oxaliplatine et de l'irinotécan modifie les pratiques et donne naissance aux protocoles FOLFOX (fluorouracile/acide folinique + oxaliplatine) et FOLFIRI (fluorouracile/acide folinique + irinotécan), dont l'efficacité est équivalente. L'introduction en 2004 du bévacizumab, un anticorps monoclonal ciblant le VEGF, permet le développement du protocole FOLFOX-bévacizumab utilisé en situation métastatique dans le cancer du côlon.
Le traitement par 5-FU entraîne une prise de poids chez les patients traités.
Déficit en dihydropyrimidine déshydrogénase
Depuis les années 1990, plusieurs études montrent que le médicament a une toxicité importante vis-à-vis des patients ayant un déficit d'une enzyme intervenant dans l'élimination du produit, la dihydropyrimidine déshydrogénase (DPD)[8] - [9] - [10].
En France, en janvier 2019, quatre familles de patients portent plainte contre X à la suite d'effets secondaires graves liés à une déficience non dépistée de l'enzyme DPD[11].
Le , en France, l'ANSM conditionne tout traitement à la 5-FU à un test préalable de dépistage du déficit en DPD[12].
Liens externes
- Compendium suisse des médicaments : spécialités contenant Fluorouracile
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- WHO Model List of Essential Medicines, 18th list, avril 2013
- The Evolution of Drug Discovery: From Traditional Medicines to Modern Drugs
- (en) « Biochemical modulation of fluorouracil: evidence of significant improvement of survival and quality of life in patients with advanced colorectal carcinoma. », J Clin Oncol.,
- (en) Charles G. Moertel, « Levamisole and Fluorouracil for Adjuvant Therapy of Resected Colon Carcinoma », New england journal of medicine,
- (en) De Gramont, « Randomized trial comparing monthly low-dose leucovorin and fluorouracil bolus with bimonthly high-dose leucovorin and fluorouracil bolus plus continuous infusion for advanced colorectal cancer: a French intergroup study. », J Clin Oncol,
- (en) Diasio RB, Beavers TL et Carpenter JT, « Familial deficiency of dihydropyrimidine dehydrogenase. Biochemical basis for familial pyrimidinemia and severe 5-fluorouracil-induced toxicity. », J Clin Invest., (lire en ligne)
- Coursier S, Martelet S, Guillermet A, Emptoz J, Villier C et Bontemps H, « Toxicité sévère à la capécitabine liée à un déficit enzymatique en dihydropyrimidine déshydrogénase (DPD) », Gastroentérologie Clinique et Biologique, (lire en ligne)
- Cécile Thibert, « Un anticancéreux mortel pour certains malades », Le Figaro,
- Chimiothérapie: Les proches de quatre patients victimes d'une allergie mal dépistée portent plainte, 20 minutes, 5/1/2019
- Chimiothérapies à base de 5-FU ou capécitabine : recherche obligatoire du déficit en DPD avant tout traitement - Point d'Information