Acide fluoroacétique
L'acide fluoroacétique est un composé chimique de formule FCH2COOH. Il s'agit d'un solide combustible cristallisé incolore et inodore faiblement volatil et très soluble dans l'eau. Cet acide carboxylique organofluoré très toxique est utilisé comme poison contre les rongeurs, généralement sous forme de sels (monofluoroacétates) plutôt que sous la forme de l'acide libre.
| Acide fluoroacétique | |
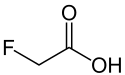 Structure de l'acide fluoroacétique |
|
| Identification | |
|---|---|
| Nom UICPA | acide 2-fluoroacétique |
| Synonymes |
acide monofluoroacétique |
| No CAS | |
| No ECHA | 100.005.120 |
| PubChem | 5237 |
| ChEBI | 30775 |
| SMILES | |
| InChI | |
| Apparence | solide incolore et inodore |
| Propriétés chimiques | |
| Formule | C2H3FO2 [Isomères] |
| Masse molaire[1] | 78,042 4 ± 0,002 4 g/mol C 30,78 %, H 3,87 %, F 24,34 %, O 41 %, |
| Propriétés physiques | |
| T° fusion | 35,2 °C[2] |
| T° ébullition | 165 °C[2] |
| Masse volumique | 1,369 3 g·cm-3[2] à 36 °C |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 4,68 mg·kg-1[2] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est présent naturellement, essentiellement sous forme de fluoroacétate de sodium FCH2COONa, dans une quarantaine de plantes d'Afrique, d'Australie et d'Amérique du Sud. Présent dans les feuilles d'un arbuste du nord de l'Afrique du Sud, le Dichapetalum cymosum, appelé Gifblaar en afrikaans (littéralement « feuille toxique »), il est à l'origine de cas mortels d'intoxication du bétail, essentiellement dans la province du Limpopo et, dans une moindre mesure, dans les provinces limitrophes du Nord-Ouest, du Gauteng et du Mpumalanga. Une problématique semblable affecte les élevages d'Australie Occidentale où pousse le Gastrolobium, ou poison pea.
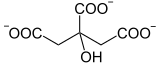
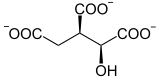
La toxicité de ce composé provient du fait qu'il est métabolisé dans le cycle de Krebs par la citrate synthase sous forme d'acide fluorocitrique HOOC–CHF–COH(COOH)–CH2–COOH qui bloque l'aconitase en empêchant la déshydratation du citrate en cis-aconitate, rendant ainsi l'isomérisation du citrate en isocitrate impossible ; ci-dessous est présenté la réaction normalement catalysée par l'aconitase en l'absence d'acide fluoroacétique :

Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Fluoroacetic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 avril 2013 (JavaScript nécessaire)