Système du complément
Le système du complément est un groupe d'environ 50 protéines connues du sérum, faisant partie de l'immunité innée. Douze (12) de ces protéines sont directement impliquées dans les mécanismes d'élimination des pathogènes, les autres régulent finement l'activité des premières afin d'éviter une réaction auto-immune (réaction contre le soi). Il y a trois voies biochimiques qui activent le système du complément : la voie classique du complément, la voie alterne du complément et la voie des lectines liant les résidus mannose des membranes bactériennes. Le complément peut s'activer en l'absence d'anticorps, dans les trois voies, raison pour laquelle il est considéré comme faisant partie de l'immunité innée[1]. Néanmoins, la voie dite classique d'activation, la première découverte, peut aussi débuter par la reconnaissance d'anticorps et fait à ce titre partie de l'immunité acquise (dite aussi adaptative). L'enfant allaité reçoit les compléments C1 à C9 via le lait maternel[2] - [3].
De façon générale, le complément montre qu'immunité innée et immunité acquise doivent être considérées comme deux systèmes collaborant pour élaborer la réponse immunitaire et non comme deux systèmes indépendants. Le complément stimule l’inflammation et l'opsonisation, lyse directement les cellules pathogènes par formation du complexe d'attaque membranaire, recrute les lymphocytes B (initiant ainsi la réponse adaptative) ainsi que les macrophages phagocytant les pathogènes.
Histoire
À la fin du XIXe siècle, on découvrit que le sérum du sang contenait un « facteur » ou un « principe » capable de tuer les bactéries. En 1895, Jules Bordet, un jeune scientifique belge à l’Institut Pasteur de Paris, démontra que cet élément pouvait être décomposé en deux composants : un thermostable et un thermolabile[4].
Il a été découvert que le composant thermostable conférait une immunité contre des microorganismes spécifiques, alors que le composant thermolabile était responsable d’une activité non spécifique, conféré par tous les sérums. Ce composant thermolabile est ce que nous appelons maintenant « complément ».
Le terme « complément » fut introduit par Paul Ehrlich à la fin des années 1890, dans une partie de sa grande théorie sur le système immunitaire. D’après cette théorie, le système immunitaire est constitué de cellules qui possèdent des récepteurs spécifiques à leur surface afin de reconnaître des antigènes. Après l’immunisation par un antigène, beaucoup de ces récepteurs sont formés, et ils empêchent ainsi ces cellules de circuler dans le sang.
Ces récepteurs que l’on appelle maintenant « anticorps », étaient nommés par Ehrlich « Amboceptors », afin d’appuyer sur leur double capacité d’attache : Ils reconnaissent et fixent un antigène spécifique, mais ils peuvent aussi être reconnus et être fixé par le composant antimicrobien thermolabile du sérum. Ehrlich nomma « complément » ce composant thermolabile, parce que c’est un élément présent dans le sang qui « complète » les cellules du système immunitaire.
Ehrlich croyait que chaque « amboceptor » spécifique à un antigène avait son propre complément, alors que Bordet croyait qu’il n’y avait qu’un seul type de complément. Au début du XXe siècle, la controverse fut résolue lorsqu’on comprit que le complément peut agir en combinaison avec des anticorps spécifiques, ou peut aussi agir par sa propre voie non spécifique.
Généralités
Le système du complément est un ensemble de protéines circulantes ou membranaires du sang, principalement sécrétées par le foie. Leur rôle initialement reconnu était de compléter l'action des immunoglobulines sériques, d'où leur nom. En l'absence des protéines thermolabiles (qui perdent leur qualités à une température déterminée), les immunoglobulines thermostables spécifiques sont incapables d'entraîner la lyse de leur cible. Il convient de signaler que le procédé visant à décomplémenter un sérum destiné à un usage en culture cellulaire se fait selon ce principe. En effet, en portant le sérum à une température de l'ordre de 56 °C, on lui retire ses activités lytiques non spécifiques et spécifiques qui seraient néfastes pour son utilisation ultérieure.
Les protéines du complément représentent environ 5 % des globulines plasmatiques. Les différentes protéines du complément sont des proenzymes inactives et qui sont activées en cascade par clivage. Le clivage libère une fraction ayant une activité enzymatique de protéase, et un petit fragment qui possède souvent un rôle sur les cellules inflammatoires.
Le système du complément possède plusieurs fonctions importantes : la cytolyse d'une cellule ou d'un agent pathogène, l'activation du système immunitaire par les petits fragments de clivage proinflammatoires, l'opsonisation de certains agents permettant leur phagocytose, et le métabolisme des complexes immuns circulants grâce aux récepteurs des fragments du complément.
Les différentes voies activant le complément aboutissent à la formation d'une C3 Convertase, point de départ de la voie effectrice commune qui détruit la cible en formant un canal transmembranaire, permettant l'entrée de molécules d'eau dans la cellule. Les principales protéines du complément sont notées de C1 à C9, elles migrent en électrophorèse dans la fraction des Beta Globulines et ont un poids moléculaire de 100 à 200 kDa.
Il existe trois voies principales : la voie classique, la voie alterne, et la voie des lectines, C3 étant le pivot de chacune des voies.
Les fragments C3a et C5a sont des molécules appelées « anaphylatoxines » : elles ont pour rôle de libérer l'histamine, de plus C5a a une activité chimiotaxique importante. Lorsqu'elles sont produites en trop grand nombre, elles peuvent provoquer un choc anaphylactique[5]. C5a peut aussi activer la voie des lipoxygénases et augmenter l’adhésion leucocytaire. Tandis que C3b et C3bi fonctionnent comme des opsonines.
Les protéines de C5 à C9 en s'assemblant forment le « complexe d'attaque membranaire » (en anglais membrane attack complex, MAC), qui est en l'occurrence l'élément permettant la lyse des cellules pathogènes.
Voie classique
Activation

La voie classique commence par l'activation du complexe C1, un détecteur de pathogènes qui interagit aussi bien directement avec des pathogènes (immunité innée) qu'avec des antigène-anticorps (immunité adaptative). C1 est un gros complexe, composé de trois sous-composants : C1q, le plus gros de ses éléments composé de 6 trimères se terminant chacun par une tête globulaire et dotés d'une queue de type collagène, et qui porte la fonction de reconnaissance du pathogène, C1r et C1s, deux sérine-protéases, qui sont inactives au début du processus[6].
Lorsque deux têtes globulaires ou plus de C1 se lient à un ligand (pathogène ou anticorps), C1 active C1r, qui devient protéolytique, et clive C1s pour désamorcer la cascade de protéolyse[6]. Chaque clivage libère un petit fragment : C4a, C2a et C3a qui agissent sur les cellules inflammatoires.
Le C1s activé clive alors le C4 en C4a (qui va dans le sang) et C4b qui se fixe sur la membrane de la cellule à lyser et va recruter C2. C2 sera également clivé par C1s mais aussi via C4b. Le fragment C2 se divise en C2a et C2b et C2a reste fixé à C4b alors que C2b reste libre. Le complexe C4bC2a ainsi formé s'appelle la C3-convertase dont le rôle est de scinder C3 en C3a (qui part dans le sang) et C3b. Ce dernier se fixe sur la membrane de la cellule à lyser et forme le complexe C4bC2aC3b : c'est la C5 convertase[6].
En immunité innée, C3b se lie ensuite directement au pathogène pour l'opsoniser, selon les cas directement à ses éléments de surface, ou via la Protéine C réactive[6]. Ces liaisons restent cantonnées à la surface du pathogène[7].
En immunité adaptative, le processus est le même qu'en immunité innée, à cette différence que C3b se lie aux régions Fc d'anticorps. Seules les IgG1, IgG3, les IgM, et faiblement les IgG2 sont capables d'entraîner la cascade des évènements. La fixation de deux ou plusieurs immunoglobulines d'IgG ou une molécule d'IgM pentamérique, à la surface d'un microorganisme, permet à leur région Fc de fixer le premier composant de la voie classique. Ce sont bel et bien les têtes globulaires qui vont interagir avec les fragments Fc des immunoglobulines ayant lié l'antigène.
Régulation
Plusieurs mécanismes interviennent dans la régulation du système de complément :
- Inhibiteur de la C1 estérase (C1 Inh) : serpine qui inhibe plusieurs enzymes autres que C1r et C1s, dont le déficit en C1-Inh est responsable d'une maladie, l'angiœdème héréditaire ;
- Facteur I et son cofacteur C4BP (en)
Voie alterne
La voie alterne est la première défense mise en jeu lors d'une infection par un germe inconnu de l'organisme infecté avant une réponse immune spécifique.
Activation

Elle est activée quant à elle par les surfaces cellulaires des bactéries gram+ ou gram-, quelques cellules infectées par un virus, quelques levures, et parasites. Également par les polysaccharides, comme le zymosan ou l'inuline, par les LPS (lipopolysaccharides) bactériens, et diverses substances, comme les fibres d'amiante, le gluten, l'hémoglobine, certains produits de contraste fortement iodés et quelques cellules tumorales. À noter qu'une membrane cellulaire est d'autant plus activatrice de la voie alterne qu'elle est pauvre en acide sialique. La voie alterne d'activation résulte de la fixation du C3b sur un site accepteur. En permanence de faibles quantités de C3 sont clivées spontanément en C3a et C3b. Ce dernier possède, pendant un très court instant, un site hautement réactif capable de se fixer sur des groupements chimiques présents sur virtuellement toutes les surfaces biologiques, principalement bactériennes. En l'absence de ce site accepteur, le C3b réagit avec l'eau et donne le C3b soluble. Le C3b fixé à une surface peut alors lier le facteur B qui est clivé, en présence d'ions Mg2+, par le facteur D en Bb et Ba, formant la C3-convertase alterne, ou C3bBb. Cette C3-convertase clive des molécules de C3 pour former un complexe C3bBbC3b, ou C5-convertase alterne. Cette dernière va à son tour cliver le c5 rejoignant ainsi la voie classique.
Régulation
Elle s'effectue grâce à différentes protéines :
- le facteur H, qui agit sur la dissociation de la C3/C5 convertase alterne et comme cofacteur du facteur I dans l'inactivation du C3b en C3bi ; le facteur H intervient pour contrôler l'activation de la voie alterne en phase fluide ;
- le Facteur I, qui inactive le C3b en C3bi puis en C3c et C3dg, en présence de facteur H ;
- la properdine (en) ou facteur P, qui stabilise le complexe C3bBbC3b.
Au niveau des membranes, la régulation de l'activation de la voie alterne se fait grâce à différentes protéines membranaires: le récepteur du C, CR1, le facteur d'accélération de dissociation (DAF), la protéine cofacteur de membrane (MCP) ou CD46. Ces protéines agissent comme cofacteur du facteur I pour dégrader C3b et C4b ou comme accélérateur de la dissociation des C3/C5 convertase alterne ou classique (CR1 et DAF).
Voie des lectines
Une protéine globulaire, la Mannose Binding Lectin (MBL) appartenant à la famille des collectines, peut interagir avec les résidus mannose ou N-acétylglucosamine (GlcNac) des microorganismes. Sa structure est homologue au C1q. Sa fixation sur des mannoses de bactéries active 2 sérine-protéases MASP1 et MASP2 ou MASP3 qui clivent et activent C4 et C2, rejoignant ainsi la voie classique.
Voie effectrice commune
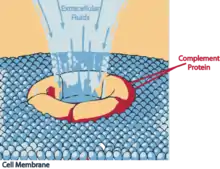
Dans les trois cas, les composants précoces activent localement C3, qui est le facteur pivot du complément, et dont le clivage conduit non seulement à l'assemblage du complexe qui attaque la membrane, mais aussi au recrutement des différents globules blancs.
Le C3b, qui est le plus grand fragment de la lyse de C3 par la C3-convertase, se lie de façon covalente à la surface de la cellule. Le plus petit fragment, C3a, agit quant à lui comme signal diffusible qui provoque une réponse inflammatoire, en stimulant la migration des globules blancs vers le site de l'infection. Le fragment C3b fixé à la membrane, produit à la fois par la voie classique et la voie alterne, et même la voie des lectines, amorce la cascade des réactions qui conduit à la formation du complexe d'attaque membranaire, à partir des composants tardifs du complément. Il est donc fixé sur la membrane de façon covalente, et il clive le facteur C5 en C5a et C5b. C5b reste faiblement lié à C3b et s'assemble rapidement à C6 et C7 pour former le complexe C5b67 qui va s'ancrer à la membrane via C7. Ce complexe lie ensuite C8, pour former le complexe C5b678. La liaison du facteur C9, qui expose une région hydrophobe après changement de conformation, entraîne son insertion dans la membrane plasmique de la cellule. Il s'ensuit alors une réaction en chaîne où les C9 de nouvelle conformation vont lier des C9 de l'ancienne, entraînant le changement conformationnel qui leur permet de s'insérer dans la double couche lipidique. C'est ainsi qu'il se forme un canal au travers de la membrane cellulaire (Complexe d'attaque membranaire (CAM)). Dès lors, la perméabilité de la cellule est perturbée, les petites molécules pénètrent et sortent de la cellule au voisinage de ces pores, et à travers ceux-ci. Les macromolécules ne peuvent cependant pas passer. De ce fait, le mécanisme cellulaire contrôlant l'équilibre des échanges est bouleversé. L'eau entre par osmose dans la cellule, faisant augmenter son volume jusqu'à la lyse. On observe ce même phénomène de lyse avec des globules rouges en solution hypotonique. Ce système est très efficace puisqu'il a été observé que la présence d'un seul de ces canaux permet la lyse d'un globule rouge.
Rôle dans les maladies
Les maladies liées à un déficit en complément sont rares :
- les déficits en protéines de la voie classique : C1q, C2, C4, se révèlent par un lupus ;
- les déficits en protéines de la voie des mannanes : MBP, donnent des infections graves et récidivantes ;
- les déficits en protéines de la voie alterne : B, D, Properdine, donnent des infections bactériennes graves ;
- les déficits en protéines du complexe d'attaque membranaire : C5, C6, C7, C8, s'accompagnent d'infections à Neisseria ;
- les déficits en inhibiteurs : H, I donnent des infections avec urticaire, anémie hémolytique, syndrome hémolytique et urémique, glomérulopathie ou les déficits en CD55 et CD59 donnent l'hémoglobinurie paroxystique nocturne (maladie de Marchiafava et Michelli) ou encore les déficits en C1inh (angiœdème bradykinique) ;
- des déficits en CR-1 (en) et CR-3 (en) ont aussi été décrits.
Les maladies accompagnées de dysfonctionnements du complément sont nombreuses.
Bien que certains agents pathogènes soient capables d'inactiver le complément, la plus grande majorité ne le peut pas, et au contraire, active la voie alterne de la C3 convertase. Ces agents pathogènes favorisent la production des molécules de la voie alterne d'activation, en particulier C3a, C3b, C5a et le complexe d'attaque membranaire C56789. Celui-ci étant formé sur le site de la C3-convertase, son activité de dégradation s'exerce sur les pathogènes et non sur les cellules de l'hôte. Les fragments solubles du complément C3a et C5a qui sont formés possèdent des propriétés pro-inflammatoires. Par exemple, la liaison du C5a aux récepteurs des cellules endothéliales augmente la perméabilité vasculaire et l'infiltration des protéines plasmatiques dans les tissus inflammés.
Notes et références
- Janeway et Murphy 2018, p. 49.
- (en) MO Ogundele. « Bactericidal Activity of Human Milk Complement System » présenté à l'INABIS '98 - 5e congrès mondial Internet des sciences biomédicales à l'université McMaster, Canada, 7 au 16 décembre 1998.
- (en) Hanson, Lars A. Immunobiology of Human Milk. Pharmasoft Publishing, Amarillo (Texas) 2004.
- « Immunologie 1 : hémolyse immune », Activités et Travaux Pratiques (ATP), sur www.snv.jussieu.fr, Biologie et Multimédia, (consulté le )
- Janeway et Murphy 2018, p. 65.
- Janeway et Murphy 2018, p. 56.
- Janeway et Murphy 2018, p. 56-57.
Bibliographie
- Charles A Janeway et Kenneth Murphy (trad. de l'anglais par Pierre L. Masson), Immunobiologie de Janeway, Louvain-la-Neuve (Belgique)/Paris, De Boeck Superieur, , 885 p. (ISBN 978-2-8073-0612-7 et 2-8073-0612-8, lire en ligne)