Histoire de la production d'hydrogène
L’histoire de la production d'hydrogène débute avec les expériences de Cavendish en 1766.
L'alchimiste Paracelse, qui vivait au XVIe siècle, a entrevu le gaz ; un siècle plus tard, Robert Boyle parvint à le recueillir, mais ne le distingua pas de l’air ordinaire. En 1603, Théodore de Mayerne l’enflamma, et John Mayow, vers la fin du XVIIe siècle, le distingua de l’air. Enfin, au commencement du XVIIIe siècle, Nicolas Lémery en constata aussi l’inflammabilité[1].
Ce n’est qu’en 1766 que ce gaz fut étudié par Cavendish. En 1783, Antoine Lavoisier découvre que l’« air inflammable » de Cavendish, qu’il baptise hydrogène (du grec « formeur d’eau »), réagit avec l’oxygène pour former de l’eau.
La découverte de l’« air inflammable » comme on l’appelait est donc ancienne. Théodore de Mayerne et Paracelse l’obtenaient par réaction entre l’« huile de vitriol » (de l’acide sulfurique) diluée et versée sur du fer ou du zinc[2]. En 1870, le gaz produit pour les besoins des ballons à gaz n’utilise pas d’autre moyen[3]. Au XXIe siècle, le gros du dihydrogène requis est produit à partir du méthane présent dans le gaz naturel, par catalyse hétérogène[4].
Le gaz inflammable
Le processus historique de production d’hydrogène fait réagir des copeaux de fer ou de zinc et de l’acide sulfurique.
C’est le moyen qui est utilisé par Paracelse (1493-1541) qui savait que, pendant cette réaction, il se dégageait « un air comme un souffle », et que cet air provenait de l’eau dont il était un élément. Toutefois Paracelse ne connaissait aucun moyen pour recueillir les gaz, quoique le moyen en fût très-simple, et d’en étudier les propriétés[5].
Robert Boyle (1627-1691) compléta l’expérience de Paracelse de la manière suivante :
« Nous remplissons, dit-il, d’environ parties égalés d’huile de vitriol et d’eau commune un petit matras de pierre, pourvu d’un long col cylindrique. Puis, après y avoir jeté six petits clous de fer, nous fermons aussitôt l’ouverture du vase, parfaitement plein, et nous introduisons le col dans un autre vase renversé, d’une plus grande capacité et contenant de l’eau. Aussitôt nous voyons s’élever, dans le vase supérieur, des bulles aériformes qui, en se rassemblant, dépriment l’eau dont elles prennent la place. Bientôt toute l’eau du vase supérieur (renversé) est expulsée et remplacée par un corps qui a tout l’aspect de l’air[5]. »
Mais d’où provenait ce corps aériforme ? Ici Boyle n’était pas aussi bien inspiré que Paracelse : au lieu de prendre ce corps pour un élément de l’eau, il le considérait comme le résultat d’une transformation artificielle de l’air[6].
Nicolas Lémery (1645-1715) fut le premier à observer l’inflammabilité de l’hydrogène. Il le préparait en mêlant ensemble de la limaille de fer, de l’acide sulfurique et de l’eau dans un matras à col étroit : il l’allumait en approchant une bougie de l’orifice du col. L’expérience fut depuis lors répétée par d’autres[5]. John Mayow (1641–1679), qui avait obtenu ce gaz par le même procédé, doutait de son identité avec l’air commun. Ce ne fut donc pas Cavendish qui découvrit l’hydrogène ; mais il en décrivit le premier les propriétés caractéristiques.
En 1766, Henry Cavendish, détermine la nature de l’hydrogène qu’il désigne sous le nom de « gaz inflammable » et qu’il produit avec du zinc, de l’acide et de l’eau. Priestley continue les études de Cavendish et c’est Antoine Lavoisier qui donne enfin au nouveau corps le nom d’« hydrogène »[7].
La réaction entre l’acide sulfurique et le fer est la suivante :
- Fe(s) + H2SO4 (aq) → H2 (g) + FeSO4 (aq)
On prépare aussi l’hydrogène en attaquant le zinc par de l’acide sulfurique hydraté. Ce métal, sous l’influence de l’acide, décompose l’eau, passe à l’état d’oxyde de zinc qui se combine à l’acide, et l’hydrogène devient libre. Voici l’équation qui rend compte de la réaction :
- Zn(s) + H2SO4 (aq) → H2 (g) + ZnSO4 (aq)
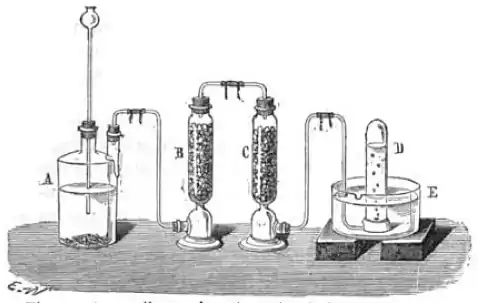
A-Flacon où se dégage l’hydrogène
B-Éprouvette remplie de morceaux de pierre ponce imbibée de potasse
C-Éprouvette remplie de morceaux de pierre ponce imbibée d’une solution de sublimé corrosif (Chlorure de mercure(II))
D-Éprouvette où vient se rendre le gaz purifié
En 1861, le zinc contenant presque toujours un peu de soufre et d’arsenic, le gaz obtenu est impur et possède une odeur désagréable, due à la présence de l’hydrogène sulfuré et de l’hydrogène arsénié. On le purifie en le faisant passer sur de la pierre ponce imprégnée de potasse, sur de la pierre ponce humectée de sublimé corrosif, ou plus simplement sur du charbon[8].
En 1883, les ballons à gaz s’ils doivent utiliser l’hydrogène n’utilisent pas d’autre moyen que celui utilisés par Paracelse trois siècles auparavant. Notons qu’à cette époque, c’est notamment la grande disponibilité du gaz d’éclairage, contenant 50 % de dihydrogène qui le fait préférer au dihydrogène pur. Ainsi, si l’on devait, gonfler le ballon au dihydrogène pur, « il faudrait organiser une installation laborieuse et longue, composée de quelques centaines de touries d’acide sulfurique et de plusieurs milliers de kilogrammes de copeaux de fer, remplir une série de tonneaux joints ensemble d’acide sulfurique et d’eau, conduire le gaz ainsi obtenu dans une cuve où il se lave, le sécher par de la chaux et le refroidir par un courant d’eau, et seulement enfin le conduire à l’aérostat par un long tube[3]. »
De la décomposition de l'eau en oxygène et en hydrogène
L’eau (H2O), est constituée de deux atomes d’hydrogène (H) et d’un atome d’oxygène (O). Cette découverte est entièrement réalisée, fin XVIIIe siècle par les chimistes anglais et français Cavendish, Priestley et Lavoisier.
Henry Cavendish, l’un des fondateurs de la chimie, introduit dans cette science des méthodes de travail inconnues avant lui. En 1766, il présente devant la Société Royale de Londres, dont il est devenu membre, un premier mémoire intitulé On Factitious Airs (« Sur les airs factices »). Il y établit l’existence de gaz autres que l’air, et montre que l’hydrogène (inflamable air, « air inflammable ») qu’il a isolé le premier, pèse dix fois moins que l’air atmosphérique (common air, « air commun »). En 1783, Henry Cavendish, fait une analyse de l’air et l’année suivante, il reconnaît que l’eau est le produit de la combinaison de l’hydrogène et de l’oxygène.
En 1774, le physicien et chimiste britannique Joseph Priestley produit pour la première fois de l’oxygène. Cependant, en tant que partisan de la théorie phlogistique, il nomme ce nouveau gaz, l’« air déphlogistiqué », et ne se rend pas compte de l’importance de sa découverte. De son vivant, la réputation scientifique de Priestley résulte de sa « découverte » de l’eau gazeuse, de ses traités sur l’électricité et de ses études sur les différents « airs » (gaz), le plus connu étant celui qu’il baptise « l’air déphlogistiqué ». Cependant, sa détermination à défendre la théorie phlogistique et son rejet des concepts qui vont conduire à la révolution chimique l’ont isolé au sein de la communauté des savants.
Ce fut le chimiste français Antoine Lavoisier, père de la chimie moderne qui fut le grand démystificateur de la théorie phlogistique. Se basant sur les travaux de Priestley, c’est lui qui identifie et donne à l’oxygène son nom[9] - [10]. En 1783, il découvre aussi que l’« air inflammable » de Cavendish, qu’il baptise hydrogène (du grec « formeur d’eau »), réagit avec l’oxygène pour former une rosée, qui est de l’eau, comme l’a remarqué Priestley.
Les expériences de Lavoisier
Décomposition de l’eau
Trois expériences sont expliquées par Lavoisier dans son Traité élémentaire de chimie qui servent à démontrer et caractériser ce « radical constitutif » de l’eau, qu’il baptise hydrogène :
- La première expérience est une simple distillation de la vapeur d’eau. Elle met en œuvre les phénomènes de vaporisation et de condensation de l’eau.
- La seconde expérience fait réagir du carbone (C) pur porté à incandescence avec de la vapeur d’eau : de l’oxyde de carbone est produit ainsi que de l’hydrogène. Suivant que le carbone est porté au rouge sombre ou au rouge vif, la réaction produit du dioxyde de carbone ou du monoxyde de carbone :
- Porté au rouge sombre : du dioxyde de carbone est produit et du dihydrogène
- Porté au rouge vif : du monoxyde de carbone est produit et du dihydrogène
- La troisième expérience fait réagir des copeaux de fer avec de l’eau sous l’effet de la chaleur. De l’oxyde de fer est produit et du dihydrogène.
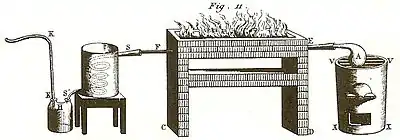
Effet
À mesure que l’eau de la cornue A se vaporise par l’ébullition, elle remplit l’intérieur du tube EF, et elle en chasse l’air commun qui s’évacue par le tube KK ; le gaz aqueux est ensuite condensé par le refroidissement dans le serpentin SS′, et il tombe de l’eau goutte à goutte dans le flacon tubulé H.
En continuant cette opération jusqu’à ce que toute l’eau de la cornue A soit évaporée, on retrouve dans le flacon H une quantité d’eau rigoureusement égale à celle qui était dans la cornue A, sans qu’il y ait eu dégagement d’aucun gaz ; en sorte que cette opération se réduit à une simple distillation ordinaire, dont le résultat est absolument le même que si l’eau n’eût point été portée à l’état incandescent, en traversant le tube intermédiaire EF.
Effet :
L’eau de la cornue A se distille dans cette expérience comme dans la précédente ; elle se condense dans le serpentin, et coule goutte à goutte dans le flacon H ; mais en même temps il se dégage une quantité considérable de gaz, qui s’échappe par le tuyau KK, et qu’on recueille dans un appareil convenable. L’opération finie, on ne retrouve plus dans le tube EF que quelques atomes de cendre ; les vingt-huit grains de charbon ont totalement disparu. Les gaz qui se sont dégagés examinés avec soin, se trouvent peser ensemble 113 grains 7⁄10 ; ils sont de deux espaces, savoir 144 pouces cubiques de gaz acide carbonique, pesant 100 grains, et 380 pouces cubiques d’un gaz extrêmement léger, pesant 13 grains 7⁄10, et qui s’allume par l’approche d’un corps enflammé lorsqu’il a le contact de l’air. Si on vérifie ensuite le poids de l’eau passée dans le flacon, on la trouve diminuée de 85 grains 7⁄10. Ainsi dans cette expérience, 85 grains 7⁄10 d’eau, plus 28 grains de charbon ont formé 100 grains d’acide carbonique, plus 13 grains 7⁄10 d’un gaz particulier susceptible de s’enflammer. Mais j’ai fait voir plus haut, que pour former 100 grains de gaz acide carbonique, il fallait unir 72 grains d’oxygène à 28 grains de charbon ; donc les 28 grains de charbon placés dans le tube de verre ont enlevé à l’eau 72 grains d’oxygène ; donc 85 grains 7⁄10 d’eau sont composés de 72 grains d’oxygène et de 13 grains 7⁄10 d’un gaz susceptible de s’enflammer. On verra bientôt qu’on ne peut pas supposer que ce gaz ait été dégagé du charbon, et qu’il est conséquemment un produit de l’eau.
Effet :
Il ne se dégage point de gaz acide carbonique dans cette expérience, mais seulement un gaz inflammable 13 fois plus léger que l’air de l’atmosphère : le poids total qu’on en obtient est de 15 grains, et son volume est d’environ 416 pouces cubiques. Si on compare la quantité d’eau primitivement employée avec celle restante dans le flacon H, on trouve un déficit de 100 grains. D’un autre côté, les 274 grains de fer renfermés dans le tube EF se trouvent peser 85 grains de plus que lorsqu’on les y a introduits ; et leur volume se trouve considérablement augmenté ; ce fer n’est presque plus attirable à l’aimant, il se dissout sans effervescence dans les acides ; en un mot, il est dans l’état d’oxyde noir, précisément comme celui qui a été brûlé dans le gaz oxygène.
« Le résultat de cette expérience présente une véritable oxidation du fer par l’eau ; oxidation toute semblable à celle qui s’opère dans l’air à l’aide de la chaleur. Cent grains d’eau ont été décomposés ; 85 d’oxygène se sont unis au fer pour le constituer dans l’état d’oxide noir, & il s’est dégagé 15 grains d’un gaz inflammable particulier : donc l’eau est composée d’oxygène & de la base d’un gaz inflammable, dans la proportion de 85 parties contre 15[11]. »
« Ainsi l’eau indépendamment de l’oxygène qui est un de ses principes, & qui lui est commun avec beaucoup d’autres substances, en contient un autre qui lui est propre, qui est son radical constitutif, & auquel nous nous sommes trouvés forcés de donner un nom. Aucun ne nous a paru plus convenable que celui d’hydrogène, c’est-à-dire, principe générateur de l’eau, de ὕδωρ eau, & de γείνομαι j’engendre. Nous appellerons gaz hydrogène la combinaison de ce principe avec le calorique, & le mot d’hydrogène seul exprimera la base de ce même gaz, le radical de l’eau[11]. »
« On a critiqué même avec assez d’amertume cette expression hydrogène, parce qu’on a prétendu qu’elle signifioit fils de l’eau & non pas qui engendre l’eau. Mais qu’importe, si l’expression est également juste dans les deux sens : les expériences rapportées dans ce Chapitre, prouvent que l’eau, en se décomposant, donne naissance à l’hydrogène, & surtout l’hydrogène donne naissance à l’eau en se combinant avec l’oxygène. On peut donc dire également que l’eau engendre l’hydrogène, & que l’hydrogène engendre l’eau[11]. »
« Voilà donc un nouveau corps combustible, c’est-à-dire, un corps qui a assez d’affinité avec l’oxygène pour l’enlever au calorique & pour décomposer l’air ou le gaz oxygène. Ce corps combustible a lui-même une telle affinité avec le calorique, qu’à moins qu’il ne soit engagé dans une combinaison, il est toujours dans l’état aériforme ou de gaz au degré habituel de pression & de température dans lequel nous vivons. Dans cet état de gaz, il est environ 13 fois plus léger que l’air de l’atmosphère, il n’est point absorbable par l’eau, mais il est susceptible d’en dissoudre une petite quantité ; enfin il ne peut servir à la respiration des animaux[11]. »
Recomposition de l’eau
Cette expérience réalise la recomposition de l’eau, en fait l’oxydation ou la combustion de l’hydrogène par l’oxygène :
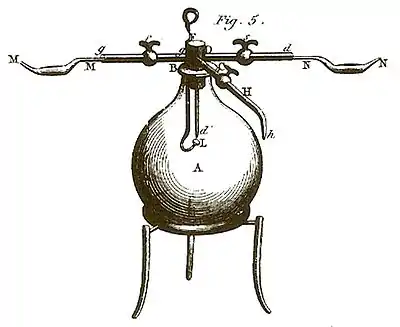
On doit s’être prémuni d’avance d’une provision suffisante de gaz oxygène bien pur ; & pour s’assurer qu’il ne contient point d’acide carbonique, on doit le laisser long-temps en contact avec de la potasse dissoute dans de l’eau, & qu’on a dépouillée de son acide carbonique par de la chaux : on donnera plus bas quelques détails sur les moyens d’obtenir cet alcali.
On prépare avec le même soin le double de gaz hydrogène. Le procédé le plus sûr pour l’obtenir exempt de mélange, consiste à le tirer de la décomposition de l’eau par du fer bien ductile et bien pur.
Lorsque ces deux gaz sont ainsi préparés, on adapte la pompe pneumatique au tuyau Hh, & on fait le vide dans le grand ballon A : on y introduit ensuite l’un ou l’autre des deux gaz, mais de préférence le gaz oxygène par le tuyau gg, puis on oblige par un certain degré de pression le gaz hydrogène à entrer dans le même ballon par le tuyau dDd′, dont l’extrémité d’ se termine en pointe. Enfin on allume ce gaz à l’aide d’une étincelle électrique. En fournissant ainsi de chacun des deux airs, on parvient à continuer très-long-temps la combustion. J’ai donné ailleurs la description des appareils que j’ai employés pour cette expérience, & j’ai expliqué comment on parvient à mesurer les quantités de gaz consommées avec une rigoureuse exactitude. Voyez la troisième partie de cet Ouvrage.
« Ainsi, soit qu’on opère par voie de décomposition ou de recomposition, on peut regarder comme constant & aussi bien prouvé qu’on puisse le faire en Chimie & en Physique, que l’eau n’est point une substance simple ; qu’elle est composée de deux principes, l’oxygène & l’hydrogène, & que ces deux principes séparés l’un de l’autre, ont tellement d’affinité avec le calorique, qu’ils ne peuvent exister que sous forme de gaz, au degré de température & de pression dans lequel nous vivons[11]. »
« Ce phénomène de la décomposition & de la recomposition de l’eau s’opère continuellement sous nos yeux, à la température de l’atmosphère & par l’effet des affinités composées. C’est à cette décomposition que sont dus, comme nous le verrons bientôt, au moins jusqu’à un certain point, les phénomènes de la fermentation spiritueuse, de la putréfaction, & même de la végétation. Il est bien extraordinaire qu’elle ait échappé jusqu’ici à l’œil attentif des Physiciens & des Chimistes, & on doit en conclure que dans les sciences comme dans la morale il est difficile de vaincre les préjugés dont on a été originairement imbu, & de suivre une autre route que celle dans laquelle on est accoutumé de marcher[11]. »
D’une manière générale, l’hydrogène se consume avec l’oxygène ou l’air et forme de l’eau. Un mélange d’hydrogène et d’oxygène ou d’air explose violemment quand allumé, à condition que l’un ou l’autre gaz n’est pas en excès : la limite inférieure d’explosivité de l’hydrogène est de 4,1 %, la limite supérieure d’explosivité est de 74,8 %. La LIE et la LSE sont les concentrations limites (dans l’air) qui permettent à un gaz de s’enflammer et d’exploser explose.
L'électrolyse de l'eau

La première électrolyse de l'eau (H2O), en ses deux composants le dihydrogène (H2) et le dioxygène (O2) a été réalisée le par deux chimistes britanniques, William Nicholson (1753 - 1815) et Sir Anthony Carlisle (1768-1840), quelques jours après l'invention de la première pile électrique par Alessandro Volta (1745-1827), donnant naissance à l'électrochimie:
« Cette faculté que possède le courant électrique d'opérer des décompositions chimiques apparut pour la première fois à Carlisle et à Nicholson un jour que ces deux savants laissèrent par mégarde tomber dans l'eau les conducteurs d'une pile en activité. Comme ces conducteurs étaient formés de cuivre, métal oxydable, l'hydrogène seul se dégagea d'abord au pôle négatif, tandis que l'autre fil s'oxydait d'une manière manifeste. Mais ayant bientôt substitué l'or au cuivre, les deux physiciens eurent la joie de voir pour la première fois l'eau se résoudre comme par enchantement en deux gaz, hydrogène et oxygène, qui se dégageaient isolément et en proportions définies autour.des deux pôles. Cette magnifique découverte a donné naissance à l'électrochimie[12]. »
La réaction est la suivante:
Propriétés de l'hydrogène
Toxicité
L’hydrogène n’est pas toxique quoique non respirable. Toutefois, on constate que la respiration d’un animal, entretenue à l’aide d’un mélange d’oxygène et d’hydrogène ne semble pas lui causer de malaise sensible, quoiqu’on constate chez lui un engourdissement et une grande propension au sommeil. Humphry Davy et Felice Fontana constatèrent que, mêlé à l’air, l’hydrogène pouvait être respiré par l’homme, et, en 1741, Brittan voulut reprendre leurs expériences et fut victime de son dévouement à la science, soit qu’il ait respiré le gaz seul, ou que le gaz dont il se servit ne fût pas pur[1]. Ce fait vient de démontrer que dans les essais à faire relativement à la respiration de ce gaz, on doit prendre des précautions : M. Brittan, auteur d’un ouvrage sur la chimie, « voulait, avant de l’achever, constater jusqu’à quel point un homme pourrait, sans danger, respirer une quantité donnée de gaz hydrogène. Il en fit l’essai sur sa propre personne et en fut malheureusement la victime. Un malaise général, suivi d’une stupéfaction complète, se déclara bientôt, et en dépit de tous les secours de l’art qui lui furent prodigues, il mourut au bout de quelques heures, par suite du dangereux essai auquel il s’était livré[13]. ».
Un phénomène bien remarquable produit par l’inspiration de l’hydrogène a été constaté par Maunoir et Paul, de Genève ; il consiste en ce que la voix devient faible et le son criard et clapissant[1].
Explosivité

Le dihydrogène est un gaz classé « extrêmement inflammable.
Pilâtre des Rosiers, « qui mourut si malheureusement en 1785, le feu ayant dévoré son aérostat lorsqu'il se trouvait à une hauteur de 500 mètres, non-seulement respira sans accident le gaz hydrogène, mais encore il osa l'enflammer, à l'extrémité d'un long tube, quand il sortait de ses poumons. Enfin, il lui arriva involontairement de mettre le feu à un mélange gazeux d'hydrogène et d'oxygène qu'il avait introduit dans ses poumons; il ressentit une violente secousse et crut avoir les dents cassées; mais ayant reconnu qu'en réalité cela ne lui avait causé aucun accident, il eut la témérité de répéter l'expérience plusieurs fois[1]. »
Bon conducteur électrique
Meilleur que d'autres gaz.
Ballon à gaz: les propriétés « endosmotiques » du dihydrogène
.jpg.webp)
L' « endosmose » ou osmose découverte par Henri Dutrochet décrit la manière dont se conduisent deux fluides de densité différente qui ne sont séparés que par une membrane poreuse et perspirable.
La grande légèreté de l'hydrogène lui donne la propriété de traverser les petites ouvertures et les membranes avec beaucoup plus de facilité que les autres gaz[14]. L'hydrogène pur est, de tous les gaz, celui qui présente les phénomènes d'endosmose les plus intenses : il traverse toutes les membranes, végétales ou animales, avec la plus singulière facilité. Un jet d'hydrogène qui vient frapper une feuille de papier perpendiculairement à sa direction, traverse cette feuille à peu près comme s'il n'avait pas rencontré d'obstacle sur son chemin[15].
Les vitesses avec lesquelles deux gaz traversent un faible orifice d'une membrane, sont en raison inverse de la racine carrée de leur densité[14]. La propriété endosmotique remarquable du dihydrogène se démontre en plaçant un ballon en caoutchouc mince et plein d'air dans une cloche remplie d'hydrogène, le ballon a été entouré de fil qui s'applique sur lui sans le serrer. Au bout d'un jour, le fil disparait sous les deux hémisphères qui se forment (suite de l'augmentation de volume, et souvent le ballon finit par éclater). Ainsi il a dû entrer dans le ballon 3,5 fois plus d'hydrogène qu'il n'en est sorti d'air, puisque le premier de ces gaz pèse 14 fois moins que le deuxième[14].
La « densité de l'hydrogène pur étant quatorze fois et demie moindre que celle de l'air, on comprend qu'il devra passer environ quatre fois plus d'hydrogène dans l'air que d'air dans l'hydrogène. Cette perte continue, à laquelle il est extrêmement difficile de remédier, est une seconde raison de la substitution du gaz d'éclairage à l'hydrogène pur pour le gonflement des aérostats[3]. »

Le gaz d'éclairage contient 50 % de dihydrogène, 32 % de méthane et 8 % de monoxyde de carbone.
Les frères Montgolfier qui connaissent les propriétés osmotiques de l'hydrogène, lui préfèrent l'air chaud.
Le , peu après l'expérience des frères Montgolfier (), Jacques Alexandre César Charles (1746-1823), fait voler son ballon à gaz avec du dihydrogène. Mais par la suite on lui préféra longtemps le gaz d'éclairage, sept fois plus lourd, plus disponible, mais surtout ayant de meilleurs propriétés osmotiques que le dihydrogène.
Ainsi, dans un ouvrage de 1870 traitant d'aéronautique:
« Le gonflement des aérostats se fait ordinairement par l'hydrogène carboné, ou gaz d'éclairage, dont la densité moyenne est la moitié de celle de l'air. Quoique beaucoup plus lourd que l'hydrogène pur, il est d'un usage beaucoup plus facile, puisqu'au lieu de le fabriquer à grands frais spécialement pour une ascension, il suffit de le faire arriver d'une usine ou d'un tuyau de conduite. Lorsqu'une ascension doit être exécutée dans un établissement scientifique, on peut facilement amener le gaz d'éclairage des tuyaux les plus voisins, et se borner à prendre exactement la quantité de gaz égale à la capacité de l'aérostat[3]. »

Henri Giffard (1825-1882) en 1852 utilisera le dihydrogène afin d'optimiser la portance. Il améliorera la technique de production du dihydrogène, et la qualité de l'enveloppe:
« L'étoffe du ballon consiste en deux toiles réunies par une dissolution de caoutchouc, et enduites à l'extérieur d'un vernis à l'huile de lin. Toutes les coutures ont été recouvertes d'une bande de la même étoffe appliquée au moyen de la dissolution de caoutchouc et enduite du vernis à l'huile de lin. Cet enduit paraît avoir résolu en grande partie le problème, tant cherché, de la conservation du gaz hydrogène dans un aérostat. Tandis que dans la plupart des aérostats construits jusqu'à ce jour, le gaz hydrogène traverse, avec une promptitude extraordinaire, l'étoffe de soie vernie du ballon, l'aérostat de M. Henry Giffard est doué d'une propriété de conservation remarquable. Il n'a pas été nécessaire de renouveler, pendant deux mois, la provision de gaz dans le ballon, une fois gonflé, à la condition de remplacer, tous les deux ou trois jours, les 40 ou 50 mètres cubes de gaz perdus dans cet intervalle, par leur passage à travers l'enveloppe[16]. »
L'hydrogène quasi pur produit Giffard est issu d'une réaction de gaz à l'eau: de la vapeur d'eau jetée sur des charbons incandescents:
« Le système employé par M. Giffard pour la préparation du gaz hydrogène au moyen de la décomposition de l'eau repose en partie sur des principes connus, en partie sur des dispositions nouvelles. Il consiste à opérer la décomposition de la vapeur d'eau par le charbon, en faisant d'abord traverser un foyer chargé de coke incandescent, par un courant de vapeur d'eau, qui produit, en réagissant sur le charbon rouge, de l'hydrogène carboné et de l'oxyde de carbone. Pour ramener l'hydrogène carboné à l'état d'hydrogène pur, l'oxyde de carbone à l'état d'acide carbonique, on fait arriver à l'autre extrémité du fourneau, un nouveau courant de vapeur d'eau. Cette vapeur produit de l'hydrogène pur et de l'acide carbonique, en réagissant, par son oxygène, sur les deux gaz qui remplissent l'enceinte du fourneau. Ce mélange d'acide carbonique et d'hydrogène est alors dirigé à travers un dépurateur plein de chaux, semblable à celui dont on se sert dans les usines à gaz. L'hydrogène s'y débarrasse de l'acide carbonique ; de sorte que l'on obtient aussi de l'hydrogène pur, que l'on dirige à l'intérieur du ballon, dès sa sortie du dépurateur à chaux[16]. »
Lorsque les processus de production seront améliorés, de même que les membranes des aérostats, l'hydrogène (14 fois plus léger que l'air) remplacera le gaz d'éclairage (2,6 fois plus léger que l'air), notamment dans les ballons dirigeables et ballons-sonde. Le dihydrogène sera lui-même remplacé par l'hélium, non combustible mais plus coûteux.
Les recherches sur les ballons à gaz ont conduit à la découverte du gaz d'éclairage en 1784 par Jan Pieter Minckelers. Toutefois celui-ci ne lui donna pas les suites industrielles que lui donneront le français Philippe Lebon et l'anglais William Murdoch (Voir plus loin, le gaz d'éclairage)[17].
Le gaz d'éclairage
Gaz de houille
.jpg.webp)
Vers 1812, le gaz d'éclairage (ou gaz manufacturé), essentiellement du gaz de houille, composé pour moitié d'hydrogène, est fabriqué de manière industrielle dans des usines à gaz et concourt à l'éclairage de toutes les grandes villes européennes. La propriété de la découverte du gaz d'éclairage, aux alentours de 1800 se trouve partagée entre le français Philippe Lebon, l'anglais William Murdoch, l'allemand Frédéric-Albert Winsor, le limbourgeois Jan Pieter Minckelers qui est le seul à ne lui a pas avoir donné de suites industrielles. Le gaz d'éclairage d'abord produit à partir du bois est nommé de manière erronée « gaz hydrogène » par Lebon, qui probablement n'en connaît pas la composition. Le gaz de houille sera appelé « gaz hydrogène carboné». L'anglais, William Murdoch lui donnera le nom de gaz light.
La pyrolyse du bois ou de la houille dans des cornues placées en batterie, (mais aussi de résines (gaz de résine), d'huiles (gaz d'huile), de schiste bitumineux (gaz portatif comprimé), de déchets de l'industrie pétrolière (gaz de pétrole), etc.) permet d'obtenir un gaz riche en hydrogène: le gaz de bois (« gaz hydrogène ») de Lebon est en fait constitué d'hydrogène(H2), monoxyde de carbone(CO) et de dioxyde de carbone (CO2); le gaz de houille (« gaz hydrogène carboné »), contient lui du dihydrogène(H2), méthane(CH4), monoxyde de carbone(CO). Dans une usine à gaz en 1970, peu de temps avant que la production ne décline définitivement, le gaz produit contenait[18]:
| En volume | En poids | |
|---|---|---|
| Dihydrogène (H2) | 50 % | 8,4 % |
| Méthane (CH4) | 32 % | 41,6 % |
| Monoxyde de carbone (CO) | 8 % | 18,8 % |
| Éthylène et autres hydrocarbures | 4 % | 9,4 % |
| Diazote | 3 % | 7,1 % |
| Gaz carbonique | 2 % | 7,4 % |
| Benzène et produits aromatiques | 1 % | 7,3 % |
Les gaz manufacturés employés comme gaz d'éclairage signent le premier véritable éclairage public. La photométrie est redevable aux gaz manufacturés dans la mesure où pour la première fois de l'histoire on doit pouvoir quantifier le pouvoir éclairant de plusieurs combustibles ou de plusieurs appareils d'éclairages à destination de l'éclairage des villes.
Les gaz manufacturés étendent ensuite leurs applications à l'éclairage et au chauffage domestiques. Une bonne partie des canalisations du gaz est alors constituée par les colonnes montantes du gaz de ville dans les appartements.
Le gaz manufacturé sera utilisé par les turbines et moteurs. Jean-Joseph Étienne Lenoir, en 1859, conçoit le premier moteur à combustion interne, fonctionnant au gaz manufacturé. Les grands constructeurs automobiles, Deutz AG, Daimler AG, Mercedes-Benz, et BMW sont redevable aux améliorations du moteur à gaz par Nikolaus Otto en 1867 et la création par celui-ci de la « Gasmotoren-Fabrik Deutz AG ».
Les gaz manufacturés seront utilisés par les ballons à gaz en remplacement de l'hydrogène, moins facile à mettre en œuvre, ouvrant une ère où les scientifiques seront aussi de véritables aventuriers, où le météorologistes devront aussi se préoccuper de gaz, tels les aérostiers, Jacques Alexandre César Charles, Gaston Tissandier (1843 - 1899) ou Auguste Piccard.
En 1940, le dihydrogène nécessaire à l'industrie chimique pour la transformation des huiles végétales, animales ou minérales (graisses non saturées) en graisses compactes et la fabrications de certains solvants, est aussi extraite des gaz manufacturés (composé, en volume, de 50 % d'hydrogène, le gaz à l'eau peut en contenir jusqu'à 90 %) par liquéfaction. Une augmentation de pression et un refroidissement suffisants liquéfient tous les gaz sauf l'hydrogène. Pour la synthèse de l'ammoniac, le diazote présent dans les gaz manufacturés (en volume, environ 3 %) n'est pas liquéfié[19].
Gaz à l'eau, sur charbon de bois
La thermolyse de l'eau sur du charbon de bois menée à l'usine à gaz de Narbonne en 1859, produit un gaz contenant de l'hydrogène et de l'oxyde de carbone. Le travail d'épuration conduit à un gaz composé à 95 % d'hydrogène, utilisé pour l'éclairage. L'usage de l'hydrogène quasi pur conduit à l'utilisation de becs de gaz en platine: la température élevée de la flamme de l'hydrogène aurait bientôt altéré les couronnes, si elles étaient en cuivre jaune. Cet anneau en platine constitue la seule différence entre ces couronnes et celles qui sont employées dans l'éclairage au gaz de houille; peut-être aussi le diamètre des orifices est-il un peu moindre que dans ce dernier système[20].
Dans la flamme sont placées les mèches en fil de platine. La forme de ces mèches se rapproche de celle d'une corbeille renversée sans fond. Elles sont fixées par trois supports, en fil de platine de 0,75 mm d'épaisseur, à un anneau circulaire qui passe sur la couronne; la distance entre celle-ci et la base de la mèche est de 4 mm[20].
La première tentative faite sur une certaine échelle pour l'éclairage à l'aide du gaz à l'eau, carburé par les vapeurs huileuses, est due à un ingénieur, Alexandre Selligue (Alexander Selligue (en)); En 1848, un certain Gillard construisit à Passy une usine pour fabriquer du gaz en décomposant la vapeur d'eau par le charbon de bois dans de grands cylindres en fonte. Ce gaz, qu'on disait exempt d'oxyde de carbone, en conséquence du mode même de sa fabrication, en contenait néanmoins encore souvent 20 % après son épuration par la chaux. Le système de M. Gillard fut appliqué pendant quelque temps à l'éclairage des rues de la ville de Narbonne[21]
Dans l'usine à gaz de Narbonne, « la réaction entre la vapeur d'eau se fait dans des cornues en fonte chauffées au rouge-orange. Ces cornues en forme de berceau (1,90 m x 0,39 m x 0,33 m) sont pourvues d'injecteurs pour la vapeur d'eau. L'expérience montre que les fours contenant cinq cornues sont les plus avantageux. La vapeur d'eau est préparée sur le côté dans une chaudière chauffée à la houille et injectée à une pression de 5 à 6 atmosphères. Les injecteurs sont pourvus de capsules de terre réfractaire (80 à 90 par cornue) pour éviter l'obstruction par oxydation du fer au contact de l'eau. Leur disposition font que la vapeur va lécher la surface de charbon de bois incandescent.
Les cornues contiennent de 75 à 80 kilogrammes de charbon de bois. Le chargement des cornues se fait toutes les cinq heures. Le travail de maintenance est moins important que pour le gaz de houille. 1 mètre cube de gaz requiert 324 grammes de charbon de bois et 4791 grammes de houille.
Le gaz obtenu passe dans des réfrigérants et ensuite des épurateurs dont le but est de délester le gaz de l'acide carbonique venu avec l'hydrogène. Cette épuration se fait au moyen de la chaux hydratée placée su des cribles. Pour obtenir 800 mètres cubes d'hydrogène, il faut 1 tonne de chaux vive, ce qui par rapport au gaz de houille est énorme. Pour éteindre cette chaux vive il faut 321 kilogrammes d'eau si bien qu'au final on se retrouve avec 2 tonnes de chaux éteinte : des amas de carbonates de chaux s'accumulent aux abords de l'usine. Ce résidu est vendu pour la confection de mortiers mais est pressentie comme engrais[20]. »
Les premiers essais de gaz à l'eau mettent en relief la présence de 20 à 21 % de monoxyde de carbone. Mais en modifiant le procédé, en soustrayant l'acide carbonique avant qu'il ne se transforme en monoxyde carbone, on obtint plus que 4 à 5 % de monoxyde carbone. Ce gaz est principalement composé d'hydrogène[20]:
| En volume | |
|---|---|
| Dihydrogène (H2) | 94 % |
| Acide carbonique et monoxyde de carbone (CO) | 4 % |
| Eau (H2O) | 1 % |
| Diazote et autres | 1 % |
Lumière oxhydrique
— Et qu’est-ce qu’on brûlera à la place du charbon?
— L’eau, répondit Cyrus Smith.
— L’eau, s’écria Pencroff, l’eau pour chauffer les bateaux à vapeur et les locomotives, l’eau pour chauffer l’eau !
— Oui, mais l’eau décomposée en ses éléments constitutifs, répondit Cyrus Smith, et décomposée, sans doute, par l’électricité, qui sera devenue alors une force puissante et maniable, car toutes les grandes découvertes, par une loi inexplicable, semblent concorder et se compléter au même moment. Oui, mes amis, je crois que l’eau sera un jour employée comme combustible, que l’hydrogène et l’oxygène, qui la constituent, utilisés isolément ou simultanément, fourniront une source de chaleur et de lumière inépuisables et d’une intensité que la houille ne saurait avoir. Un jour, les soutes des steamers et les tenders des locomotives, au lieu de charbon, seront chargés de ces deux gaz comprimés, qui brûleront dans les foyers avec une énorme puissance calorifique. Ainsi donc, rien à craindre. Tant que cette terre sera habitée, elle fournira aux besoins de ses habitants, et ils ne manqueront jamais ni de lumière ni de chaleur, pas plus qu’ils ne manqueront des productions des règnes végétal, minéral ou animal. Je crois donc que lorsque les gisements de houille seront épuisés, on chauffera et on se chauffera avec de l’eau. L’eau est le charbon de l’avenir.
En 1823, Goldsworthy Gurney invente la lumière oxhydrique dite également lumière Drummond, émise par un bloc de matière réfractaire porté à l'incandescence par la flamme d'un chalumeau oxhydrique (combinaison de l'oxygène et de l'hydrogène). La douceur de la lumière oxhydrique et son bon Indice de rendu de couleur en fait un moyen d'éclairage de choix dans les théâtres et autres lieux de spectacle à partir des années 1830 où ils seraient fabriqués au théâtre même[22]. En 1868, un mémoire du Société des ingénieurs civils de France encourage l'utilisation de l'oxygène à la place du gaz d'éclairage et des expériences sont même réalisées place de l'hôtel de ville à Paris à l'instigation du barron Haussmann. L'innocuité de la lumière oxhydrique (l'oxygène nécessaire à la combustion n'étant pas pris dans l'air ambiant comme c'est le cas pour le gaz d'éclairage, dont la combustion vicie l'air) suscite l'enthousiasme. On imagine déjà les services que pourraient rendre la lumière oxhydrique à l'éclairage sous-marin en appui des Scaphandriers[23].
On peut raisonnablement attribuer à l'euphorie née de ces expériences la tirade de Jules Verne en 1874 dans l’« L'Île mystérieuse » :
« Oui, mes amis, je crois que l’eau sera un jour employée comme combustible, que l’hydrogène et l’oxygène, qui la constituent, utilisés isolément ou simultanément, fourniront une source de chaleur et de lumière inépuisables et d’une intensité que la houille ne saurait avoir »
— Jules Verne, L’Île mystérieuse - Partie 2, Chapitre 11 1874.
Le moteur à hydrogène

Dans son brevet de 1799, Lebon avait prédit que son « gaz hydrogène » (du gaz de bois, dont on peut supposer qu’il contenait au moins 50 % de dihydrogène) serait « une force applicable à toutes espèces de machine ». Le gaz de houille inventé par William Murdoch à la même époque, est nommé « gaz hydrogène carboné » puis gaz d’éclairage (« gas light », voir aussi gaz de ville, et gaz manufacturé) et contient 50 % de dihydrogène, 32 % de méthane, 8 % de monoxyde de carbone. Certains gaz à l’eau, à destination de l’éclairage contiendront jusqu’à 94 % de dihydrogène.
À partir de 1804, François Isaac de Rivaz construit les premiers moteurs à gaz utilisant du gaz de houille. Il s’inspire du fonctionnement du Pistolet de Volta pour construire le premier moteur à combustion interne dont il obtint le brevet le .
En 1859, Étienne Lenoir dépose un « brevet d’un moteur à gaz et à air dilaté », un moteur à combustion interne à deux temps qui utilise le gaz de houille.
Le gaz d’éclairage est encore utilisé dans le moteur à gaz par Nikolaus Otto en 1867. Les grands constructeurs automobiles, Deutz AG, Daimler AG, Mercedes-Benz, et BMW sont redevable aux innovations du moteur à gaz apportées par celui-ci et à la création de la « Gasmotoren-Fabrik Deutz AG » (Deutz AG), fondée par Otto en 1872.
Reformage catalytique
L'hydrogène pur est fabriqué industriellement par reformage catalytique à la vapeur du gaz naturel
Fabrication moderne
Décomposition de l’eau froide
L’eau froide est décomposé par l’aluminium amalgamé (c’est-à-dire un alliage d’aluminium et de mercure qui est faite par le frottement du papier d’aluminium avec du chlorure mercurique humide)[25].
2 Al + 6 H2O ⇒ 2 Al(OH)3 + 3 H2
Décomposition de l’eau chaude
L’eau chaude est décomposé par le couple zinc-cuivre (des granulés solides de zinc recouvert d’une couche de surface en cuivre qui est obtenu en versant une solution de sulfate de cuivre sur du zinc en granulé)[25].
Zn + 2 H2O ⇒ Zn(OH)2 + H2
Décomposition de l’eau bouillante
L’eau bouillante est lentement décomposée par le magnésium[25].
Mg + 2 H2O ⇒ Mg(OH)2 + H2
Décomposition de la vapeur d’eau
La vapeur est décomposée par action sur du magnésium, du zinc ou du fer chauffé. La réaction, du fer sur la vapeur d’eau est réversible, selon les conditions expérimentales. Mg + H2O ⇒ MgO + H2 Zn + H2O ⇒ ZnO + H2 3 Fe + H2O ⇔ Fe3O4 + 4 H2 (limaille de fer à 800 °C dans un courant de vapeur d'eau)
Par action d'un acide
L’hydrogène est préparé en laboratoire par action des acides sur les métaux : l’acide sulfurique dilué contenant un volume d’acide concentré pour cinq volumes d’eau, ou l’acide chlorhydrique dilué contenant un volume d’acide concentré pour quatre volumes d’eau, est ajouté au zinc granulé. Du sulfate de zinc ou du chlorure de zinc sont formés, de l’hydrogène est libéré[25].
Acide sulfurique
Le processus historique utilisé depuis Paracelse est décrit plus haut. Il fait réagir le « vitriol » (acide sulfurique) avec le fer ou le zinc. La réaction fournit un sel et le dihydrogène.
La réaction entre l’acide sulfurique et le fer est la suivante :
Fe(s) + H2SO4 (aq) → H2 (g) + FeSO4 (aq)
On prépare aussi le dihydrogène en attaquant le zinc par de l’acide sulfurique hydraté. Ce métal, sous l’influence de l’acide, décompose l’eau, passe à l’état d’oxyde de zinc qui se combine à l’acide, et l’hydrogène devient libre. Voici l’équation qui rend compte de la réaction :
Zn(s) + H2SO4 (aq) → H2 (g) + ZnSO4 (aq)
Plus généralement, l’acide sulfurique attaque les principaux métaux usuels en donnant un sulfate métallique par libération de dihydrogène. L’acide dilué attaque le fer, l’aluminium, le zinc, le manganèse, le magnésium et le nickel, mais seul l’acide concentré et chaud peut attaquer l’étain et le cuivre, tandis que le plomb et le tungstène ne sont pas attaqués. L’attaque de l’étain par l’acide sulfurique libère du dioxyde de soufre plutôt que de l’hydrogène, contrairement à ce qu’il en est pour les autres métaux : L’acide dilué agit plutôt comme un acide typique libère de l’hydrogène en formant le sel, l’acide sulfurique concentré et chauffé agit généralement comme un agent oxydant, libère de l’eau et du dioxyde de soufre en formant des sels avec le cuivre, le zinc et l’étain.
La réaction de l’étain avec l’acide sulfurique dégage de l’eau : Sn(s) + 2 H2SO4 (aq) → SnSO4 (aq) + 2 H2O(l) + SO2 (g).
Acide chlorhydrique
Zn + 2 HCl → ZnCl2 + H2
Soude caustique et aluminium
2 NaOH + 2 Al + 2 H2O → 2 NaAlO2 + 3 H2
Potassium et eau
L'hydrogène peut s'obtenir en décomposant l'eau par le potassium : ce métal, très-facilement oxydable, s'empare de l'oxygène en libérant l'hydrogène. Les produits obtenus sont de la potasse et de l'hydrogène[8].
2 H2O + 2 K → 2 KOH + H2 (vérifier)
Électrolyse
Aujourd'hui, l'hydrogène électrolytique, la qualité d'hydrogène la plus pure disponibles dans le commerce est fabriqué par électrolyse de l'eau. L'hydrogène pur est mieux préparé par électrolyse avec des électrodes de nickel d'une solution chaude saturée d'hydroxyde de baryum.
Le gaz est passé sur toile de platine chaud qui oxyde tout oxygène résiduel dans les gaz, et il est ensuite séché par passage du gaz sur des pastilles d'hydroxyde de potassium et sur de la poudre de pentoxyde de phosphore redistillé[25].
Reformage catalytique
L'hydrogène pur est fabriqué industriellement par reformage catalytique à la vapeur du gaz naturel
Vapeur d'eau et fer
La fabrication de l’hydrogène à l’échelle industrielle inclut la réaction entre la vapeur d’eau et du fer. Le fer spongieux de la réduction du minerai de fer spathique (carbonate ferreux) est chauffé au rouge et la vapeur d’eau passée par-dessus.
3 Fe + 4 H2O ⇒ Fe3O4 + 4 H2
L’oxyde ferroso-ferrique chaud, Fe3O4, est ensuite réduit avec du gaz à l’eau. Le gaz à l’eau est fabriqué par passage de vapeur d’eau au-dessus de carbone incandescent et il consiste en un mélange de monoxyde de carbone et d’hydrogène, avec une petite quantité de dioxyde de carbone :
Fe2O4 + 4 CO ⇒ 3 Fe + 4 CO2
La température est évaluée par la couleur du charbon qui est d'autant plus clair qu'elle est haute :
- rouge vif :C + H2O ⇒ CO + H2
- rouge sombre :C + 2 H2O ⇒ CO2 + 2 H2
Nouveaux moyens de production, prospective
- Mi-2017, une « peinture semi-conductrice » est présentée par des chercheurs australiens du Royal Melbourne Institute of Technology (RMIT) ; à la manière d'un gel de silice elle capte l’humidité de l'air et produit de l'oxygène et de l'hydrogène par un phénomène catalytique utilisant le rayonnement solaire et un matériau à base de sulfure de molybdène synthétique dopé à l'oxyde de titane. Il reste à imaginer comment récupérer cet hydrogène et vérifier que la vapeur d'eau n'est pas contaminée par des substances qui nuirait à l'efficacité du procédé[26].
Utilisations modernes
Moteur à explosion
En 1970, Paul Dieges brevète une modification des moteurs à combustion interne qui autorise la consommation d’hydrogène[27]. Le brevet renseigne clairement que le but de l’invention est de fournir un combustible non-polluants comme le sont les hydrocarbures.
À partir de 1980, le constructeur automobile japonais Mazda planche sur l’application du dihydrogène aux moteurs rotatifs (Moteur Wankel) et en 1991 présente un concept de moteur rotatif à hydrogène au Salon automobile de Tokyo. En 2006, Mazda loue des véhicules Hydrogen RE aux bureaux du gouvernement nippon[28].
Le protocole de Kyoto, signé le , vise à la réduction des émissions de gaz à effet de serre dont fait partie le dioxyde de carbone, donne une nouvelle justification à la recherche de carburants alternatifs, dont l’hydrogène, et pour les constructeurs automobiles, la production de véhicule propre parmi lesquels se trouve le véhicule à hydrogène.
La BMW Hydrogen 7, présentée pour la première fois au salon de Los Angeles en , serait la première voiture de série fonctionnant à l’hydrogène[29].
Accessoirement certains garages proposent un décalaminage à l’hydrogène pour nettoyer les moteurs en les faisant fonctionner avec de l’hydrogène produit par électrolyse.
Notes et références
- Carilian-Goeury et Dalmont. Leçons de chimie élémentaire appliquées aux arts industriels et faites aux Ouvriers du XIIe arrondissement : à l’usage des élèves de troisième scientifique et de mathématiques spéciales, des aspirants aux grades des facultés et aux écoles du gouvernement, vol. 1, 1855 (lire en ligne).
- Buck, p. 265.
- James Glaisher Wilfrid de Fonvielle Camille Flammarion Gaston Tissandier. Voyages Aériens. 1870 (Livre numérique Google).
- (en) Personnel de rédaction, « Ammonia Process Overview », Nexant, Inc., (consulté le ).
- Cité dans Jean Chrétien Ferdinand Hoefer. La chimie enseignée par la biographie de ses fondateurs: R. Boyle, Lavoisier, Priestley, Scheele, Davy, etc. L. Hachette et cie, 1865 (Livre numérique Google).
- Et cette manière de voir provenait elle-même d’une théorie qu’il est bon de faire connaître, parce qu’elle compte encore des partisans : D’après celte théorie, la diversité des corps serait due à des inégalités de forme, de grandeur, de structure, de mouvement des molécules élémentaires ; un ou deux éléments primitifs suffiraient pour expliquer toute la variété des corps de la nature. « Pourquoi donc, s’écria Boyle, les molécules de l’une ou de toute autre substance ne pourraient-elles pas, dans de certaines conditions, être groupées et agitées de façon à mériter le nom d’air ? ». D’après la théorie de Boyle, l’air ainsi obtenu (hydrogène), serait de l’air allotropique, c’est-à-dire, de l’air dans un état particulier, différent de l’air commun de l’atmosphère. (Cité dans Hoefer)
- Désiré Magnier, Nouveau manuel complet de l’éclairage au gaz, ou Traité élémentaire et pratique à l’usage des ingénieurs, directeurs, etc.. Librairie encyclopédique Roret, 1849 (Livre numérique Google).
- Barreswil (Charles Louis, M.), Aimé Girard. Introduction au Dictionnaire de chimie industrielle. Dezobry, E. Magdeleine et cie, 1861(https://books.google.be/books?id=MW5DAQAAIAAJ&dq=zn%20%2Bhcl&hl=fr&pg=PA86#v=snippet&q=hydrog%C3%A8ne&f=false Livre numérique Google)
- Thomas Kuhn 1963, p. 53–60 et Robert E. Schofield : “Enlightened Joseph Priestley: A Study of His Life and Work” (2004)
- La difficulté de dater et de situer la découverte de l’oxygène dans le contexte de la révolution chimique, est l’un des thèmes développés par Thomas Kuhn dans son ouvrage La Structure des révolutions scientifiques.
- Antoine Lavoisier Traité élémentaire de chimie Partie 1 Chapitre 8 page 90 sur wikisource.
- William Duckett. Dictionnaire de la conversation et de la lecture: inventaire raisonné des notions générale les plus indispensable à tous, Volume 8 (Livre numérique Google)
- Carilian-Goeury et Dalmont, Journal de chimie médicale, de pharmacie et de toxicologie, Volume 2 ; Volume 8 , 1855 (Livre numérique Google).
- Revue scientifique, Volume 2. 1865 (Livre numérique Google)
- James Glaisher, Camille Flammarion, W. De Fonvielle, Gaston Tissandier. Voyages Aériens. 1870 (Livre numérique Google)
- Louis Figuier, Émile Gautier. L'Année scientifique et industrielle, Volume 13 (Livre numérique Google)
- Jan Pieter Minckelers Mémoire sur l'air inflammable tiré de différentes substances, Collège Faucon 1784 (Livre numérique Google)
- Tout l'Univers. Volume 13. Hachette/Le livre de Paris 1975
- Grand mémento encyclopédique Larousse. 1941. page 519.
- B. Verver L'éclairage au gaz à l'eau à Narbonne et l'éclairage au gaz Leprince examinés et comparés à l'éclairage au gaz de houille ordinaire; F. Renard, 1859 (Livre numérique Google)
- Charles Adolphe Wurtz, Jules Bouis. Dictionnaire de chimie pure et appliquée: comprenant la chimie organique et inorganique, la chimie appliquée à l'industrie, à l'agriculture et aux arts, la chimie analytique, la chimie physique et la minéralogie, Volume 2. Hachette, 1870(Livre numérique Google)
- « Pour sa production dans ces établissements publics, on a recours le plus ordinairement, comme cela a lieu au Théâtre de la Renaissance, à des sacs en caoutchouc. Deux poches disposées entre des châssis pressés convenablement et chargés de poids en fonte pour faire ainsi office de soufflet, et contenant l'une de l'hydrogène, l'autre de l'oxygène, fabriqués au théâtre même, sont mis en rapport par des tuyaux de conduite, avec un appareil spécial nommé chalumeau, par où ils viennent se mélanger convenablement et se rendre dans une petite chambre ou barillet ». Dans musée des familles: Lectures du soir, Volume 36. 1869 (Livre numérique Google)
- « C'est ainsi qu'on a déjà songé à produire la lumière oxhydrique dans des ballons en verre absolument clos et sans communication directe avec l'air extérieur. — Cette application exige, naturellement, des dispositions spéciales pour le dégagement régulier de la vapeur d'eau ou des gaz résultant de la combustion; mais on conçoit aisément que si cet éclairage réussissait bien, il pourrait rendre d'immenses services pour les travaux des mines, en les préservant des accidents du feu grisou; il pourrait s'appliquer également à l'éclairage sous-marin et augmenter considérablement les services qu'on peut attendre des scaphandres; enfin il s'appliquerait aussi avec de notables avantages dans les fabriques de poudre, de produits chimiques, les filatures ». Dans Mémoires et compte-rendu des travaux. Société des ingénieurs civils de France. 1868. Livre numérique Google
- Louis Figuier. Les merveilles de la science, ou Description populaire des inventions modernes Livre numérique Google
- (en) Hydrogen sur le site </ www.ucc.ie University college cork.
- Torben Daeneke & al. (2017) Surface Water Dependent Properties of Sulfur-Rich Molybdenum Sulfides: Electrolyteless Gas Phase Water Splitting ; ACS Nano, Article ASAP ; DOI: 10.1021/acsnano.7b01632 ; publié le 14 juin 2017 (résumé)
- (en) Paul Bertrand Dieges. VAPORIZATION OF EXHAUST PRODUCTS IN HYDROGEN-OXYGEN ENGINE. 3,844,262 29 octobre 1974. Continuation-in-part of Ser. No. 79,473, 9 octobre 1970.google patent.
- (en) Advanced Rotary Engines sur le site mazda.com.
- BMW Hydrogen 7, première voiture de série fonctionnant à l’hydrogène sur le site moteurnature.com.
Voir aussi
Bibliographie
- Thomas Kuhn (trad. de l'anglais), La Structure des révolutions scientifiques, Paris, Flammarion, , 284 p. (ISBN 2-08-081115-0)
- (en) Robert E. Schofield, The Enlightened Joseph Priestley : A Study of His Life and Work from 1773 to 1804, University Park, Pennsylvania State University Press, , 461 p. (ISBN 0-271-02459-3)








