Folpel
Le folpet (nom ISO), plus souvent dénommé folpel en France ([N-(trichlorométhylthio)phtalimide] ou N-(trichlorométhylthio)phtalimide ou 2-{(trichlorométhyl)thio}-1H-isoindole-1,3(2H)-dione dont la formule est C9H4Cl3NO2S), est un pesticide de la famille des biocides industriels et agricoles organochlorés et organosulfurés, proche du thalidomide[7] et destiné à tuer les champignons.
| Folpet (ou Folpel) | |
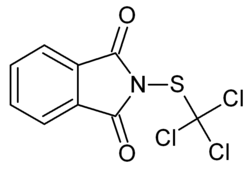
| |
| Structure moléculaire du folpel (ou folpet) | |
| Identification | |
|---|---|
| Nom UICPA | 2-(trichlorométhylsulfanyl)isoindole-1,3-dione |
| Synonymes |
folpet |
| No CAS | |
| No ECHA | 100.004.627 |
| No CE | 205-088-6 |
| No RTECS | TI5685000 |
| PubChem | 8607 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs |
| Propriétés chimiques | |
| Formule | C9H4Cl3NO2S [Isomères] |
| Masse molaire[1] | 296,558 ± 0,019 g/mol C 36,45 %, H 1,36 %, Cl 35,86 %, N 4,72 %, O 10,79 %, S 10,81 %, |
| Propriétés physiques | |
| T° fusion | 177 °C[2] (ou 178,5 °C ?) |
| Solubilité | quasi-insoluble dans l'eau (où il ne se dissocie pas[3]) 0,8 mg/L (1,4 mg/L à 20 °C selon GESTIS[4]) et seulement 0,5 mg/L à 15 °C[3], mais très soluble dans certains solvants organiques (ex. : acétone : 34 g/L à 25 °C[3], acétonitrile : 19 g/L à 25 °C[3], chloroforme (87 g/l)[5], benzène (22 g/l)[5], heptane : 0,45 g/L à 25 °C[3] ou isopropanol (12,5 g/l)[5], méthanol : 3,1 g/L à 25 °C[3], octanol : 1,4 g/L à 25 °C[3], tétrachlorure de carbone : 6 g/L à 25 °C[3], toluène : 26,3 g/L à 25 °C[3] |
| Pression de vapeur saturante | <0,0013 Pa à 20 °C[6] et 2,1 × 10−5 Pa à 25 °C[3], 9,7 × 10−5 Pa à 35 °C[3] et 45 × 10−4 Pa à 45 °C[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
C'est un fongicide du groupe des dicarboximides, à large spectre. Il est notamment efficace contre l'oïdium, le mildiou, le botrytis et le rougeot parasitaire. Il est pour ces raisons très utilisé et depuis plus d'un demi-siècle contre le mildiou de la vigne et de la tomate.
En Europe, il n'est autorisé que comme fongicide[8] et est principalement utilisé dans la culture du blé ordinaire, des tomates et en viticulture, mais il est aussi à faibles doses dans certaines peintures et matières plastiques. Pour lutter contre les phénomènes de résistance aux pesticides ou avoir plus d'efficacité, il est souvent utilisé en association avec d'autres fongicides (ex. : fosétyl-aluminium et cymoxanyl dans les années 2000-2015[9] - [10]).
Ce pesticide n'est pas classé parmi les plus toxiques, et il est réputé peu rémanent, mais il peut être localement très utilisé (vignes, tomates, blé) dont les mois d'été en région viticole et/ou d'arboriculture fruitière. Son bilan toxicologique et écotoxicologique doit donc tenir compte d'une « balance toxicité/quantité ». Selon sa fiche de sécurité, il est « très toxique pour les organismes aquatiques. Cette substance entre dans l'environnement lors d'une utilisation normale. Un grand soin devrait cependant être apporté pour éviter tout rejet supplémentaire, par exemple par un déversement inapproprié »[2].
Le folpet est un puissant sensibilisant notamment responsable d'« œdèmes de la face, de rash cutané, de phlyctènes, de conjonctivites, rhinites et troubles respiratoires » chez le viticulteur[11] et les personnels agricoles qui y sont exposés[12]. Selon le réseau Phyt'attitude créé par la MSA, il est en France la première cause de signalement chez l'agriculteur[12].
Sa forte prégnance (notamment dans les zones viticoles européennes) est donc une source de préoccupations en santé environnementale[13] - [14]. Les tonnages utilisés en France ne sont pas connus des auteurs d'évaluations sanitaires (lors d'une évaluation récente[9], les administrations et autorités compétentes ayant rédigé le rapport précisent que malgré « une convention […] signée le 10 mars 2003 entre le préfet, les fédérations régionales des coopératives et du négoce, le Comité interprofessionnel des vins de Champagne et les 12 distributeurs de produits phytosanitaires, il n’a pas été possible d’obtenir ces données par secteur viticole »).
Il fait depuis plusieurs années l'objet d'études de réévaluation toxicologique ou écotoxicologique sous l'égide de la Commission européenne. Dans ce cadre, les groupes d'experts en toxicologie et sur les résidus (réunis en novembre 2007 et avril 2008) ont rediscuté des données dont ils disposaient au sujet de ce pesticide, conduisant à une modification des valeurs de référence qui dataient de 2006[8]. Les nouvelles valeurs ont été présentées dans un rapport scientifique de l'AESA en 2009[8]. Le demandeur souhaitait disposer d'une autorisation de mise sur le marché incluant la pulvérisation foliaire sur le blé d'hiver, les tomates et les raisins de cuve à des taux allant jusqu'à 750 g/ha de folpet sur les céréales d'hiver d'application céréales, jusqu'à 1,6 kg sur les tomates et jusqu'à 1,5 kg sur le raisin[8].
Classification et étiquettes de sécurité
Ce biocide appartient au groupe antibiotique/antifongique des phtalimides (tout comme le captafol et le captane).
Selon sa fiche internationale de sécurité (consultée 2015-09-13)[2], ce produit est classé comme suit :
- classification européenne :
Symbole : Xn, N ; R : 20-36-40-43-50 ; S : (2)-36/37-46-61 ; - classification ONU :
Classe de danger ONU : 9 ; groupe d'emballage ONU : III ; - classification SGH :
- mention d'avertissement : danger,
- risque avéré d'effets graves pour le tractus gastro-intestinal à la suite d'expositions répétées ou d'une exposition prolongée par ingestion,
- provoque une irritation oculaire (« sérieuse » selon les tests faits sur le lapin en laboratoire[3]),
- peut provoquer une allergie cutanée (ja) (dermatites),
- très toxique pour les organismes aquatiques.
Histoire
Ce produit chimique a été lancé sur le marché au début des années 1950 au XXe siècle.
Il est actuellement vendu sous plusieurs noms de marque, dont :
En 1989, la consommation mondiale a été estimée à plus de 5 000 t/an[15].
Aspect, chimie, mécanisme d'action et dangers chimiques
À l'état pur, il se présente sous la forme de cristaux incolores.
Théoriquement, le folpet a une pureté d'au moins 94 % selon l'Union européenne (ou 86 % pour la FAO). Deux de ses impuretés organochlorées sont réglementées :
- perchlorométhylmercaptan (R005406) : 3,5 g/kg[3] ;
- Tétrachlorure de carbone : 4 g/kg[3].
Son mécanisme d’action est basé sur l'« inhibition de la respiration cellulaire (des champignons), bloquant ainsi la production d’énergie. L’action est donc préventive et curative ».
Exposé à la chaleur, au-delà d'une certaine température, « il produit des fumées toxiques et corrosives, notamment d'oxydes de soufre, d'oxydes d'azote et de chlorure d'hydrogène (cf. ICSC 0163) »[2].
Application
Le folpet est un puissant fongicide, à large spectre.
En agriculture et arboriculture, il est pulvérisé sur les plantes en aérosols (dispersion aqueuse, pulvérisé sur les feuilles). Les pépinières l'utilisent pour désinfecter des plants (de vigne…) par trempage (« à l'égard des champignons associés aux maladie s du bois » ; ex. : 1 h de trempage dans une solution à 200 g/hL selon l'Institut français de la vigne et du vin[16]) sans que l'on sache comment ce traitement pourrait ou non ensuite éventuellement nuire à la bonne mycorhization du plan.
Le folpet n'est pas autorisé en agriculture biologique et sur la vigne classique c'est le fongicide chimique le plus utilisé (6 applications par an, essentiellement en fin de printemps et été, avec des dosages de 5 à 16,7 mg/L selon G. de Lozzo (2015)[12]), en association avec d'autres fongicides souvent (ex. : 2 applications par saison de dithiocarbamates dosées à 10 mg/L[12]) et l'INSERM pointait en 2013 le fait que selon les statistiques disponibles, la vigne française bien que ne couvrant que 3 % de la surface agricole utilisable consommerait (avec l’arboriculture) 20 % des pesticides[17].
C'est l'un des pesticides parfois pulvérisés par hélicoptère ou avion, dont sur les vignes.
Il a autrefois été proposé en sylviculture pour le traitement d'arbres attaqués par des maladies fongiques (exemple contre la maladie chancreuse du pin d'Alep)[18].
Présence, biodisponibilité, mobilité et cinétique environnementale
- Dans l'air : on a longtemps considéré qu'une fois pulvérisé, ce produit n'était pas ou très peu volatil (constante de Henry calculée = 8×10-3 Pa·m3·mol-1 à 25 °C[19] ou qu'il présentait une volatilisation « négligeable »[20]. Mais si la pulvérisation est faite dans de mauvaises conditions (par temps sec et/ou venteux, sous la pluie, ou avec des buses de pulvérisateur de mauvaise qualité ou mal nettoyées, une grande partie du produit pulvérisé peut être immédiatement dispersé par le vent et/ou la pluie). Même dans des conditions normales (selon 9 tests faits en Europe du Nord et du Sud), environ 50 à 85 % du produit pulvérisé était « intercepté » par la plante pour la vigne et selon 4 tests faits pour le blé d'hiver, ce taux était de 70 % environ[21].
30 à 50 % du produit peut donc être retrouvé dans l'environnement immédiatement après la pulvérisation ; peu de données semblent disponibles au sujet du devenir de la molécule et de ses sous-produits dans ces cas (sauf pour la fraction solubilisée dans l'eau). Il est probable qu'il varie avec la température et l'ensoleillement (pour ce qui concerne la photodégradation). Dans une zone viticole de Gironde (Sud-Ouest de la France) et durant plusieurs années, l'Agence Airaq et l'InVS ont quantifié les principaux pesticides dans l'air ambiant ; en 2004, lors des 2 mois de la période d'épandage à Rauzan[22], un préleveur situé près d'une parcelle « où pouvaient être réalisés des épandages de produits phytopharmaceutiques » a détecté la présence d'un cocktail de pesticides à des taux très hétérogènes, allant du seuil de détection à plusieurs centaines de ng/m3 et le produit quantitativement le plus présent était le folpel (avec le chlorpyriphos éthyl, un insecticide organophosphoré homologué et récemment rendu obligatoire contre le vecteur de la flavescence dorée par arrêté préfectoral). Lors des traitements, le taux de folpel dans l'air était multiplié par 5[13] et était dans cette commune 20 fois plus présent qu'à Saint-Symphorien (Gironde) où la vigne est moins cultivée[13]. La saisonnalité est forte « avec des niveaux très faibles relevés au printemps et plus élevés en été »[9] (avec, en Aquitaine, une diminution de teneur dans l'air observée « à partir de la 2e quinzaine du mois d’août » quand les traitements de la vigne sont moins nombreux ou cessent[9]). Les taux retrouvés dans l'air varient également fortement selon l'heure de la journée[9]. En Aquitaine, c'est la molécule la plus présente dans l'air avec le chlorpyriphos-éthyl (qui est moins présent et qui disparait rapidement et presque complètement de l'air après les périodes de traitement, ce qui n'est pas le cas du folpet qui est retrouvé en « bruit de fond » jusque mi-septembre au moins (en 2004)[9]). C'est l'un des rares pesticides peu volatil néanmoins trouvé dans l'air en quantité et fréquences significatives à importantes[23]), ce qui fait que certains auteurs le classent désormais parmi les produits moyennement volatils plutôt que faiblement volatils[23]. Une étude espagnole a été conduite à Alzira, au cœur d'une zone rurale située à 43 km de Valence (Espagne). On y a recherché et dosé 16 pesticides communément utilisés dans cette région, dans des échantillons d'air prélevés (en 2012-2013) en les classant par taille de particule. C'est dans la fraction fine (dans 6 % des prélèvements) et plus encore (5 fois plus) dans la fraction des particules atmosphériques ultra-fines (37 % des prélèvements à Valence) que le folpet a été le plus retrouvé[23], ce qui laisse penser qu'il peut facilement passer dans le sang des animaux et des hommes ou dans le tractus digestif, via le mucus pulmonaire avalé.
- Dans le sol : selon les données mises à disposition par les fabricants ou soumises aux experts de l'AESA qui précisent qu'ils ont dû se baser sur des modélisations appuyées sur les propriétés physiques et chimiques et/ou des calculs théoriques, le folpet est supposé être moyennement mobile dans le sol (« Organic carbon adsorption coefficient » = KOK = Koc = 304 ml/g), mais son métabolite acide phtalamique présente une mobilité très élevée (Koc = 10 ml/g) et l'acide phtalique encore plus hautement mobile (K oc = 73 ml/g)[8].
Un sous-produit (le phtalimide) a fait l'objet d'expérimentations ; elles montrent qu'il est « moyennement mobile dans le sol » (K foc = 72 à 385 ml/g)[8].
- Dans l'eau : le folpet pur est assez rapidement hydrolysé dans les eaux dont le pH est neutre à acide (la moitié de la dose est hydrolysée après 3 heures) et encore plus vite à un pH alcalin (DT 50 <3 min), avec comme principaux sous-produits d'hydrolyse le phathalimide et l'acide phtalique[8]. On suppose qu'il y a aussi production d'acide trichlométhylsulfénique et de triclorométhylmercaptan[24] qui seront dégradés/minéralisés en thiophosgène et oxysulfure de carbone et en CO2[8].
- Dans le temps : sa présence dans l'environnement est a priori principalement liée au contexte agricole et pédoclimatique, ainsi qu'aux dates de pulvérisation (car en zone chaude et tempérée, c'est un produit assez peu rémanent).
- Sur les végétaux et fruits traités : le produit y persiste un certain temps. Les travailleurs y sont plus exposés durant ou après les traitements qu'au moment de la vendange (« l’accolage ainsi que la coupe des branches aériennes sont entre 10 et 30 fois plus à risque que les vendanges »[12]), et selon une étude récente (2015) dans la vigne, « travailler le matin s'avèrerait 2 fois moins contaminant que travailler l'après-midi. Les concentrations maximales sont retrouvées sur les avant-bras, bras et cuisses », peut-être en raison de l'évapotranspiration foliaire qui favorise le décollement des molécules et parce que la chaleur et la sudation sont souvent plus importantes l'après-midi[25] - [12]. Le port d'un tee-shirt augmente la contamination (par rapport à une tenue longue couvrante ne pouvant généralement être portée en plein été), mais porter un short n’affecte pas significativement l'exposition au folpet[12].
Écotoxicologie
Le folpet est un produit écotoxique en ce qu'il affecte la mycoflore du sol, la flore aquatique et le milieu aquatique.
À partir d'une certaine dose, il semble également présenter des effets toxiques pour les plantes ou certains insectes auxiliaires utiles (ex. : après pulvérisation à la dose de 5,25 kg/ha, on a observé une mortalité de plus de 50 % des Aphidius rhopalosiphi exposés aux résidus frais du produit (animal utile pour l'agriculture, du groupe des Aphidiinae car parasitant les pucerons)). De même la coccinelle à sept points semble insensible dans un contexte d'application unique de 3,38 kg/ha, mais une mortalité plus significative est constatée dans un environnement pulvérisé à la dose de 5,25 kg de folpel par ha (+ 11,8 %).
Son écotoxicité (phytotoxicité en particulier) semble pourvoir évoluer synergiquement (synergies positives ou négatives) quand il est utilisé en présence d'autres produits, dont par exemple avec le cuivre[26] ou le diuron[27]. Sa phytotoxicité (quand elle est observée) semble au moins liée à l'induction d'un stress oxydatif (génération d'espèces réactives de l'oxygène quand le fongicide est absorbé par la feuille)[28].
Au-delà d'une certaine dose (10 mg/jour/kg de poids corporel), il diminue la croissance du lapin (en laboratoire), sans effets tératogènes observés, ce qui a fait suggérer en 2009 de lui associer l'étiquette de danger R63 (décision en réflexion)[29].
Toxicologie et sécurité
Selon sa fiche internationale toxicologique, ses valeurs limites d'exposition professionnelle n'ont pas été établies pour la TLV (Not-Established) et le MAK (not established). La contamination individuelle est difficile à mesurer, car ce produit à courte demi-vie circule rapidement dans l'organisme où il est également rapidement métabolisé ; les analyses classiquement faites dans deux liquides biologiques (sang, urine) ne sont peut être pas de bons indicateurs biologiques d’exposition, même si elles sont réputées refléter l'ensemble des contaminations (absorption orale, transcutanée et par inhalation)[25].
Selon les bases de données françaises Agritox (Inra/ANSES)[3], Extoxnet et Teletox et le rapport 2009 de l'AESA, à partir des données alors disponibles sur ce produit.
- En termes de cinétique corporelle chez les mammifères (absorption, distribution, excrétion and métabolisation dans l'organisme) ; ce produit peut être accidentellement inhalé, ingéré et passer au travers de la peau (10 % d'une dose concentrée ou diluée de Folpan 80 WDG (avec donc son surfactant) pour une exposition expérimentale chez le rat et 1 % sur de la peau humaine[30]). Chez le rat, plus de 80 % du produit ingéré passe dans l'organisme[31] où il est rapidement largement dispersé, mais il est ensuite rapidement excrété[31] (via l'urine et les fèces ou rapidement métabolisé[31]). Pour ces raisons, le potentiel de bioaccumulation de cette molécule est jugé très bas[31]. Selon sa fiche toxicologique : « Une concentration gênante de particules en suspension dans l'air peut être atteinte rapidement par dispersion »[2]. Chez l'humain, la molécule de folpet est hydrolysée en phtalimide (PI) et en thiophosgène dans le sang dès qu'elle entre en contact avec un thiol sanguin (ou tissulaire dans un tissu) ; le phtalimide est à son tour rapidement hydrolysé en acide phtalamique puis en acide phtalique. Quant au thiophosgène, le glutathion ou une cystéine vont s'y lier (en formant de l’acide thiazolidine-2-thione-4-carboxylique (TTCA)[32] - [33]). Le PI est donc un biomarqueur humain du folpet ; il est essentiellement éliminé par l’urine (demi-vie d’élimination : 11,7 h à la suite d'une contamination orale et 28,8 h s'il s'agit d'une contamination percutanée). Sur ces bases un modèle mathématique montre que le travailleur viticole ou arboriculteur est surtout exposé par voie cutanée (s'il ne mange pas ce qu'il récolte), bien plus que via l'inhalation[25]. Une valeur de référence biologique pour le PI a été retenue : « 36,6 pmol/kg de poids corporel pour des urines cumulatives de 24 heures » et en Suisse, 2 travailleurs sur 3 testés présentaient des valeurs urinaires dépassant cette valeur de référence[25].
- En termes de toxicité aiguë et de court terme, le folpet a longtemps été réputé présenter une faible toxicité orale et dermique pour les mammifères, mais en cas d'intoxication aiguë par ingestion, il affecte chez la souris de laboratoire l'estomac/œsophage (« hyperkératose de l'estomac non glandulaire à forte dose »[3], cet effet étant réversible[3]). Chez le chien mâle, les testicules sont l'organe-cible avec à fortes doses des lésions accompagnées de vomissements, diarrhées et phénomène d'hypersalivation[3]. Il est classé chez l'homme « nocif par inhalation » (R20), non-irritant à court terme pour la peau (bien que des tests histologiques faits sur de la vraie peau humaine en 2014 montrent des effets importants (effets marqués de dégradation cellulaire, plus que pour les 2 autres molécules connues pour être irritantes testées ; 1-bromohexane et méthylchloroisothiazolinone[34]) et très irritant pour les yeux (les experts de l'AESA ont proposé de la classer dans la catégorie R41 Risque de dommages sérieux pour les yeux). Et un contact cutané répété ou prolongé peut causer une sensibilisation de la peau puis une dermatite de contact[2] ; les thiophtalimides (dont le folpet et le captane font partie) sont considérés comme les pesticides les plus sensibilisants[35] ; les experts de l'AESA ont donc proposé de la classer dans la catégorie R41 « pourrait causer une sensibilisation par contact cutané »)[8].
Sa toxicité aiguë est également à ce jour considérée comme faible envers les oiseaux et les abeilles (DL50 orale : >236 µg/abeille[3] ou DL50 contact : >160 µg SA/abeille, et DL50 orale :>179 µg SA/abeille en cas d'exposition plus longue (heures).
Ce produit présente une toxicité significative pour certains poissons[36], bien plus que ses métabolites. La « concentration sans effet prévisible pour les organismes aquatiques » (PNEC) a été établie en 2012 à 39 ug/L (FS = 10)[3].
Il est jugé modérément toxique pour les invertébrés aquatiques (sur la base de tests sur la daphnie Daphnia magna exposée durant 48 h à du Folpan 80 WDG ou des métabolites, ou exposée 21 jours à du Folpan 80 WDG ; alors : CSEO (CN+) =: 0,055 mg SA/L) , et les algues (test sur Scenedesmus subspicatus[37], de même pour les vers de terre). Si la molécule (qui n'est presque pas soluble dans l'eau) est associée à un solvant organique, elle peut être source de nausées et vomissements[2](en cas d'intoxication, il faut alors aussi consulter la fiche toxicologique ICSC (ou autre) du solvant en cause)[2]. Les surfactants ou solvants utilisés peuvent aussi modifier les propriétés du folpet[2] et devraient donc être pris en compte par les évaluations toxicologiques et écotoxicologiques. La littérature scientifique ne semble pas citer d'études en microcosme[3] ni en mésocosme[3].
- En termes de toxicité à long terme : Il est principalement connu comme irritant (après sensibilisation) avec hyperkératose et acanthose de l'épiderme, plus chez le mâle que chez la femelle selon le modèle animal (rat)[3].
En 2009, le folpet ne s'est pas montré neurotoxique chez le rat de laboratoire, ni génotoxique in vivo, mais des données de laboratoire montrent qu'il est cancérigène pour le modèle animal murin (souris de laboratoire qui développe des tumeurs du duodénum selon un mécanisme a priori non génotoxique[3]) sans l'être chez le rat ; une majorité des experts de l'AESA l'ont proposé en 2009 pour la catégorie 3, R40.
Le folpet est considéré sur cette base comme « peut-être cancérogène pour l'homme »[8].
Mutagénicité : elle est soupçonnée et testée dès les années 1960[38] et au milieu des années 1970[7] mais souvent avec des résultats contradictoires ou non reproductibles.
Une évaluation de mutagénicité de cette molécule a été faite en même temps que pour le captane, le captafol, le dichlofluanide (et le thalidomide[7]) en observant ses effets via des tests sur la Salmonelle (souches TA102 et TA104) et des micro-mammifères. Les tests ont mis en évidence un effet mutagène du Captan et du folpet pour la souche TA104, alors que le captafol se montrait mutagène pour la souche TA102[39] mais non pour deux souches de lapins dont les embryons s'étaient montrés très sensibles au thalidomide[38], ni pour les souris et rats de laboratoires selon une expérience de 1975[7], ni pour des hamsters de laboratoire[40], ni pour des femelles enceintes de deux espèces de primates non humains testés en laboratoire, selon une étude publiée en 1971[40] alors que chez ces espèces le thalidomide se montrait mutagène et/ou tératogène. Chez la drosophile, des effets mutagènes ont été observés, mais non reproductibles, ce qui a fait conclure à une mutagénicité possible mais faible[41].
En termes de reprotoxicité, des effets sont observés (sur le modèle animal, à partir d'une certaine dose délivrée par voie orale, avec des effets différents selon l'espèce testée et l'âge de l'animal exposé[3]). Il ne semble pas y avoir d'études à partir de contamination transcutanée. Il se montre tératogène chez le lapin (en 2009, une classification en R63 était en discussion et la décision repoussée en attendant des données complémentaires)[8].
- Effets sur le développement : chez le lapin exposé in utero ou lors de sa croissance, on observe un « retard d'ossification à dose légèrement toxique pour la mère », qui pourrait peut-être être expliqué par des lésions gastro-intestinales qui chez la mère induiraient un déséquilibre alimentaire sévère pour les fœtus. Il s'agirait alors d'un effet indirect.
- Allergénicité : ce produit est connu pour être allergène. Par exemple, une étude transversale faite à Taïwan en 1991 a montré chez 122 ouvriers en arboriculture fruitière, une prévalence d'eczéma des mains chez 1/3 d'entre eux et 46 de ces ouvriers présentaient des tests épicutanés positifs aux thiophtalimides (captane, folpet et/ou captafol)[42] et des cas de photoallergie ont été rapportés avec le folpet (comme pour le captane)[43].
- Dose journalière admissible (DJA) : elle a été fixée à 0,1 mg/jour/kg de poids corporel, de même que l'AOEL (acceptable operator exposure level, ou niveaux acceptables d’exposition pour l’opérateur)[8]. Cette valeur de 0,1 mg a été proposée par un groupe d'experts sur la base de la Dose sans effet toxique observable ou NOAEL (qui est de 10 mg/kg par jour, établie à partir d'une étude sur un an sur le modèle canin et une étude de 2 ans sur le rat de laboratoire, en retenant un facteur de sécurité de 100[44]). Il a été calculé que cette dose pourrait être dépassée chez les jeunes enfants consommant du raisin de table et des tomates[8] (ou plus encore du raisin sec en raison d'un « facteur de transfert » théorique bien plus élevé que lors du passage du raisin au vin ou au jus de fruit[45]).
- La dose de référence pour la toxicité aiguë (ou ARfD pour « Acute Reference Dose », qui est la dose maximale orale à ne pas dépasser pour éviter la toxicité aiguë chez un adulte moyen en bonne santé[46]) a été fixée à 0,2 mg/j/kg de poids corporel.
- Concernant les risques liés à l'exposition directe des opérateurs-applicateurs, selon les données disponibles en 2009 et compilées par les experts de l'AESA, l'exposition estimée serait de 34 à 77 % de l'AOEL pour les scénarios d'exposition en plein air (modèlisation allemande avec PPE considéré), et pour un opérateur travaillant sous serre, les estimations disponibles variaient de 29 % à 33 % de l'AOEL (PPE is worn)[8].
L'exposition du public serait de 1,6 % de l'AOEL[8]. Sans gants de protection adéquats, dans le cas particulier de la récolte des raisins, l'AOEL serait dépassé de 133 % (et serait approché pour 68 % lors de la récolte de tomates traitées). Avec les seuls gants comme équipement de protection individuelle, on suppose (en 2009) que l'exposition est inférieure à l'AOEL[8]. On suppose aussi que l'exposition des travailleurs exposés au folpet pulvérisé sur le blé devrait être inférieure à ce qu'elle est dans le secteur du vignoble ou de la culture de tomate[8]. Pour les experts de l'AESA (2009), le port de gants de protection est nécessaire pour les travailleurs manipulant le raisin, faute de quoi ils peuvent dépasser de 130 % environ la dose acceptable pour les travailleurs (AOEL), tout en sachant qu'avec des gants l'exposition resterait quand même de 68 % de l'AOEL[47].
- limites maximales de résidus(LMR) : des résidus sont présents sur les plantes traitées[48], dont sur les grains de raisins où, malgré une faible solubilité dans l'eau, probablement grâce aux adjuvants, il pénètre faiblement la cire épicuticulaire du fruit ; il est principalement retrouvé sur presque toute la surface du grain, le résidu montrant en outre une « haute résistance au lavage »[48] avec un effet de la pluie « négligeable dans la réduction des résidus »[48]. La LMR de 5, 3 et 0,05 mg/kg pourrait être nécessaire pour les raisins, tomates et blé respectivement.
Métabolisation, dégradation, biodégradation et résidus
- Ce produit semble se dégrader assez rapidement, notamment par plusieurs processus d'oxydation[49]. Au début des années 2000, le métabolisme du folpet dans l'organisme végétal a été « adéquatement élucidé »[8] : dans la plante, les principaux métabolites (produits de dégradation) issus de la fragmentation de la chaine trichloro-méthyl-thio sont le phtalimide et l'acide phtalique. En 2009, les experts de l'AESA jugent que comme « il est encore impossible à ce stade de pleinement caractériser les propriétés toxicologiques du phtalimide », ce métabolite doit être inclus parmi les résidus à suivre et devant faire l'objet d'une « évaluation des risques ». Les résultats de tests mis à disposition des experts-évaluateurs ne concernaient presque que des suivis de la seule molécule de folpet ; il a donc été impossible d'établir une limite maximale de résidus (LMR) et d'évaluer les risques d'exposition au phtalimide (en tant que résidu du folpet)[8].
- Sur les feuilles et les fruits, exposés au soleil, il se dégrade progressivement en sous-produits (qui, en 1996, n'avaient toujours pas été identifiés selon Cabras et al. (1997)[50]).
Le phtalimide est son principal métabolite connu, notamment sur le grain de raisin. Et selon les conclusions de 2009, des experts de l'AESA, sur la base des informations disponibles, la photolyse ne contribue pas de manière significative à la dissipation du folpet dans l'environnement[8].
- Après la récolte et dans les processus de transformation agroalimentaires : le folpet est ensuite rapidement dégradé dans le moût en donnant (pour 80 % de sa masse) du phtalimide, avec aussi de petites quantités d'acide phtalique[50]. En fin de fermentation, du phtalimide est encore présent dans le vin où il est retrouvé stable après plusieurs mois[50]. In vitro, la présence de folpet dans les raisins inhibe temporairement à complètement la fermentation alcoolique par Saccharomyces cerevisiae, mais le résidu phtalimide, au contraire, n'a pas (in vitro) d'effet négatif sur l'action de fermentation de ces deux levures[50] ; ce produit modifie le microbiote de la peau du raisin[51] et peut donc modifier le goût du vin et sa qualité.
- Dans le sol naturel et humide, ce produit est jugé (en 2009) faiblement ou très faiblement persistant dans le sol (de même que ses principaux métabolites dans des sols bien aérés et à 20 °C)[8]. Il commence à s'y décomposer en quelques jours via le très réactif thiophosgène (en phtalimide et en acide phtalique) ; sa minéralisation est élevée et les résidus non-extractibles sont formés en « quantités modérées (max. 31,2 % AR à 14 d) »[8]. Concernant la part et le devenir du thiophosgène, des informations supplémentaires ont été « dérivées » à partir des informations disponibles sur une molécule proche, le captane et les experts ont en 2009 jugé qu'« il est peu probable que le thiophosgène libre atteigne des niveaux importants dans le sol à la suite de la dégradation du folpet »[8]; pour ces raisons, en 2009, les experts réunis par l'AESA ont supposé qu'aucune molécule de folpet ne perdurait dans les cultures en rotation ni n'était transférée dans les produits d'origine animale[8] (viande, lait, fromage.. car le blé et certains sous-produits agroalimentaires sont aussi très utilisés pour produire de la nourriture pour animaux d'élevage). De plus, selon les données disponibles sur la métabolisation de ce produit, il est très peu probable qu'il en reste des traces dans la viande d'animaux en ayant ingéré. Les données manquent pour une évaluation précise et exhaustive de la dégradabilité des sous-produits, notamment en sol sec, froid ou peu aéré (en condition anaérobie, le folpet et certains de ses sous-produits se montrent beaucoup plus stables, mais les métabolites semblent les mêmes qu'en condition aérobie). L'étude de la toxicité éventuelle du folpet sur les vers de terre et d'autres organismes contribuant à aérer le sol est donc importante et justifie des données plus précises car une étude a montré qu'il faut de hautes doses pour tuer des vers de terre, mais qu'à des doses plus faibles, leur reproduction est inhibée (reprotoxicité : NOEC = 5,18 mg de folpet par kg de sol)[52] ; en 2009, l'AESA considère que des calculs plus précis de PEC-sol (PEC signifie Predicted environmental concentration) doivent encore être faits pour le vignoble, et restent à mieux justifier pour les pulvérisations sur cultures de tomates[8], qui par ailleurs sont souvent faites en serre et en hydroponie, ce qui invite à des évaluations spécifiques. Enfin, en raison d'ambiguïtés dans les données confiées aux experts, le calcul de la PEC-sol (PECs) n'a pu (en 2009) être établie pour le blé.
- Dans l'eau, le folpet est rapidement hydrolysé en donnant du phtalimide (molécule stable à un pH neutre à acide), et éventuellement en interagissant avec l'ADN[53]. Selon une expérience récente (publication 2014) conduite par un laboratoire d'État chinois, basé à l'université de Nanchang[54], l'ajout d'ADN dans une solution contenant du folpet en cours de dégradation affecte de manière significative l'hydrolyse du folpet : « le folpet et le produit intermédiaire de dégradation (acide phtalique) peuvent s'intercaler dans la double hélice de l'ADN, alors que le phtalimide ne montre pas la liaison avec l'ADN. En outre, la liaison du folpet (ou du produit intermédiaire de décomposition) et de l'acide phtalique à l'ADN induit des changements structurels de l'ADN »[53]. L'acide phtalique n'est pas considéré comme mutagène quand il est seul, mais il peut le devenir en synergie avec d'autres agents mutagènes (amines hétérocycliques)[3].
- Sur la base des données dont disposaient les experts de l'AESA, le folpet se montre assez rapidement biodégradable dans l'eau et dans les sédiments : à la concentration de 1 mg/L, la DT 50 est inférieure à 1 heure, et la DT 90 inférieure à 5 heures (DT 50 = temps requis pour la dégradation de 50 % du produit). Ce chiffre est assez bas pour que les experts missionnés par l'AESA ne jugent pas utile de lui apposer la phrase de risque R53. Dans les deux cas, la part du produit minéralisée est relativement élevée (51 à 54 % après 100 jours, date de la fin de l'étude)[8]. Après un apport ponctuel, la molécule de folpet n'est pas, à moyen ou long terme, retrouvée dans les sédiments (mais des traitements réguliers peuvent causer un apport régulier). Il en va de même pour ses métabolites majeurs, mais ces derniers dont le phtalimide, l'acide phtalamique, l'acide phtalique, le benzamide et de l'acide 2-cyanobenzoïque, sont par contre retrouvés dans l'eau[8]. Tous ces métabolites se dégradent rapidement dans l'eau, comme dans les sédiments (DT 50 inférieure à 7 jours)[8].
Réglementation ; autorisation d'usages et de mise sur le marché (AMM)
La Directive de l'Union européenne sur les pesticides (directive 91/414/CEE) implique que le folpet soit réévalué en tant que substance active susceptible d'avoir des effets pour la santé ou être source de risques environnementaux (avec 51 autres pesticides).
Cette évaluation est basée sur une revue des études (peer review) organisée par l'AESA, avec l'Italie comme État-membre rapporteur[8]. Sur la base des conclusions des experts sollicités, la Commission pourra inclure ou non le folpet dans la liste des substances actives interdites ou autorisées[8] - [55].
Cette procédure d'enregistrement a débuté le 1er octobre 2007 pour son utilisation en hiver, et court jusqu'au 30 septembre 2017[56]. La procédure se double d'une réévaluation toxicologique et écotoxicologique (pour les applications non hivernale, des données appropriées doivent être fournies comme preuves que ce produit satisfait les exigences de la Directive de l'Union européenne sur les pesticides.
Méthodes analytiques pour le dosage
Des méthodes d'analyses existent pour le doser dans l'eau, l'air et le sol, mais l'AESA fait remarquer en 2008 que « pour les aliments d'origine végétale aucune méthode analytique validée n'est disponible à des fins de surveillance sanitaire » et que « ne sont disponibles que des méthodes d'analyse de sous-produits résiduels individuels, car les méthodes d'analyse multi-résidus (comme le S19 allemand ou le MM1 néerlandais) ne sont pas ici applicables en raison de la nature des résidus de ce produit ».
En 2009, l'AESA estimait que l'on disposait de méthodes analytiques suffisantes ainsi que de données suffisantes (relatives aux propriétés physiques, chimiques et techniques du produit) pour permettre des mesures de contrôle de la qualité du produit phytopharmaceutique, mais que « toutefois, en raison de certaines données manquantes, aucune spécification finale ne peut être proposée pour le matériel technique pour le moment » (2009)[8].
Les dosages dans le sol sont encore difficiles en raison du fait que de nombreuses molécules peuvent être fortement adsorbées sur les composants du sol. Des méthodes d'extraction/désorption bien plus précises et performantes que l'extraction par solvants sont en cours de développement depuis les années 1980, dont via une désorption (en une seule étape) des échantillons de sols assistée par ultrasons (extraction assistée par ultrasons) et/ou micro-ondes (extraction assistée par micro-ondes)[57]. L'acétone se montre un mauvais solvant d'extraction (par rapport à l'acétate d'éthyle par exemple, qui est un produit pouvant naturellement apparaitre dans la fermentation alcoolique de fruit, et que l'on peut trouver dans le rhum et donc dans la sangria).
Suspicion d'effets sanitaires négatifs
Ce produit fait partie des pesticides qui pourraient affecter la santé des vignerons et ouvriers travaillant dans la vigne ou l'arboriculture ou d'autres secteurs agricoles utilisant cette molécule.
Une étude rétrospective de mortalité conduite sur un groupe de 134 ouvriers potentiellement exposés à cette molécule durant au moins trois mois a conclu à une augmentation apparente du nombre de décès chez ces travailleurs par rapport à la normale (en raison de maladies de la circulation et des causes externes non reliées au métier, dans l'augmentation détectée de cancers duodénaux). D'autres études ont recherché des liens entre exposition au folpet et mortalité, sans trouver de preuve précise que l'exposition potentielle au folpet puisse être un facteur de morbidité ou mortalité[58].
Selon l'InVS et l'Agence régionale de santé Aquitaine[13] - [9], les pesticides utilisés sur la vigne pourraient être liés à l'accroissement de cancers pédiatriques dont le nombre est anormalement élevé[59] dans la commune de Preignac. Le folpet étant très utilisé et très présent dans l'air de cet environnement, il fait partie des molécules pouvant être suspectées[13].
Une carte de risque des zones d'épandages aériens de folpet a été réalisée pour la Marne (saison 2001), montrant que l'Est du département y a été très exposé en 2001[9]. Et les mesures de terrain montrent que le folpet est retrouvé dans l'environnement y compris hors période de traitement, bien que ce produit ait longtemps été jugé très rapidement dégradé[9].
Précautions à prendre
Selon la fiche internationale de sécurité du produit[2] :
- le folpet est « combustible dans certaines conditions. Les formulations liquides contenant des solvants organiques peuvent être inflammables », avec en cas d'incendie la production de fumées (ou de gaz) irritants ou toxiques. Le feu peut être éteint avec de « l'eau pulvérisée, de la poudre, de la mousse, du dioxyde de carbone » ;
- ce produit ne doit pas être transporté « avec des produits destinés à l'alimentation humaine ou animale » et il doit être manipulé avec une protection individuelle (au minimum gants, vêtements de protection et lunette de sécurité). En cas de contact avec les yeux, « rincer abondamment à l'eau pendant plusieurs minutes (retirer si possible les lentilles de contact »). Ne pas manger, boire ou fumer pendant le travail. Le stockage doit se faire en prévoyant un « dispositif pour contenir l'écoulement des résidus lors de l'extinction (…) dans une zone sans drain ou accès d'égout (…) à l'écart des produits destinés à l'alimentation humaine et animale ».
En cas de fuite ou déversement, « ne pas laisser ce produit contaminer l'environnement. Balayer et récupérer la substance répandue dans des récipients couverts. S'il y a lieu, humidifier d'abord pour prévenir la formation de poussières. Recueillir soigneusement les résidus. Puis stocker et éliminer conformément à la réglementation locale ».
Les mentions d'avertissement sont :
- Toxicité aiguë (par inhalation), catégorie 4
H332 Nocif par inhalation[3] ; - Sensibilisation cutanée, catégorie 1
H317 Peut provoquer une allergie cutanée[3] ; - Irritation oculaire, catégorie 2
H319 Provoque une sévère irritation des yeux[3] ; - Cancérogénicité, catégorie 2
H351 Susceptible de provoquer le cancer[3] ; - Dangers pour le milieu aquatique - Danger aigu, catégorie 1, Facteur M aigu : 10
H400 Très toxique pour les organismes aquatiques[3].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche internationale de sécurité (version francophone), IPCS, mise à jour en 2012 (consultée le 13 septembre 2015)
- Fiche du folpel, Agritox (Inra)
- Entrée « Folpel » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 avril 2020 (JavaScript nécessaire)
- « Folpet » dans la base de données Hazardous Substances Data Bank
- Donald Mackay, Wan Ying Shiu, Kuo-Ching Ma, Sum Chi Lee, Handbook of physical-chemical properties and environmental fate for organic chemicals, vol. IV, 2e éd., CRC Press, 2006 (ISBN 978-1-56670-687-2), S. 4065.
- Kennedy, G.L., Arnold, D.W. et Keplinger, M.L. (1975), Mutagenicity studies with captan, captofol, folpet and thalidomide, Food and cosmetics toxicology, 13(1), 55-61. (résumé)
- EFSA (2009), Conclusion regarding the peer review of the pesticide risk assessment of the active substance folpet (Question no EFSA-Q-2009-605) EFSA Scientific Report (2009) 297, 1-80 : document de réévaluation publié en 2009 remplaçant celui du 24 avril 2006 (EFSA Scientific Report, 2006) [PDF], 80 p.
- Exposition aérienne aux pesticides des populations à proximité de zones agricoles Bilan et perspectives du programme régional intercire, [PDF], 64 p., voir notamment fig. 3 (carte de modélisation des zones d'épandage de Folpel) et haut de la page 19 (« En dehors des périodes de traitement, seules trois substances sont retrouvées, dont le folpel en quantité beaucoup plus faible qu’en période de traitement »)
- Piperkova, N. (2014). In vitro screening of fungicides for yeast like form of Taphrina deformans/Berk./Tul. Agrarni Nauki, 6(16), 33-38. (résumé)
- Baldi I., Lebailly P., Jean S. et al. (2006), Pesticide contamination of workers in vineyards in France. J. Expo. Sci. Environ. Epidemiol. ;16:115-24 (résumé)
- De Lozzo, Geoffroy (2015), Impact des pesticides sur la santé du vigneron, thèse de doctorat en pharmacie, soutenue le 28 avril 2015 à l'université de Toulouse III. Voir notamment p. 25 et 63/128
- (InVS, Dcar, Cire-Aquitaine, CVAGS et ARS (2015), 1 Protocole du dispositif de signalement des plaintes en lien avec une exposition aux pesticides en population générale : Phytoplainte. Aquitaine, version du 22 avril 2015, sur le site de l'ARS Aquitaine
- de Jaeger, C., Cherin, P., Fraoucene, N. et Voronska, E. (2012), Place, intérêt et danger des produits phytosanitaires, Médecine & Longévité, 4(2), 59-67 (résumé).
- OMS (1992), Folpet Health & Safety Guide, WHO
- P. Larignon, Institut français de la vigne et du vin (2010), Les maladies du bois de la vigne, Acte des journées des 16-17 novembre 2010 à Villefranche-sur-Saône, [PDF], 59 p. (voir notamment p. 33,59)
- NSERM (2013) Pesticides et effets sur la santé, Expertise collective (voir p. 7)
- RenouxJ. (1987), La maladie chancreuse du pin d'Alep (II). Recherche de moyens d'intervention (avec Inist/CNRS)
- Source : Agritox, citant la Commission européenne (consulté le 13 septembre 2015)
- EFSA (2009), Conclusion on the peer review of folpet, EFSA Scientific Report (2009) 297, 51-80, voir p. 68/80 du [PDF]
- EFSA (2009), Conclusion on the peer review of folpet EFSA Scientific Report (2009) 297, 51-80, voir chap. PEC (ground water) (Annex IIIA, point 9.2.1) p. 68/80 du [PDF]
- Airaq, InVS. Campagne de mesures de produits phytosanitaires dans l’air ambiant sur la commune de Rauzan (33) du 12/07/04 au 16/09/04
- « All pesticides detected only in year 2013 also presented a high volatility (>10-1 Pa), except for folpet (2.110-2Pa), which have medium volatility. They also have atmospheric life (DT50) of few hours (Tables SD-1.1 and 1.2) » in Coscollà, C., Muñoz, A., Borrás, E., Vera, T., Ródenas, M. et Yusà, V. (2014), Particle size distributions of currently used pesticides in ambient air of an agricultural Mediterranean area. Atmospheric Environment, 95, 29-35 (voir notamment le tableau 2 page 33).
- « Trichlomethylsulfenic acid and tricloromethylmercaptan are postulated to be the two major non characterized hydrolysis metabolites of folpet », in Rapport d'évaluation EFSA 2009, p. 3-3/80
- David Vernez (2012), [http://www.revmed.ch/rms/2012/RMS-325/Pesticides Pesticides] (séminaire), Rev. Med. Suisse 2012;180-181
- Teisseire, H., Couderchet, M. et Vernet, G. (1998), Toxic Responses and Catalase Activity of Lemna minor L. exposed to Folpet, Copper, and Their Combination. Ecotoxicology and environmental safety, 40(3), 194-200 (résumé).
- Teisseire, H., Couderchet, M. et Vernet, G. (1999). Phytotoxicity of diuron alone and in combination with copper or folpet on duckweed (Lemna minor). Environmental Pollution, 106(1), 39-45 (résumé)
- Teisseire, H. et Vernet, G. (2001), Effects of the fungicide folpet on the activities of antioxidative enzymes in duckweed (Lemna minor). Pesticide Biochemistry and Physiology, 69(2), 112-117 (résumé).
- EFSA (2009), Conclusion on the peer review of folpet EFSA Scientific Report (2009) 297, 51-80, voir p. 37 et 51/80 du [PDF]
- EFSA (2009), Conclusion on the peer review of folpet EFSA Scientific Report (2009) 297, 51-80, voir p. 52/80 du [PDF] (section Dermal absorption (Annex IIIA, point 7.3))
- EFSA (2009), Conclusion on the peer review of folpet EFSA Scientific Report (2009) 297, 51-80, voir p. 50/80 du [PDF] (section Dermal absorption (Annex IIIA, point 7.3)
- Berthet A, Bouchard M, Vernez D. Toxicokinetics of captan and folpet biomarkers in dermally exposed volunteers. J Appl Toxicol 2011; epub ahead of print.
- Berthet A, Bouchard M, Danuser B. Toxicokinetics of captan and folpet biomarkers in orally exposed volunteers. J Appl Toxicol 2011; epub ahead of print
- Miles, A., Berthet, A., Hopf, N. B., Gilliet, M., Raffoul, W., Vernez, D. et Spring, P. (2014), A new alternative method for testing skin irritation using a human skin model: A pilot study. Toxicology in Vitro, 28(2), 240-247. résumé
- Testud F. et Grillet J.-P. (2007), Produits phytosanitaires ; intoxications aigues et risques professionnels, Paris, Éd. Eska, 432 p.
- chez le salmonidé Oncorhynchus mykiss, CL50=233 µg SA/L pour une durée d'exposition (statique) de 96 heures / Pour la truite Salmo trutta, CL50=98 µg SA/L pour 96 heures d'exposition statique selon l'Union européenne, citée par Agritox dans la fiche Folpel au chap. 5.2.1 Toxicité aiguë chez les poissons. Pour Oncorhynchus mykiss exposé 28 jours à du Folpan 500 SC (en exposition semi-statique), la CL50 était de 110 µg SA/L.
- CEr50 :> 10 mg/L - Durée d'exposition : 72 heures selon agritox
- Kennedy, G., Fancher, O. E. et Calandra, J. C. (1968), An investigation of the teratogenic potential of captan, folpet, and Difolatan. Toxicology and applied pharmacology, 13(3), 420-430 (résumé).
- Barrueco, C. et de Torres, P. (1988), Mutagenic evaluation of the pesticides captan, folpet, captafol, dichlofluanid and related compounds with the mutants TA102 and TA104 of Salmonella typhimurium (résumé)
- Vondruska, J.F., Fancher, O.E. et Calandra, J.C. (1971), An investigation into the teratogenic potential of captan, folpet, and Difolatan in nonhuman primates. Toxicology and applied pharmacology, 18(3), 619-624.
- Kramers, P.G. et Knaap, A.G. (1973), Mutagenecity tests with captan and folpet in Drosophila melanogaster. Mutation Research/Environmental Mutagenesis and Related Subjects, 21(3), 149-154. (résumé)
- Guo YL, Wang Bj, Lee CC, Wang JD (1996), Prevalence of dermatoses and skin sensitisation associated with use of pesticides in fruit farmers of thoutherne Taiwan'Texte en italique. Occup; Environ Med. 53 (6):427-31
- Marik Ka, Brancaccio R.R., Soter Na et Cohen De (), Allertic contact and phtoallergic contact dermatitis to plant and pesticide allergens, Arch. Dermatol. 1999 ; 135 (1):67-70
- Voir p. 1380 du rapport de réévalation déjà cité : Peer review of the pesticide risk asse ssment of the active substance folpet de 2009.
- Voir le tableau intitulé Processing factors (Annex IIA, point 6.5, Annex IIIA, point 8.4), p. 57/80 de l'étude de réévaluation de l'EFSA (2009)
- Commission européenne (2001) Guide relatif à la Dose de référence en Europe 05/07/2001 ;
- EFSA (2009), Conclusion on the peer review of folpet EFSA Scientific Report (2009) 297, 51-80, voir p. 53/80 du [PDF] (section Acceptable exposure scenarios (including method of calculation))
- Cabras, P., Angioni, A., Caboni, P., Garau, V. L., Melis, M., Pirisi, F. M. et Cabitza, F. (2000), Distribution of folpet on the grape surface after treatment. Journal of agricultural and food chemistry, 48(3), 915-916. DOI:10.1021/jf990069u (résumé)
- Al Rashidi, M., Chakir, A. et Roth, E. (2014), Heterogeneous oxidation of folpet and dimethomorph by OH radicals: A kinetic and mechanistic study, Atmospheric Environment, 82, 164-171 (résumé).
- Cabras, P., Angioni, A., Garau, V. L., Melis, M., Pirisi, F. M., Farris, G. A., … et Minelli, E. V. (1997), Persistence and metabolism of folpet in grapes and wine, Journal of Agricultural and Food Chemistry, 45(2), 476-479 (résumé).
- Martins, G., Miot-Sertier, C., Lauga, B., Claisse, O., Lonvaud-Funel, A., Soulas, G. et Masneuf-Pomarède, I. (2012), Grape berry bacterial microbiota: impact of the ripening process and the farming system. International journal of food microbiology, 158(2), 93-100 (résumé).
- Voir p. 77-80 de l'étude réévaluation par l'EFSA en 2009)
- Zhang, Y. et Zhang, G. (2014), Spectroscopic and Chemometrics Analysis of the Hydrolytic Process of Folpet and Its Interaction with DNA, Journal of Solution Chemistry, 43(8), 1388-1401 (résumé.
- State Key Laboratory of Food Science and Technology, Nanchang University
- Commission européenne (2006), Review report for the active substance Folpet, 29 septembre 2006 (sur le site de l'AESA)
- (nl) Richtlijn 2007/5/EG van de Commissie van 7 februari 2007 tot wijziging van Richtlijn 91/414/EEG van de Raad teneinde captan, folpet, formetanaat en methiocarb op te nemen als werkzame stoffen, 8 février 2007
- Merdassa, Y., Liu, J. F. et Megersa, N. (2014), Development of a one-step microwave-assisted extraction procedure for highly efficient extraction of multiclass fungicides in soils. Analytical Methods, 6(9), 3025-3033.
- EFSA (2009), Conclusion on the peer review of folpet, EFSA Scientific Report (2009) 297, 51-80, voir p. 12/80 du [PDF], chap. 2.9. Medical data
- source : étude épidémiologique, relayée par Le Parisien, commandée par Jean-Pierre Manceau, ancien maire de la commune, qui s'inquiétait de la multiplication de cancers chez les enfants à Preignac. De 1990 à 2012, neuf cas de cancers - dont six pouvant être liés à une exposition aux pesticides - ont été détectés sur les 2.595 enfants de Preignac et des communes environnantes. Ce taux est très supérieur à la moyenne nationale.
Voir aussi
Articles connexes
- Phtalimide (sous-produit de dégradation)
- Acide phtalique (sous-produit de dégradation)
- Pesticide
- Surfactant
- Liste des pesticides autorisés par l'Union européenne
- Liste des pesticides interdits dans l'Union européenne
Lien externe
IPCS (2004-2012), Fiche de sécurité internationale du Folpet, ICSC:0156 (dans les archives du Net) et Fiche actuelle, rédigée dans le cadre de la coopération entre l'International Programme on Chemical Safety et la Commission européenne (mise à jour en 2012).
Bibliographie
- Al Rashidi M.J., Chakir A., Roth E. (2013), Heterogeneous ozonolysis of folpet and dimethomorph: a kinetic and mechanistic study, J. Phys. Chem. A., 11 avril 2013, 117(14):2908-15, DOI 10.1021/jp3114896, Epub 27 mars 2013,
- Richtlijn 2007/5/EG van de Commissie van 7 februari 2007 tot wijziging van Richtlijn 91/414/EEG van de Raad teneinde captan, folpet, formetanaat en methiocarb op te nemen als werkzame stoffen, Publicatieblad L35 van 8 februari 2007, blz. 11.
- Salau J.S., Alonso R., Batlló G. et Barceló D. (1994), Application of solid-phase disk extraction followed by gas and liquid chromatography for the simultaneous determination of the fungicides: captan, captafol, carbendazim, chlorothalonil, ethirimol, folpet, metalaxyl and vinclozolin in environmental waters, Analytica Chimica Acta, 293(1), 109-117 (résumé).
- Siegel M.R. (1971), Reactions of the fungicide folpet (N-(trichloromethylthio) phthalimide) with a thiol protein, Pesticide Biochemistry and Physiology, 1(2), 225-233 (résumé).
- Teisseire H., Couderchet M. et Vernet G. (1998), Toxic Responses and Catalase Activity ofLemna minorL. Exposed to Folpet, Copper, and Their Combination, Ecotoxicology and environmental safety, 40(3), 194-200 (résumé).
- Teisseire H., Couderchet M. et Vernet G. (1999), Phytotoxicity of diuron alone and in combination with copper or folpet on duckweed (Lemna minor), Environmental Pollution, 106(1), 39-45 (résumé).
- Zang X., Wang J., Wang O., Wang M., Ma J., Xi G. et Wang Z. (2008), Analysis of captan, folpet, and captafol in apples by dispersive liquid–liquid microextraction combined with gas chromatography, Analytical and bioanalytical chemistry, 392(4), 749-754 (https://link.springer.com/article/10.1007/s00216-008-2296-1 résumé]).