Explosion cambrienne
L’explosion cambrienne (il y a entre 541 et 530 millions d'années) désigne l'apparition soudaine – à l'échelle géologique – de la plupart des grands embranchements actuels de métazoaires (animaux pluricellulaires)[1] ainsi que de quelques autres, disparus entre-temps, initiant ainsi une grande diversification des classes et des espèces animales, végétales et bactériennes. Certains auteurs[2] n'hésitent pas à parler de « big bang zoologique au Cambrien », avec l'apparition en quelques dizaines de millions d'années de la quasi-totalité des grands plans d'organisation connus actuellement (Annélides, Mollusques, Échinodermes, Chordés, etc.)[3].
Cette « explosion » fut révélée par les fossiles conservés dans les schistes de Burgess au Canada. Ce site découvert en 1909 a révélé un biotope marin riche en espèces, mais dont les restes n'ont été correctement analysés que plus de cinquante ans après.
Les raisons de cette apparition soudaine restent encore peu connues à cause du faible nombre de fossiles. L'explosion cambrienne a été précédée par un phénomène similaire, mais moins important : la diversification édiacarienne ; avant ces deux phénomènes, la plupart des organismes étaient simples et composés de cellules individuelles, parfois regroupées sous forme de colonies[4].
Histoire et importance

.png.webp)

Dès Buckland (1784-1856), les scientifiques avaient remarqué l'apparition rapide de fossiles à l'époque cambrienne[5]. Charles Darwin considérait d'ailleurs cela comme l'un des principaux points faibles de sa théorie de la sélection naturelle[6]. En effet, à son époque, ces animaux semblaient sortir de nulle part et il consacra à ce problème un chapitre entier de son ouvrage L'Origine des espèces. Le paléontologue américain Charles Walcott supposa alors qu'un intervalle de temps géologique qu'il appela « Lipalien » n'avait pas encore été découvert et que c'est durant cette période que les « ancêtres » des animaux du Cambrien s'étaient développés[7].
On sait aujourd'hui que les premières formes de vie sont apparues il y 3 450 millions d'années[8] d'après l'étude des roches de Warrawoona en Australie. Celles-ci renfermaient des stromatolithes : des formations sédimentaires dues aux colonies de micro-organismes. En 2010, des fossiles sont découverts au Gabon. Il s'agit d'un ensemble de fossiles d'organismes pluricellulaires macroscopiques, appelés Gaboniontes, trouvés dans une couche géologique datée de 2 100 millions d'années[9] - [10]. Les roches plus jeunes, datant de 565 à 543 millions d'années, contiennent des fossiles des premiers organismes de taille métrique, appelés « Édiacariens » ou parfois « animaux pneumatiques ». On ignore si les lacunes fossilifères entre les Gaboniontes, la faune de l'Édiacarien et l'explosion cambrienne sont dues simplement à la non-conservation ou la non-découverte de fossiles, ou bien si elles signifient qu'entre ces trois diversifications, les espèces pluricellulaires ont disparu faute de conditions de vie favorables[11].
En 1909, Walcott découvre dans des schistes près du Mont Burgess au Canada, des fossiles datant du Cambrien. Il y retourna jusqu'à sa mort en 1924 et excava plus de 65 000 spécimens de 120 espèces différentes. Le schiste étant un type de roche sédimentaire formé de particules fines d’argile et de limon, les fossiles sont très bien conservés et permettent de distinguer la plupart des détails des organismes. Malgré leur aspect surprenant et novateur, Walcott chercha, comme c'était la règle à l'époque, à ranger ces espèces dans la classification existante, sans vraiment en comprendre la complexité. Ainsi, les organismes découverts restèrent au stade de curiosité jusque dans les années 1960 lorsqu'une nouvelle génération de scientifiques menée par Whittington réalise que les fossiles découverts représentent une faune beaucoup plus diversifiée et originale que ne l'avait pensé Walcott[12] - [13].
L'organisme le plus courant des schistes de Burgess, Marrella, est clairement un arthropode mais n'appartient à aucune des classes d'arthropodes connues. Opabinia est le premier animal inhabituel à avoir été complètement décrit lors de la redécouverte des fossiles dans les années 1970. Initialement classé parmi les arthropodes, Whittington démontre qu'Opabinia n'appartient à aucun embranchement connu. Cet organisme et bien d'autres comme Wiwaxia ou Yohoia ne ressemblent à aucun animal existant aujourd'hui. Dans son ouvrage, La vie est belle : les surprises de l'évolution[14], Stephen Jay Gould révèle au public l'existence de l'explosion cambrienne et les problèmes qu'elle soulève. En effet, Whittington et Gould proposent que tous les embranchements biologiques sont apparus soudainement il y a 535 millions d'années et que la plupart des formes de vie animales actuelles ne sont que des variations des organismes de cette époque. Cette vue est influencée par la théorie des équilibres ponctués qui voit l'évolution comme une suite de longues phases de stagnation "ponctuées" par de brèves périodes de changements rapides[15].
Cependant, la faune de l'Édiacarien montre que la vie avant l'explosion cambrienne n'était pas uniquement constituée d'organismes unicellulaires.
Preuves de l'explosion
Étudier des événements datant d'environ un demi-milliard d'années est un exercice difficile car les seuls indices sont des traces biologiques et chimiques dans les roches et de rares fossiles.
Datation du Cambrien
La datation absolue par radioactivité est obtenue en étudiant la proportion de radioisotopes dans les roches. Cette méthode n'est devenue relativement précise qu'il y a peu de temps et n'a encore été utilisée que dans peu de régions[16].
La datation relative (A était là avant B) est souvent suffisante pour étudier les processus évolutifs mais il est souvent difficile de trouver des roches datant de la même époque sur différents continents[17].
Par conséquent la succession d'événements doit être prise avec précaution jusqu'à ce que des données plus fiables soient disponibles.
Fossiles

Les fossiles des organismes sont souvent les sources d'informations les plus importantes. La fossilisation est un événement très rare et de nombreux fossiles sont détruits par l'érosion ou le métamorphisme avant d'avoir été étudiés. Par conséquent, les restes fossiles sont d'autant plus rares qu'ils sont anciens. Ils permettent cependant de connaitre les grandes lignes de l'histoire de la vie. Il existe également des biais dans les traces fossiles. Certains environnements sont beaucoup plus propices à la fossilisation que d'autres[19]. De plus, seules les parties déjà minéralisées des organismes comme les coquilles des mollusques ou les os des vertébrés sont généralement conservées. Les parties molles sont souvent décomposées avant d'avoir été fossilisés.
Les fossiles du Cambrien sont quasiment tous issus de lagerstättes qui préservent les tissus mous et permettent aux paléontologues d'étudier l'anatomie interne des animaux y compris les parties disparues sur les spécimens issus d'autres roches. Les principaux lagerstättes du Cambrien sont ceux de Maotianshan et de Qingjiang[20] en Chine, d'Emu Bay en Australie, de Sirius Passet au Groenland et d'Öland en Suède. Bien que les lagerstättes aient préservé bien plus de fossiles que les autres roches, ils sont loin d'être suffisants. Les lagerstätte sont limités à quelques environnements (ceux où les organismes mous sont rapidement ensevelis comme lors de glissements de terrain) et de nombreuses espèces ne sont sans doute pas représentées.
Les corps fossilisés ne sont pas les seules traces biologiques des organismes. Ceux ci ont laissé des traces comme des sillons, des terriers ou des coprolithes (excréments fossilisés). Ces traces permettent d'approfondir notre connaissance du comportement des organismes et sont souvent découvertes avant l'organisme qui les a créés.
Études géochimiques
De nombreux marqueurs chimiques indiquent un changement radical dans l'environnement au début du Cambrien et sont cohérents avec une extinction de masse[21] ou avec un réchauffement massif dû à un largage massif d'hydrate de méthane qui peuvent être l'une des causes de l'explosion.
Techniques phylogénétiques
La cladistique est une technique permettant de dessiner l'"arbre généalogique" d'une famille d'organismes. Cette méthode repose sur le fait que si les groupes B et C ont plus de points communs entre eux qu'avec le groupe A alors B et C sont plus proches l'un de l'autre que de A. Les caractéristiques comparées peuvent être anatomiques, comme la présence de notochorde ou moléculaires en comparant les séquences d'ADN ou les protéines. Finalement, on obtient une hiérarchie de clades qui sont des groupes dont les membres ont probablement un ancêtre commun. Cette technique n'est pas parfaite car certaines caractéristiques comme les ailes ou l'œil évoluent en plusieurs étapes. La convergence évolutive doit également être prise en compte.
À l'aide de ces relations, il est possible d'obtenir la date d'apparition de la lignée. Par exemple, si les fossiles B ou C datent de X millions d'années et si selon l'« arbre généalogique » A est un ancêtre de B ou C alors A doit être apparu il y a plus de X millions d'années.
Il est également possible d'estimer la durée séparant la divergence entre deux clades en supposant que les mutations génétiques s'accumulent à un rythme constant. Ces « horloges moléculaires » sont cependant peu précises et ne permettent pas d'estimer à quel moment a commencé l'explosion cambrienne. Cependant, elles permettent de dire qu'une période de forte diversification a eu lieu lors de l'Ediacarien et du Cambrien[22].
Horloge moléculaire
L'horloge moléculaire est une méthode utilisée afin de déterminer à quel moment une dichotomie évolutive est apparue. En effet, l'idée principale de cette méthode est qu'un gène donné développe des mutations à un rythme constant. Ainsi, en comparant le même gène entre deux clades, il est possible d'inférer le moment où la séparation de ceux-ci s'est faite. Cependant, ces études n'étaient pas très crédibles, car il a été démontré que les gènes n'évoluent pas tous au même taux. Ainsi, les nouvelles études doivent tenir compte de cette hétérogénéité des taux d'évolution des gènes afin de mieux inférer les dates d'apparitions des nouveaux embranchements. Par contre, la prise en compte de cette nouvelle notion infirme l'hypothèse de l'explosion du Cambrien, où la majorité des embranchements serait apparue dans un intervalle d'environ 20 millions d'années. En effet, elle montre que plusieurs embranchements existaient avant le Cambrien (Mollusca, Annelida, Cnidaria, Echindermata)[23]. L'absence de ces organismes dans les registres fossiles pré-cambrien serait expliquée par le fait que ces animaux auraient été trop petits et dotés d'un corps trop mou. De plus, ce serait seulement au Cambrien que les sédiments auraient permis la fossilisation d'organismes, ce qui explique la faible représentation animale de l'Édiacarien. Cependant, puisque l'estimation des différents taux d'évolution des gènes est quelque chose d'assez récent, les incertitudes quant aux intervalles où les dichotomies ont pu subvenir sont encore grandes, ce qui les rend plus permissives.
Explication de quelques termes scientifiques
Un embranchement est le niveau le plus élevé de la classification classique. Cette classification repose sur un système hiérarchique. Les organismes sont rassemblés au sein de groupes selon leurs caractéristiques morphologiques et les groupes créés sont ensuite regroupés par similarités jusqu'à obtenir une hiérarchie. Cependant, cette classification par formes reflétait mal la diversité des organismes. Malgré leurs différences évidentes, les araignées et les balanes appartiennent tous deux à l'embranchement des arthropodes, en revanche les lombrics et les ténias bien que d'apparence similaire appartiennent à deux embranchements différents. Cette classification en embranchements ne caractérise pas une division fondamentale de la nature mais est un groupe de haut niveau de la classification classique permettant de décrire tous les organismes vivants. Cette classification est imparfaite même pour les espèces existantes ainsi les spécialistes sont rarement d'accord sur la liste d'embranchements en particulier dans le cas des espèces de vers. De plus, elle est basée sur les espèces vivantes et accepte mal l'ajout d'espèces disparues[24]. Cela est montré par la volonté de Walcott de faire rentrer les fossiles de Burgess dans les cases déjà existantes malgré de profondes différences.
Le concept de groupe-couronne fut introduit pour couvrir l'évolution des « cousins » des groupes vivants. Un groupe-couronne est un groupe contenant tous les organismes vivants du groupe, leur plus proche ancêtre commun, et tous les groupes aujourd'hui disparus relevant de cet ancêtre. Un groupe-souche rassemble les ramifications antérieures à l'ancêtre commun du groupe-couronne. Par exemple, les tardigrades sont des animaux existants actuellement et possèdent leur propre groupe-couronne mais Budd les considère comme un groupe-souche de celui des arthropodes[25] - [26].
Les triploblastiques sont des animaux dont l'embryon s'organise en trois feuillets embryonnaires. Chacun de ces feuillets a pour rôle de former les organes du futur individu. Le feuillet interne produit l'appareil digestif, le feuillet extérieur forme la peau ou la carapace et le système nerveux. Le feuillet intermédiaire produit les muscles et les organes internes à l'exception du système digestif et le squelette pour les vertébrés. La plupart des animaux sont triploblastiques mais les éponges et les méduses sont diploblastiques et ne possèdent pas de feuillet intermédiaire.
Les bilatériens sont des animaux possédant une symétrie bilatérale (avant/arrière et droite/gauche) à la différence des radiaires qui possèdent une symétrie radiale (en forme de roue). Tous les animaux triploblastiques connus sont bilatériens et inversement. Les échinodermes vivants (étoiles de mer, oursins ou Holothuries…) semblent avoir une symétrie radiale néanmoins leurs larves possèdent une symétrie bilatérale et les plus anciens échinodermes semblent avoir été bilatériens[27]. Les méduses et les éponges sont des radiaires diploblastiques.
Les cœlomates sont des triploblastiques possédant une cavité interne (cœlome). Ce taxon est obsolète mais permet de décrire les animaux. La plupart des embranchements issus de l'explosion cambrienne sont des cœlomates, les priapulidas sont l'une des principales exceptions. Tous les cœlomates sont des triploblastiques mais l'inverse est faux car les vers plats sont des triploblastiques mais n'ont pas de cœlome.
Vie précambrienne
Notre compréhension de l'explosion cambrienne repose sur la connaissance de ce qu'il y avait avant.
Preuve de l'existence d'animaux il y a un milliard d'années
- Pour plus d'informations, voir Acritarche et Stromatolithe


Les stromatolithes sont des roches formées par l'accumulation de couches minérales formées par des colonies de bactéries. Ceux-ci existaient déjà il y a 3,5 milliards d'années, cependant leur abondance a fortement diminué il y a 1,25 milliard d'années. Ce déclin est généralement attribué à l'apparition de la prédation avec des animaux rongeurs ou foreurs[28] - [29] - [30].
La vie marine précambrienne était dominée par de petits organismes connus sous le nom d'acritarches. Ce terme, dérivant du grec akritos (incertain ou confus) et de arche (ce qui est premier; principe, origine), désigne tous les petits organismes à coquille calcaire vivant dans les océans précambriens. Les acritarches regroupent cependant des organismes très variés, depuis des petits animaux à des spores d'algues vertes, qui apparaissent il y a environ 2 milliards d'années et connaissent un boom il y a 1 milliard d'années. Ce boom pourrait indiquer un besoin croissant de défense contre les prédateurs. Cependant, le rythme d'évolution au cours du Précambrien était très lent et de nombreuses espèces d'algues bleues restèrent inchangées durant des millions d'années[31]. Si ces organismes prédateurs étaient réellement des animaux, cela signifie que ceux du Cambrien n'ont pas surgi du néant ; leurs ancêtres existaient déjà plusieurs centaines de millions d'années auparavant.
Fossiles de la formation de Doushantuo
La Formation de Doushantuo âgée de 580 millions d'années dans le sud de la Chine abrite des micro-fossiles qui pourraient être les premiers représentants des bilatériens[32]. Certains ont été décrits comme des embryons d'animaux ou des œufs bien qu'ils puissent représenter les restes d'une bactérie géante[33] - [34] - [35]. Un autre fossile, Vernanimalcula a été décrit comme un cœlomate bilatérien[36] mais cette analyse reste très controversée et pourrait simplement être une bulle pleine[37].
La révolution agronomique

Des traces d'organismes se déplaçant sur et sous le biofilm microbien qui recouvrait les fonds marins de l'Édiacarien ont été découvertes et remontaient à environ 565 millions d'années. Ces traces ont été réalisées par des organismes semblables à des vers qui se nourrissaient des micro-organismes du biofilm. Ces creuseurs n'ont pas encore été découverts mais comme ils avaient besoin d'une tête et d'une queue, ils possédaient probablement une symétrie bilatérale et étaient donc des bilatériens[38]. C'est dans cet environnement que vivait la faune de l'Édiacarien.
Au début de la période cambrienne (il y a environ 541 millions d'années), de nouvelles traces apparaissent dont des terriers verticaux à travers le substrat sous le biofilm et des traces attribuées à des arthropodes. Les terriers verticaux indiquent que les organismes ressemblant à des vers ont acquis un nouveau comportement et probablement de nouvelles capacités mécaniques. Certaines traces indiquent que les creuseurs possédaient un exosquelette non nécessairement minéralisé[39].
Les terriers indiquent avec certitude l'existence d'organismes complexes. La raison de ces terriers est probablement défensive du fait de l'apparition de la prédation au début du Cambrien. Le creusement de ces terriers a provoqué une véritable révolution car en remuant les fonds marins, celui-ci est devenu plus habitable et un grand nombre d'organismes ont pu coloniser ce nouveau milieu. De même, l'apparition d'animaux "brouteurs" comme Spriggina ont progressivement décimé le biofilm qui recouvrait le fond des océans, ce qui a probablement provoqué la disparition de la faune de l'Édiacarien.
Faune de l'Édiacarien

Au début de l'Édiacarien, il y a 630 millions d'années, la plupart des acritarches qui n'avaient pratiquement pas évolué durant des centaines de millions d'années disparurent et furent remplacés par de nouvelles espèces plus grandes[31]. Cette radiation, la plus ancienne connue à ce jour[31] donne naissance à l'étrange faune de l'Édiacarien[40] qui se développe durant 40 millions d'années jusqu'au commencement du Cambrien[41]. Ces organismes mesurent quelques centimètres et sont bien plus imposants que les spécimens antérieurs.
La plupart de ces organismes en forme de disques mous ne possédaient ni tête, ni queue, ni membres, ni même une bouche ou organes digestifs et ne semblent correspondre à aucune autre espèce ayant existé avant ou après eux. Ceci amena le paléontologue Adolf Seilacher à proposer de classifier ces étranges organismes dans un règne séparé, les Vendozoaires, ou de les rattacher au règne animal dans un embranchement spécifique, classifications désormais obsolètes[42] - [43]. Ces organismes devaient probablement se nourrir en filtrant l'eau à la manière des éponges.
Certains organismes ont été identifiés comme pouvant être à l'origine des embranchements de l'explosion cambrienne comme les premiers mollusques (Kimberella)[44] - [45], échinodermes (Arkarua)[46] ou arthropodes (Spriggina[47], Parvancorina[48]). La classification de ces spécimens reste cependant encore sujet à débats car les caractéristiques permettant de classifier les espèces plus récentes sont absentes chez les organismes de la faune de l'Ediacarien[49]. Ces spécimens jouent un rôle majeur dans la question de l'importance et de la soudaineté de l'explosion cambrienne. Si certains sont les premiers représentants des embranchements animaux actuels, l'explosion semble beaucoup moins soudaine que si ces organismes n'étaient qu'une « expérience ratée » n'ayant débouché sur rien.
Vie cambrienne
Les connaissances actuelles sur la vie au Cambrien sont basées sur l'étude des lagerstätte de l'époque. Les schistes de Burgess au Canada ont été les premiers découverts en 1909. Ceux-ci sont âgés de 505 millions d'années et correspondent à la fin de l'explosion cambrienne. Par la suite d'autres sites plus anciens ont été découverts et le plus important d'entre eux est probablement celui des schistes de Maotianshan découvert en 1984 en Chine. Ceux-ci sont âgés de 520 millions d'années et se trouvent donc au milieu de l'explosion cambrienne. Les schistes d'Emu Bay en Australie et de Kaili en Chine sont situés entre ces deux dates. La faune du Cambrien apparait extraordinairement diversifiée et la dispersion des sites fossiles montre qu'elle existait dans une grande partie des océans de l'époque.
Les fossiles connus sous le nom de « petits fossiles coquilliers » ont été retrouvés dans de nombreuses parties du monde et existaient au début du Cambrien. Ils regroupent une grande variété de spécimens allant des archaeocyatha (sorte d'éponges) à des petits coquillages comme les brachiopodes ou des mollusques en forme d'escargot pouvant posséder des épines ou des sclérites. Néanmoins, ces animaux étaient minuscules, les éponges pouvaient atteindre plusieurs centimètres mais les mollusques ne dépassaient pas quelques millimètres[50]. Les embranchements actuels apparaissent à cette période. Sanctacaris et Sidneyia appartiennent au groupe des arthropodes. De même que les trilobites apparus il y a 530 millions d'années. Les premiers échinodermes apparurent un peu plus tard, il y a 520 millions d'années. À la différence des échinodermes actuels, ceux-ci ne présentaient pas tous une symétrie radiale[51]. On retrouve également des ancêtres des onychophores et des priapuliens et de très nombreuses éponges. Des méduses au stade de polype ont également été découverts. Haikouichthys descendant de Pikaia est considéré comme le premier vertébré et le plus ancien poisson connu.
Néanmoins, de nombreux fossiles causèrent de nombreux problèmes aux paléontologues. Ainsi Marrella, pourtant le spécimen le plus répandu dans les schistes de Burgess fut successivement classé parmi les crustacés, les trilobites et les branchiopodes avant que Whittington ne le classe dans un groupe spécifique d'arthropodes. De même Opabinia semblait tellement étrange que l'audience rit lors la présentation de son analyse par Whittington[52].

Opabinia fut alors retiré de l'embranchement des arthropodes et placé dans un embranchement spécifique. Hallucigenia est un autre exemple de mauvaise interprétation. Il fut décrit par Walcott en 1909 qui lui donna ce nom à cause des « qualités étranges et fantaisistes semblant sorties d'un rêve » de cet animal. La description faite à l'époque était très peu satisfaisante mais elle était néanmoins la plus convaincante. Les fossiles issus des schistes de Maotianshan encore mieux conservés que ceux de Burgess permirent d'affiner la description de nombreux spécimens, ainsi Hallucigenia fut rapproché des onychophore. Cependant, cette analyse reste controversée et il se pourrait qu'Hallucigenia ne soit qu'une partie d'un animal plus imposant. Ainsi, la bouche fossilisée d'Anomalocaris fut d'abord considérée comme une méduse, ses appendices buccaux comme des crevettes et son corps comme un concombre de mer, il faudra attendre les années 1980 pour que ces différentes parties soient rassemblées au sein d'un même animal.
À la différence des animaux plus anciens, ceux du Cambrien sont bien plus imposants et atteignant couramment plusieurs centimètres. Les 80 centimètres de l'Anomalocaris en font un véritable géant des mers cambriennes. On peut remarquer l'apparition d'une véritable chaine alimentaire, ainsi Haplophrentis servait de nourriture au ver Ottoia qui était probablement chassé par Opabinia, lui-même servant de proie à l'énorme Anomalocaris au sommet de cette chaine.

Récemment, une espèce semblable à Anomalocaris a été découverte dans les schistes de Burgess situés en Colombie Britannique. Cette espèce ayant des caractéristiques morphologiques telles qu'elle fut d'abord considérée comme différentes espèces fossilisées proches l'une de l'autre, se nomme Hurdia. Contrairement à Anomalocaris, Hurdia peut atteindre jusqu'à 20 cm, ce qui est beaucoup plus petit que son voisin phylogénétique qui lui peut atteindre 80 cm, les positionnant tout de même parmi les plus grands prédateurs du Cambrien. De plus, cette espèce possédait des plus petits et moins robustes appendices que son rival. Le trait le plus intéressant de ce nouveau spécimen est la présence d'une plaque relativement dure sur la partie supérieure de la tête pouvant atteindre près de la moitié de la taille de l'individu. Hurdia était probablement nectobenthique, c'est-à-dire qu'elle nageait dans les fonds marins, mais qu'elle pouvait aussi s'éloigner du fond vers la colonne d'eau. Cette adaptation est probablement survenue à la suite de la colonisation de la colonne d'eau par les proies, qui voulaient s'échapper des prédateurs benthiques. D'un point de vue phylogénétique, Hurdia et Anomalocaris font partie du groupe maintenant éteint Euarthropoda qui est le groupe frère de tous les arthropodes. Plus précisément, les analyses phylogénétiques démontrent que Hurdia est le groupe frère du clade composé des deux anomalocarides Anomalocaris et Laggania, rendant la nouvelle espèce plus basale. Le trait morphologique le plus convaincant concernant la position de ces espèces comme étant le clade frère des arthropodes est la présence de branchies en lanières. Cette structure est un ensemble de plusieurs branchies filamenteuses toutes rattachées à une structure rigide en forme de demi-cercle. En effet, ces branchies sont considérées homologues aux structures respiratoires des pattes des arthropodes du Cambrien (Crustacea et Chelicerata)[53]. Pour cela, il faut comparer la patte des arthropodes du Cambrien aux pattes biramées (crustacés modernes). En effet, la patte des arthropodes du Cambrien est en fait la fusion d'une patte uniramée et de l'appareil respiratoire, qui serait dérivé des branchies en lanières des euarthropodes. D'un autre côté, la patte biramée provient de la division de la patte principale. La patte biramée serait donc apparue par après. Ainsi, cette homologie avec la patte des espèces présentes au Cambrien renforce l'argument que les euarthropodes dont font partie les anomalocarides sont le groupe frère des arthropodes.
La faune du Cambrien fut décimée par une extinction importante marquant le début de l'Ordovicien, il y a environ 485 Ma (millions d'années). Cette extinction a probablement été causée par une diminution de la teneur en oxygène de l'eau liée à un refroidissement global. Lors de l'Ordovicien, la diversité augmente fortement avec un doublement du nombre d'ordres et un triplement de celui des familles lors de la phase de Grande biodiversification ordovicienne[54].
Hemichordata
Le groupe des hémichordés est positionné parmi les deutérostomes, avec les échinodermes et les chordés. Les hémichordés forment le groupe frère des échinodermes, qui a eux deux forment le groupe Ambulacria, qui lui est le groupe frère des chordés. Chez Ambulacria, les deux groupes se distinguent par la perte des fentes branchiales chez Echinodermata. De nos jours, on retrouve deux classes existantes chez les hémichordés, soit les entéropneustes et les ptérobranches. Les entéropneustes sont vermiformes et davantage solitaires alors que les ptérobranches sont coloniaux et sont fixés au substrat par un tube de chitine. Le corps des entéropneustes peut être divisé en trois parties : le proboscis, le collet et le tronc. Le proboscis sert généralement à creuser son tunnel et le tronc contient l'intestin et peut s'allonger au fur et à mesure de la croissance de l'organisme[55]. Puisque ces espèces creusent des tunnels et sécrètent un mucus servant à protéger leur corps fragile et à retenir les sédiments, leur mode d'alimentation consiste à se nourrir des sédiments et d'en assimiler les éléments nutritifs. Chez les ptérobranches, on retrouve aussi le corps tripartite des entéropneustes, mais ces espèces sont sessiles, coloniales et se nourrissent en filtrant l'eau. Cependant, le collet des ptérobranches est hautement modifié pour porter plusieurs tentacules servant à l'alimentation.

D'un point de vue paléontologique, les entéropneustes sont beaucoup moins représentés en raison de leur difficulté à être fossilisés causée par l'absence de chitine. Ainsi, la phylogénie n'est pas tout à fait résolue. Par contre, la récente découverte d'un entéropneuste vivant dans un tube qu'il sécrète permet de tirer des nouvelles conclusions. En effet, l'entéropneuste primitif Oesia disjuncta construisait des tubes de chitine parfois divisés en branches possédant des pores. Le plus intéressant est l'absence de sédiments retrouvés dans l'intestin, ce qui suggère un mode d'alimentation davantage filtreur que sédimentaire. Par contre, les entéropneustes actuels se nourrissent des sédiments. Il y a donc eu un changement majeur dans leur alimentation, mais qui a été conservée chez les ptérobranches. Cette espèce possédait une grande distribution dans la carrière où elle a été trouvée, ce qui lui confère un rôle assez important dans la faune cambrienne. Le tube que créait cet organisme contenait des pores et était construit par le proboscis. Le rôle de ces pores était probablement d'oxygéner l'intérieur du tube et de faciliter l'alimentation de l'individu en permettant une bonne entrée d'eau pour la filtration. Les relevés fossiles démontrent qu'il y avait généralement un seul individu par tube, favorisant donc un mode de vie solitaire. De plus, le tube était souvent divisé en branches, dont le rôle était probablement de favoriser la fuite de l'individu en cas de prédation.
Il est cependant difficile de déterminer quelle est la place de cette espèce dans la phylogénie des hémichordés. En effet, est-il à la base des entéropneustes, des ptérobranches, ou plus basalement encore? Par contre, quelques indices peuvent nous pointer vers la bonne réponse. L'arrangement des fentes branchiales de Oesia disjuncta et leur présence chez les entéropneustes dérivés actuels semblent démontrer que le mode d'alimentation d'origine était celui de la filtration, même si ces derniers se nourrissent maintenant des sédiments. Ce changement important peut être expliqué par une augmentation dans la pression de prédation. En effet, les entéropneustes, en voyant leur prédation augmenter, on dû délaisser leurs tubes et se réfugier dans les sédiments. D'un autre côté, Oesia possède une queue dont le rôle aurait probablement été celui de l'attachement. Puisque les ptérobranches possèdent aussi une structure homologue leur permettant d'être fixes et donc de former des colonies, il semblerait plus logique de placer Oesia comme leur ancêtre.
Donc, Oesia disjuncta est en fait un mélange de caractères propres à la fois aux entéropneustes et au ptérobranches. En effet, il partage avec les ptérobranches l'alimentation par la filtration, un mode de vie sessile, un tube pour être fixé au substrat et une queue servant à l'attachement. Du côté des entéropneustes, cette nouvelle espèce possède une morphologie vermiforme et un mode de vie solitaire. Ainsi, Oesia serait plutôt à la base de la dichotomie entre les ptérobranches et les entéropneustes. Les entéropneustes auraient perdu leur mode de vie tubicole et auraient développé une alimentation sédimentaire alors que les ptérobranches ont développé le mode de vie colonial par l'entremise de la queue fixatrice. Donc, la découverte de cette espèce laisse présager que le mode d'alimentation filtreur est en fait l'état plésiomorphique des hémichordés, ou même des deutérostomes en général et que l'alimentation par les sédiments a évolué par après. Cela propose aussi que les ptérobranches sont donc dérivés d'un ancêtre entéropneuste[57].
Causes possibles de l'explosion
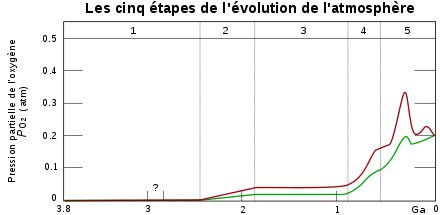
| Phase | Période (Ga) | Caractéristiques |
|---|---|---|
| 1 | 3,85–2,45 | Pas de production d'O2 |
| 2 | 2,45–1,85 | La production d'O2 est absorbée par les océans et les fonds marins |
| 3 | 1,85–0,85 | Les océans dégagent de l'O2 mais il est absorbé par les terres et la constitution de la couche d'ozone |
| 4 et 5 | 0,85–0,54 0,54–présent | Les puits d'O2 sont saturés et l'O2 s'accumule dans l'atmosphère |
Malgré les preuves que des animaux complexes (triploblastique bilatériens) existaient bien avant le début du Cambrien, il semble que le rythme de l'évolution fut extrêmement rapide au cours du Cambrien. Les explications de cette explosion sont classées en trois catégories : environnementales, liées au développement et écologiques
Accroissement du niveau d'oxygène
L'atmosphère originelle de la Terre ne contenait pas d'oxygène. L'oxygène actuellement présent dans l'air et dissous dans l'eau est le résultat de milliards d'années de photosynthèse. La concentration en oxygène de l'atmosphère augmenta progressivement au cours du Précambrien. Le manque d'oxygène pourrait avoir retardé l'apparition de grands animaux complexes. La quantité d'oxygène qu'un animal peut absorber est largement déterminée par la surface de ses organes respiratoires (poumons et branchies pour les plus évolués, la peau pour les autres). En revanche la quantité d'oxygène nécessaire dépend largement du volume de l'animal qui augmente plus rapidement que la surface des organes respiratoires si l'animal grossit. Un accroissement de la quantité d'oxygène dans l'eau a permis à des organismes de croitre sans que leurs organes ne soient en manque d'oxygène[58]. La consommation accrue d'oxygène répond aussi à la production de collagène nécessaire à la construction de structures complexes[59] tout comme de nombreuses molécules indispensables à la fabrication d'un exosquelette[60].
Terre boule de neige
À la fin du Protérozoïque (jusqu'au début de l'Édiacarien), la Terre subit une glaciation massive au cours de laquelle la totalité de la surface terrestre a pu être recouverte par la glace. Cela a entrainé une extinction massive et un goulot d'étranglement génétique qui aurait causé une sélection de parentèle. La diversification résultante aurait pu conduire à l'apparition de la faune de l'Édiacarien[61]. Cependant, il est difficile de confirmer cette théorie, et les épisodes de glaciation successifs auraient tout aussi bien pu retarder l'évolution sur une grande échelle[30]. Cependant, cette glaciation à l'échelle globale n'est pas tout à fait synchronisée avec l'apparition soudaine et massive des fossiles du Cambrien. En effet, la dernière de ces glaciations mondiale s'est produite il y a 635 millions d'années et la glaciation des Gaskiers (une glaciation partielle) il y a 580 millions d'années. Ces deux glaciations ne correspondent pas à la période charnière du Cambrien qui est estimée à environ 540 millions d'années. De plus, il est difficile d'imaginer qu'un événement provoquant l'extinction de la faune édiacarienne puisse provoquer l'apparition de la faune cambrienne. Par contre, en règle générale, une extinction permet de libérer les niches écologiques occupées et ainsi permettre à d'autres organismes d'évoluer pour venir combler ces niches. De plus, il est possible de relier cette hypothèse avec celle de l'augmentation de la concentration en oxygène. En effet, avec la fin de la glaciation, les océans ne sont donc plus recouvert de glace ce qui permet des échanges beaucoup plus fréquents et efficaces entre l'atmosphère et la surface de l'eau, augmentant ainsi la concentration en oxygène par diffusion. Cependant, il n'est pas clair pourquoi on retrouve des fossiles seulement après cette glaciation et non entre deux glaciations précédentes.
Mouvement des continents
Une autre hypothèse cherchant à expliquer l'énorme augmentation en diversité observée au Cambrien mais qui n'a toutefois pas été prouvée serait celle du mouvements des continents. En effet, la reconstitution des mouvements des différentes plaques tectoniques causés par la dérive des continents démontre des mouvements rapides de celles-ci dans les périodes géologiques pré-cambrienne. Les géologues affirment que de tels mouvements auraient relâché de grandes quantités de méthane dans l'eau et l'atmosphère. Ces émanations de méthane auraient alors eu pour cause d'augmenter la température des océans et causé une augmentation dans la diversité animale.
Explication liées au développement
Une série d'explications sont fondées sur la théorie que de petites modifications lors du développement de l'animal de l'embryon à l'état adulte pourraient causer des changements importants sur le spécimen à l'âge adulte. Les gènes HOX contrôlent par exemple le positionnement et le développement des différents organes dans une région précise. Par exemple, si un certain gène HOX est exprimé, la zone va se développer sous la forme d'un membre, si un autre est exprimé, la région peut devenir un œil. Ces gènes furent découverts dans les années 1980 mais l'idée avait été pressentie par Richard Goldschmidt dès les années 1940. Un tel système permet l'apparition d'un grand nombre de modifications corporelles à partir d'un nombre limité de gènes.
Origine bilatérienne
Les embranchements des animaux les plus basaux que l'on retrouve aujourd'hui sont généralement soit de symétrie radiale (les cnidaires ou bi-radiale chez les cténophores) ou encore asymétrique (les éponges). Cependant, c'est avec l'arrivée de la symétrie bilatérale que l'on voit une grande radiation des adaptations morphologiques dans le plan organisationnel des organismes. De plus, l'origine de la symétrie bilatérale coïncide avec la période attribuée à l'explosion du Cambrien. Donc, la grande diversité soudainement apparue au Cambrien serait en partie expliquée par l'évolution d'un plan bilatéral.
Cependant, pour pouvoir observer un tel changement dans le plan organisationnel, c'est qu'il y a nécessairement un changement dans un ou plusieurs gènes qui est en cause. Dans le cas de la symétrie bilatérale, il s'agit probablement d'un cas de duplication génique. La duplication génique est un mécanisme de duplication d'un gène suivi d'une divergence. Tout d'abord, la duplication d'un gène se produit lorsqu'il y a un crossing-over inégal entre les deux chromosomes. Ainsi, deux copies du même gène se retrouvent sur le même chromosome. Si cet échange n'est pas létal pour l'organisme, ce nouvel arrangement sera celui qui sera transmis aux autres générations. De plus, le fait de posséder deux copies du même gène sur le même chromosome rend l'évolution d'un nouveau trait plus facile. En effet, la première copie du gène servant à la fonction prévue pour ce gène, la deuxième copie est libre de développer des mutations et d'ainsi adopter une nouvelle fonction après plusieurs millions d'années de dérive et de mutations.
Un exemple de duplication génique serait celui du complexe de gène Hox. Le complexe Hox fait partie des gènes homéoboîtes et est donc responsable du développement des organismes. Plus précisément, il régule l'axe antéro-postérieur des animaux. La duplication de ce complexe a permis la formation d'un autre complexe appelé parahox, qui après plusieurs millions d'années d'évolution a adopté une nouvelle fonction, soit celle de régionaliser le tube digestif, permettant ainsi d'avoir une bouche et un anus, ce qui n'est pas le cas chez les animaux plus primitifs (les animaux comme les méduses ne possèdent qu'un seul orifice). En raison de cela, l'apparition du complexe parahox est estimée entre les lignées Cnidaria (méduses, anémones) et Bilateria (tous les animaux possédant la symétrie bilatérale).
Donc, la duplication de certains gènes aurait permis à ceux-ci d'adopter de nouvelles fonctions et d'éventuellement permettre une symétrie bilatérale, qui à son tour aurait ouvert de nouvelles niches écologiques (espèces fouisseuses, rampantes) ainsi permettant une grande radiation des embranchements déjà existant.
Canalisation des patrons de développement
Une autre hypothèse suggère qu'il est plus facile de développer de nouveaux plans organisationnels lorsque les organismes sont plus primitifs, ou que l'on les retrouve plus basalement dans l'histoire évolutive des animaux. Cela serait expliqué par le fait que plus nous progressons dans l'évolution, plus les nouveaux gènes doivent s'ajouter à une cascade de gène déjà existante, ce qui rend l'évolution de patrons de développement alternatifs beaucoup plus difficile que lorsque cette même mutation apparaît dans un embranchement moins dérivé. Donc, dans le cas de l'explosion du Cambrien, puisque la faune édiacarienne était une des premières faunes existantes, les cascades de gènes n'étaient pas très bien développées et probablement très simples, ce qui aurait rendu l'évolution de plusieurs patrons différents non seulement possible, mais surtout plus aisé que dans le cas d'embranchements beaucoup plus évolués comme les échinodermes ou encore les chordés.
Explications écologiques
Ces explications se concentrent sur les interactions entre les différents organismes. Certaines supposent des changements dans la chaine alimentaire, d'autres font appel à une course aux armements entre les prédateurs et les proies et d'autres suggèrent des mécanismes de coévolution.
D'un point de vue écologique, les chercheurs s'entendent pour dire qu'un des grands facteurs ayant permis la radiation du Cambrien est celui de la pression sélective exercée par la prédation. En effet, l'apparition de prédateurs a fait en sorte de favoriser un développement de certaines adaptations favorisant les proies. Par exemple, on observe une augmentation massive du nombre d'espèces ayant des éléments de squelette externe pour des fins de protection dans les registres de fossiles. Ainsi, on voit une tendance favorisant les animaux à squelette externe plutôt que les animaux à corps mou. De plus, les nouveaux embranchements semblent avoir envahi la colonne d'eau inversement à la faune édiacarienne qui était majoritairement benthique. Cette adaptation permettrait également de fuir la prédation élevée au niveau du sol marin.
De plus, le fait que la radiation du Cambrien n'a jamais été égalée par après peut être expliqué justement par son amplitude. En effet, tous les embranchement que l'on retrouve aujourd'hui à l'exception d'un seul ont fait leur apparition au Cambrien. Ainsi, une grande partie des niches écologiques disponibles a été comblée et il serait donc difficile d'imaginer un scénario où autant de nouvelles branches évolutives viendraient coloniser de nouveaux milieux en même temps. Ces niches ont été rendus disponibles par l'extinction massive de l'Édiacarien. L'extinction du Crétacé n'a pas eu le même effet sur les mammifères, car ceux-ci occupaient déjà en grande partie leur niche et la disparition des dinosaures non aviaires (entre autres) n'a permis qu'une augmentation de la taille des individus et quelques modifications des plans organisationnels[62]. Donc, l'aptitude à développer de nouveaux embranchements dépend des niches et des opportunités écologiques disponibles.
Extinction de masse de la fin de l'Édiacarien
Les preuves d'une telle extinction incluent la disparition des sources fossiles des organismes de la faune de l'Édiacarien et la modification du ratio 12C/13C due à un changement dans le réseau trophique. Les extinctions de masse sont souvent suivies par des radiations évolutives lorsque les groupes survivants occupent les niches écologiques laissées vacantes par les organismes disparus.
Évolution de l'œil
Le biologiste Andrew Parker suggéra que les relations entre les prédateurs et leurs proies avaient considérablement changé après l'amélioration de la vue. Avant cela, la chasse et la fuite se déroulaient à faible distance, l'odorat et le toucher étaient les seuls sens utilisés. Lorsque les prédateurs purent repérer leurs proies à distance, de nouvelles stratégies défensives devinrent nécessaires. Les carapaces, les épines et les autres systèmes de défense ont pu apparaître en réponse au développement de la vue. Il avança également que là où les animaux perdaient la vue dans des environnements non éclairés comme des grottes, la diversité des formes animales avait tendance à diminuer[63]. Néanmoins, de nombreux scientifiques doutent que la vision ait pu causer l'explosion à elle seule. En effet, d'autres sens comme l'odorat ou la détection des changements de pression permettent de repérer des proies aussi bien que la vue et leur apparition n'a semble-t-il pas causé d'explosion évolutionnaire.
Course aux armements
La capacité de résister à la prédation est un avantage décisif pour une espèce et est l'un des acteurs fondamentaux de la sélection naturelle. La pression adaptative est plus forte sur la proie que sur le prédateur : si le prédateur échoue, il perd un repas, si la proie échoue, elle perd la vie[64]. Cependant, il existe des preuves que la prédation existait déjà avant le Cambrien comme le nombre grandissant d'épines sur les acritarches, les trous dans les coquilles de Cloudina et des traces de forages pour échapper aux prédateurs. Ainsi, il est improbable que l'« apparition » de la prédation soit l'un des éléments déclencheurs de l'explosion cambrienne, bien qu'elle ait considérablement influencé la forme des organismes issus de cette explosion[30]
Unicité de l'explosion
L'explosion cambrienne peut être vue comme deux vagues d'expansion animales au sein de niches écologiques vacantes, à l'Édiacarien lorsque les animaux s'établirent sur le fond marin puis au Cambrien lorsqu'ils conquirent la colonne d'eau[31]. Le taux de diversification au Cambrien est sans équivalent pour les animaux marins, il a affecté tous les clades animaux. Les radiations évolutives suivantes comme celle des poissons au Silurien et au Dévonien n'impliquèrent que quelques taxons. Bien que la radiation après l'extinction Permien-Trias commençât avec aussi peu d'espèces animales que celle du Cambrien, elle produisit beaucoup moins de nouveaux types d'animaux[65].
Quelle que soit la cause de la diversification au Cambrien, elle a ouvert la voie à un nombre exceptionnellement large de nouvelles niches écologiques. Une fois celles-ci occupées, il restait peu de place pour une nouvelle diversification aussi large car il y avait déjà une compétition féroce au sein de toutes les niches et les espèces déjà en place ont généralement l'avantage.
Il existe deux explosions évolutives similaires dans l'histoire évolutive des végétaux et des animaux, lors d'épisodes d'extinctions massives qui libèrent les niches écologiques laissées vacantes par la disparition de nombreuses espèces et sont suivies d'une période de radiation évolutive marquée par des phylums survivants qui se diversifient en éliminant des lignées concurrentes et recolonisent ces niches : explosion du Dévonien (il y 400 millions d'années) à la suite de l'extinction dévonienne (les plantes colonisent rapidement les terres émergées) et explosion au Paléogène à la suite de l'extinction de la fin du Crétacé (foisonnement évolutif chez les plantes à fleurs, mais aussi chez les mammifères et les oiseaux) lors du Crétacé).
Notes et références
- (en) D.Y.C. Wang, S. Kumar et S. B. Hedges, « "Divergence time estimates for the early history of animal phyla and the origin of plants, animals and fungi." », Proceedings of the Royal Society of London, Series B, Biological Sciences, vol. 266, , p. 163-171
- Armand de Ricqlès, « Un “big-bang” zoologique au cambrien ? », La Recherche, no 240, , p. 224-227.
- Pierre-Henri Gouyon, Jacques Arnould, Jean-Pierre Henry, Les avatars du gène. La théorie néodarwinienne de l'évolution, Humensis, (lire en ligne), p. 98.
- Guy Narbonne, The Origin and Early Evolution of Animals, Department of Geological Sciences and Geological Engineering, Queen's University, ()
- (en) W. Buckland, Geology and Mineralogy Considered with Reference to Natural Theology, Lea & Blanchard, (ISBN 978-1-147-86894-4)
- (en) C. Darwin, On the Origin of Species by Natural Selection, New York, Murray, London, United Kingdom, , 328 p. (ISBN 978-1-60206-144-6, OCLC 176630493, lire en ligne), p. 437–438
- (en) C. D. Walcott, « Cambrian Geology and Paleontology », Smithsonian Miscellaneous Collections, vol. 57, , p. 14
- (en) Heinrich D. Holland, « Evidence for life on earth more than 3850 million years ago », Science, vol. 275, no 5296, , p. 38 (PMID 11536783, DOI 10.1126/science.275.5296.38)
- Emilie Rauscher, « Il y a 2,1 milliards d'années : sous les mers, la vie foisonnait déjà ! », sur science-et-vie.com,
- http://www2.cnrs.fr/presse/communique/1928.htm
- Robert Pascal, Hervé Martin, Purificacion Lopez-Garcia et Murielle Gargaud, Le Soleil, la Terre… la Vie, Paris, Belin, , 301 p. (ISBN 2701147999)
- (en) Whittington, H. B. (1979). Early arthropods, their appendages and relationships. In M. R. House (Ed.), The origin of major invertebrate groups (p. 253–268). The Systematics Association Special Volume, 12. London: Academic Press.
- (en) H. B. Whittington, The Burgess Shale, Ottawa, Yale University Press, , 31 p., poche (ISBN 978-0-660-11901-4, OCLC 15630217, LCCN 86141281, lire en ligne)
- (en) S. J. Gould, Wonderful Life : The Burgess Shale and the Nature of History, New York, W.W. Norton & Company, , 1re éd., 347 p. (ISBN 978-0-393-02705-1, OCLC 185746546)
- (en) S. Bengtson, « Neoproterozoic- Cambrian Biological Revolutions », Palentological Society Papers, Lipps, J.H., and Waggoner, B.M., vol. 10, , p. 67–78 (lire en ligne [PDF], consulté le )
- e.g. (en) J. B. Jago et P. W. Haines, « Recent radiometric dating of some Cambrian rocks in southern Australia: relevance to the Cambrian time scale », Revista Española de Paleontología, , p. 115–22
- e.g. (en) James Gehling, Sören Jensen, Mary Droser, Paul Myrow et Guy Narbonne, « Burrowing below the basal Cambrian GSSP, Fortune Head, Newfoundland », Geological Magazine, vol. 138, no 2, , p. 213–218 (DOI 10.1017/S001675680100509X, lire en ligne)
- (en) Royal Ontario Museum and Parks Canada, « The Burgess Shale », sur burgess-shale.rom.on.ca, (consulté le )
- (en) N. J. Butterfield, « Exceptional Fossil Preservation and the Cambrian Explosion », Integrative and Comparative Biology, vol. 43, no 1, , p. 166–177 (DOI 10.1093/icb/43.1.166, lire en ligne, consulté le )
- (en) Dongjing Fu et al., « The Qingjiang biota—A Burgess Shale–type fossil Lagerstätte from the early Cambrian of South China », Science, vol. 363, no 6433, , p. 1338–1342 (DOI 10.1126/science.aau8800).
- (en) J. E. Amthor, J. P. Grotzinger, S. Schroder, S. A. Bowring, J. Ramezani, M.W. Martin et A. Matter, « Extinction of Cloudina and Namacalathus at the Precambrian-Cambrian boundary in Oman », Geology, vol. 31, no 5, , p. 431–434 (DOI 10.1130/0091-7613(2003)031<0431:EOCANA>2.0.CO;2)
- (en) Kevin J. Peterson, J.A. Cotton, J. G. Gehling et D. Pisani, « The Ediacaran emergence of bilaterians: congruence between the genetic and the geological fossil records », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 363, no 1496, , p. 1435 (ISSN 0962-8436, PMID 18192191, PMCID 2614224, DOI 10.1098/rstb.2007.2233, lire en ligne [Free full text])
- (en) Lindell Bromham, Andrew Rambaut, Richard Fortey et Alan Cooper, « Testing the Cambrian explosion hypothesis by using a molecular dating technique », Proceedings of the National Academy of Sciences, vol. 95, no 21, , p. 12386–12389 (ISSN 0027-8424 et 1091-6490, PMID 9770496, DOI 10.1073/pnas.95.21.12386, lire en ligne, consulté le )
- (en) R.P.S. Jefferies, The origin of chordates — a methodological essay, London, Academic Press, coll. « The origin of major invertebrate groups », , p. 443–477, résumé dans (en) G. E. Budd, « The Cambrian Fossil Record and the Origin of the Phyla », Integrative and Comparative Biology, vol. 43, no 1, , p. 157–165 (DOI 10.1093/icb/43.1.157, lire en ligne)
- (en) A.J. Craske et R.P.S. Jefferies, « A new mitrate from the Upper Ordovician of Norway, and a new approach to subdividing a plesion », Palaeontology, vol. 32, , p. 69–99 (lire en ligne [PDF])
- (en) G. E. Budd, « The morphology of Opabinia regalis and the reconstruction of the arthropod stem-group », Lethaia, vol. 29, no 1, , p. 1–14 (DOI 10.1111/j.1502-3931.1996.tb01831.x)
- (en) P. Dominguez, A. G. Jacobson et R. P. S. Jefferies, « Paired gill slits in a fossil with a calcite skeleton », Nature, vol. 417, no 6891, , p. 841–844 (ISSN 0028-0836, PMID 12075349, DOI 10.1038/nature00805, lire en ligne)
- (en) K. J. McNamara, « Dating the Origin of Animals », Science, vol. 274, no 5295, , p. 1993–1997 (DOI 10.1126/science.274.5295.1993f, lire en ligne, consulté le )
- (en) S. M. Awramik, « Precambrian columnar stromatolite diversity: Reflection of metazoan appearance », Science, vol. 174, no 4011, , p. 825–827 (PMID 17759393, DOI 10.1126/science.174.4011.825, lire en ligne [abstract], consulté le )
- (en) S. Bengtson, « Origins and early evolution of predation », dans M. Kowalewski et P. H. Kelley, The fossil record of predation. The Paleontological Society Papers 8, The Paleontological Society, , PDF (lire en ligne), p. 289–317
- (en) N. J. Butterfield, « Macroevolution and macroecology through deep time », Palaeontology, vol. 50, no 1, , p. 41-55 (DOI 10.1111/j.1475-4983.2006.00613.x)
- (en) D. Condon, M. Zhu, S. Bowring, W. Wang, A. Yang et Y. Jin, « U-Pb Ages from the Neoproterozoic Doushantuo Formation, China », Science, vol. 308, no 5718, , p. 95–98 (PMID 15731406, DOI 10.1126/science.1107765, résumé)
- (en) S. Xiao, Y. Zhang et A. H. Knoll, « Three-dimensional preservation of algae and animal embryos in a Neoproterozoic phosphorite », Nature, vol. 391, no 1, , p. 553–558 (ISSN 0090-9556, DOI 10.1038/35318, Bibcode 1998Natur.391..553X)
- (en) J. W. Hagadorn, S. Xiao, P. C. Donoghue, S. Bengtson, N. J. Gostling, M. Pawlowska, E. C. Raff, R. A. Raff et F. R. Turner, « Cellular and Subcellular Structure of Neoproterozoic Animal Embryos », Science, vol. 314, no 5797, , p. 291–294 (ISSN 0036-8075, PMID 17038620, DOI 10.1126/science.1133129)
- (en) Jake V. Bailey, S. B. Joye, K. M. Kalanetra, B. E. Flood et F. A. Corsetti, « Evidence of giant sulphur bacteria in Neoproterozoic phosphorites », Nature, vol. 445, no 7124, , p. 198–201 (ISSN 0028-0836, PMID 17183268, DOI 10.1038/nature05457)
- (en) J. Y. Chen, D. J. Bottjer, P. Oliveri, S. Q. Dornbos, F. Gao, S. Ruffins, H. Chi, C. W. Li et E. H. Davidson, « Small Bilaterian Fossils from 40 to 55 Million Years Before the Cambrian », Science, vol. 305, no 5681, , p. 218–222 (PMID 15178752, DOI 10.1126/science.1099213)
- (en) S. Bengtson et G. Budd, « Comment on ‘‘Small bilaterian fossils from 40 to 55 million years before the Cambrian’’ », Science, vol. 306, no 5700, , p. 1291a (PMID 15550644, DOI 10.1126/science.1101338)
- (en) M. A. Fedonkin, Origin and early evolution of the Metazoa, New York, Springer, , 570 p. (ISBN 978-0-306-44067-0, OCLC 231467647, LCCN 92016461, lire en ligne), « Vendian faunas and the early evolution of Metazoa », p. 87–129
- (en) S. Jensen, « The Proterozoic and Earliest Cambrian Trace Fossil Record; Patterns, Problems and Perspectives », Integrative and Comparative Biology, vol. 43, , p. 219 (DOI 10.1093/icb/43.1.219)
- (en) B. Shen, L. Dong, S. Xiao et M. Kowalewski, « The Avalon Explosion: Evolution of Ediacara Morphospace », Science, vol. 319, no 5859, , p. 81–84 (PMID 18174439, DOI 10.1126/science.1150279, résumé)
- (en) D. Grazhdankin, « Patterns of distribution in the Ediacaran biotas: facies versus biogeography and evolution », Paleobiology, vol. 30, , p. 203-221 (DOI 10.1666/0094-8373(2004)030<0203:PODITE>2.0.CO;2)
- (en) A. Seilacher, « Vendobionta and Psammocorallia: lost constructions of Precambrian evolution », Journal of the Geological Society, London, vol. 149, no 4, , p. 607–613 (DOI 10.1144/gsjgs.149.4.0607, lire en ligne [abstract], consulté le )
- (en) M. A. Fedonkin et al., The Rise of Animals : Evolution and Diversification of the Kingdom Animalia, , 326 p. (ISBN 978-0-8018-8679-9, lire en ligne), p. 74.
- (en) M. A. Fedonkin et B. M. Waggoner, « The late Precambrian fossil Kimberella is a mollusc-like bilaterian organism », Nature, vol. 388, no 6645, , p. 868–871 (ISSN 0372-9311, DOI 10.1038/42242, Bibcode 1997Natur.388..868F, lire en ligne [abstract])
- (en) M. W. Martin, D.V. Grazhdankin, S. A. Bowring, D. A. D. Evans, M. A. Fedonkin et J. L. Kirschvink, « Age of Neoproterozoic Bilaterian Body and Trace Fossils, White Sea, Russia: Implications for Metazoan Evolution », Science, vol. 288, no 5467, , p. 841 (PMID 10797002, DOI 10.1126/science.288.5467.841, résumé)
- (en) R. Mooi et D. Bruno, « Evolution within a bizarre phylum: Homologies of the first echinoderms », American Zoologist, vol. 38, , p. 965–974 (lire en ligne [PDF])
- (en) M.A.S McMenamin, « Spriggina is a trilobitoid ecdysozoan », Abstracts with Programs, Geological Society of America, vol. 35, no 6, , p. 105 (résumé)
- (en) J. P. Lin, S. M. Gon, J. G. Gehling, L. E. Babcock, Y. L. Zhao, X. L. Zhang, S. X. Hu, J. L. Yuan, M. Y. Yu et J. Peng, « A Parvancorina-like arthropod from the Cambrian of South China », Historical Biology: An International Journal of Paleobiology, vol. 18, no 1, (DOI 10.1080/08912960500508689, résumé)
- (en) N. J. Butterfield, « Hooking some stem-group "worms": fossil lophotrochozoans in the Burgess Shale », Bioessays, vol. 28, no 12, , p. 1161–6 (ISSN 0265-9247, PMID 17120226, DOI 10.1002/bies.20507)
- (en) S. C. Matthews et V. V. Missarzhevsky, « Small shelly fossils of late Precambrian and early Cambrian age: a review of recent work », Journal of Geological Society, vol. 131, no 3, , p. 289 (DOI 10.1144/gsjgs.131.3.0289)
- (en) S. Q. Dornbos et D. J. Bottjer, « Evolutionary paleoecology of the earliest echinoderms: Helicoplacoids and the Cambrian substrate revolution », Geology, vol. 28, no 9, , p. 839–842 (DOI 10.1130/0091-7613(2000)28<839:EPOTEE>2.0.CO;2, lire en ligne)
- (en) H. B. Whittington, « The enigmatic animal Opabinia regalis, Middle Cambrian Burgess Shale, British Columbia », Philosophical Transactions of the Royal Society of London: Biological Sciences, vol. 271, no 910, , p. 1–43 271 (DOI 10.1098/rstb.1975.0033, lire en ligne, consulté le )
- (en) A. Daley, « The burgess Shale Anomalocaridid Hurdia and Its Significance for Early Euarthropod Evolution », Science, , pp.1597-1600 (lire en ligne)
- (en) Mary L. Droser et Seth Finnegan, « The Ordovician Radiation: A Follow-up to the Cambrian Explosion? », Integrative and Comparative Biology, vol. 43, no 1, , p. 178 (DOI 10.1093/icb/43.1.178)
- (en) K. Nanglu, « Cambrian suspension-feeding tubicolous hemichordates », BMC Biology,
- (en) K.Nanglu, J-B. Caron, C. Cameron, « Cambrian suspension-feeding tubicolous hemichordates », BMC Biology,
- (en) J-B. Caron, « Tubicolous enteropneusts from the Cambrian period », Letter to Nature,
- La quantité d'oxygène nécessaire est proportionnelle au volume de l'animal, qui est fonction du cube de ses dimensions. La consommation d'oxygène est proportionnelle à la surface des organes respiratoires, qui est fonction du carré de ses dimensions. Le doublement de la taille quadruple la surface des organes respiratoires mais multiplie par huit la quantité d'oxygène nécessaire.
- (en) K. M. Towe, « Oxygen-Collagen Priority and the Early Metazoan Fossil Record », Proceedings of the National Academy of Sciences, vol. 65, no 4, , p. 781–788 (PMID 5266150, PMCID 282983, DOI 10.1073/pnas.65.4.781, lire en ligne [abstract])
- (en) D. C. Catling, C. R. Glein, K. J. Zahnle et C. P. McKay, « Why O2 Is Required by Complex Life on Habitable Planets and the Concept of Planetary "Oxygenation Time" », Astrobiology, vol. 5, no 3, , p. 415–438 (ISSN 1531-1074, PMID 15941384, DOI 10.1089/ast.2005.5.415)
- (en) P.F. Hoffman, A.J. Kaufman, G.P. Halverson et D.P. Schrag, « A Neoproterozoic Snowball Earth », Science, vol. 281, no 5381, , p. 1342–1346 (PMID 9721097, DOI 10.1126/science.281.5381.1342, résumé)
- (en) C.Marshall, « Explaining the Cambrian Explosion of Animals », Harvard University, , p. 355-384
- (en) Parker, Andrew, In the Blink of an Eye, Cambridge, Massachusetts, USA, Perseus Books, (ISBN 0-7382-0607-5, OCLC 52074044)
- (en) R. Dawkins et R. J. Krebs, « Arms races between and within species », Proceedings of the Royal Society: Biological Sciences Series B, vol. 205, no 1161, , p. 489–511 (PMID 42057, DOI 10.1098/rspb.1979.0081, lire en ligne)
- (en) D.H. Erwin, J. W. Valentine et J. J. Sepkoski, « A Comparative Study of Diversification Events: The Early Paleozoic Versus the Mesozoic », Evolution, vol. 41, no 6, , p. 1177–1186 (PMID 11542112, DOI 10.2307/2409086, lire en ligne, consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cambrian explosion » (voir la liste des auteurs).
Sources
- (en) G. E. Budd et J. Jensen, « A critical reappraisal of the fossil record of the bilaterian phyla », Biological Reviews, vol. 75, no 2, , p. 253–295 (PMID 10881389, DOI 10.1017/S000632310000548X)
- (en) Collins, Allen G. “Metazoa: Fossil record”. Retrieved Dec. 14, 2005.
- (en) Simon Conway-Morris, « The Cambrian "explosion" of metazoans and molecular biology: would Darwin be satisfied? », The International Journal of Developmental Biology, vol. 47, nos 7-8, , p. 505-515 (PMID 14756326, lire en ligne [PDF], consulté le )
- (en) S. Conway Morris, « Darwin’s dilemma: the realities of the Cambrian ‘explosion’ », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 361, no 1470, , p. 1069–1083 (ISSN 0962-8436, PMID 16754615, PMCID 1578734, DOI 10.1098/rstb.2006.1846) An enjoyable account.
- Stephen Jay Gould La vie est belle : les surprises de l'évolution (Wonderful Life: The Burgess Shale and the Nature of History), 1989 (ISBN 2-02-035239-7).
- (en) M. Kennedy, M. Droser, L. Mayer., D. Pevear et D. Mrofka, « Clay and Atmospheric Oxygen », Science, vol. 311, no 5766, , p. 1341 (DOI 10.1126/science.311.5766.1341c)
- (en) A. H. Knoll et S. B. Carroll, « Early Animal Evolution: Emerging Views from Comparative Biology and Geology », Science, vol. 284, no 5423, , p. 2129 (PMID 10381872, DOI 10.1126/science.284.5423.2129)
- (en) Alexander V. Markov, and Andrey V. Korotayev (2007) “Phanerozoic marine biodiversity follows a hyperbolic trend” Palaeoworld 16(4): p. 311–318.
- (en) M. Montenari et U. Leppig, « The acritarcha : their classification morphology, ultrastructure and palaeoecological/palaeogeographical distribution. », Paläontologische Zeitschrift, vol. 77, , p. 173–194
- Jean Vannier, « L'Explosion cambrienne ou l'émergence des écosystèmes modernes », Comptes Rendus Palevol, vol. 8, nos 2-3, , p. 133-154 (DOI 10.1016/j.crpv.2008.10.006)
- (en) D. Y.-C. Wang, S. Kumar et S. B. Hedges, « Divergence time estimates for the early history of animal phyla and the origin of plants, animals and fungi », Proceedings of the Royal Society of London, Series B, Biological Sciences, vol. 266, no 1415, , p. 163–71 (ISSN 0962-8452, PMID 10097391, PMCID 1689654, DOI 10.1098/rspb.1999.0617)
- (en) S. Xiao, Y. Zhang et A. Knoll, « Three-dimensional preservation of algae and animal embryos in a Neoproterozoic phosphorite », Nature, vol. 391, no 1, , p. 553–58 (ISSN 0090-9556, DOI 10.1038/35318, Bibcode 1998Natur.391..553X)
- A. Daley, G. Budd, J-B. Caron, G. Edgecombe, D. Collins, The Burgess Shale Anomalocaridid Hurdia and Its Significance for Early Euarthropod Evolution, Science, 20 March 2009, Vol. 323, p. 1597-1600
- C. Marshall, Explaining the Cambrian "Explosion" of Animals, Department of Earth and Planetary Sciences, Harvard University, 2006, p. 355-384
- J-B. Caron, S. Morris, C. Cameron, Tubicolous enteropneusts from the Cambrian period, Letter to Nature, 13 March 2013
- J. Finnerty, K. Pang, P. Burton, D. Paulson, M. Martindale, Origins of Bilateral Symmetry: Hox and Dpp Expression in a Sea Anemone, Science, 28 May 2004, Vol. 304, Issue 5675, p. 1335-1337
- K. Nanglu, J-B. Caron, S. Morris, C. Cameron, Cambrian suspension-feeding tubicolous hemichordates, BMC Biology, 2016, 14:56
- L. Bromham, A. Rambaut, R. Fortey, A. Cooper, D. Penny, Testing the Cambrian explosion hypothesis by using a molecular dating technique, Proceedings of the National Academy of Sciences of the United States of America, 1998, Vol. 95 no. 21
- Sur la chronologie
- (en) M. W. Martin, D. V. Grazhdankin, S. A. Bowring, D. A. D. Evans, M. A. Fedonkin et J. L. Kirschvink, « Age of Neoproterozoic Bilaterian Body and Trace Fossils, White Sea, Russia: Implications for Metazoan Evolution », Science, vol. 288, no 5467, , p. 841–845 (PMID 10797002, DOI 10.1126/science.288.5467.841)
Liens externes
- « Explosion cambrienne : quand la vie fait boom ! », La Méthode scientifique, France Culture, 14 avril 2022.
- Eric F.-Bellot, Le Schiste de Burgess , 15/06/2002
- (en) On embryos and ancestors by Stephen Jay Gould
- (en) « The Cambrian “explosion”: Slow-fuse or megatonnage? » [Scholar search]
- (en) The Cambrian Explosion – In Our Time, BBC Radio 4 enregistrement radio, 17 February 2005
- (en) Utah's Cambrian life – Site présentant de bonnes images d'un grand nombre de fossiles datant du Cambrien
- (en) - Article expliquant la technique de datation nommé horloge moléculaire
- (en) - Article expliquant l'origine de la symétrie bilatérale au Cambrien
- (en) Lien vidéo portant sur les appendices des anomalocarides
- (en) Galerie de fossiles du Cambrien - Royal Ontario Museum
- (en) Lancelet and Ancestral Body (article : évolution des chordés, patrimoine génétique, découvertes récentes) - PENICHEFOSSIL
