Séquestration du dioxyde de carbone
La séquestration du dioxyde de carbone, appelée plus simplement piégeage du carbone ou séquestration du carbone est le stockage à long terme du dioxyde de carbone hors de l'atmosphère. Elle est réalisée de manière naturelle par des processus biologiques et géologiques.

Elle peut également être réalisée par la main de l'homme, via des processus biologiques ou des procédés industriels, et est alors connue sous le nom anglais carbon dioxide removal (CDR) ou sous le terme d'émissions négatives. C'est l'une des techniques et mesures envisagées pour atteindre les engagements climatiques et énergétiques de la communauté internationale (Accord de Paris). Pour cela, selon le scénario « technologies propres » (CTS) de l'Agence internationale de l'énergie, il faut stocker dans le monde 107 Gt CO2 (gigatonnes de dioxyde de carbone) entre 2015 et 2060.
Par ailleurs, des procédés industriels permettent également de capter le CO2 directement à la source, notamment en sortie d'usines ; il s'agit alors de carbon capture and storage (CCS).
Une alternative à la séquestration du CO2 est sa valorisation. On parle alors de « captage et valorisation du dioxyde de carbone » (en anglais « CCUS », acronyme de Carbon Capture, Utilization, and Storage), qui vise à stocker puis à utiliser ou réutiliser le CO2 capté.
Modes de séquestration
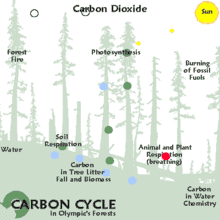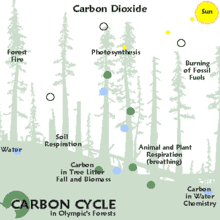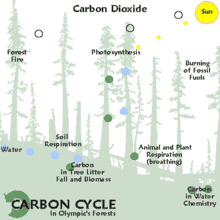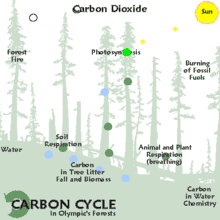
On distingue trois grands modes de séquestration :
- la séquestration biologique, qui implique des processus biologiques permettant de capter et stocker le CO2 atmosphérique par le biais des équilibres du cycle du carbone. Sur le très long terme, elle permet la formation des vastes gisements de charbon et de pétrole enfouis dans le sol. La séquestration biologique naturelle peut être renforcée par l'action de l'homme et constitue alors des émissions négatives ;
- la capture et séquestration industrielle (ou artificielle) du CO2 atmosphérique, qui permet des émissions négatives : bioénergie avec captage et stockage de dioxyde de carbone (BECCS), capture du dioxyde de carbone dans l'air (DAC), etc. ;
- la séquestration industrielle (ou artificielle) à la source, qui consiste soit à capter le CO2 industriel à son point d'émission (centrale électrique, cimenterie, aciérie…), à le concentrer et le transporter vers un site géologique adéquat pour son stockage (c'est la séquestration géologique du dioxyde de carbone). La séquestration à la source réduit les émissions atmosphériques mais ne constitue pas des émissions négatives.
Le terme anglophone carbon dioxide removal (CDR), qui correspond également à la notion d'« émissions négatives » (de CO2), désigne quant à lui le retrait par l'être humain, via des processus biologiques (stockage dans les puits naturels de carbone via la reforestation, un changement des pratiques agricoles, etc.) ou des procédés industriels (bioénergie avec captage et stockage de dioxyde de carbone, capture du dioxyde de carbone dans l'air…) du CO2 présent dans l'atmosphère[1].
La séquestration naturelle s'appuie sur la capacité des organismes vivants à synthétiser des molécules organiques, à partir de CO2 atmosphérique ou en recyclant de la matière organique préexistante, et à stocker cette matière (puits de carbone). Ce processus, complémentaire de la séquestration géologique, est adapté aux sources d'émissions diffuses (transports, habitat, etc.). La séquestration naturelle est un enjeu important pour la protection et la stabilité du climat.
La séquestration artificielle est une des pistes explorées par divers chercheurs, entreprises[2], agences et États pour atténuer les effets du réchauffement climatique et notamment dans le cadre du protocole de Kyoto.
Séquestration naturelle
La séquestration naturelle se fait dans un puits de carbone comme les océans[3] (CO2 dissous et CO2 fixé dans des organismes photosynthétiques : algues planctoniques, bactéries photosynthétiques), les forêts (au-dessus et en dessous du sol : système racinaire, humus), et, dans une moindre mesure, les prairies et le reste du couvert végétal, qu'il soit naturel ou sous conduite humaine (pâturages, cultures, jardins, etc.).
Compte tenu de l'intrication des menaces sur le climat et la biodiversité, l'Union internationale pour la conservation de la nature préconise le recours à des solutions fondées sur la préservation ou la restauration des écosystèmes, notamment les forêts[4] - [5].
Séquestration du carbone dans les sols
Le sol stocke plus de carbone terrestre que la somme des puits de carbone atmosphérique et végétal. La plus grande densité de ce carbone séquestré se trouve dans les sols des prairies[6] - [7].
Quatre acteurs clés interviennent dans ce processus[8] :
- les litières végétales (feuilles, plantes et racines mortes) ;
- les micro-organismes saprotrophes libres, qui se nourrissent exclusivement de matière organique morte ;
- les champignons mycorhiziens, qui vivent en symbiose avec les racines de certaines plantes ;
- les animaux détritivores du sol (vers de terre, cloportes, collembolles et mille-pattes), qui se nourrissent des déchets végétaux.
Les pratiques culturales sans labour, en présence de paillage, visent à maintenir la séquestration de matière organique riche en carbone dans le sol. Cette pratique empêche l'exposition du sol à l'oxygène atmosphérique, la lixiviation et l'érosion. L'arrêt du labour encouragerait la prédation des fourmis sur les termites mangeurs de bois, permettrait aux mauvaises herbes de régénérer le sol et aiderait à ralentir les ruissellements sur les terres[9].
Séquestration du carbone par les océans
Le carbone bleu fait référence au dioxyde de carbone retiré de l'atmosphère par les écosystèmes océaniques côtiers du monde, principalement les mangroves, les marais salants, les herbiers marins et potentiellement les macroalgues, par la croissance des plantes et l'accumulation et l'enfouissement de matière organique dans le sol[10] - [11].
Séquestration du carbone par les forêts

Les forêts du monde contiennent plus de carbone que l’ensemble de l’atmosphère, « avec 650 milliards de tonnes de piégé, dont 44 pour cent dans la biomasse, 11 pour cent dans le bois mort et la litière, et 45 pour cent dans le sol. Si la gestion durable, la plantation et la réhabilitation des forêts peuvent conserver ou accroître les stocks de carbone forestier, la déforestation, la dégradation forestière et une gestion forestière insuffisante ont pour effet de les réduire. Cette baisse est principalement imputable à la réduction de la superficie forestière mondiale et s’est produite en dépit de l’augmentation du matériel sur pied par hectare dans certaines régions[14]. »
Longtemps nommée « poumon vert de la planète » (l'image est un contre-sens car un poumon consomme de l'oxygène et rejette du CO2), la forêt amazonienne émettrait aujourd'hui plus de CO2 que d'O2, en raison de la déforestation et du réchauffement climatique[15].
Séquestration par l'arbre urbain et les « forêts urbaines »
Les végétaux présents dans le milieu urbain contribuent aussi à piéger du dioxyde de carbone. Différentes études ont été menées pour mesurer la quantité de gaz concernée, notamment en Chine et aux États-Unis.
En 2010, une étude[16] a par exemple cherché à quantifier le stockage du carbone et la séquestration permise par certaines forêts urbaines au regard des émissions de carbone venant de la consommation d'énergies fossiles par les sources industrielles de Hangzhou, en Chine). Les données d'inventaire des forêts urbaines, via des équations basées sur le volume de biomasse, et le calcul de l'accroissement annuel et via une modélisation de la productivité primaire nette (PPN), des estimations de carbone stocké ont été faites.
Le carbone total stocké par les forêts urbaines de Hangzhou a ainsi été estimé à 11,74 MtC (soit environ 30,25 t de carbone par hectare en moyenne). La séquestration du carbone par les forêts urbaines était de 1.33 Mt/an, soit une séquestration par hectare de 1,66 t de carbone par hectare et par an. Or, les émissions industrielles de CO2 étaient pour Hangzhou de 7 MtC/an[16].
Dans ce cas, les forêts urbaines semblent donc capables de compenser par séquestration chaque année 19 % de la quantité de carbone émise par la combustion d'énergies fossiles par l'industrie locale[16]. Ce taux de carbone séquestré pourrait encore être amélioré par des pratiques de gestion adaptées[16].
Une étude[17] publiée en 2011, du même type, utilisant aussi des images haute définition (Images QuickBird d'), et intégrant une évaluation de la valeur monétaire et compensatoire du carbone stocké (au regard du marché du carbone) a été fait à Shenyang (Liaoning, Chine), ville très industrialisée du nord de la chine peu boisée. La surface boisée était de 101 km2 (5,76 millions d'arbres et 569 arbres par hectare en moyenne), couvrant 22 % de la superficie totale du site d'étude (intérieur du 3e anneau routier périphérique de Shenyang). Le statut de ces boisements était une conservation d'intérêt écologique ou d'intérêt social[18] sur près de 50 % de l'aire d'étude ; 10,9 ha (environ 10 % du total et avec la plus grande densité d'arbres ; 905 ± 133 tiges/ha) étaient destinés à l'exploitation du bois.
Selon les calculs des auteurs, ces forêts urbaines (anciennes ou récemment plantées aux abords du périphérique, abritant 120 espèces d'arbres et 53 espèces de buissons, les espèces les plus communes étant le peuplier du Canada (Populus ×canadensis, Moench), le saule matsudana Salix matsudana (à croissance rapide), et l'orme de Sibérie Ulmus pumila) peuvent réellement jouer un rôle en matière de stockage de carbone, avec environ 337 000 t de carbone actuellement stocké par an (pour une valeur estimée de 13,88 millions de dollars), et avec un taux de séquestration du carbone de 29 000 t/an (équivalent à 1,19 million de dollars).
Le carbone stocké par la forêt périurbaine correspond à 3,02 % des émissions annuelles de carbone provenant de la combustion de combustibles fossiles. La séquestration du carbone pourrait ainsi compenser 0,26 % des émissions annuelles de carbone de Shenyang. L'étude montre aussi que le stockage de carbone et le taux de séquestration varient fortement selon le type de forêt urbaine (essences, sol, composition en espèces, structure forestière et classes d'âge), et qu'il pourrait être amélioré par une gestion adaptée.
En zone subtropicale de Miami-Dade et de Gainesville aux États-Unis, la forêt urbaine a aussi été étudiée de ce point de vue[19]. Gainesville, où le boisement urbain est plus dense, stocke et séquestre plus de carbone que Miami-Dade, en raison de cet environnement mais aussi du mode d'urbanisation. Les quartiers plantés de bois de pins et chênes naturels, ainsi que les mangroves et des boisements subspontanés (friches...) séquestrent mieux le carbone. Ces boisements ne compensent cependant que peu les émissions urbaines (−3,4 % à Gainesville et −1,8 % à Miami-Dade). De plus, reconvertir l'espace urbain encore disponible en forêt ne diminuerait que peu les émissions de CO2. Pour les années 2010, le CO2 capté par les arbres était comparable aux effets des autres politiques de réduction de CO2. Mais au vu des objectifs à long terme, des multiples services écosystémiques rendus par les boisements, des coûts, des besoins communautaires, les auteurs jugent que la préservation des forêts existantes doit être reconsidérée en intégrant leur valeur pour la lutte contre le réchauffement climatique, l'adaptation à ce réchauffement, et pour la restauration ou conservation d'autres services écosystémiques[20], dont l'amélioration de la qualité de l'air[21] ou la dépollution de certains sols[22].
Le département des forêts de l'USDA a collecté[23] des données pour 10 grandes villes des États-Unis et pour le couvert forestier nord américain. Selon ces sources, les arbres urbains USA stockeraient actuellement et provisoirement aux États-Unis environ 700 millions de tonnes de carbone (soit un service équivalent à 14,3 milliards de dollars de valeur au « prix du carbone » de 2010, avec un bilan brut de séquestration du carbone de 22,8 millions tC/an (soit un service écosystémique correspondant à environ 460 millions de dollars/an).
Ce stockage « urbain » du carbone varie considérablement selon les villes ; de 1,2 million de t/an à New York, à 19 300 tC à Jersey City (New Jersey). En moyenne, ce stockage de carbone a été estimé aux États-Unis (pour le début des années 2000) à 25,1 t de carbone par hectare (comparativement à 53,5 tC/ha dans les peuplements forestiers).
Un mouvement issu des travaux du botaniste japonais Akira Miyawaki cherche à planter de minuscules forêts denses dans toute l'Europe afin de restaurer la biodiversité et de lutter contre la crise climatique. Selon leurs promoteurs, ces forêts miniatures poussent 10 fois plus vite et deviennent 30 fois plus denses et 100 fois plus riches en biodiversité que celles plantées par des méthodes conventionnelles. Ce résultat est obtenu par la plantation de jeunes arbres rapprochés, trois par mètre carré, en utilisant des variétés indigènes adaptées aux conditions locales et une grande variété d'espèces pour recréer les couches d'une forêt naturelle[24].
Amélioration de la photosynthèse
L'efficacité photosynthétique des plantes peut être augmentée en modifiant leurs gènes Rubisco pour augmenter leur activité catalytique, afin d'accroître la séquestration du carbone[25]. Un des domaines de recherche consiste à augmenter la proportion de plantes photosynthétiques à fixation du carbone en C4. Les plantes C4 représentent environ 5 % de la biomasse végétale sur terre et 1 % des espèces végétales connues[26], mais elles réalisent environ 30 % de la fixation terrestre du carbone[27]. Dans les feuilles des plantes C3, les photons subissent une photosynthèse accompagnée d'une photorespiration qui protège la photosynthèse de la photoinhibition, mais « gaspille » 50 % du carbone potentiellement fixé[28]. La voie photosynthétique C4 réduit cependant la photorespiration[29]. Une piste envisagée par certains chercheurs consiste à tenter de modifier génétiquement les cultures vivrières de base C3 (comme le blé, l'orge, le soja, les pommes de terre et le riz) avec l'appareil photosynthétique « turbo » des plantes C4[30].
Séquestration artificielle
Le dioxyde de carbone pourrait théoriquement être massivement enfoui, par des méthodes qu'il faudra sécuriser sur le très long terme. On considère trois principaux lieux et modes de séquestration :
- le substrat géologique rocheux (pour une capacité estimée d'environ 2 000 Gt de CO2, selon le GIEC qui estime qu'avec des technologies à développer et valider, et une surveillance appropriée, plus de 99 % du CO2 injecté sur 1 000 ans pourrait ainsi être emprisonné pour plusieurs millions d'années), par injection via des puits sous forme de fluide supercritique dans des roches perméables (aquifères). Les technologies dérivent de l'industrie pétrolière (caractérisation de réservoirs potentiels, forages, gazoduc, compression) qui se positionne sur ce nouveau marché lui permettant de limiter les émissions en CO2 de son exploitation du carbone fossile. Le risque de remontée de CO2, massive depuis un puits mal étanchéifié, ou plus diffuse, ou de diffusion du CO2 dans les aquifères supérieurs, doit être maîtrisé ;
- les grands fonds océaniques (stockage provisoire et incertain, et à haut risque pour la biodiversité des grands fonds) ;
- l'inertage sous forme de carbonates minéraux reconstitués (solution copiant la nature, mais coûteuse en énergie).
Étapes de capture avant le stockage
Avant la phase de séquestration à proprement parler, une étape de captage (et éventuellement de transport) est nécessaire :
- La capture du dioxyde de carbone CO2 peut se faire selon plusieurs techniques :
- en postcombustion (capture dans les fumées en aval de la combustion),
- en précombustion (décarbonatation du combustible en amont, c'est-à-dire avant la combustion. Le carbone est alors enlevé du carburant et stocké en amont de la combustion qui ne concernera que de l'hydrogène en n'émettant que de la vapeur d'eau et des oxydes d'azote, de soufre, etc.),
- en oxycombustion (l'oxycombustion consiste à remplacer l'air (le comburant de la chaudière ou du moteur) par du dioxygène pur, pour n'émettre qu'un flux de dioxyde de carbone très concentré voire pur) ;
- Capture dans l'air ambiant par adsorption ;
- Captage direct du dioxyde de carbone ;
- L’entreposage intermédiaire de courte durée directement après le processus de séparation et en attente du transport et/ou de la séquestration du dioxyde de carbone récupéré ;
- Le transport : le plus souvent, le CO2 (sous forme gazeuse ou autre) doit être transporté (par gazoduc ou bateau) de manière sécurisée quand le site de stockage est éloigné du site de capture ;
Séquestration dans le substrat géologique rocheux
Si des solutions géotechniques étaient validées et efficaces, selon le GIEC (en 2005), cette solution pourrait potentiellement répondre de 10 % à 55 % de l'effort total de réduction à envisager pour le siècle 2000-2100, mais leur fiabilité à long et très long terme reste discutée, notamment face au risque sismique.
- Dans des gisements d'hydrocarbures étanches : les gisements de gaz naturel et de pétrole sont les candidats les plus fréquemment cités pour y séquestrer du CO2 en raison de leur étanchéité et de leur stabilité à l'échelle des temps géologiques. L'injection de CO2 dans des gisements pétroliers étant d'ailleurs déjà pratiquée depuis des décennies (surtout au Texas), à des fins de récupération assistée : Puissant solvant, le CO2 supercritique aide à récupérer une partie du pétrole résiduel de gisements difficiles ou en baisse de production. Néanmoins, la grande majorité des projets de récupération assistée à base de CO2 (CO2-EOR, pour (en) enhanced oil recovery) entrepris jusqu'à présent utilisent du CO2 issu de sources naturelles.
- Dans des veines de charbon : sorption sur du charbon inexploitable dans des séquences de lits de charbon peu épais, difficilement accessibles à grande profondeur et confinés par des formations schisteuses peu perméables. Le méthane de veines de charbon non exploitées pourrait être extrait et remplacé par du CO2, la récupération du méthane finançant le stockage du CO2. Réinjecter du gaz dans les pores du charbon est théoriquement possible si les couches ne se sont pas tassées après extraction. Des pilotes expérimentaux testent cette solution, qui pourrait éventuellement être associée à la gazéification du charbon, si des méthodes probantes et sécurisées étaient développées.
- Les aquifères salins sont géologiquement pour partie comparables aux gisements d'hydrocarbures, mais avec une capacité bien plus grande. Plusieurs mécanismes de piégeage semblent pouvoir y immobiliser le CO2, avec moins de risque de fuite que dans les bassins houillers ou dans certains champs pétrolifères criblés de puits et parfois affectés par des affaissements et donc des fissures dans les terrains surincombants.
- Autres milieux : le stockage géologique entre des strates de schistes serait aussi considéré. Les solutions aujourd'hui envisagées visent quasi-toujours des bassins sédimentaires. Toutefois, dans des régions volcaniques, les formations de basalte pourraient aussi servir à stocker du CO2 par réaction du CO2 avec des silicates réactifs (piégeage minéral). Le CO2 peut alors réagir avec le basalte et les nombreuses communautés microbiennes qui y sont présentes[31].
Stockage dans les fonds océaniques
Plusieurs approches sont proposées pour séquestrer du CO2 en mer ou dans les abysses :
- ensemencement d'horizons marins superficiels par du fer, car le fer est un facteur limitant pour la croissance du plancton (dont la masse morte piégerait alors le carbone). En 1990 l’océanographe John Martin dans la revue scientifique Nature montrait que le fer naturellement présent dans l'eau dopait la croissance du phytoplancton. Le rôle du fer (quand il est biodisponible et bioassimilable) a été confirmé par plusieurs études, mais sans que l'on puisse encore savoir si un forçage anthropique par ajout de fer pourrait efficacement et durablement piéger plus de carbone[32]. L'idée a germé qu'on pourrait hors de zones déjà eutrophes ou dystrophes « fertiliser » artificiellement la mer pour accélérer sa fonction de « pompe biologique à carbone » (qui absorbe de 10 à 20 milliards de tonnes de carbone par an dans les sédiments marins). De 2002 à 2005, 12 fertilisations artificielles ont été testées, mais seules trois d'entre elles ont pu faire la preuve qu'il y a réellement eu séquestration de carbone, souligne le biogéochimiste Philip Boyd[33], et on ignore ce qu'il est advenu à long terme du carbone. Une des difficultés semble être que le fer doit être bioassimilable pour le plancton et très largement réparti. D'autre part, les boucles de rétroaction des écosystèmes marins sont encore mal cernées ;
- Rejet en mer (via les fleuves) de grandes quantités de déchets agricoles (résidus de récolte), qui selon Stuart E. Strand et Gregory Benford (du Département de physique et astronomie de l'université de Washington) serait la seule méthode actuellement reproductible, pratique, économique, immédiatement applicable, sans « dommages inacceptables » ayant un impact significatif et pouvant traiter de grandes quantités de carbone pour des milliers d'années[34]. Selon eux : après 20 ans, 92 % de ce carbone serait séquestré dans les grands fonds alors que la production d'éthanol cellulosique n'a qu'un rendement de 32 % et que le sol n'en aurait séquestré que 14 %[35] - [36]. L'océan profond pourrait ainsi selon eux capter 15 % de l'augmentation annuelle mondiale actuelle du CO2, et le stocker pour des millénaires, sans besoins techniques nouveaux[34]. Mais, outre que l'immersion de déchets est interdite par des conventions internationales, ces déchets intéressent les unités de méthanisation et/ou sont jugés nécessaires à la restauration et conservation de la matière organique des sols cultivés dont pour lutter contre l'érosion et nourrir la microfaune du sol. Ils sont en outre souvent pollués par des pesticides. Jetés dans les fleuves ou sur les littoraux, ils pourraient aggraver certains problèmes de dystrophisation (efflorescences algales, marées vertes, pullulation de sargasses...), d'anoxie et de zones mortes[34].
- dissolution par injection de CO2 à au moins 1 000 m de profondeur, avec le risque de dispersion de ce carbone sous forme d'acide carbonique, et d'impacts mal maîtrisables liés à l'acidification de l'eau ;
- injection de CO2 sous très haute-pression dans des fosses marines (à au moins 3 000 m), où on espère que le CO2 formerait durant un certain temps un lac plus lourd que l’eau de mer, ralentissant sa dissolution du CO2 dans l'environnement. Cette solution a peu de soutiens en raison de ses impacts environnementaux certains sur la faune et les écosystèmes microbiens des grands fonds[37] ;
- conversion de CO2 en bicarbonates, hydrates ou matière organique, via le phytoplancton[38], pour induire une nécromasse riche en carbone sédimentant, qui est une dernière possibilité, mais les capacités maximales d'absorption naturelle de CO2 par l'océan semblent souvent déjà atteintes.
Stockage minéral
Le stockage sous forme stable et inertée (par exemple de carbonates insolubles : réaction du CO2 avec certains minéraux silicatés très réactifs tels que l'olivine ou la serpentine présent dans les roches basaltiques et mafiques et transformation en carbonate de magnésium ou de fer insoluble) est la solution évaluée la plus sûre et durable, mais pour le moment la plus coûteuse et techniquement non maîtrisée à grande échelle. Cette altération forcée est en particulier très coûteuse en énergie (selon le GIEC, en 2005). Avec les technologies actuelles, il faudrait augmenter de 60 à 180 % de la consommation de carburant des centrales thermiques, augmentation ne pouvant qu'être partiellement compensée par des technologies plus efficaces.
Des tests de minéralisation du CO2 sous forme de carbonates sont effectués sur le site de la centrale géothermique de Hellisheiði (Islande) dans le cadre du projet CarbFix. Le CO2 est injecté avec de l'eau à une profondeur comprise entre 400 et 800 m (il faut 25 tonnes d'eau par tonne de CO2 injecté) et réagit avec le calcium, le magnésium et le fer présents dans la roche pour former des carbonates. Plus de 95 % du CO2 injecté est minéralisé au bout de deux ans[39].
En 2023, une étude destinée à tester la faisabilité d'une séquestration à température ambiante du dioxyde de carbone dans des roches broyées révèle qu'il n'y pratiquement pas de carbonatation mais qu'il y a bien une séquestration par adsorption sur les surfaces et aux interfaces entre les minéraux (joints de grains). À la suite du broyage et de la rupture mécanique de liaisons chimiques au sein des minéraux concassés, de nouvelles surfaces chimiquement réactives sont formées. Des gaz, comme le CO2, peuvent alors se sorber préférentiellement sur ces surfaces nouvelles activées et s'y fixer de façon plus ou moins stable. On peut ainsi stocker 13,9 grammes de CO2 par kilogramme de roche dans du granite et 15,5 g/kg dans du basalte. Cette séquestration pourrait devenir un sous-produit de la fabrication de matériaux de construction si les granulats (ou agrégats) les composant peuvent être broyés sous atmosphère de CO2 pur, ou fortement enrichie avec ce gaz[40] - [41].
Autres processus expérimentaux
- La capture et la réduction du CO2 peuvent être réalisées par des micro-organismes cultivés en réacteur et le carbone stocké grâce à la biomasse produite (qui peut être éventuellement valorisée sous forme de matériaux bio sourcés, combustibles, produits chimiques, bio plastiques, isolants, etc.). L'échelle industrielle n'est pas encore atteinte, mais 29 micro-organismes ont été retenus sur environ 3 000 à Niederaussem (Allemagne) par une start-up de biotechnologies Brain AG, pour le compte de l'énergéticien RWE. Ces micro-organismes seraient les plus performants pour absorber de grandes quantités de CO2. Brain AG et RWE envisagent une commercialisation du procédé avant 2025[42].
- La séquestration dans des solides (MOF ou Metal–organic framework) ou liquides synthétiques sophistiqués est nettement moins prometteuse et peu économique à très grande échelle. Le téréphtalate de chrome (ou « mil-101 ») a été considéré comme un candidat théorique. Il est testé en laboratoire ; le plus performant vers mi-2008 (il peut aussi stocker du méthane). Sous forme d'une poudre (verte) ; un mètre cube de ce produit peut absorber – à haute pression (50 bars) et à 25 °C – environ 400 m3 de dioxyde de carbone (25 % de plus que les matériaux antérieurement disponibles)[43]. Cependant les quantités considérables de chrome ou de métaux lourds à engager à très grande échelle dans de tels procédés, leur relative rareté (et donc leur coût) et leur grande toxicité constituent autant de handicaps techniques et financiers probablement insurmontables, sans parler du bilan énergétique total généralement négatif et des quantités de CO2 prohibitives produites elles aussi par la synthèse de ces matériaux. Toutefois, des matériaux de synthèse à usage réversible peuvent s'avérer des outils industriels indispensables pour les opérations de séparation, de récupération et d'entreposage de courte durée du CO2 dans les usines de capture.
Risques et impacts environnementaux
Ils sont essentiellement sismiques (séisme induit) et liés aux risques de fuites durant la concentration et le transport puis le stockage à court, moyen ou long terme. Ces fuites peuvent affecter l'eau, l'air, les sols ou les nappes. Tous ces impacts sont environnementalement problématiques, mais encore difficiles à modéliser précisément faute de connaissance suffisante, notamment sur l'écologie des grands fonds et sur le fonctionnement écosystémique de l'océan mondial (en particulier sur les très nombreux virus marins qui « contrôlent » et limitent la croissance du plancton et les effets de la méthanisation).
- Les effets de l’augmentation du CO2 sur la vie benthique, bathypélagique et abyssalopélagique ou hadopélagique, en particulier de l'acidification sont encore peu étudiés. Peu de données concernent les capacités d'adaptation et de résilience des communautés vivantes à une fuite de CO2[44] - [45]. Mais on sait que le CO2, au-delà de certains seuils, est à la fois un asphyxiant, un eutrophisant et un acidifiant (il forme avec l’eau de l'acide carbonique (H2CO3). Il tuerait la plupart des formes de vies dans les zones où il serait massivement présent, dont dans les parties peu diluées du panache se formant au point de fuite). S’il diffusait en quantité ou durablement dans la colonne d'eau, il y attaquerait aussi certaines formes de vie planctonique, les coraux et roches calcaires (qui sont un puits de carbone).
- Le CO2 est un nutriment pour le phytoplancton, mais il sur-favorise le plancton non fixateur de calcium[46], et le dopage de l'activité planctonique qu'il induit peut rapidement se traduire par des zones marines mortes, une méthanisation accrue dans les sédiments et/ou la constitution d'hydrates de méthane dont le comportement en cas de réchauffement est encore inconnu, mais qui s'ils étaient brutalement relargués accéléreraient le réchauffement climatique.
- Une étude intégrée et multidisciplinaire de 2018 a porté sur les impacts écologiques de fuites de CO2 sur l'écosystème benthique marin, à partir d'une méta-analyse d'études expérimentales[47] et in situ[48]. Elle montre qu'une fuite de CO2 affecterait fortement les processus biogéochimiques, et la composition des communautés microbiennes et fauniques. La biodiversité de fonds marins naturellement ventilés par du CO2 géologique est en effet bien plus faible que celle des sables non-exposés[48]. Des flux de CO2 de 4 à 7 moles par m2 et par heure ont entièrement dissous le carbonate sédimentaire, et une migration conjointe du fer et des silicates a induit une dystrophisation (explosion du microphytobenthos de +450 %) et des stocks sur pied (+300 %)[48]. Et en dépit d'une disponibilité alimentaire apparemment accrue, la biomasse faunique a chuté de −80 % alors que la diversité trophique diminuait aussi par rapport au site de référence. La structure des communautés bactériennes et ses aspects fonctionnels ont aussi été bouleversés (ex. : modification de la part des hétérotrophes et effondrement de 90 % des sulfates microbiens)[48]. Ces modifications persistent tant que le taux de CO2 ne redescend pas[48].
- La vie semble discrète et clairsemée dans les grands fonds, mais elle est localement densément présente (sur les cadavres de cétacés, autour des sources chaudes), et de manière générale elle semble jouer un rôle majeur dans les processus de sédimentation et le cycle du carbone.
- Le temps moyen de circulation de l’eau des grands fonds vers la surface est estimée à 1 600 ans environ, mais avec de grandes variations possibles selon les lieux, les courants et l’activité volcanique sous-marine (l’effet d’un tsunami sous-marin sur un stockage en profondeur, ou d'un tremblement de terre sur les hydrates de méthane pourrait être important). Si du méthane gagnait brutalement et massivement la surface et l’atmosphère, il y accélérerait fortement le réchauffement, d’autant plus vite qu’il aurait au passage dégradé les puits biologiques océaniques de carbone (Cf Phénomène de zone morte).
Coûts
En France, selon les évaluations de Gaz de France citées dans un rapport parlementaire de 2006, la capture est la partie la plus coûteuse de l'opération (de 40 à 60 € la tonne de CO2), le coût du transport étant de 2 à 20 €/t de CO2, et le stockage ne comptant que pour de 0,5 à 10 €/t de CO2, pour un total compris entre 43 et 90 €/t de CO2. L'Industrie des hydrocarbures estime elle-même que seuls environ 10 % des émissions mondiales pourraient faire l'objet d'un stockage à des coûts raisonnables (à partir des grandes sources d'émissions, situées à une relative proximité de sites potentiels de stockage)[49].
Selon Antoine Frérot en 2014, alors PDG de Veolia, la capture et séquestration du carbone représenteraient un surcoût de 30 à 40 % de l'électricité produite, ce qui n'aurait rien d'excessif en comparaison des surcoûts de l'éolien et du solaire ; pour financer les investissements nécessaires, une taxation du CO2 d'au moins 40 €/tonne serait nécessaire, alors que le prix de marché se situait alors autour de 7 à 8 €/t[50].
Le , quatre grands énergéticiens européens : le français EDF, l'allemand RWE, le suédois Vattenfall et l'espagnol Gas Natural Fenosa se sont retirés du projet européen de développement des techniques de captage et de stockage du carbone (CCS) baptisé « plate-forme zéro émission » (ZEP), qui conseille la Commission européenne sur les techniques de captage et de stockage du carbone ; ils estiment qu'ils ne disposent pas actuellement du cadre économique nécessaire en Europe pour faire des CCS une technologie attractive pour l'investissement[51].
Le rapport du Grantham Institute sur la capture et séquestration du carbone (CCS) dans l'Union européenne, publié en , relève que la plupart des scénarios de réduction des émissions de gaz à effet de serre donnent une place majeure à la CCS ; c'est en particulier le cas de l'Energy Roadmap 2050 publiée en 2011 par la Commission européenne ; or les efforts du secteur public et du secteur privé pour la promouvoir ont été très faibles, le principal obstacle étant le coût d'investissement : 18 à 35 milliards d'euros pour les 11 GW prévus par l'Energy Roadmap pour 2030 et 160 à 320 Mds € pour les 100 GW prévus en 2050. Le prix du carbone devrait atteindre 35 à 60 €/tonne de CO2 pour rendre la CCS compétitive dans les centrales à charbon et 90 à 105 €/tCO2 pour les centrales à gaz naturel ; un système de prix garantis semblable à celui en vigueur pour les énergies renouvelables pourrait rendre la CCS compétitive à partir de 140 €/MWh pour le charbon et 190 €/MWh vers 2020, prix qui pourraient descendre à 110 €/MWh vers 2030 ; en comparaison, le gouvernement britannique garantit 190 €/MWh aux éoliennes offshore en 2014/15[52].
Lancé en 2019, le projet européen 3D rassemblant 11 partenaires sous la direction de l'IFPEN doit valider en démonstration l'usage d'un nouveau solvant permettant de faire baisser le coût de la capture à moins de 30 € la tonne[53].
Scénarios de l'Agence internationale de l'énergie
Dans le scénario « 2DS » de l'Agence internationale de l'énergie publié en 2015 dont l'objectif est de limiter à 2 °C le réchauffement climatique d'ici 2050, la capture et séquestration du carbone (CCS) contribue pour 13 % à la réduction cumulée des émissions de CO2 nécessaire pour atteindre cet objectif. Ceci représenterait la capture et le stockage d'environ 6 milliards de tonnes de CO2 par an en 2050, soit près du triple des émissions du secteur énergétique indien en 2015. La moitié de ces captures serait le fait des secteurs industriels, où contrairement au secteur électrique il n'existe pas ou peu de solutions alternatives pour réduire les émissions. Les centrales à charbon équipées de CCS pourraient être compétitives par rapport aux centrales à gaz en Asie vers 2030[54].
Selon le scénario « technologies propres » (CTS) de l'Agence internationale de l'énergie (2019), pour atteindre les engagements climatiques et énergétiques de l'Accord de Paris sur le climat, il faudrait stocker dans le monde 107 Gt CO2 (gigatonnes de dioxyde de carbone) entre 2015 et 2060[55].
Autres solutions de séquestration artificielle
Il a été proposé d'injecter dans les fonds océaniques une grande quantité de biomasse végétale dans les zones où des courants plongent vers les grands fonds, par exemple face à l'estuaire du Mississippi, au golfe du Mexique ou au Nil, mais on trouve déjà des zones mortes sur ces sites et le risque de conséquences écologiques inattendues est très important.
Des méthodes utilisant la catalyse ou inspirées des processus biochimiques naturels sont à l'étude, dont celui dit de la boucle chimique[56].
En France
Selon le Centre interprofessionnel technique d'études de la pollution atmosphérique (CITEPA) 2015 (p. 238), en 2013, 59 millions de tonnes de CO2 ont été séquestrées dans les écosystèmes forestiers (sous forme de lignine et cellulose d'arbre principalement) notamment grâce à l'extension des surfaces forestières inventoriées (qui représentent 95 % des surfaces forestières de métropole)[57]. Ce chiffre ne tient pas compte des variations de carbone des stocks de bois mort et des sols forestiers (qui auraient pu atteindre 27 millions de tonnes de CO2 en 2013). Ainsi la forêt de Métropole aurait pu absorber 86 millions de tonnes de CO2 (environ 17 % des émissions françaises de CO2 de 2013[58]).
En Guyane, la forêt séquestrerait actuellement peu de carbone (car proche de son équilibre) mais les mangroves et les herbiers des collectivités d'outre-mer pourraient en absorber 2,5 millions de tonnes de CO2 (en Nouvelle-Calédonie surtout)[57].
Notes et références
- (en) Climate Change 2021, The Physical Science Basis : Full Report, Groupe d'experts intergouvernemental sur l'évolution du climat, (lire en ligne), « Glossary », p. 2221.
- La société américaine Planktos espérait fin 2007 pour 5 euros piéger 1 tonne de carbone (théoriquement vendable 70 euros sur le marché) en épandant du fer dans l'océan, mais l'efficacité du processus n'a pas été à la hauteur (30 à 50 fois moins que prévu par l'entreprise). Source : Lise Barneoud, « Bras de fer avec la mer », Libération, .
- Centre national de la recherche scientifique, « Stockage du CO2 dans l'océan : de nouvelles données à prendre en compte dans les modèles de prévision du changement climatique », sur Futura, .
- @NatGeoFrance, « Changement climatique : comment absorber le CO2 présent dans l’atmosphère ? », sur National Geographic, (consulté le ).
- « Les Solutions fondées sur la Nature », sur UICN France (consulté le ).
- (en) A. J. Fynn, P. Alvarez, J. R. Brown, M. R. George, C. Kustin, E. A. Laca, J. T. Oldfield, T. Schohr, C. L. Neely et C. P. Wong, « Soil carbon sequestration in U.S. rangelands » [PDF], sur Organisation des Nations unies pour l'alimentation et l'agriculture, New York, Environmental Defense Fund, .
- R. F. Follett, J. M. Kimble et R. Lal, « The Potential of U.S. Grazing Lands to Sequester Carbon and Mitigate the Greenhouse Effect », (version du 28 septembre 2013 sur Internet Archive).
- Sylvain Coq et François-Xavier Joly, « Stockage du carbone : Le rôle insoupçonné du petit monde du sol », Pour la science, no 544, , p. 44-53 (présentation en ligne).
- (en) Andrews, Peter, Beyond the brink : Peter Andrews' radical vision for a sustainable Australian landscape, Sydney, ABC Books for the Australian Broadcasting Corporation, , 231 p. (ISBN 978-0-7333-2410-9), p. 40.
- (en) Christian Nellemann, Emily Corcoran, Carlos M. Duarte, Luis Valdrés, Cassandra De Young, Luciano Fonseca et Gabriel Grimsditch, « Blue Carbon - The Role of Healthy Oceans in Binding Carbon », Organisation des Nations unies pour l'environnement, GRID-Arendal, .
- (en) Negative Emissions Technologies and Reliable Sequestration : A Research Agenda, Washington, D.C., National Academies of Sciences, Engineering, and Medicine, , 45 p. (ISBN 978-0-309-48452-7, DOI 10.17226/25259, lire en ligne).
- (en) Sandra Brown et Ariel E. Lugo, « The Storage and Production of Organic Matter in Tropical Forests and Their Role in the Global Carbon Cycle », Biotropica, vol. 14, no 3, , p. 161-187 (DOI 10.2307/2388024).
- (en) World Resource Review, Institute for World Resource Research, , p. 464.
- FAO, Évaluation des ressources forestières mondiales 2010. Rapport Principal, FAO Éditions, , p. 13-14.
- Frédéric Mouchon, « Climat : pourquoi la forêt amazonienne rejette désormais plus de carbone que d‘oxygène », Le Parisien, (consulté le ).
- (en) Min Zhao, Zheng-hong Kong, Francisco J. Escobedo et Jun Gao, « Impacts of urban forests on offsetting carbon emissions from industrial energy use in Hangzhou, China », Journal of Environmental Management, vol. 91, no 4, , p. 807-813 (DOI 10.1016/j.jenvman.2009.10.010, lire en ligne).
- (en) Changfu Liu et Xiaoma Li, « Carbon storage and sequestration by urban forests in Shenyang, China », Urban Forestry & Urban Greening, (DOI 10.1016/j.ufug.2011.03.002, lire en ligne).
- « Public Welfare Forest » dans le texte.
- (en) Francisco Escobedo, Sebastian Varela, Min Zhao, John E. Wagner et Wayne Zipperer, « Analyzing the efficacy of subtropical urban forests in offsetting carbon emissions from cities », Environmental Science & Policy, vol. 13, no 5, , p. 362-372 (DOI 10.1016/j.envsci.2010.03.009, lire en ligne).
- (en) Robert F. Young, « Managing municipal green space for ecosystem services », Urban Forestry & Urban Greening, vol. 9, no 4, , p. 313-321 (DOI 10.1016/j.ufug.2010.06.007, lire en ligne).
- (en) David J. Nowak, « Institutionalizing urban forestry as a “biotechnology” to improve environmental quality », Urban Forestry & Urban Greening, vol. 5, no 2, , p. 93-100 (lire en ligne).
- (en) Francisco J. Escobedo, Timm Kroeger et John E. Wagner, « Urban forests and pollution mitigation: Analyzing ecosystem services and disservices », Environmental Pollution, vol. 159, nos 8-9, , p. 2078-2087 (lire en ligne).
- (en) David J. Nowak et Daniel E. Crane, « Carbon storage and sequestration by urban trees in the USA », Environmental Pollution, vol. 116, no 3, , p. 381-389 (DOI 10.1016/S0269-7491(01)00214-7, lire en ligne).
- (en-GB) Hannah Lewis, « Fast-growing mini-forests spring up in Europe to aid climate », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- (en) « Rubisco: structure, regulatory interactions, and possibilities for a better enzyme », Annual Review of Plant Biology, vol. 53, , p. 449–75 (PMID 12221984, DOI 10.1146/annurev.arplant.53.100301.135233).
- « The global distribution of ecosystems in a world without fire », New Phytologist, vol. 165, no 2, , p. 525–38 (PMID 15720663, DOI 10.1111/j.1469-8137.2004.01252.x).
- Osborne et Beerling, « Nature's green revolution: the remarkable evolutionary rise of C4 plants », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 361, no 1465, , p. 173–94 (PMID 16553316, PMCID 1626541, DOI 10.1098/rstb.2005.1737).
- Leegood RC., « C4 photosynthesis: principles of CO2 concentration and prospects for its introduction into C3 plants », Journal of Experimental Botany, vol. 53, no 369, , p. 581–90 (PMID 11886878, DOI 10.1093/jexbot/53.369.581).
- Mitsue Miyao, « Molecular evolution and genetic engineering of C4 photosynthetic enzymes », Journal of Experimental Botany, vol. 54, no 381, , p. 179–89 (PMID 12493846, DOI 10.1093/jxb/54.381.179).
- David Beerling, The Emerald Planet : How Plants Changed Earth's History, Oxford University Press, , 194–5 p. (ISBN 978-0-19-954814-9).
- http://www.insu.cnrs.fr/node/7513.
- (en) Blain S., Quéguiner, B., Armand, L.K., Belviso, S., Bombled, B., Bopp, L., Bowie, A., Brunet, C., Brussaard, C., Carlotti, F., Christaki, U., Shreeve R.S., Corbière, A., Durand, I., Ebersbach, F., Fuda, J.L., Garcia, N., Gerringa, L., Griffiths, B., Guigue, C., Guillerm, C., Jacquet, S., Jeandel, C., Laan, P., Lefèvre, D., Lomonaco, C., Malits, A., Mosseri, J., Obernosterer, I., Park, H.Y., Picheral, M., Pondaven, P., Remenyi, T., Sandroni, V., Sarthou, G., Savoye, N., Scouarnec, L., SouhautM., Thuiller, D., Timmermans, K., Trull, T., Uitz, J., Van-Beek, P., Veldhuis, M., Vincent, D., Viollier, E., Vong, L. et Wagener, T., « Impact Of Natural Iron Fertilisation On Carbon Sequestration In The Southern Ocean », Nature, vol. 446, , p. 1070-1074 (DOI 10.1038/nature05700).
- Institut de recherche sur l’eau et l’atmosphère, et Université d'Otago (Nouvelle-Zélande, Page personnelle, avec biblio).
- Stuart E. Strand et Gregory Benford, « Ocean Sequestration of Crop Residue Carbon: Recycling Fossil Fuel Carbon Back to Deep Sediments », Environmental Science & Technology, vol. 43, no 4, , p. 1000–1007 (PMID 19320149, DOI 10.1021/es8015556, lire en ligne).
- Baker J.M, Ochsner T.E, Venterea R.T & Griffis T.J (2007) Tillage and soil carbon sequestration - What do we really know Agric. Ecosyst. Environ., 118 (1−4) 1– 5.
- Pimentel D, Hepperly P, Hanson J, Douds D & Seidel R (2005) Environmental, energetic, and economic comparisons of organic and conventional farming systems| Bioscience, 55 (7) 573– 582.
- (en) S. M. Benson et T. Surles, « Carbon Dioxide Capture and Storage: An Overview With Emphasis on Capture and Storage in Deep Geological Formations », Proceedings of the IEEE, vol. 94, no 10, , p. 1795–1805 (ISSN 0018-9219, DOI 10.1109/JPROC.2006.883718).
- V. R. Johnson, C. Brownlee, R. E. M. Rickaby, M. Graziano, M. Milazzo et J. M. Hall-Spencer, « Responses of marine benthic microalgae to elevated CO2 », Mar. Biol., vol. 160, , p. 1813–1824.
- Sciences et Vie, octobre 2016, N° 1189, pages 102-103.
- (en) Andrew Grant, « A mineralogical carbon-capture method works—but not the way we thought », Physics Today, (DOI 10.1063/PT.6.1.20230328a
 ).
). - (en) Mark Stillings, Zoe K. Shipton et Rebecca J. Lunn, « Mechanochemical processing of silicate rocks to trap CO2 », Nature Sustainability (en), (DOI 10.1038/s41893-023-01083-y).
- Édith Chezel, « Bulletin électronique Allemagne 554 : Des microorganismes mangeurs de CO2 produisent de nouvelles ressources valorisables », sur Agence pour la diffusion de l'information technologique, (version du 7 juillet 2012 sur Internet Archive).
- Langmuir, prépublication en ligne, 2008, reprise par le journal Pour la science, juillet 2008.
- J.P Gattuso & al. (2015) Contrasting futures for ocean and society from different anthropogenic CO2 emissions scenarios. Science 349, aac4722.
- S. Widdicombe & al. (2015) Impact of sub-seabed CO2 leakage on macrobenthic community structure and diversity. Int. J. Greenh. Gas Control. 38, 182–192.
- B.M Hopkinson, C.L Dupont, A.E Allen & F.M.M Morel (2011) Efficiency of the CO2-concentrating mechanism of diatoms. Proc. Natl. Acad. Sci. U.S.A. 108, 3830–3837.
- ex : A. Lichtschlag, R.H James, H Stahl, D Connelly (2015) Effect of a controlled sub-seabed release of CO2 on the biogeochemistry of shallow marine sediments, their pore waters, and the overlying water column. Int. J. Greenh. Gas Control. 38, 80–92.
- (en) Massimiliano Molari et al., « CO2 leakage alters biogeochemical and ecological functions of submarine sands », Science Advances, vol. 4, no 2, (DOI 10.1126/sciadv.aao2040, lire en ligne).
- Christian Bataille et Claude Birraux, « Les nouvelles technologies de l'énergie et la séquestration du dioxyde de carbone : aspects scientifiques et techniques » [PDF], sur Assemblée nationale, , p. 20.
- Antoine Frérot : « L'Europe a beaucoup d'atouts pour développer les bonnes solutions », Les Échos, 23 septembre 2014.
- Stockage du CO2 : les énergéticiens se retirent d’un projet européen, Les Échos, 20 janvier 2015.
- (en) [PDF] Bridging the gap : improving the economic and policy framework for carbon capture and storage in the European Union, Sciences blog, juin 2015.
- E.G, « Un pilote de captage de CO2 d'origine industrielle est lancé à Dunkerque », sur environnement-magazine.fr, (consulté le ).
- (en)Carbon Capture and Storage: The solution for deep emissions reductions, Agence internationale de l'énergie, 2015.
- (en) Agence internationale de l'énergie Exploring Clean Energy Pathways ; The Role of CO2 Storage ; Exploring Clean Energy Pathways, 22 juillet 2019.
- « IFPEN | Captage du CO2 : mieux comprendre le Chemical Looping Combustion (CLC) », sur IFPEN (consulté le )
- CGDD (Commissariat général au développement durable) « Rapport intermédiaire de l'évaluation française des écosystèmes et des services écosystémiques » (Efese), publié mi-décembre 2016.
- hors secteur UTCATF.
Voir aussi
Bibliographie
- INRA, Stocker du carbone dans les sols agricoles de France ? (Expertise scientifique collective – rapport d’expertise sur demande du ministère de l’écologie et du développement durable),
- Alterre Bourgogne, Stockage naturel du carbone : état des lieux des connaissances et estimations régionales,
- Lal R. (2018) Management of Carbon Sequestration in Soil: 0. CRC Press, 473 p., eBook (ISBN 9781351082709)
- Douglas Fox, « Séquestration du CO2 : La piste d'Oman », Pour la science, no 531, , p. 64-73
- (en) Muhammad Ali, Nilesh Kumar Jha, Nilanjan Pala, Alireza Keshavarz, Hussein Hoteit et Mohammad Sarmadivaleh, « Recent advances in carbon dioxide geological storage, experimental procedures, influencing parameters, and future outlook », Earth-Science Reviews (en), vol. 225, , article no 103895 (DOI 10.1016/j.earscirev.2021.103895, lire en ligne
 , consulté le )
, consulté le )
Articles connexes
Présentation
- Jean-François Soussana & al (2016) Séquestration de carbone dans le sol : les enjeux du ‘4/1000’ ; INRA, aux rencontres professionnelles de RITMO, PDF, 25 pages
