Champignon mycorhizien arbusculaire
Un champignon mycorhizien arbusculaire (ou endomycorhizien), ou CMA est un champignon symbiote de nombreuses plantes terrestre[1], qui produit un type de mycorhize particulier, où le champignon symbiote (champignons AM, ou CMA) pénètre dans les cellules corticales des racines d'une plante vasculaire en formant des arbuscules (à ne pas confondre avec l' ectomycorhize ou la mycorhize éricoïde).

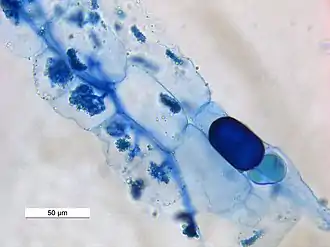
Un cas particulier est le champignon ectendomyrorhizien qui produit de ectendomycorhizes, c'est-à-dire des mycorhizes possédant à la fois des ectomycorhizes, où les hyphes forment un manteau (ou manchon fongique autour de la racine et des endomycorhizes, avec le développement d'haustoriums endocellulaires, pénétrant dans les cellules corticales).
Les mycorhizes arbusculaires sont caractérisées par la formation de structures uniques, d'arbuscules et de vésicules par Glomeromycota et Mucoromycota, clades sœurs des champignons dicaryens les plus connus et les plus divers (tous les trois sont appelés ensemble « symbiomycota »).
Les champignon mycorhizien arbusculaire (CMA ) aident grandement les plantes à capter les nutriments tels que l'eau, le phosphore, le soufre, l'azote et les micronutriments du sol. La symbiose mycorhizienne arbusculaire a probablement joué un rôle crucial dans la colonisation initiale des terres émergées par les plantes, puis dans l'évolution des plantes vasculaires[2]. On dit qu'il est plus rapide d'énumérer les plantes qui ne forment pas d'endomycorhizes que celles qui le font[3] ; Ce serait la symbiose végétale connue la plus fréquent[4] ; le CMA se vivent en symbiose avec 80% des familles de plantes vasculaires aujourd'hui décrites[5].
Les progrès de la recherche en physiologie et en écologie mycorhizienne depuis les années 1970 ont permis de mieux comprendre les multiples rôles écosystémiques du CMA, et la manière dont ils défendent leur plante hôte. Un exemple est la contribution importante de la glomaline, une protéine ressemblant à de la colle, à la structure du sol (voir ci-dessous). Ces connaissances intéressent notamment l'écologie de la restauration, la sylviculture et l'agriculture .
Évolution de la symbiose mycorhizienne
_colonization.png.webp)
Le réseau d'hyphes des CMA s'étend au-delà de la zone d'appauvrissement (gris), accédant à un plus grand volume de sol pour l'absorption de phosphate. Une zone d'appauvrissement en phosphate mycorhizien finira également par se former autour des hyphes MA (violet). D'autres nutriments ayant une meilleure assimilation dans les racines colonisées par un CMA sont notamment l'azote (ammonium), le zinc et le cuivre. Les avantages de la colonisation comprennent des tolérances à de nombreux stress abiotiques et biotiques grâce à l'induction d'une résistance systémique acquise.[6]
Paléobiologie
Des preuves paléobiologiques et moléculaires indiquent que la MA (mycorhisation arbusculaire) est née il y a au moins 460 millions d'années. Le caractère omniprésent parmi les plantes terrestres de la symbiose par MA suggère que les mycorhizes étaient présentes chez les premiers ancêtres des plantes terrestres existantes et qu'elles ont facilité le développement des plantes et écosystèmes terrestres[4].
Le chert Rhynie du Dévonien inférieur a livré des fossiles siliceux des premières plantes terrestres dans lesquelles des traces de champignons MA sont observées[7].
Le Dévonien inférieur a vu le développement de la flore terrestre. Les plantes du chert Rhynie du Dévonien inférieur (il y a 400 millions d'années) se sont avérées contenir des structures ressemblant à des vésicules et des spores des espèces actuelles de Glomus. Des racines fossiles colonisées ont été observées chez Aglaophyton major et Rhynia, qui sont des plantes anciennes possédant des caractéristiques de plantes vasculaires et de bryophytes à rhizomes protostéliques primitifs[7].
Du mycélium intraracinaire a été observé dans les espaces intracellulaires des racines, et des arbuscules ont été observés dans les cellules à paroi mince de la couche similaires au parenchyme palissadique. Les arbuscules fossiles semblent très similaires à celles des CMA existants[7]. Les cellules contenant des arbuscules ont des parois épaissies, phénomène aussi observé dans les cellules colonisées existantes.
Les mycorhizes du Miocène présentent une morphologie vésiculaire proche de celle des Gloméraux actuels. Cette morphologie conservée peut refléter la disponibilité immédiate des nutriments fournis par les plantes hôtes dans les mutualismes modernes et miocènes[8].
L'efficacité des processus de signalisation a probablement évolué depuis le Miocène, ce qui ne peut être détecté dans les archives fossiles. On suppose qu'un réglage fin des processus de signalisation a pu améliorer la coordination, et l'échange de nutriments et autres molécules utiles entre les symbiotes ; au profit d'un meilleure vitalité des champignons et des symbiotes végétaux.
La nature de la relation entre les plantes et les ancêtres des champignons mycorhiziens à arbuscules est controversée. Deux hypothèses sont :
- La symbiose mycorhizienne aurait évolué à partir d'une interaction parasitaire qui s'est développée en une relation mutuellement bénéfique ;
- Les champignons mycorhiziens se seraient développés à partir de champignons saprobies devenus endosymbiotiques[7].
Des saprotrophes et des biotrophes ont été trouvés dans le Rhynie Chert, mais il y a peu de preuves pour étayer l'une ou l'autre hypothèse.
Des preuves fossiles suggèrent que les champignons parasites n'ont pas tué les cellules hôtes immédiatement après l'invasion, bien qu'une réponse à l'invasion ait été observée dans les cellules hôtes. Cette réponse pourrait avoir évolué vers les processus de signalisation chimique nécessaires à la symbiose[7].
Dans les deux cas, l'interaction symbiotique plante-champignon aurait pu évoluer d'une relation dans laquelle les champignons prenaient des nutriments à la plante, vers une relation d'échange mutuels symbiotique entre la plante et le champignons associé.
Preuve moléculaire
L'intérêt accru pour la symbiose mycorhizienne et le développement de techniques moléculaires sophistiquées ont conduit au développement rapide de preuves génétiques.
Wang et al. (2010) ont étudié les gènes végétaux impliqués dans la communication avec les partenaires fongiques de l'ordre Glomales (DMI1, DMI3, IPD3)[9] - [10]. Ces trois gènes pourraient être séquencés à partir de tous les principaux clades de plantes terrestres modernes, y compris les hépatiques, le groupe le plus basal. La phylogénie de ces trois gènes s'est avérée en accord avec les phylogénies actuelles des plantes terrestres. Ceci indique que les gènes mycorhiziens doivent avoir été présents chez l'ancêtre commun des plantes terrestres et qu'ils doivent avoir été hérités verticalement depuis que les plantes ont colonisé la terre[9].
Symbiose entre champignons MA et cyanobactéries ?
Les champignons MA disposent d'un enzyme central de type bactérien (ribonucléase III) du mécanisme de traitement de l'ARNs éventuellement lié à la symbiose. Ils l'auraient acquis via un transfert de gène horizontal à partir d'un ancêtre cyanobactérien. Cette découverte de fossiles génétiques à l'intérieur des champignons MA soulève l'hypothèse d'une relation intime entre les champignons MA et les ancêtres des cyanobactéries contemporaines. Une symbiose Geosiphon – Nostoc a d'ailleurs été signalée précédemment[11].
Évolution de l'horloge circadienne chez les champignons AM ?
Étonnamment, malgré leur longue évolution en tant que partenaire (essentiellement souterrain) de la racine de la plante, dans un environnement isolé des fluctuations de lumière et de température, les CMA ont toujours conservé une horloge circadienne, avec un oscillateur circadien fongique ( frq ) activé par la lumière bleue, similaire à celui du champignon modèle pour le rythme circadien : Neurospora crassa[12]. La conservation prouvée de l'horloge circadienne et des gènes de sortie chez R. irregulare ouvre la porte à l'étude des horloges circadiennes chez le partenaire fongique de la symbiose MA. Le gène CMA frq caractérisé par la même recherche [12] est le premier gène frq identifié hors groupe de Dikarya, ce qui suggère que l'évolution du gène frq dans le royaume fongique est beaucoup plus ancienne que celle précédemment étudiée.
Physiologie
Présymbiose
La phase de développement des champignons MA avant qu'il ne colonise des racines, est connu sous le nom de présymbiose. Cette phase comprend plusieurs étapes : la germination des spores, la croissance des hyphes, la reconnaissance de l'hôte et la formation de l' appressorium.
Germination des spores
Les spores des champignons CMA sont des structures de repos multinucléées à parois épaisses[14]. La germination de la spore ne dépend pas de la plante (ce spores germent en conditions expérimentales en l'absence de plantes à la fois in vitro et dans le sol. Mais le taux de germination est augmenté par les exsudats de la racine de l'hôte[15]. Les spores de CMA germent dans des conditions appropriées de la matrice du sol, de la température, de la concentration en dioxyde de carbone, du pH et de la concentration en phosphore[14].
Croissance des hyphes
La croissance des hyphes AM à travers le sol est contrôlée par les exsudats de la racine de l'hôte appelés strigolactones et le taux de phosphore du sol. Un sol pauvre en phosphore, dope la croissance et la ramification des hyphes, par une augmentation de l'exsudation par les plantes de composés qui contrôlent l'intensité de la ramification des hyphes[15] - [16].
La ramification des hyphes de CMA cultivés dans un milieu de phosphore de 1 mM est significativement réduite, mais la longueur du tube germinatif et la croissance totale des hyphes ne sont pas affectées.
Une concentration dix fois plus élevée (10 mM) de phosphore inhibe à la fois la croissance et la ramification des hyphes. Une telle concentration de phosphore se produit dans les conditions naturelles du sol et pourrait ainsi contribuer à réduire la colonisation mycorhizienne[16] (les phosphates des lessives ont été un polluant environnemental majeur, et les engrais phosphatés sont aussi des sources majeures de phosphore)
Reconnaissance de l'hôte
Les exsudats émis par les plantes hôtes de CMA cultivés dans un milieu liquide avec et sans phosphore affectent la croissance des hyphes.
Des spores de Gigaspora margarita ont été cultivées dans des exsudats de plantes hôtes. Les hyphes des champignons cultivés dans les exsudats de racines privées de phosphore ont poussé davantage et ont produit des branches tertiaires par rapport à ceux cultivés dans les exsudats de plantes ayant reçu suffisamment de phosphore. Lorsque les exsudats racinaires favorisant la croissance étaient ajoutés en faible concentration, les CMA produisaient des arbuscules en forme de longues 'branches' dispersées. Au fur et à mesure que la concentration d'exsudats augmentait, les champignons produisaient des branches plus étroitement groupées. Aux arbuscules les plus concentrés, les structures CMA d'échange de phosphore se sont formées[16].
Cette réponse chimiotaxique fongique aux exsudats des plantes hôtes augmente probablement l'efficacité de la colonisation des racines hôtes dans les sols à faible teneur en phosphore[15]. C'est a priori une adaptation des champignons leur permettant d'explorer efficacement le sol à la recherche d'une plante hôte appropriée[16].
Des chercheurs ont utilisé une membrane uniquement perméable aux hyphes de champignons. Au moyen de cette membrane, ils ont séparés des spores de Glomus mosseae de racines d'une plante hôte ; des racines de plantes non-hôtes ; et des racines d'une plante hôte morte.
Les hyphes du champignon n'ont traversé la membrane pour se développer dans une zone proche (800 µm) de la racine, uniquement dans le cas de leur plante-hôte, jamais vers les plantes non hôtes ou vers les racine de plantes mortes[17].
Voies de signalisation entre les mycorhizes arbusculaires et les racines des plantes.
En 2003, des techniques moléculaires ont permis de mieux les comprendre, montrant comment le CMA subit des changements physiologiques dès qu'il est exposé aux exsudats raçinaires d'une plantes hôte potentielle, changements qui lui permettent de la coloniser sans être repoussé par ses défenses immunitaires. Les exsudats des racines des plantes hôtes déclenchent et activent les gènes du CMA nécessaires à la respiration des composés carbonés des spores. Dans des expériences, le taux de transcription de 10 gènes a augmenté une demi-heure après l'exposition et à dess taux encore plus élevé après 1 heure et après 4 heures d'exposition, la MA répondant alors par une croissance morphologique. Ces gènes sont impliqués dans l'activité mitochondriale et la production d'enzymes. Le taux de respiration fongique, mesuré par le taux de consommation d'O2, a augmenté de 30 % trois heures après l'exposition aux exsudats racinaires, indiquant que ces exsudats stimulent l'activité mitochondriale des spores CMA. Ceci semble être une partie d'un mécanisme de régulation fongique qui conserve l'énergie des spores pour une croissance efficace et la ramification des hyphes lors de la réception de signaux d'une plante hôte potentielle[18].
Appressorium
Lorsque les hyphes fongiques mycorhiziens arbusculaires rencontrent la racine d'une plante hôte, un appressorium («structure d'infection») se forme sur l'épiderme de la racine.
Via cette structure, les hyphes peuvent pénétrer le cortex du parenchyme de l'hôte et s'y développer[19]. La MA n'a pas besoin de signaux chimiques de la plante pour former les appressoria. Les CMA peuvent former des appressoriums sur les parois cellulaires de cellules « fantômes » dont le protoplaste a été retiré pour éliminer toute signalisation entre les deux partenaires (champignons et plante hôte). Mais les hyphes ne pénètrent alors pas davantage dans les cellules et se développent vers le cortex racinaire. Ceci montre que des signaux entre symbiotes sont nécessaires pour une bonne colonisation de la plante par le champignon une fois les appressoriums formés[15].
Symbiose
Une fois introduit à l'intérieur du parenchyme, le champignon forme des structures très ramifiées pour l'échange de nutriments (phosphore, de carbone, et eau notamment)[14] avec la plante ; ce sont les arbuscules[19].
Deux formes d'hymnes sont :
le type Paris se caractérise par la croissance des hyphes d'une cellule à l'autre ;
le type Arum est caractérisé par la croissance d’hyphes dans l'espace intercellulaire (entre les cellules végétales)[20].
Le choix entre le type Paris et le type Arum semble principalement déterminé par la famille de plantes hôtes, bien que certaines familles ou espèces soient capables de générer l'un ou l'autre type[21] - [22].
La plante hôte exerce toujours un contrôle sur la prolifération des hyphes intercellulaires et sur la formation d'arbuscules. On observe une décondensation de la chromatine de la plante, qui indique une transcription accrue de l'ADN de la plante dans les cellules contenant des arbuscules[19]. Des modifications majeures sont nécessaires dans la cellule hôte de la plante pour accueillir et contrôler les arbuscules : les vacuoles rétrécissent et d'autres organites cellulaires prolifèrent et le cytosquelette des cellules végétales se réorganise autour des arbuscules.
Il existe deux autres types d'hyphes émergeant de la racine de la plante, une fois la colonisation effectuée par le CMA : des hyphes coureurs de courte durée se développent de la racine de la plante dans le sol ; ils absorbent le phosphore et les micronutriments, et les cèdent à la plante. Les hyphes de CMA ont un rapport surface / volume élevé, ce qui rend leur capacité d'absorption supérieure à celle des racines des plantes[23]. Les hyphes de CMA sont également plus fins que les racines ; ils peuvent pénétrer dans les pores du sol inaccessibles aux racines[24]. Le quatrième type d'hyphes de CMA se développe à partir des racines et colonise d'autres racines de plantes hôtes. Ces quatre types d'hyphes sont morphologiquement distincts[14].
Absorption et échange de nutriments
Les champignons CMA sont des symbiotes obligatoires. Ils ont une capacité saprobique limitée et dépendent de la plante pour leur nutrition en carbone[25]. Les champignons AM absorbent les produits de la photosynthèse de la plante hôte sous forme d'hexoses.
Le transfert de carbone de la plante aux champignons peut se produire par les arbuscules ou les hyphes intraradicaux[26]. La synthèse secondaire à partir des hexoses par AM se produit dans le mycélium intraradical. À l'intérieur du mycélium, l'hexose est converti en tréhalose et en glycogène. Le tréhalose et le glycogène sont des formes de stockage du carbone qui peuvent être rapidement synthétisées et dégradées et peuvent tamponner les concentrations de sucre intracellulaire[26]. L'hexose intraradical entre dans la voie oxydative des pentoses phosphates, qui produit des pentoses pour les acides nucléiques.
La biosynthèse des lipides se produit également dans le mycélium intraradical. Les lipides sont ensuite stockés ou exportés vers des hyphes extraradicaux où ils peuvent être stockés ou métabolisés. La décomposition des lipides en hexoses, connue sous le nom de gluconéogenèse, se produit dans le mycélium extraradical[26]. Environ 25% du carbone transféré de la plante aux champignons est stocké dans les hyphes extraradicaux[27]. Jusqu'à 20 % du carbone de la plante hôte peut être transféré aux champignons CMA[26]. Cela représente l'investissement considérable en carbone de la plante hôte dans le réseau mycorhizien et sa contribution au réservoir de carbone organique souterrain.
L'augmentation de l'apport de carbone de la plante aux champignons CMA augmente l'absorption et le transfert de phosphore des champignons à la plante[28]. De même, l'absorption et le transfert de phosphore sont réduits lorsque le photosynthate fourni aux champignons est diminué. Les espèces de CMA diffèrent dans leurs capacités à approvisionner la plante en phosphore[29]. Dans certains cas, les mycorhizes arbusculaires sont de mauvais symbiotes, fournissant peu de phosphore tout en absorbant des quantités relativement élevées de carbone[29].
Le principal avantage des mycorhizes pour les plantes a été attribué à une absorption accrue de nutriments (phosphore notamment). Cela peut être dû à une surface accrue en contact avec le sol, à un mouvement accru des nutriments dans les mycorhizes, à un environnement racinaire modifié et à un stockage accru[24]. Les mycorhizes peuvent être beaucoup plus efficaces que les racines des plantes pour absorber le phosphore. Le phosphore se déplace vers la racine ou via la diffusion et les hyphes réduisent la distance requise pour la diffusion, augmentant ainsi l'absorption. Le taux de phosphore s'écoulant dans les mycorhizes peut être jusqu'à six fois supérieur à celui des poils absorbants[24]. Dans certains cas, le rôle d'absorption du phosphore peut être entièrement pris en charge par le réseau mycorhizien, et tout le phosphore de la plante peut être d'origine hyphale[29]. On en sait moins sur le rôle de la nutrition azotée dans le système mycorhizien arbusculaire et son impact sur la symbiose et la communauté. Bien que des progrès significatifs aient été réalisés dans l'élucidation des mécanismes de cette interaction complexe, de nombreuses recherches restent à faire.
L'activité mycorhizienne augmente le taux de phosphore disponible dans la rhizosphère. Les mycorhizes abaissent le pH de la zone racinaire en absorbant sélectivement NH4+ (ions ammonium ) et en libérant des ions H+. La diminution du pH du sol augmente la solubilité des précipités de phosphore. L'absorption hyphale de NH4+ augmente également le flux d'azote vers la plante, car les surfaces internes du sol absorbent l'ammonium et le distribuent par diffusion[27].
Écologie
Biogéographie
Les champignons mycorhiziens arbusculaires sont les plus fréquents chez les plantes poussant sur des sols minéraux et revêtent une importance extrême pour les plantes poussant dans des substrats déficients en nutriments (ex : sols volcaniques et milieux dunaire et sableux. Les populations de CMA sont les plus importantes dans les communautés végétales à forte diversité (forêts tropicales humides) et dans les prairies tempérées où ils ont de nombreuses plantes hôtes potentielles et où ils peuvent tirer parti de leur capacité à coloniser une large gamme d'hôtes[30]. L'incidence de la colonisation mycorhizienne est plus faible dans les sols très arides ou riches en nutriments. Des mycorhizes ont aussi été observées dans les habitats aquatiques mais les sols gorgés d'eau diminuent la colonisation chez certaines espèces[30]. Les champignons mycorhiziens arbusculaires (CMA) sont retrouvés dans 80 % des espèces végétales[31] ; ils ont été étudiés sur tous les continents (sauf en Antarctique)[32] - [33]. La biogéographie des glomeromycota est a priori influencée par la limitation de leur dispersion[34] et par des facteurs environnementaux tels que le climat[32], la pédologie (type de sols et le pH du sol)[33], les nutriments du sol [35] et la communauté végétale[32] - [36].
Beaucoup d'études suggèrent que les CMA ne sont pas des spécialistes d'une seule espèce hôte[37], des études montrent qu'en zone tropicale, il y a une grande diversité et d'énormess variation détectées selon les lieux et points temporels, indiquant que les types de champignons MA sont écologiquement distincts et pourraient donc influencer le recrutement et la composition des hôtes dans les forêts tropicales[38] ; au moins certains taxons de champignons sont des spécialistes de l'hôte [38].
Il reste encore de nombreuses espèces de CMA à découvrir, et l'écologie des champignons mucoromycotiniens, qui forment des mycorhizes arbusculaires «endophytes à racines fines», est encore largement inconnue.
Réponse aux communautés végétales
La spécificité, la gamme d'hôtes et le degré de colonisation des champignons mycorhiziens sont difficiles à analyser sur le terrain en raison de la complexité des interactions entre les champignons au sein d'une racine et au sein du système rhizosphérique. I
Aucune preuve ne montre clairement que les CMA présentent une spécificité pour la colonisation d'espèces végétales hôtes potentielles MA, comme c'est le cas pour les pathogènes fongiques vis à vis de leurs plantes hôtes[30]. Cela pourrait résulter du jeu des pressions sélectives.
Dans le cas des relations pathogéniques, la plante hôte peut bénéficier de mutations empêchant la colonisation, alors que, dans une relation symbiotique mutualiste, la plante doit bénéficier de mutations permettant au contraire la colonisation par le CMA[30].
Mais les espèces végétales diffèrent dans l'étendue et dans leur degré de dépendance à la colonisation par certains champignons MA, et certaines plantes peuvent être des mycotrophes facultatives, tandis que d'autres peuvent être des mycotrophes obligatoires[30].
Récemment, le statut mycorhizien a aussi été relié à la distribution des plantes[39]: les plantes mycorhiziennes obligatoires occupent des habitats plus chauds et/ou plus secs, alors que les plantes mycorhiziennes facultatives occuperaient une gamme d'habitats plus large.
La capacité d'un même champignon MA à coloniser de nombreuses espèces de plantes a des implications écologiques : des plantes d'espèces différentes peuvent être reliées sous terre à un réseau mycélien commun[30]. Une plante peut alors fournir le carbone d'origine photosynthétique pour l'établissement du réseau mycélien qu'une autre plante d'une espèce différente peut utiliser pour l'absorption des minéraux. Cela implique que les mycorhizes arbusculaires sont capables d'équilibrer les interactions végétales intra et interspécifiques souterraines[30].
Les champignons Glomeromycota vivant à l'intérieur des racines des plantes, ils sont considérablement influencés par leur plante hôte ; et en retour, ce couple affecte également la communauté végétale. Les plantes peuvent allouer jusqu'à 30 % de leur carbone photosynthétique aux champignons MA[40] et, en retour, les champignons AM peuvent apporter jusqu'à 80 % du phosphore et de l'azote dont les plantes ont besoin[31]. La diversité des communautés fongiques MA a été positivement liée à la diversité des plantes[41], à la productivité des plantes [42] et à la pression de l'herbivorie[43]. Les champignons mycorhiziens arbusculaires (CMA) peuvent être influencés par des interactions à petite échelle avec la communauté végétale locale. Ainsi, le voisinage des plantes autour d'une plante focale peut modifier les communautés fongiques MA [44], tout comme l'ordre d'établissement des plantes dans les sites[45].
Champignons MA et invasion de plantes
Lors d'invasions d'espèces végétales, la communauté fongique MA et la biomasse peuvent être radicalement modifiées.
En général, la biomasse et la diversité des champignons MA diminuent avec les invasions[46] - [47] - [48]. Mais certaines espèces végétales mycotrophes peuvent en fait augmenter la diversité fongique MA lors de l'invasion[49].
Le statut mycorhizien des espèces végétales envahissantes varie souvent d'une région à l'autre, pour des raisons encore mal comprises. Ainsi, au Royaume-Uni et en Europe centrale récemment, les plantes envahissantes e sont montrées plus fréquemment mycorhizées que prévu[39] - [50] alors qu'inversement, les plantes envahissantes en Californie se sont révélées être moins fréquemment mycorhizées que prévu[51].
Interactions entre les champignons MA et d'autres symbiotes végétaux
Les symbiotes d'une plante hôte interagissent entre eux, souvent de manière imprévisible.
Selon une méta-analyse (2010), les plantes colonisées à la fois par les champignons AM et les endophytes transmis verticalement sont souvent plus grandes que les plantes colonisées indépendamment par l'un ou l'autre de ces symbiotes[52]. Cependant, cette relation dépend du contexte car les champignons MA peuvent interagir de manière synergique avec les endophytes fongiques habitant les feuilles de leur plante hôte[53] - [54] ou de manière antagoniste[55] - [56] - [57].
Des gammes similaires d'interactions peuvent se produire entre les champignons MA et les champignons ectomycorhiziens et d'autres organismes endophytes[58].
Réponse aux gradients environnementaux
Les espèces et comportements de champignons mycorhiziens arbusculaires (CMA) varient selon de nombreux gradients environnementaux. Leur tolérance à la congélation et à la déshydratation est connue pour varier entre les taxons fongiques MA[59]. Les champignons MA se font aussi plus rares et moins diversifiés là où les taux de nutriments et d'humidité du sol sont plus élevés[60] probablement parce que dans ces deux contextes, les plantes allouent moins de carbone aux champignons MA (dont elles ont ici moins besoin), et que les champignons MA réaffectent leurs ressources aux hyphes intraracinaires dans ces conditions environnementales[61]. À long terme, ces conditions environnementales peuvent créer une adaptation locale entre les plantes hôtes, les champignons MA, en fonction des taux de nutriments dans le sol[62]. En général, la variété des CMA diminue vers les sommets des( montagnes par rapport aux altitudes plus basses), ce qui serait le reflet de la diminution du nombre d'espèces végétales avec l'altitude[63].
Il est démontré que les champignons MA améliorent la tolérance des plantes aux facteurs environnementaux abiotiques, dont la salinité ; Ils atténuent le stress salin et favorisent ainsi la croissance et la productivité des plantes[64].
Écologie de la rhizosphère
La rhizosphère est la zone du sol directement formée et influencée par les racines et les microorganismes associés qui font partie du microbiote des plantes. La mycorrhizosphère est la rhizosphère des racines mycorhizées[65] - [66], une zone privilégiée qui héberge une énorme population de microorganismes saprophytes fongiques ou bactériens, en général plus abondante que dans un sol ''témoin éloigné des mycorhizes[67]. Cette couche du sol joue un rôle majeur pour les cycles biogéochimiques et en particulier pour le cycle du carbone.
La symbiose MA (mycorhizienne arbusculaire) affecte la communauté et la diversité des autres organismes du sol, via la libération d'exsudats, ou indirectement via un changement dans l'espèce végétale et le type et/ou la quantité d'exsudats végétaux[68].
La diversité des mycorhizes augmente la diversité des espèces végétales à mesure que le nombre potentiel d'associations augmente ; les champignons mycorhiziens arbusculaires dominants peuvent empêcher l'invasion de plantes non mycorhiziennes sur les terres où ils ont établi une symbiose et favoriser leur hôte mycorhizien[69].
On a récemment montré que les CMA libèrent un facteur de diffusion non identifié, dit facteur myc, qui active le gène inductible du facteur de nodulation MtEnod11, gène connu pour être impliqué dans l'établissement de la symbiose avec la bactérie rhizobienne fixatrice d'azote (Kosuta et al. 2003). Quand des bactéries rhizobium sont présentes dans le sol, la colonisation mycorhizienne augmente en raison d'une augmentation de la concentration des signaux chimiques impliqués dans l'établissement de la symbiose (Xie et al. 2003). Des molécules similaires aux facteurs Nod ont été isolées à partir de champignons AM et se sont avérées induire MtEnod11, la formation de racines latérales et améliorer la mycorhization[70]. Une colonisation mycorhizienne efficace peut augmenter les nodulations et la fixation symbiotique de l'azote par les légumineuses mycorhiziennes[27].
L'étendue de la colonisation mycorhizienne arbusculaire et des espèces affectent la population bactérienne dans la rhizosphère[71]. Les espèces bactériennes diffèrent dans leurs capacités à concourir pour les exsudats racinaires riches en carbone d'origine photosynthétique. Un changement dans la quantité ou la composition des exsudats racinaires et des exsudats fongiques dû à la colonisation mycorhizienne existante détermine la diversité et l'abondance de la communauté bactérienne dans la rhizosphère[68].
L'influence des champignons MA sur la croissance des racines et des pousses a aussi un effet indirect sur les bactéries de la rhizosphère. Les CMA leur apportent une quantité substantielle de carbone, via la croissance puis la dégénérescence du réseau d'hyphes. Il existe également des preuves suggérant que les champignons AM peuvent jouer un rôle important dans la médiation de l'effet spécifique de l'espèce végétale sur la composition bactérienne de la rhizosphère[68].
Glomeromycota et changement climatique global
Le changement climatique mondial et ses conséquences en termes de désertification, salinisation, inondations, érosion et dégradation des sols... affectent les communautés fongiques MA ainsi que les interactions entre ces champignons MA et leurs plantes hôtes. Il est généralement admis que les interactions entre les organismes affecteront leur réponse au changement climatique mais on ne peut actuellement prédire le résultat de ces interactions dans les climats futurs[72]. Des méta-analyses récentes laissent penser que les champignons MA augmenteraient la biomasse végétale en contexte de sècheresse et la diminuaient en situation de dépôt d'azote simulées[73] - [74]. Il a été démontré que les champignons mycorhiziens arbusculaires eux-mêmes augmentent leur biomasse en réponse à une élévation du CO2 atmosphérique[75], mais qu'ils régressent dans un sol engorgé.
Plantes sans mycorhizes arbusculaires
Les membres de la famille de la moutarde ( Brassicaceae ), tels que le chou, le chou-fleur, le canola et le crambe, n'acceptent pas de champignons mycorhiziens arbusculaires dans leurs racines[76].
Analyses génétiques moléculaires des champignons mycorhiziens à arbuscules
Depuis les années 1990, les technologies et les outils de génétique moléculaire ont fait des progrès spectaculaires, permettant aux écologues étudiant le monde microbien et mycorhizien de poser de nouvelles questions et hypothèses sur les rôles écologiques et évolutifs des champignons mycorhiziens arbusculaires (MA) en tant qu'individus et groupe, dans les communautés et les écosystèmes.
L'analyse génétique des champignons MA permet d'explorer la structure génétique de spores uniques via un génotypage multilocus[77], d'étudier la diversité et les adaptations de CMA dans plusieurs communautés de prairies[78], jusqu'à une enquête mondiale sur la diversité des CMA, qui a considérablement augmenté la diversité moléculaire décrite au sein du phylum Glomeromycota[79].
Les communautés microbiennes sont ainsi étudiées à des échelles beaucoup plus fines et fonctionnelles et potentiellement avec plus de confiance que par les méthodes précédentes. Pour identifier un CMA il fallait autrefois end extraire des spores du sol et en analyser la morphologie [80]. Or, certaines espèces de CMA ne sporulent pas ou très peu ou saisonnièrement, ou sont presque incultivables ou sont multinucléées [81] ou présentent une forte variation génétique au sein de l'espèce[82] et il n'y avait pas de moyen de déterminer si le CMA étai actif / fonctionnel et impliqué dans une fonction écologique ou écosystémique importante. L'identification et la quantification des symbiotes fongiques associés à une plante était impossible.
Cependant, bien que l'analyse génétique des communautés fongiques AM ait beaucoup progressé au cours de la dernière décennie, la méthodologie n'est pas encore complètement affinée. Vous trouverez ci-dessous un aperçu des méthodes utilisées dans les analyses génétiques moléculaires des champignons AM, ainsi que des applications à la recherche, des orientations futures et certains de leurs problèmes.
ADN/ARN
Les analyses génétiques de champignons MA à partir d'échantillons de sol et de racines varient dans leur applicabilité pour répondre à des questions écologiques ou phylogénétiques. Les analyses d'ADN utilisent divers marqueurs nucléaires pour décrire les champignons MA et représentent différentes régions de l'opéron ribosomique nucléaire ( ARNr 18S ) trouvé dans tous les organismes eucaryotes. Elle a commencé au début des années 1990 [83] et continue à se développer. Le gène de l'ARNr de la petite sous-unité (SSU), le gène de l'espaceur transcrit interne ( ITS ) et le gène de l'ARNr de la grande sous-unité (LSU) sont actuellement les marqueurs d'ADN les plus couramment utilisés. La région SSU a été utilisée le plus fréquemment dans les études écologiques[84] tandis que les régions ITS et LSU ont été principalement utilisées dans les constructions taxonomiques du phylum Glomeromycota[85].
qPCR et qRT-PCR
La PCR en temps réel ou PCR quantitative (qPCR) permet d'amplifier rapidement et de quantifier simultanément l'ADN de champignons MA ciblé à partir d'échantillons biologiques (racines de plantes, ou sol). Des développements assez récents dans les marqueurs qPCR permettent aux chercheurs d'explorer l'abondance relative des espèces fongiques MA dans les racines dans des expériences en serre ainsi que sur le terrain pour identifier les communautés fongiques MA locales.
Les marqueurs qPCR pour les champignons mycorhiziens à arbuscules consisteront en des amorces spécifiques à l'AM et des sondes d'hydrolyse marquées par fluorescence. Ces amorces spécifiques aux CMA peuvent être choisies par le chercheur en fonction de la question à résoudre, des ressources disponibles.
Micropuce
L'analyse par puces à ADN permet de mesurer simultanément l'expression de nombreux gènes à partir d'espèces cibles ou d'échantillons expérimentaux.
La technologie la plus utilisée est celle des micropuces FGA (functional gene array) contenant des sondes pour les gènes qui sont fonctionnellement importants dans les processus microbiens tels que le cycle du carbone, le cycle de l'azote ou le cycle du phosphore. Les FGA peuvent examiner simultanément de nombreux gènes fonctionnel[86]. Elle peut être complétée par le séquençage génétique, et alors permettre des déductions sur le lien entre la composition de la communauté fongique et les fonctionnalités microbiennes.
PLFA / NLFA
Des signatures chimiques d'organismes spécifiques peuvent être utilisées pour détecter la biomasse d'organismes cryptiques, tels que les champignons AM ou les bactéries du sol.
Les lipides, plus précisément les phospholipides et les lipides neutres, contiennent des acides gras reliés à un squelette glycérol. La composition en acides gras des organismes varie et les proportions d'acides gras spécifiques peuvent être spécifiques à l'organisme. Par exemple, dans les champignons MA, la proportion d'acides gras, 16:1ω5 et 18:1ω7, dans la partie phospholipidique représente environ 58 % de la composition totale en acides gras[87]. L'acide gras 16:1ω5 est l'acide le plus couramment utilisé pour caractériser les champignons MA dans les sols, et peut être utilisé comme un indicateur fort de la biomasse mycélienne dans l'échantillon de sol[87].
L'analyse des acides gras lipidiques neutres des champignons MA est généralement utilisé pour évaluer le stockage d'énergie, et, plus important, le rapport entre NLFA (16:1ω5) et PLFA (16:1ω5) peut potentiellement être utilisé pour indiquer l'état nutritionnel du CMA dans le sol. L'énergie est principalement stockée dans les champignons MA sous forme de lipides neutres dans des structures de stockage comme les spores et les vésicules. De ce fait, la NLFA est assez bien corrélée avec le nombre de spores dans un volume de sol donné[87]. Le rapport de la concentration en NLFA à la concentration en PLFA (mycélium actif) peut alors donner la proportion de carbone allouée aux structures de stockage (spores, mesurées en NLFA).
Les problèmes liés aux analyses des acides gras lipidiques comprennent :
- la spécificité incomplète des acides gras pour les champignons MA ;
- la variation spécifique à l'espèce ou au genre de la composition en acides gras, qui peuvent compliquer l'analyse dans les cas où plusieurs espèces de champignons MA cohabitent (par exemple, dans le sol des champs) ;
- les niveaux de fond élevés de certaine concentration d'acides gras dans les sols ;
- le fait que les phospholipides sont corrélés à la surface de la membrane d'un organisme, et que le rapport surface / volume peut varier considérablement entre les organismes tels que les bactéries et les champignons[88].
Des travaux supplémentaires sont donc nécessaires pour identifier l'efficacité de cette méthode dans les sols de champs avec de nombreux genres et espèces de champignons AM afin de discerner la capacité des méthodes à faire la distinction entre de nombreuses compositions d'acides gras variables.
Orientations de recherche futures avec les champignons MA
Une perspective passionnante pour l'analyse future des champignons MA est l'utilisation de sondes d'isotopes stables.
Le sondage des isotopes stables ( SIP pour Stable isotope probing) est une technique pouvant être utilisée pour déterminer la fonction métabolique active de taxons individuels au sein d'un système complexe de microbes.
Ce niveau de spécificité, liant fonction microbienne et phylogénétique, n'a jamais été atteint auparavant en écologie microbienne.
Cette méthode peut aussi être utilisée indépendamment des méthodes de culture classiques en écologie microbienne, permettant une analyse in situ des microbes fonctionnels. L'application du séquençage d'un noyau unique à partir de spores de champignons MA a aussi été développée récemment et contourne également le besoin de méthodes de culture[89].
Sondage des isotopes stables (SIP)
Le SIP, plus explicitement le SIP à base d'ADN/ARN, utilise des substrats enrichis en isotopes stables, tels que 13C, 15N, ou H218O, puis analyse les marqueurs « marqués » à l'aide de marqueurs d'ADN ou d'ARN spécifiques à l'espèce[90]. L'analyse de l'ADN marqué est réalisée en séparant l'ADN non marqué et marqué sur un gradient de chlorure de césium formé dans une ultracentrifugeuse[91]. Comme tous les organismes microbiens peuvent importer de l'eau dans leurs cellules, l'utilisation du sondage des isotopes stables H218O est une nouvelle méthode qui pourrait faire la lumière sur les questions auxquelles les écologues et les biologistes microbiens peinent à répondre, en particulier, ce que sont les organismes microbiens actifs dans u système . La méthode H218O (ou eau lourde) ciblera tous les organismes en croissance active sans influencer significativement la croissance elle-même. Cela est particulièrement vrai en serre pour les mycorhizes arbusculaires car les plantes doivent y être arrosées de toute façon, et l'eau ne sélectionne pas directement les organismes avec des voies métaboliques spécifiques[91] comme cela se produirait en utiliant du 13C et 15N.
Si elle s'avère efficace dans une expérience contrôlée, et avec un raffinement supplémentaire des techniques d'analyse de la communauté fongique ADN / ARN, cette technique pourrait être une option viable pour déterminer très spécifiquement la partie en croissance active d'une espèces de champignon MA au cours des saisons de croissance, avec différents hôtes végétaux, divers traitements et face au changement climatique.
Mécanisme de traitement des petits ARN pour comprendre la symbiose AM
Il a été rapporté que les petits ARN jouent un rôle crucial dans la diaphonie entre l'hôte et le symbiote[92]. Le mécanisme de traitement des petits ARN (en) est donc important pour comprendre la symbiose MA. Les champignons MA semblent avoir des caractéristiques uniques avec un enzyme central de type bactérien et un grand nombre de protéines Argonaute dans leur système de traitement de l'ARN (Cf. Interférence par ARN).
La recherche sur les petits ARN et sur les mécanismes de traitement des ARN devrait permettre de mieux comprendre la symbiose des champignons AM.
Renaturation, phytoremédiation
La perturbation des communautés végétales indigènes dans les zones menacées par la désertification est souvent suivie d'une dégradation des propriétés physiques et biologiques du sol, de la structure du sol, de la disponibilité des éléments nutritifs et de la matière organique. Lors de la restauration d'un terrain ainsi perturbé, il est essentiel de restaurer non seulement la végétation aérienne, mais aussi les propriétés biologiques et physiques du sol[93].
Une approche relativement nouvelle de la restauration des sols consiste à inoculer le sol avec des champignons MA lors de la réintroduction de la végétation ; il est ainsi possible d'associer phytoremédiation et fongoremédiation. Les plantes hôtes se rétablissent alors plus facilement sur le sol dégradé, et avec ses symbiotes, va mieux améliorer la qualité et la santé des sols[94]. Les paramètres de qualité des sols ont été significativement améliorés à long terme quand un mélange d'espèces indigènes de champignons mycorhiziens à arbuscules a été introduit (par rapport au sol non inoculé et au sol inoculé avec une seule espèce exotique de champignons MA[93]. Les avantages sont une croissance accrue des plantes, une augmentation de l'absorption de phosphore [95] et de la teneur en azote du sol (grâce notamment à une nodulation plus élevée des légumineuses en présence de champignons MA), une teneur plus élevée du sol en matière organique, une meilleure agrégation du sol, une meilleure aération su sol et infiltration de l'eau[93].
Les souches indigènes de champignons MA améliorent aussi l'extraction des métaux lourds des sols pollués et rendent le sol sain et adapté à la production agricole[96].
Agriculture
_and_beneficial_bacteria_on_plant_performance_and_soil_fertility.webp.png.webp)
- À gauche : une représentation visuelle du cycle de vie du CMA et des facteurs affectant ses différents stades de développement.
- À droite : bactéries auxiliaires mycorhiziennes, promotrices de croissance des plantes, interagissant de manière synergique avec le CMA[97]
Les pratiques agricoles conventionnelles, telles que le travail du sol, les engins lourds, les engrais chimiques et les fongicides, les mauvaises rotations des cultures et la sélection de plantes qui survivent à ces conditions, entravent la capacité des plantes à former de riches symbioses avec les champignons mycorhiziens arbusculaires.
Favoriser la symbiose mycorhizienne a un fort potentiel pour améliorer les rendements de l'agriculture à faibles intrants.
La plupart des cultures agricoles sont moins malades et plus productives lorsqu'elles sont bien colonisées par les champignons MA, qui facilitent notamment l'absorption de phosphore et de micronutriments et donc et la croissance de leur plante hôte (George et al. 1992).
La gestion des champignons MA est particulièrement importante en agriculture biologique et à faibles intrants où le phosphore du sol est, en général, faible.
Certaines plantes cultivées ne parviennent pas trouver seules le phosphore (ou d'autres nutriments) du sol ; elles sont très dépendantes des champignons AM ; c"est le cas du lin par exemple, qui, dans le sol pauvres et intermédiaires, a une faible capacité chimiotaxique, il dépend alors fortement des CMA pour trouver et absorber le phosphore (Thingstrup et al. 1998).
Une bonne gestion des CMA dans les agroécosystèmes peut améliorer la qualité du sol et la productivité des sols. Les pratiques agricoles telles qu'un travail réduit du sol, l'utilisation d'engrais ou d'amendements à faible teneur en phosphore et les systèmes de culture pérennes favorisent la symbiose mycorhizienne fonctionnelle.
Labour
Le labour et toute forme de travail profond ou intense du sol réduit le potentiel d'inoculation du sol et par suite l'efficacité des mycorhizes, en perturbant le réseau des hyphes extraracinaires (Miller et al. 1995, McGonigle & Miller 1999, Mozafar et al. 2000).
Quand la macrostructure du sol est détruite, le réseau d'hyphes devient non infectieux (Miller et al. 1995, McGonigle & Miller 1999). La perturbation du réseau d'hyphes diminue en outre les capacités d'absorption des mycorhizes car la surface couverte par les hyphes est fortement réduite. In fine l'apport de phosphore aux plantes qui sont connectées au réseau d'hyphes diminue (Figure 3, McGonigle & Miller 1999).
Dans le système de travail du sol réduit, l'apport d'engrais phosphoreux peut ne pas être nécessaire (par rapport aux systèmes de travail du sol lourd). Cela est dû à l'augmentation du réseau mycorhizien, qui permet aux mycorhizes de fournir à la plante suffisamment de phosphore (Miller et al. 1995).
Engrais phosphatés
Les avantages des CMA sont les plus importants dans les systèmes où les intrants sont faibles. L'utilisation intensive d'engrais phosphorés peut inhiber la colonisation et la croissance mycorhiziennes.
À mesure que les niveaux de phosphore du sol disponibles pour les plantes augmentent, la quantité de phosphore augmente également dans les tissus de la plante, et le drain de carbone sur la plante par la symbiose des champignons AM devient non bénéfique pour la plante (Grant 2005).
Une moindre colonisation mycorhizienne induite par des niveaux élevés de phosphore dans le sol peut à son tour aussi entraîner des carences des plantes en d'autres micronutriments absorbés par les mycorhizies (cuivre par exemple, selon Timmer & Leyden en 1980).
Systèmes de culture pérennes
Les semis de couverture sont pratiquées pour couvrir le sol à l'automne, en hiver et au printemps, et dans toutes les périodes où il serait laissé sans couverture de plantes en croissance.
Les cultures de couverture mycorhizées peuvent être utilisées pour améliorer le potentiel d'inoculum mycorhizien et le réseau d'hyphes (Kabir et Koide 2000, Boswell et al. 1998, Sorensen et al. 2005).
Puisque les champignons MA sont biotrophes, ils dépendent des plantes pour la croissance de leurs réseaux d'hyphes. La culture d'une culture de couverture prolonge le temps de croissance MA jusqu'à l'automne, l'hiver et le printemps. La promotion de la croissance des hyphes crée un réseau d'hyphes plus étendu. L'augmentation de la colonisation mycorhizienne constatée dans les systèmes de cultures de couverture peut être largement attribuée à une augmentation du réseau d'hyphes extraradicaux qui peuvent coloniser les racines de la nouvelle culture (Boswell et al. 1998). Les mycéliums extraracinaires peuvent survivre à l'hiver, assurant une (re)colonisation printanière rapide et une symbiose dès le début de saison de végétation (McGonigle et Miller 1999) ; les plantes peuvent alors puiser dans le réseau d'hyphes bien établi et recevoir une nutrition adéquate en phosphore, dès leur début de la croissance, ce qui améliore considérablement le rendement des cultures et la stabilité des écosystèmes.
Qualité du sol
La restauration de populations de champignons MA indigènes augmente le succès des opérations de renaturation, et la rapidité de la récupération du sol[93]. Les champignons MA améliorent la stabilité des agrégats du sol grâce aux hyphes extraracinaires et grâce à une protéine du sol : la glomaline.
Les protéines du sol liées à la glomaline (ou GRSP pour Glomalin-related soil proteins) ont été identifiées à l'aide d'un anticorps monoclonal (Mab32B11) dirigé contre des spores écrasées de CMA. Elle est définie par ses conditions d'extraction et de réaction avec l'anticorps Mab32B11.
D'autres preuves circonstancielles ont prouvé que la glomaline provient des CMA (si on élimines ces champignons, par exemple, par un fongicide, ou simplement par incubation du sol sans leurs plantes hôtes) le taux de GRSP dans le sol diminue[98] - [99].
La glomaline améliore aussi la stabilité de l'eau globale du sol tout en diminuant l'érosion du sol. Une forte corrélation a été trouvée entre le GRSP et la stabilité de l'eau des agrégats du sol dans une grande variété de sols où la matière organique est le principal agent de liaison, bien que le mécanisme précis ne soit pas connu[99]. La protéine glomaline n'a pas encore été isolée et décrite, et le lien entre la glomaline, le GRSP et les champignons mycorhiziens arbusculaires n'est pas encore très clair[99].
Voir aussi
Articles connexes
- Mycorhizes
- Ectomycorhize
- Mycorhize éricoïde
- Mycorhizes et changement climatique
- Champignons mycorhiziens et stockage du carbone dans le sol
- Défense des plantes par champignons endophytes
- Prototaxites
Liens externes
- Associations mycorhiziennes : la ressource Web. Section 4 : Mycorhizes arbusculaires.
- INVAM : Collection culturelle internationale de champignons mycorhiziens arbusculaires (vésiculaires)
- Phylogénie et taxonomie de Glomeromycota
- Échange de littérature mycorhizienne
- Janusz Blaszkowski – Informations sur l'AMF
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Arbuscular mycorrhiza » (voir la liste des auteurs).
- (en) B. Wang et Y.-L. Qiu, « Phylogenetic distribution and evolution of mycorrhizas in land plants », Mycorrhiza, vol. 16, no 5, , p. 299–363 (ISSN 0940-6360 et 1432-1890, DOI 10.1007/s00572-005-0033-6, lire en ligne, consulté le )
- Brundrett, M.C., « Coevolution of roots and mycorrhizas of land plants », New Phytologist, vol. 154, no 2, , p. 275–304 (PMID 33873429, DOI 10.1046/j.1469-8137.2002.00397.x)
- M.G. Barbour, J.H. Burk et W.D. Pitts, Terrestrial plant ecology, Benjamin/Cummings Publishing Company, coll. « Frontiers in Physics », (ISBN 978-0-8053-0540-1, lire en ligne
 ), 118
), 118 - Simon, L., Bousquet, J., Levesque, C. et Lalonde, M., « Origin and diversification of endomycorrhizal fungi and coincidence with vascular land plants », Nature, vol. 363, no 6424, , p. 67–69 (DOI 10.1038/363067a0, Bibcode 1993Natur.363...67S, S2CID 4319766)
- Schüßler, A., « A new fungal phylum, the Glomeromycota: phylogeny and evolution », Mycol. Res., vol. 105, no 12, , p. 1413–1421 (DOI 10.1017/S0953756201005196, lire en ligne)
- (en) Catherine Jacott et Jeremy Murray, « Trade-Offs in Arbuscular Mycorrhizal Symbiosis: Disease Resistance, Growth Responses and Perspectives for Crop Breeding », sur Agronomy, (ISSN 2073-4395, DOI 10.3390/agronomy7040075, consulté le ), p. 75
- Remy, W., Taylor, T., Hass, H. et Kerp, H., « Four hundred-million-year-old vesicular arbuscular mycorrhizae », Proceedings of the National Academy of Sciences of the United States of America, vol. 91, no 25, , p. 11841–11843 (PMID 11607500, PMCID 45331, DOI 10.1073/pnas.91.25.11841, Bibcode 1994PNAS...9111841R)
- Kar, R.K., Mandaokar, B.D. et Kar, R., « Mycorrhizal fossil fungi from the Miocene sediments of Mirozam, Northeast India », Current Science, vol. 89, , p. 257–259
- Wang, B., Yeun, L.H., Xue, Y. et Liu, Y., « Presence of three mycorrhizal genes in the common ancestor of land plants suggests a key role of mycorrhizas in the colonization of land by plants », New Phytologist, vol. 186, no 2, , p. 514–525 (PMID 20059702, DOI 10.1111/j.1469-8137.2009.03137.x, hdl 2027.42/78704)
- Ané, « Genetic and cytogenetic mapping of DMI1, DMI2, and DMI3 genes of Medicago truncatula involved in Nod factor transduction, nodulation, and mycorrhization. », Molecular Plant-Microbe Interactions, vol. 15, no 11, , p. 1108–18 (PMID 12423016, DOI 10.1094/MPMI.2002.15.11.1108)
- Alexopolous C, Mims C, Blackwell M. 2004. Introductory mycology, 4th ed . Hoboken (NJ): John Wiley and Sons.
- Lee, SJ., Kong, M., Morse, D. et al. Expression of putative circadian clock components in the arbuscular mycorrhizal fungus Rhizoglomus irregulare. Mycorrhiza (2018) https://doi.org/10.1007/s00572-018-0843-y
- (en) Julie Marleau, Yolande Dalpé, Marc St-Arnaud et Mohamed Hijri, « Spore development and nuclear inheritance in arbuscular mycorrhizal fungi », BMC Evolutionary Biology, vol. 11, no 1, , p. 51 (ISSN 1471-2148, PMID 21349193, PMCID PMC3060866, DOI 10.1186/1471-2148-11-51, lire en ligne, consulté le )
- Wright S.F., Roots and Soil Management: Interactions between roots and the soil, USA, American Society of Agronomy, , 183–197 p., « Management of Arbuscular Mycorrhizal Fungi »
- Douds, D.D. and Nagahashi, G. 2000. Signalling and Recognition Events Prior to Colonisation of Roots by Arbuscular Mycorrhizal Fungi. In Current Advances in Mycorrhizae Research. Ed. Podila, G.K., Douds, D.D. Minnesota: APS Press. Pp 11–18.
- Nagahashi, G, Douds, D. D. et Abney, G.D., « Phosphorus amendment inhibits hyphal branching of VAM fungus Gigaspora margarita directly and indirectly through its effect on root exudation », Mycorrhiza, vol. 6, no 5, , p. 403–408 (DOI 10.1007/s005720050139, S2CID 36014515, lire en ligne)
- Sbrana, C. et Giovannetti, M., « Chemotropism in the arbuscular mycorrhizal fungus Glomus mosseae », Mycorrhiza, vol. 15, no 7, , p. 539–545 (PMID 16133246, DOI 10.1007/s00572-005-0362-5, S2CID 23648484)
- Tamasloukht, M., Sejalon-Delmas, N., Kluever, A. et Jauneau, A., « Root Factors Induce Mitochondrial-Related Gene Expression and Fungal Respiration during the Developmental Switch from Asymbiosis to Presymbiosis in the Arbuscular Mycorrhizal Fungus Gigaspora rosea », Plant Physiology, vol. 131, no 3, , p. 1468–1478 (PMID 12644696, PMCID 166906, DOI 10.1104/pp.012898)
- Gianinazzi-Pearson, V., « Plant Cell Responses to Arbuscular Mycorrhizal Fungi: Getting to the Roots of the Symbiosis », The Plant Cell, vol. 8, no 10, , p. 1871–1883 (PMID 12239368, PMCID 161321, DOI 10.1105/tpc.8.10.1871, JSTOR 3870236)
- Lara Armstrong, R. Larry Peterson, Lara Armstrong et R. Larry Peterson, « The Interface between the Arbuscular Mycorrhizal Fungus Glomus intraradices and Root Cells of Panax quinquefolius: A Paris-Type Mycorrhizal Association », Mycologia, vol. 94, no 4, , p. 587–595 (PMID 21156532, DOI 10.2307/3761710, JSTOR 3761710, lire en ligne)
- Yamato, Masahide, « Morphological types of arbuscular mycorrhizas in pioneer woody plants growing in an oil palm farm in Sumatra, Indonesia », Mycoscience, vol. 46, , p. 66–68 (DOI 10.1007/s10267-004-0212-x, S2CID 83767351)
- Matekwor, Ahulu E, Nakata, M et Nonaka, M, « Arum- and Paris-type arbuscular mycorrhizas in a mixed pine forest on sand dune soil in Niigata Prefecture, central Honshu, Japan », Mycorrhiza, vol. 15, no 2, , p. 129–36 (ISSN 0940-6360, PMID 15290409, DOI 10.1007/s00572-004-0310-9, S2CID 25476630)
- Tuomi, J., Kytoviita, M. et Hardling, R., « Cost efficiency of nutrient acquisition of mycorrhizal symbiosis for the host plant », Oikos, vol. 92, , p. 62–70 (DOI 10.1034/j.1600-0706.2001.920108.x)
- Bolan, N.S., « A critical review of the role of mycorrhizal fungi in the uptake of phosphorus by plants », Plant and Soil, vol. 134, no 2, , p. 189–207 (DOI 10.1007/BF00012037, S2CID 44215263)
- Harley, J.L., Smith, S.E., 1983. Mycorrhizal Symbiosis. Academic Press: London.
- Pfeffer, P., Douds D., Becard, G. et Shachar-Hill, Y., « Carbon Uptake and the Metabolism and Transport of Lipids in an Arbuscular Mycorrhiza », Plant Physiology, vol. 120, no 2, , p. 587–598 (PMID 10364411, PMCID 59298, DOI 10.1104/pp.120.2.587)
- Hamel, C., « Impact of arbuscular mycorrhiza fungi on N and P cycling in the root zone », Canadian Journal of Soil Science, vol. 84, no 4, , p. 383–395 (DOI 10.4141/S04-004)
- H. Bücking and Y.Shachar-Hill (2005). Phosphate uptake, transport and transfer by the arbuscular mycorrhizal fungus Glomus intraradices is stimulated by increased carbohydrate availability New Phytologist 165:899–912
- Smith, S., Smith, A. et Jakobsen, I., « Mycorrhizal Fungi Can Dominate Phosphate Supply to Plants Irrespective of Growth Responses », Plant Physiology, vol. 133, no 1, , p. 16–20 (PMID 12970469, PMCID 1540331, DOI 10.1104/pp.103.024380)
- Smith, S.E., Read D.J. Mycorrhizal Symbiosis. 2002. Academic Press: London.
- Sally, DJ Smith, Read, Mycorrhizal symbiosis, New York, Academic Press,
- Opik, Vanatoa A, Vanatoa E et Moora M, « The online database MaarjAM reveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi (Glomeromycota) », New Phytologist, vol. 188, no 1, , p. 233–241 (PMID 20561207, DOI 10.1111/j.1469-8137.2010.03334.x)
- Kivlin, Christine V. Hawkes et Kathleen K. Treseder, « Global diversity and distribution of arbuscular mycorrhizal fungi », Soil Biology and Biochemistry, vol. 43, no 11, , p. 2294–2303 (DOI 10.1016/j.soilbio.2011.07.012, lire en ligne)
- Lekberg, Koide RT, Rohr JR et Aldirch-Wolfe L, « Role of niche restrictions and dispersal in the composition of arbuscular mycorrhizal fungal communities », Journal of Ecology, vol. 95, , p. 95–100 (DOI 10.1111/j.1365-2745.2006.01193.x)
- (en) Leff, Jones, Prober et Barberán, « Consistent responses of soil microbial communities to elevated nutrient inputs in grasslands across the globe », Proceedings of the National Academy of Sciences, vol. 112, no 35, , p. 10967–10972 (ISSN 0027-8424, PMID 26283343, PMCID 4568213, DOI 10.1073/pnas.1508382112, Bibcode 2015PNAS..11210967L)
- Allen, Allen MF, Helm DJ et Trappe JM, « Patterns and regulation of mycorrhizal plant and fungal diversity », Plant and Soil, vol. 170, , p. 47–62 (DOI 10.1007/bf02183054, S2CID 25097125)
- John Klironomos, Host-specificity and functional diversity among arbuscular mycorrhizal fungi, Halifax, Canada, Microbial Biosystems: New Frontiers. Proceedings of the 8th International Symposium on Microbial Ecology. Atlantic Canada Society for Microbial Ecology, , 845–851 p.
- Husband, Herre EA, Turner SL et Gallery R, « Molecular diversity of arbuscular mycorrhizal fungi and patterns of associations over time and space in a tropical forest », Molecular Ecology, vol. 11, no 12, , p. 2669–2678 (PMID 12453249, DOI 10.1046/j.1365-294x.2002.01647.x, S2CID 10279037, lire en ligne)
- Hempel, Gotzenberger L, Kuhn I et Michalski SG, « Mycorrhizas in the Central European flora – relationships with plant life history traits and ecology », Ecology, vol. 94, no 6, , p. 1389–1399 (PMID 23923502, DOI 10.1890/12-1700.1)
- Drigo, Pijl, Duyts et Kielak, « Shifting carbon flow from roots into associated microbial communities in response to elevated atmospheric CO2 », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 24, , p. 10938–10942 (PMID 20534474, PMCID 2890735, DOI 10.1073/pnas.0912421107, Bibcode 2010PNAS..10710938D)
- van der Heijden, Boller AT, Wiemken A et Sanders IR, « Different arbuscular mycorrhizal fungi species are potential determinants of plant community structure », Ecology, vol. 79, no 6, , p. 2082–2091 (DOI 10.1890/0012-9658(1998)079[2082:damfsa]2.0.co;2)
- van der Heijden, Bardgett RD et Van Straalen NM, « The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems », Ecology Letters, vol. 11, no 3, , p. 296–310 (PMID 18047587, DOI 10.1111/j.1461-0248.2007.01139.x)
- Vannette et Rasmann S, « Arbuscular mycorrhizal fungi mediate below-ground plant–herbivore interactions: a phylogenetic study », Functional Ecology, vol. 26, no 5, , p. 1033–1042 (DOI 10.1111/j.1365-2435.2012.02046.x)
- Haumann et Hawkes CV, « Plant neighborhood control of arbuscular mycorrhizal community composition », New Phytologist, vol. 183, no 4, , p. 1188–1200 (PMID 19496954, DOI 10.1111/j.1469-8137.2009.02882.x)
- Hausmann et Hawkes CV, « Order of plant host establishment alters the composition of arbuscular mycorrhizal communities », Ecology, vol. 91, no 8, , p. 2333–23343 (PMID 20836455, DOI 10.1890/09-0924.1)
- Batten, Skow KM, Davies KF et Harrison SP, « Two invasive plants alter soil microbial community composition in serpentine grasslands », Biological Invasions, vol. 8, no 2, , p. 217–230 (DOI 10.1007/s10530-004-3856-8, S2CID 24969103)
- Hawkes, Belnap J, D'Antonio C et Firestone M, « Arbuscular mycorrhizal assemblages in native plant roots change in the presence of invasive exotic grasses », Plant and Soil, vol. 281, nos 1–2, , p. 369–380 (DOI 10.1007/s11104-005-4826-3, S2CID 16801874)
- Kivlin et Christine V. Hawkes, « Differentiating between effects of invasion and diversity: impacts of aboveground plant communities on belowground fungal communities », New Phytologist, vol. 189, no 2, , p. 526–535 (PMID 20958304, DOI 10.1111/j.1469-8137.2010.03494.x)
- Lekberg, Gibbons SM, Rosendahl S et Ramsey PW, « Severe plant invasions can increase mycorrhizal fungal abundance and diversity », ISME Journal, vol. 7, no 7, , p. 1424–1433 (PMID 23486251, PMCID 3695300, DOI 10.1038/ismej.2013.41)
- Fitter, « Darkness visible: reflections on underground ecology », Journal of Ecology, vol. 93, no 2, , p. 231–243 (DOI 10.1111/j.0022-0477.2005.00990.x, lire en ligne)
- Pringle, Bever, Gardes et Parrent, « Mycorrhizal symbioses and plant invasions », Annual Review of Ecology, Evolution, and Systematics, vol. 40, , p. 699–715 (DOI 10.1146/annurev.ecolsys.39.110707.173454)
- Larimer, Bever JD et Clay K, « The interactive effects of plant microbial symbionts: a review and meta-analysis », Symbiosis, vol. 51, no 2, , p. 139–148 (DOI 10.1007/s13199-010-0083-1, S2CID 11569239)
- Novas, Iannone LJ, Godeas AM et Cabral D, « Positive association between mycorrhiza and foliar endophytes in a Poa bonariensis », Mycological Progress, vol. 8, , p. 75–81 (DOI 10.1007/s11557-008-0579-8, S2CID 2206235)
- Larimer, Bever JD et Clay K, « Consequences of simultaneous interactions of fungal endophytes and arbuscular mycorrhizal fungi with a shared host grass », Oikos, vol. 121, no 12, , p. 2090–2096 (DOI 10.1111/j.1600-0706.2012.20153.x)
- Omacini, Eggers T, Bonkowski M et Gange AC, « Leaf endophytes affect mycorrhizal status and growth of co-infected and neighboring plants », Functional Ecology, vol. 20, no 2, , p. 226–232 (DOI 10.1111/j.1365-2435.2006.01099.x)
- Mack et Rudgers JA, « Balancing multiple mutualists: asymmetric interactions among plants, arbuscular mycorrhizal fungi, and fungal endophytes », Oikos, vol. 117, no 2, , p. 310–320 (DOI 10.1111/j.2007.0030-1299.15973.x, CiteSeerx 10.1.1.722.4169)
- Liu, Parsons AJ, Xue H et Fraser K, « Competition between foliar Neotyphodium lolii endophytes and mycorrhizal Glomus spp. fungi in Lolium perenne depends on resource supply and host carbohydrate content », Functional Ecology, vol. 25, no 4, , p. 910–920 (DOI 10.1111/j.1365-2435.2011.01853.x, hdl 10214/3316)
- Reininger et Sieber TN, « Mycorrhiza reduces adverse effects of dark septate endophytes (DSE) on growth of conifers », PLOS ONE, vol. 7, no 8, , p. 1–10 (PMID 22900058, PMCID 3416760, DOI 10.1371/journal.pone.0042865, Bibcode 2012PLoSO...742865R)
- Klironomos, Hart MM, Gurney JE et Moutoglis P, « Interspecific differences in the tolerance of arbuscular mycorrhizal fungi to freezing and drying », Canadian Journal of Botany, vol. 79, no 10, , p. 1161–1166 (DOI 10.1139/cjb-79-10-1161)
- Auge, « Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis », Mycorrhiza, vol. 11, , p. 3–42 (DOI 10.1007/s005720100097, S2CID 29379395)
- Johnson, Rowland DL, Corkidi L et Egerton-Warburton LM, « Nitrogen enrichment alters mycorrhizal allocation at five mesic to semiarid grasslands », Ecology, vol. 84, no 7, , p. 1895–1908 (DOI 10.1890/0012-9658(2003)084[1895:neamaa]2.0.co;2)
- Johnson, Wilson GWT, Bowker MA et Wilson JA, « Resource limitation is a driver of local adaptation in mycorrhizal symbioses », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 5, , p. 2093–2098 (PMID 20133855, PMCID 2836645, DOI 10.1073/pnas.0906710107, Bibcode 2010PNAS..107.2093J)
- Gai, Tian H, Yang FY et Christie P, « Arbuscular mycorrhizal fungal diversity along a Tibetan elevation gradient », Pedobiologia, vol. 55, no 3, , p. 145–151 (DOI 10.1016/j.pedobi.2011.12.004)
- Porcel, Aroca et Ruiz-Lozano, « stress alleviation using arbuscular mycorrhizal fungi. A review », Agronomy for Sustainable Development, vol. 32, , p. 181–200 (DOI 10.1007/s13593-011-0029-x, S2CID 8572482, lire en ligne)
- D.H. Marx, 1972. Ectomycorrhizae as biological deterrents to pathogenic root infections. Ann. Rev. Phytopathol., 10, 429454. Cité dans Dommergues 1978
- A. Rambelli, 1973. The rhizosphere of mycorrhizae. In Ectomycorrhizae. Their Ecology and Physiology (G. C. Marks and T. T. Kozlowsky, ed.), Academic Press, Inc. New York and London 299-343. Cité dans Dommergues 1978
- Y. Dommergues, "Mycorrhizes et fixation d’azote". O.R.S.T.O.M. avril 1978
- Marschner, P. et Timonen, S., « Interactions between plant species and mycorrhizal colonization on the bacterial community composition in the rhizosphere », Applied Soil Ecology, vol. 28, , p. 23–36 (DOI 10.1016/j.apsoil.2004.06.007)
- Eriksson, A., « Arbuscular mycorrhizae in relation to management history, soil nutrients and plant diversity », Plant Ecology, vol. 155, no 2, , p. 129–137 (DOI 10.1023/A:1013204803560, S2CID 42097761)
- « Lipochitooligosaccharides Stimulating Arbuscular Mycorrhizal Symbiosis » [archive du ]
- Schrey, « Production of fungal and bacterial growth modulating secondary metabolites is widespread among mycorrhiza-associated streptomycetes », BMC Microbiology, vol. 12, no 1, , p. 164 (PMID 22852578, PMCID 3487804, DOI 10.1186/1471-2180-12-164)
- Van der Putten, « Climate change, Aboveground-belowground interactions and species' range shifts », Annual Review of Ecology, Evolution, and Systematics, vol. 43, , p. 365–383 (DOI 10.1146/annurev-ecolsys-110411-160423, hdl 20.500.11755/0f7d61b9-e435-4da3-b3d6-3ca115bdbdb5)
- Worchel, Giauque et Kivlin, « Fungal symbionts alter plant drought response », Microbial Ecology, vol. 65, no 3, , p. 671–678 (PMID 23250115, DOI 10.1007/s00248-012-0151-6, S2CID 122731)
- Kivlin, Emery SM et Rudgers JA, « Fungal symbionts alter plant response to global change », American Journal of Botany, vol. 100, no 7, , p. 1445–1457 (PMID 23757444, DOI 10.3732/ajb.1200558)
- Treseder, « A meta-analysis of mycorrhizal responses to nitrogen, phosphorus, and atmospheric CO2 in field studies », New Phytologist, vol. 164, no 2, , p. 347–355 (PMID 33873547, DOI 10.1111/j.1469-8137.2004.01159.x, lire en ligne)
- Glomalin, « Hiding Place for a Third of the World's Stored Soil Carbon », Agricultural Research Journal, (lire en ligne).
- Stukenbrock et Rosendahl, Soren, « Clonal diversity and population genetic structure of arbuscular mycorrhizal fungi ( Glomus spp.) studied by multilocus genotyping of single spores », Molecular Ecology, vol. 14, no 3, , p. 743–752 (PMID 15723666, DOI 10.1111/j.1365-294x.2005.02453.x, S2CID 30799196)
- Baoming, « Patterns of diversity and adaptation in Glomeromycota from three prairie grasslands », Molecular Ecology, vol. 22, no 9, , p. 2573–2587 (PMID 23458035, DOI 10.1111/mec.12268, S2CID 6769986)
- Opik, « Global sampling of plant roots expands the described molecular diversity of arbuscular mycorrhizal fungi », Mycorrhiza, vol. 23, no 5, , p. 411–430 (PMID 23422950, DOI 10.1007/s00572-013-0482-2, S2CID 17162006)
- Johnson, Zak, Tilman et Pfleger, « Dynamics of vesicular arbuscular mycorrhizae during old field succession », Oecologia, vol. 86, no 3, , p. 349–358 (PMID 28312920, DOI 10.1007/bf00317600, Bibcode 1991Oecol..86..349J, S2CID 31539360)
- Marleau, Dalpé, Y., St-Arnaud, M. et Hijri, M., « Spore development and nuclear inheritance in arbuscular mycorrhizal fungi », BMC Evolutionary Biology, vol. 11, no 1, , p. 51 (PMID 21349193, PMCID 3060866, DOI 10.1186/1471-2148-11-51)
- Ehinger, Daniel Croll, Alexander M. Koch et Ian R. Sanders, « Significant genetic and phenotypic changes arising from clonal growth of a single spore of an arbuscular mycorrhizal fungus over multiple generations », New Phytologist, vol. 196, no 3, , p. 853–861 (PMID 22931497, DOI 10.1111/j.1469-8137.2012.04278.x)
- Simon, Lalonde, M. et Bruns, T.D, « Specific amplification of 18S fungal ribosomal genes from vesicular-arbuscular endomycorrhizal fungi colonizing roots », Appl. Environ. Microbiol., vol. 58, no 1, , p. 291–295 (PMID 1339260, PMCID 195206, DOI 10.1128/AEM.58.1.291-295.1992, Bibcode 1992ApEnM..58..291S)
- Helgason, Fitter, A.H. et Young, J.P.W, « Molecular diversity of arbuscular mycorrhizal fungi colonising Hyacinthoides non-scripta (bluebell) in a seminatural woodland », Molecular Ecology, vol. 8, no 4, , p. 659–666 (DOI 10.1046/j.1365-294x.1999.00604.x, S2CID 85991904, lire en ligne)
- Redecker, Arthur Schüßler, Herbert Stockinger et Sidney L. Stürmer, « An evidence-based consensus for the classification of arbuscular mycorrhizal fungi (Glomeromycota) », Mycorrhiza, vol. 23, no 7, , p. 515–531 (PMID 23558516, DOI 10.1007/s00572-013-0486-y, S2CID 16495856)
- He, Joy D. VAN NOSTRAND, Ye DENG et Jizhong ZHOU, « Development and applications of functional gene microarrays in the analysis of the functional diversity, composition, and structure of microbial communities », Front. Environ. Sci. Eng. China, vol. 5, no 1, , p. 1–20 (DOI 10.1007/s11783-011-0301-y)
- Olsson, « Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil », FEMS Microbiology Ecology, vol. 29, no 4, , p. 303–310 (DOI 10.1111/j.1574-6941.1999.tb00621.x)
- J., Clarholm, M. et Rosswall, T, « Microbial biomass and activity in an agricultural soil with different organic matter contents », Soil Biology and Biochemistry, vol. 17, no 5, , p. 611–618 (DOI 10.1016/0038-0717(85)90036-7)
- Montoliu-Nerin, Sánchez-García, Bergin et Grabherr, « Building de novo reference genome assemblies of complex eukaryotic microorganisms from single nuclei », Scientific Reports, vol. 10, no 1, , p. 1303 (ISSN 2045-2322, PMID 31992756, PMCID 6987183, DOI 10.1038/s41598-020-58025-3, Bibcode 2020NatSR..10.1303M)
- Dumont et Murrell, Colin J., « Stable isotope probing – linking microbial identity to function », Nature Reviews Microbiology, vol. 3, no 6, , p. 499–504 (PMID 15886694, DOI 10.1038/nrmicro1162, S2CID 24051877)
- Schwartz, « Characterization of growing microorganisms in soil by stable isotope probing with H218O », Applied and Environmental Microbiology, vol. 73, no 8, , p. 2541–2546 (PMID 17322324, PMCID 1855593, DOI 10.1128/AEM.02021-06, Bibcode 2007ApEnM..73.2541S)
- Formey D, et al. 2016. Regulation of small RNAs and corresponding targets in Nod factor-induced Phaseolus vulgaris root hair cells. Int J Mol Sci . 176:887.
- Jeffries, P., Gianinazzi, S., Perotto, S. et Turnau, K., « The Contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility », Biology and Fertility of Soils, vol. 37, , p. 1–16 (DOI 10.1007/s00374-002-0546-5, S2CID 20792333)
- (en) Akhtar, Mishra et Kehri, « Arbuscular Mycorrhizal Association Contributes to Cr Accumulation and Tolerance in Plants Growing on Cr Contaminated Soils », Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, vol. 89, no 1, , p. 63–70 (ISSN 2250-1746, DOI 10.1007/s40011-017-0914-4, S2CID 46007322)
- Fillion, M., Brisson, J., Guidi W. et Labrecque, M., « Increasing phosphorus removal in willow and poplar vegetation filters using arbuscular mycorrhizal fungi », Ecological Engineering, vol. 37, no 2, , p. 199–205 (DOI 10.1016/j.ecoleng.2010.09.002)
- (en) Akhtar, Kehri et Zoomi, « Arbuscular mycorrhiza and Aspergillus terreus inoculation along with compost amendment enhance the phytoremediation of Cr-rich technosol by Solanum lycopersicum under field conditions », Ecotoxicology and Environmental Safety, vol. 201, , p. 110869 (ISSN 0147-6513, PMID 32585490, DOI 10.1016/j.ecoenv.2020.110869, lire en ligne)
- (en) Luca Giovannini, Michela Palla, Monica Agnolucci et Luciano Avio, « Arbuscular Mycorrhizal Fungi and Associated Microbiota as Plant Biostimulants : Research Strategies for the Selection of the Best Performing Inocula », Agronomy, vol. 10, no 1, , p. 106 (ISSN 2073-4395, DOI 10.3390/agronomy10010106, lire en ligne, consulté le )
- Rillig, M., Ramsey, P., Morris, S. et Paul, E., « Glomalin, an arbuscular-mycorrhizal fungal soil protein, responds to land-use change », Plant and Soil, vol. 253, no 2, , p. 293–299 (DOI 10.1023/A:1024807820579, S2CID 11007821)
- Rillig, M., « Arbuscular mycorrhizae, glomalin and soil aggregation », Canadian Journal of Soil Science, vol. 84, no 4, , p. 355–363 (DOI 10.4141/S04-003)