Photorespiration
La photorespiration est l'ensemble des réactions mises en œuvre par les organismes photosynthétiques à la suite de l'activité oxygénase de la Rubisco. En effet, cette enzyme intervient le plus souvent à travers son activité carboxylase, par laquelle une molécule de dioxyde de carbone CO2 est fixée sur du ribulose-1,5-bisphosphate pour donner deux molécules de 3-phosphoglycérate qui sont métabolisées par le cycle de Calvin. Cependant, la Rubisco peut également oxyder le ribulose-1,5-bisphosphate par une molécule d'oxygène O2, ce qui donne une molécule de 3-phosphoglycérate et une molécule de 2-phosphoglycolate. Ce dernier ne peut être directement métabolisé par le cycle de Calvin et passe par une série de réactions qui, chez les plantes, font intervenir les chloroplastes, les peroxysomes et les mitochondries des feuilles, où ces organites sont proches les uns des autres. Il y a alors production de glycolate HOH2C–COO−, de peroxyde d'hydrogène H2O2 et de sérine HOH2C–CH(NH2)–COOH, recyclés en libérant du CO2 et de l'ammoniac NH3. Le résultat est une perte nette en matière organique, susceptible de représenter le quart du dioxyde de carbone fixé par photosynthèse[1].


La photorespiration est une voie métabolique coûteuse pour la cellule car elle réduit le taux de production du 3-phosphoglycérate par rapport à celui résultant de la seule activité carboxylase de la Rubisco, avec de surcroît perte nette en carbone fixé[2] et libération de NH3, qui doit être détoxiqué par la cellule à travers un processus également coûteux. Ces réactions induisent en effet la consommation de 2,5 molécules[3] d'ATP et 2 molécules[3] de NADH ou de NADPH pour ribulose-1,5-bisphosphate dans les organites où elles se déroulent.
Cependant, si la photorespiration est préjudiciable à l'activité photosynthétique des cellules où elle a lieu, elle serait néanmoins utile, voire nécessaire, à d'autres fonctions cellulaires, notamment à la fixation de l'azote des nitrates ainsi que, dans une certaine mesure, à la signalisation cellulaire.
Photorespiration chez les plantes
Les réactions intervenant dans la photorespiration font intervenir une douzaine d'enzymes réparties entre les chloroplastes, les peroxysomes et les mitochondries des plantes, catalysant les réactions suivantes :
Formation de glycolate dans les chloroplastes
Dans les chloroplastes, la Rubisco fixe une molécule d'oxygène O2 sur le ribulose-1,5-bisphosphate à travers son activité oxygénase :
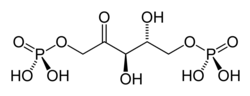
+ O2 → 3 H+ + 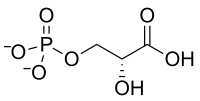
+ 
D-ribulose-1,5-bisphosphate 3-phospho-D-glycérate 2-phosphoglycolate Ribulose-1,5-bisphosphate carboxylase/oxygénase (Rubisco) – EC
Le 3-phosphoglycérate formé rejoint le cycle de Calvin tandis que le 2-phosphoglycolate est déphosphorylé en glycolate par la phosphoglycolate phosphatase et sort du chloroplaste pour être recyclé dans un peroxysome.
Conversion du glycolate en glycine dans les peroxysomes
Dans les peroxysomes, le glycolate est converti en glyoxylate par la glycolate oxydase avec formation de peroxyde d'hydrogène H2O2. Le glyoxylate peut être traité par deux enzymes pour donner de la glycine, le plus simples des acides aminés protéinogènes :
- la glycine transaminase catalyse la réaction : glyoxylate + L-glutamate α-cétoglutarate + glycine ;
- la sérine-glyoxylate transaminase catalyse la réaction : glyoxylate + L-sérine hydroxypyruvate + glycine.
L'accumulation de glycine étant nocive pour les cellules, cet acide aminé est dégradé dans les mitochondries.
Conversion de la glycine en sérine dans les mitochondries
Dans les mitochondries, la glycine est convertie en sérine par un ensemble d'enzymes et de protéines formant le système de clivage de la glycine (GCS), couplé à la sérine hydroxyméthyltransférase (SHMT). Cet ensemble GCS + SHMT catalyse la réaction globale :
Formation de glycérate dans les peroxysomes
La sérine est convertie en hydroxypyruvate avec formation de glycine sous l'action de la sérine-glyoxylate transaminase :
puis l'hydroxypyruvate est réduit en glycérate par l'hydroxypyruvate réductase avec consommation d'une molécule de NADH ou de NADPH :
- hydroxypyruvate + NADH + H+ D-glycérate + NAD+ ;
- hydroxypyruvate + NADPH + H+ D-glycérate + NADP+.
Recyclage du glycérate et de l'ammoniac dans les chloroplastes
L'α-cétoglutarate et la glutamine réagissent sous l'action de la glutamate synthase à NADPH pour former deux molécules de glutamate, dont une redonne de la glutamine par fixation d'ammoniac NH3 sous l'action de la glutamine synthétase ; la réaction globale de ces deux enzymes peut s'écrire :
- α-cétoglutarate + NH3 + ATP + NADPH + H+ L-glutamate + ADP + Pi + NADP+.
L'ammoniac formé dans les mitochondries permet ainsi de convertir une molécule d'α-cétoglutarate en glutamine moyennant la consommation d'une molécule de NADPH et l'hydrolyse d'une molécule d'ATP.
Le glycérate est enfin phosphorylé dans un chloroplaste par la glycérate kinase avec consommation d'une molécule d'ATP pour former du 3-phosphoglycérate, qui peut rejoindre le cycle de Calvin.
Représentation schématique
Ces réactions peuvent être globalement résumées par le schéma ci-dessous :

CC représente le cycle de Calvin.
| Les enzymes suivantes sont représentées :
PGP : phosphoglycolate phosphatase ; GOX : glycolate oxydase ; GGT : glycine transaminase ; GDC : système de clivage de la glycine ; SHMT : sérine hydroxyméthyltransférase ; SGT : sérine-glyoxylate transaminase ; HPR : hydroxypyruvate réductase ; GLYK : glycérate kinase ; |
Les numéros indiquent les métabolites suivants :
1 ribulose-1,5-bisphosphate, 2 3-phosphoglycérate, 3 2-phosphoglycolate, 4 glycolate, 5 glyoxylate, 6 glycine, 7 sérine, 8 hydroxypyruvate, 9 glycérate. |
Photorespiration chez les cyanobactéries
Les cyanobactéries sont les seules bactéries connues réalisant une photosynthèse oxygénique. Elles réalisent la fixation du carbone à l'aide du cycle de Calvin. On a longtemps pensé qu'elles n'avaient pas recours à la photorespiration car elles concentrent le CO2 autour de leur Rubisco à l'aide d'organites spécialisés appelés carboxysomes, ce qui favorise fortement l'activité carboxylase de la Rubisco au détriment de son activité oxygénase, et on pensait que le peu de glyoxylate formé serait facilement éliminé hors de la cellule sans nécessiter de voie métabolique spécifique pour le détoxiquer[4]. On sait cependant qu'elles métabolisent le 2-phosphoglycolate selon un ensemble de voies métaboliques qui commencent comme chez les plantes par la conversion du 2-phosphoglycolate en glyoxylate puis en glycolate. Les réactions sont semblables à celles des plantes pour Anabaena et pour Prochlorococcus marinus, mais Synechocystis a recours à une glycolate déshydrogénase qui consomme du NADH et ne libère pas de peroxyde d'hydrogène H2O2.
Le glyoxylate peut être métabolisé de différentes façons selon les cyanobactéries considérées, et trois voies métaboliques ont été partiellement identifiées à ce jour :
- Il peut être converti par une glyoxylate oxydase en oxalate, lui-même converti par une oxalate oxydase et une formiate déshydrogénase en deux molécules de CO2.
- Il peut également être converti en hydroxypyruvate, comme chez les plantes ou en condensant deux molécules de glyoxylate par une tartronate-semialdéhyde synthase pour former du tartronate semialdéhyde, lui-même converti glycérate par une tartronate semialdéhyde réductase avec consommation d'une molécule de NADH ou de NADPH.
- Chez Synechocystis et Anabaena, l'hydroxypyruvate réduit en glycérate subit une phosphorylation en 3-phophoglycérate sous l'effet d'une glycérate kinase comme chez les plantes, mais d'autres cyanobactéries forment d'abord du 2-phosphoglycérate, isomérisé par la suite en 3-phosphoglycérate par une réaction semblable à celle catalysées par la phosphoglycérate mutase de la glycolyse.
Ces trois voies métaboliques s'entrecroisent et se déroulent en même temps chez Synechocystis. Ce n'est que lorsqu'elles sont toutes les trois inactivées que cette cyanobactérie requiert des concentrations élevées de dioxyde de carbone pour survivre, comme les plantes[5] - [6].
Affinité relative de la Rubisco pour l'oxygène et le dioxyde de carbone
Le site actif de la Rubisco présente la particularité de posséder à la fois une activité carboxylase et une activité oxygénase. Ceci provient du fait que l'enzyme active son substrat, le ribulose-1,5-bisphosphate, sous forme d'un ènediol instable qui peut réagir aussi bien avec le CO2 qu'avec O2 :

Le fait que l'oxygénation se produise dans environ 25 % des cas par rapport à la carboxylation suppose que cette dernière soit fortement favorisée par la Rubisco quand on prend en compte le fait que l'oxygène est environ 500 fois plus abondant dans l'atmosphère que le dioxyde de carbone, ce ratio tombant à 25 fois en solution dans l'eau à 25 °C[7]. Le ratio de sélectivité CO2 / O2 varie entre 20 et 280 selon les espèces, tandis que la vitesse de catalyse varie de 2 à 8 cycles par seconde.
Aspects bénéfiques de la photorespiration
Couplage avec l'assimilation des nitrates
Si la photorespiration est clairement préjudiciable à l'activité photosynthétique des cellules végétales, elle serait cependant utile, voire nécessaire à d'autres fonctions cellulaires, et sa limitation ne se traduirait pas forcément par une meilleure croissance des plantes. En effet, certaines études ont par exemple suggéré que la photorespiration puisse être indispensable à la fixation de l'azote des nitrates du sol[8]. Plusieurs processus physiologiques seraient responsables du couplage de la photorespiration avec la fixation de l'azote[9] : d'une part à travers l'augmentation de la disponibilité en NADH ou NADPH dans le cytosol des cellules du mésophylle, nécessaires à la réduction des nitrates NO3− en nitrites NO2− par une nitrate réductase, d'autre part à travers la limitation de la compétition des bicarbonates HCO3− sur les transporteurs des ions nitrate, ces transporteurs intervenant sur ces deux ions à la fois, et enfin en permettant la formation de quantités suffisantes de ferrédoxine réduite dans le stroma des chloroplastes, où elle est utilisée par la ferrédoxine-nitrite réductase. Par ailleurs, des plantes ayant un métabolisme du 2-phosphoglycolate défectueux à la suite d'une mutation ne poussent pas dans des conditions normales, l'un de ces mutants ayant montré une rapide accumulation de glycolate[10].
La photorespiration est fortement réduite chez les plantes en C4, mais produit en revanche de grandes quantités de malate et de NADPH, ce qui préserve la fixation des nitrites.
Signalisation rédox
La photorespiration pourrait également jouer en rôle dans la signalisation cellulaire végétale à travers la production de peroxyde d'hydrogène H2O2[11], molécule impliquée dans la signalisation rédox qui commande notamment les mécanismes de croissance et de réponse au stress, par exemple sous l'effet de parasites.
Évolution
Les précurseurs des cyanobactéries actuelles ont été les premiers organismes capables de photosynthèse oxygénique. Ce sont par conséquent également les premiers organismes dont la Rubisco a été exposée à l'oxygène. Ils devaient certainement produire du 2-phosphoglycolate car les mécanismes de concentration du CO2 sont apparus bien plus tard, vraisemblablement autour de 360 à 300 millions d'années avant le présent, lorsque la concentration en oxygène dans l'atmosphère s'est sensiblement accrue[4]. Les plantes ont depuis perdu certaines enzymes du métabolisme du glycérate qui sont encore présentes chez les cyanobactéries, mais la photorespiration n'a pas disparu pour autant. Même le bactérioplancton, tel que Prochlorococcus marinus et Synechococcus, dont le génome est très réduit, a conservé les gènes de la photorespiration. Cette voie métabolique était ou bien présente d'emblée chez les cyanobactéries, ou bien est apparue très tôt chez les précurseurs de ces dernières.
D'après la théorie endosymbiotique, les précurseurs des cyanobactéries actuelles seraient également les précurseurs des chloroplastes des cellules des plantes et des algue. La Rubisco de tous ces organismes (cyanobactéries, plantes, algues) ont en commun d'accepter aussi bien l'oxygène O2 que le dioxyde de carbone CO2 pour réagir sur le ribulose-1,5-bisphosphate[12]. La sélectivité de la Rubisco pour le CO2 par rapport à O2 ne s'est sans doute pas beaucoup accrue au cours de l'évolution[13], car cette enzyme aurait évolué essentiellement alors que la concentration en oxygène atmosphérique était encore faible, de sorte que la photorespiration demeurait toujours négligeable et n'aurait pas représenté un facteur de sélection déterminant.
Biotechnologie
La modification de cette voie métabolique par ingénierie génétique permet d'augmenter le rendement de la photosynthèse, et par conséquent la production de biomasse chez Nicotiana tabacum[14].
Références
- (en) Thomas D. Sharkey, « Estimating the rate of photorespiration in leaves », Physiologia Plantarum, vol. 73, no 1, , p. 147-152 (DOI 10.1111/j.1399-3054.1988.tb09205.x, lire en ligne)
- (en) Richard C Leegood, « A welcome diversion from photorespiration », Nature Biotechnology, vol. 25, , p. 539-540 (PMID 17483837, DOI 10.1038/nbt0507-539, lire en ligne)
- (en) Xiaoxiao Shi et Arnold Bloom, « Photorespiration: The Futile Cycle? », Plants, vol. 10, no 5, , p. 908 (ISSN 2223-7747, PMID 34062784, PMCID PMC8147352, DOI 10.3390/plants10050908, lire en ligne, consulté le ).
- (en) Hermann Bauwe, Martin Hagemann et Alisdair R. Fernie, « Photorespiration: players, partners and origin », Trends in Plant Science, vol. 15, no 6, , p. 330-336 (PMID 20403720, DOI 10.1016/j.tplants.2010.03.006, lire en ligne)
- (en) Marion Eisenhut, Wolfgang Ruth, Maya Haimovich, Hermann Bauwe, Aaron Kaplan et Martin Hagemann, « The photorespiratory glycolate metabolism is essential for cyanobacteria and might have been conveyed endosymbiontically to plants », PNAS, vol. 105, no 44, , p. 17199-17204 (PMID 18957552, DOI 10.1073/pnas.0807043105, lire en ligne)
- (en) Veronica G Maurino et Christoph Peterhansel, « Photorespiration: current status and approaches for metabolic engineering », Current Opinion in Plant Biology, vol. 13, no 3, , p. 248-255 (PMID 20185358, DOI 10.1016/j.pbi.2010.01.006, lire en ligne)
- (en) Howard Griffiths, « Plant biology: Designs on Rubisco », Nature, vol. 441, , p. 940-941 (PMID 16791182, DOI 10.1038/441940a, lire en ligne)
- (en) Shimon Rachmilevitch, Asaph B. Cousins et Arnold J. Bloom, « Nitrate assimilation in plant shoots depends on photorespiration », PNAS, vol. 101, no 31, , p. 11506-11510 (DOI 10.1073/pnas.0404388101, lire en ligne)
- (en) Arnold J. Bloom, Martin Burger, Jose Salvador Rubio Asensio, Asaph B. Cousins, « Carbon Dioxide Enrichment Inhibits Nitrate Assimilation in Wheat and Arabidopsis », Science, vol. 328, no 5980, , p. 899-903 (PMID 20466933, DOI 10.1126/science.1186440, lire en ligne)
- (en) Eduardo Zabaleta, M. Victoria Martin et Hans-Peter Braun, « A basal carbon concentrating mechanism in plants? », Plant Science, vol. 187, , p. 97-104 (PMID 22404837, DOI 10.1016/j.plantsci.2012.02.001, lire en ligne)
- (en) Christine H. Foyer, Arnold J. Bloom, Guillaume Queval et Graham Noctor, « Photorespiratory Metabolism: Genes, Mutants, Energetics, and Redox Signaling », Annual Review of Plant Biology, vol. 60, , p. 455-484 (PMID 19575589, DOI 10.1146/annurev.arplant.043008.091948, lire en ligne)
- (en) Inger Andersson, « Catalysis and regulation in Rubisco », Journal of Experimental Botany, vol. 59, no 7, , p. 1555-1568 (PMID 18417482, DOI 10.1093/jxb/ern091, lire en ligne)
- (en) Sigrun Reumann et Andreas P.M. Weber, « Plant peroxisomes respire in the light: Some gaps of the photorespiratory C2 cycle have become filled—Others remain », Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, vol. 1763, no 12, , p. 1496-1510 (PMID 17046077, DOI 10.1016/j.bbamcr.2006.09.008, lire en ligne)
- (en) Donald R. Ort, Helen W. Liu, Amanda P. Cavanagh et Paul F. South, « Synthetic glycolate metabolism pathways stimulate crop growth and productivity in the field », Science, vol. 363, no 6422, , eaat9077 (ISSN 1095-9203 et 0036-8075, PMID 30606819, DOI 10.1126/science.aat9077, lire en ligne, consulté le )
