Synechococcus
Synechococcus (du grec synechos(suite) et du grec Kokkos (sphère) est le nom d'un genre de cyanobactéries unicellulaires picoplanctoniques (taille inférieure au micron). Ces bactéries vivent essentiellement en mer, mais certaines espèces vivent en eau douce.
| Règne | Bacteria |
|---|---|
| Division | Cyanobacteria |
| Classe | Cyanophyceae |
| Sous-classe | Synechococcophycideae |
| Ordre | Synechococcales |
| Famille | Synechococcaceae |
Espèces de rang inférieur
- S. ambiguus Skuja
- S. arcuatus var. calcicolus Fjerdingstad
- S. bigranulatus Skuja
- S. brunneolus Rabenhorst
- S. caldarius Okada
- S. capitatus A. E. Bailey-Watts & J. Komárek
- S. carcerarius Norris
- S. elongatus (Nägeli) Nägeli
- S. endogloeicus F. Hindák
- S. epigloeicus F. Hindák
- S. ferrunginosus Wawrik
- S. intermedius Gardner
- S. koidzumii Yoneda
- S. lividus Copeland
- S. marinus Jao
- S. minutissimus Negoro
- S. mundulus Skuja
- S. nidulans (Pringsheim) Komárek
- S. rayssae Dor
- S. rhodobaktron Komárek & Anagnostidis
- S. roseo-persicinus Grunow
- S. roseo-purpureus G.S. West
- S. salinarum Komárek
- S. salinus Frémy
- S. sciophilus Skuja
- S. sigmoideus (Moore & Carter) Komárek
- S. spongiarum Usher et al.
- S. subsalsus Skuja
- S. sulphuricus Dor
- S. vantieghemii (Pringsheim) Bourrelly
- S. violaceus Grunow
- S. viridissimus Copeland
- S. vulcanus Copeland
Ce genre regroupe les espèces presque les plus abondantes du milieu marin (communément de 1 000 à 200 000 cellules par millilitre d'eau de mer, voire localement jusqu'à environ 1 million de cellules/ml), et leur génome serait parmi les plus abondants sur la planète[1].
Bien que longtemps inconnues et encore méconnues en raison de leur taille minuscule, elles dominent quantitativement le phytoplancton avec leurs proches parentes du genre Prochlorococcus (encore plus abondant, mais moins ubiquiste et qui supporte moins les eaux eutrophes ou d’« upwelling »)[1].
Introduction
Synechococcus est l'un des genres les plus importants (en termes de quantité, et peut-être en termes de rôle écosystémique) au sein du picoplancton Procaryote autotrophe des eaux océaniques tropicales.
La diversité de ce genre n'a cependant été découverte puis explorée qu'à partir de la fin des années 1970[2] - [3] et a été originellement défini pour inclure de « petites cyanobactéries unicellulaires dont les cellules sont ovoïdes à cylindriques et qui se reproduisent par fission binaire transversale (La cellule se « coupe » toujours perpendiculairement à l'axe le plus long de la cellule) (par pincement ou clivage) (...) →(and lack sheaths)← » [4].
Cette définition du genre Synechococcus comprenait des organismes dont la diversité génétique était considérable. Le genre a donc été ensuite subdivisé en sous-groupes sur la base de la présence ou non d'un pigment accessoire (phycoérythrine). Une base de données est en cours de constitution[5].
Description

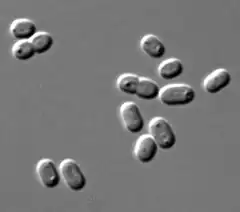
L'holotype qui a servi à décrire[6] ce genre est Synechococcus elongatus (Nägeli)[5].
Les cyanobactéries du genre Synechococcus sont unicellulaires, photoautotrophes et vivent en cellules solitaires ou agglomérées sous forme de groupes sans qu'ils semblent former de vraies colonies (pas de mucilage commun)[5]. Leur forme est ovoïde, largement ovale ou pour certaines espèces en forme de tige arrondie aux extrémités, parfois en courbe sigmoïde. Leur contenu est homogène ou comprend des granules semblant aléatoirement dispersés ou de manière polaire. La microscopie électronique révèle souvent la présence d'inclusions de phosphate, de granules de glycogène et surtout de carboxysomes très structurés. Des thylakoïdes sont localisées le long des parois de la cellules. Des filaments évoquant une involution de la cellule sont parfois observés)[5].
Couleur : souvent bleu pâle à vert, rarement vert-olive, bleu-vert vif ou rosé[5].
On pensait initialement que les espèces de ce genre étaient non mobiles. Certaines peuvent se mouvoir.
Leurs cellules, minuscules, mesurent de 0,6 à 1,6 µm. Ils sont gram négatif.
Les cellules présentent des parois cellulaires très structurées (ultrastructures)[7].
Les cellules-filles grandissent et se reproduisent lorsqu'elles ont atteint une taille plus ou moins similaire à celle de la cellule mère. Après une division, les cellules physiologiquement séparées peuvent rester un certain temps disposées en rangées et former un pseudofilament de plusieurs cellules indépendantes, mais provisoirement liées par leurs extrémités. En conditions optimales apparaissent des cellules allongées d'aspect filamenteux, capables de se diviser de manière asymétrique[5].
Les cellules photosynthétiques sont rencontrées préférentiellement dans les eaux de surface bien éclairées où cette bactérie est très abondante, mais les cellules présentent plusieurs caractéristiques adaptatives ;
- possibilité d'adapter leur métabolisme à des eaux plus profondes et moins lumineuses[1] ;
- en zone oligotrophe marine, la bactérie est capable de capter des minéraux présents dans l'eau à des concentrations moindres qu'une micromole par litre. Dans ces zones où le fer est rare, cet oligoélément constituant d'enzymes vitaux est remplacé par d'autres métaux (nickel notamment)[1].
En outre, l'« antenne photosynthétique » (phycobilisome) s'adapte à différents spectres lumineux, en biosynthétisant des pigments photosynthétiques inconnus chez les autres genres[1] ; - on a découvert chez plusieurs souches vivant en haute mer un mode de locomotion totalement différent de celui d'autres bactéries utilisant un ou plusieurs cils ou flagelles. Ces souches contiennent aussi des organelles différents et leur mouvement semble rétroagir non pas selon le gradient lumineux, mais à de subtiles variations des taux de composés azotés en solution[1].
Plusieurs espèces croissent en formant des structures en nattes ou en formant d'autres types de colonies algales, ou bien en colonisant des substrats mouillés (boue, bois, pierres, etc.)[5] ;
Un groupe d'espèces est connu pour se développer dans le metaphyton et périphyton de sources thermales et minérales, peu d'espèces ont à ce jour été découvertes sur des sites aerophytiques[5].
Des espèces picoplanctoniques ou planctoniques ont été trouvées dans les océans et dans des lacs (S. rhodobactron et d'autres).
Pigments
Le principal pigment photosynthétique de Synechococcus est la chlorophylle a, mais divers pigments « accessoires » (phycobilliprotéines) peuvent être synthétisés par ces bactéries[3]. Les quatre phycobilines communément reconnues sont la phycocyanine, l'allophycocyanine, l'allophycocyanine B et la phytoérythrine (aussi retrouvée chez des Rhodophytes et certains Cryptophytas) [8].
En outre Synechococcus synthétise aussi de la zéaxanthine (également trouvée chez le genre proche Prochlorococcus, chez les algues rouges et comme pigments mineurs dans certains Chlorophytes et Eustigmatophytes)[5].
Diversité génétique et classification
Mi-2009, il y avait 75 noms d'espèces dans la base de données du genoscope, mais seuls 34 étaient officiellement reconnues sur le plan taxonomique[5].
Depuis le , des données sur les séquences nucléotidiques sont disponibles sur la Banque de données deGenbank, pour (en 2009) plus de 4 830 échantillons identifiés comme Synechococcus (avec de possibles erreurs pour l'identification taxonomique de certains de ces échantillons (espèce, voire genre) non accompagnés d'indication décrivant finement les spécimens[9].
Le premier Synechococcus dont le génome a été publié (WH8102 [10]) est une souche mobile vivant dans des zones oligotrophes de l'océan ; son génome est de 2,4 Mpb[1].
De nombreuses espèces d'eau douce ont été décrites, dont certaines vivent dans des milieux extrêmes, par exemple hyperthermophiles. La taille du génome (nombre de paires de base) varie selon les espèces ; celui de la souche (PCC7002) de Synechococcus elongatus a une taille de 2,7 Mpb[5];
Selon le génoscope, les Synechococcus marins diffèrent phylogénétiquement fortement des Synechococcus connus en eau douce ou hydrothermales, alors que les Synechococcus spp. marins et l’ensemble du genre Prochlorococcus forment un groupe monophylétique.
Le genre est certainement hétérogène et sa taxonomie doit être révisée à l'aide de méthodes ultrastructurales et de taxonomie et phylogénie moléculaires. Le « Marine groupe A » (« Marine cluster A ») de bactéries photoautotrophes, à cellules mobiles, à contenu cellulaire rougeâtre et adaptation chromatique comp. Waterbury 1989) constitue sans doute un genre botanique à part (non encore révisé) [5].
Parce que certaines souches se cultivent bien dans différents types de cultures, que ces espèces semblent avoir des fonctions écologiques majeures, et parce que certaines présentent des résistances adaptatives étonnantes (notamment thermophiles Synechococcus lividus, et Synechococcus bigranulatus, etc.), certaines Synechococcus pourraient devenir un important « organisme modèle » de laboratoire, notamment pour étudier la séquestration du carbone par le nanoplancton, voire pour servir de support au génie génétique[1].
Phylogénie
La description phylogénétique des Synechococcus est rendue délicate par le fait qu'il s'agit encore d'un taxon provisoire regroupant des espèces encore peu connues (et probablement d'autres encore inconnues), et parce que de nombreux isolats, bien que morphologiquement très similaires, présentent de fortes différences génétiques ( G + C allant de 39 % à 71 % [11] On a d'abord tenté de subdiviser ce groupe en trois sous-groupes, chacun ayant une gamme spécifique de génomique de G + C[12]. Le manuel de Bergey (Herdmanet al.2001) divise désormais (et provisoirement) le genre Synechococcus en cinq groupes (chacun équivalent à un genre), sur la base de critères de morphologie, physiologie et traits génétiques.
- Un premier groupe (Cluster 1) contient les espèces les plus grandes du groupe (1 à 1,5 µm), non mobiles, photoautotrophes obligatoires et présentant une faible tolérance au sel. Les souches de référence pour ce groupe sont PCC6301 (antérieurement nommée Anacycstis nidulans) et PCC6312 ; respectivement isolées en eau douce au Texas et en Californie[4].
- Le second groupe (Cluster 2) est également caractérisé par une faible tolérance au sel, et une photoautrotrophie obligatoire, avec absence de phycoérythrine et thermophilie. PCC6715 est la souche de référence, isolé dans une source chaude du Parc national de Yellowstone[13].
- Le groupe 3 (Cluster 3) comprend des Synechococcus marins ne produisant pas de phycoérythrine et qui sont euryhalins (c'est-à-dire capable de croître à la fois en eau douce et salée). Plusieurs souches, dont la souche de référence PCC7003 sont hétérotrophes facultatives, et ont besoin de vitamine B12 pour leur croissance.
- Le groupe 4 (Cluster 4) ne contient qu'un seul isolat, PCC7335 qui est une souche exclusivement marine[14]. Cette souche contient de la phycoerthrine et a d'abord été isolée de la zone intertidale à Puerto Peñasco (Mexique) [4].
- Le groupe 5 (Cluster 5) contient un groupe antérieurement dénommé « groupes marins A et B » de Synechococcus. Ces cellules sont exclusivement marines et ont été isolées à la fois sur des littoraux et dans l'océan ouvert. Toutes les souches sont photoautrophes obligatoires et ont une taille de 0,6 à 1,7 µm de diamètre.
Ce cluster a été subdivisé en une population qui contient une ou l'autre (Cluster 5.1) ou ne contient pas (Cluster 5.2) de phycoérythrine. Les souches de référence sont WH8103 pour le groupe contenant de la phycoérythrine et WH5701 pour les souches n'en synthétisant pas (Waterburyet al.1986b).
Plus récemment Badger a proposé la division des cyanobactéries dans des subclusters α-et β sur la base de leur manière de concentrer le CO2, via les différences entre les types de gène RBCL (large subunit of ribulose 1,5-bisphosphate carboxylase/oxygenase) détectés dans ces organismes[15] les α-cyanobactéries étant celles qui contiennent une forme IA, les β-cyanobactéries étant celles qui contiennent une forme dite IB de ce gène. En s'appuyant sur cette division, Badger a analysé la phylogénie de certaines protéines carboxysomales (impliquées dans les carboxysomes, et donc dans la capacité à capter le CO2) qui semblent soutenir cette division. Par ailleurs, deux systèmes particulier de transport du bicarbonate ne semblent être trouvés que chez les α-cyanobactéries, qui ne produisent pas d'enzymes "carboxysomal carbonic anhydrases".
Mobilité
Les cellules de certaines espèces de ce genre sont motiles, bien que dépourvues de flagelles de cils ou d'autres moyens apparents de déplacement.
On a observé des fragments de colonie s'en éloignant à une vitesse de 10 micromètres par seconde. Certaines colonies emprisonnent des bulles qui les font flotter et leur permettent d'être emportées par le courant. Certaines cyanobactéries sont parfois animées de mouvements saccadés.
La mobilité semble dépendre de trois types de phénomènes
- reptation linéaire[16], Certaines cyanophycées sont mobiles, glissant ou pivotant, semble-t-il au moyen d'ondes de contraction
- par un autre mode de « nage » (gliding motility pour les anglophones), mal compris, non « photo-tactique » [17] qui n'implique pas de mouvement de flagelle. Il pourrait s'agir d'un phénomène d'extrusion différentiée de mucilage, permettant à la bactérie de se mouvoir autour de son axe (longitudinal).
- production (par certaines espèces) de vésicules gazeuses leur permettant de monter ou descendre dans la colonne d'eau, et de coloniser la surface de l'eau (au détriment d'autres espèces) quand les conditions (eaux calmes, chaleur...) leur sont favorables (c'est l'origine de certains blooms planctoniques).
Écologie et distribution
Les cyanobactéries du genre Synechococcus ont été observées à des concentrations variant d'un très petit nombre de cellules par ml d'eau à 10 6 cellules/ml dans presque toutes les régions de la zone euphotique océanique sauf dans les échantillons provenant de la McMurdo Sound et Ross Ice Shelf en Antarctique[11]. Ces bactéries sont plus abondantes dans les milieux eutrophes (riches en éléments nutritifs) que dans l'océan oligotrophe et elles préfèrent la partie supérieure bien éclairée de la zone euphotique[18].
Quelques pullulations ont été observées dans des eaux peu salées ou froides.
Le genre Synechococcus est habituellement moins présent en nombre de bactéries par volume d'eau que les Prochlorococcus, dans tous les milieux où ils coexistent, avec quelques exceptions dans les zones continuellement enrichies en nutriments telles que les remontées d'eau froide (upwelling en anglais) et les bassins versants sous-marin côtiers du plateau continental[18]. Dans les zones pauvres en nutriments telles que les gyres centraux des océans, Synechococcus est apparemment toujours là, mais à de faibles concentrations (allant de presque rien à environ 4 × 10³ cellules par ml[19] - [20] - [21] - [22] - [23].
Verticalement (dans la colonne d'eau) les cyanobactéries du genre Synechococcus sont généralement assez homogènement réparties dans la couche de mélange (en surface) et présentent une affinité pour les régimes plus légers.
Sous la couche de mélange, les concentrations cellulaires diminuent rapidement avec la profondeur.
Les profils sont toutefois fortement influencées par les conditions hydrologiques et peuvent fortement varier avec les saisons (ainsi que spatialement). Globalement, l'abondance de Synechococcus est souvent parallèle avec celle des Prochlorococcus dans la colonne d'eau.
Capacité à fixer le carbone
Individuellement, elles ne fixent que peu de carbone, mais le nombre immense de ces bactéries dans l'océan fait qu'elles jouent un rôle important pour la fixation océanique du carbone[1].
Capacité à fixer l'azote de l'air ou de l'eau
Alors que certaines cyanobactéries sont capables de photohétérotrophie voire d'une croissance chemohétérotrophique, toutes les souches marines connues de Synechococcus semblent être photo-autotrophes obligées[11] ; elles sont capables de pourvoir à leurs besoins en azote en utilisant les nitrates, l'ammoniaque ou même parfois directement de l'urée comme seule source d'azote. On a longtemps cru que les Synechococcus marins n'étaient pas capables de fixer l'azote, mais cette perception pourrait changer.
Références
- Page du Génoscope/CNRS consacrée à ce genre
- Johnson, P. W. & Sieburth, J. M. 1979. Chroococcoid cyanobacteria in the sea: a ubiquitous and diverse phototrophic biomass. Limnol. Oceanogr. 24:928-35.
- Waterbury, J. B., Watson, S. W., Guillard, R. R. L. & Brand, L. E. 1979. Wide-spread occurrence of a unicellular, marine planktonic, cyanobacterium. Nature 277:293-4.
- R. Rippka, J. Deruelles, J. B. Waterbury, M. Herdman & R. Y. Stanier ; 1979 ; Generic assignments, strains histories and properties of pure cultures of cyanobacteria Journal Society for General Microbiology ; vol. 111 ; pages 1 à 61
- (en) Base de données algaebase (Page : Synechococcus Nägeli, 1849)
- Publication originale : Nägeli, C. (1849). Gattungen einzelliger Algen, physiologisch und systematisch bearbeitet. Neue Denkschriften der Allg. Schweizerischen Gesellschaft für die Gesammten Naturwissenschaften 10(7): i-viii, 1-139, pls I-VIII.
- F. O. Perkins, L. W. Haas, D. E. Phillips & K. L. Webb ; 1981 ; Ultrastructure of a marine Synechococcus possessing spinae ; journal Canadian Journal of Microbiology ; vol. 27 ; pages 318 à 329
- R. Y. Stanier & G. Cohen-Bazire ; 1977 ; Phototrophic procaryotes : les cyanobactéries ; Annual Review of Microbiology ; Vol 31, pages 255 à 274 ; doi:10.1146/annurev.mi .31.100177.001301)
- Harvey et al. 2009
- résultats publié dans Nature, 2003
- J. B. Waterbury, S. W. Watson, F. W. Valois & D. G. Franks ; 1986 ; Biological and ecological characterization of the marine unicellular cyanobacterium Synechococcus ; journal : Canadian Bulletin of Fisheries and Aquatic Sciences ; vol 214, pages 71 à 120
- R. Rippka & G. Cohen-Bazire ; 1983 ;"The Cyanobacteriales: a legitimate order based on type strains Cyanobacterium stanieri? "; Annales de microbiologie ; Vol 134B, pages 21 à 36
- D. L. Dyer & RD Gafford, 1961 ; "Some characteristics of a thermophilic blue-green alga" ; Science Vol. 134, pages 616 à 617 | doi:10.1126 / science.134.3479.616 ;
- J. B. Waterbury & Stanier RY ; 1981 : Voir chap " Isolation and growth of cyanobacteria from marine and hypersaline environments " in "" ; The prokaryotes: a handbook on habitats, isolation, and identification of bacteria ; Springer-Verlag, Berlin, pages 221 à 223 ; (ISBN 0-38-708871-7)
- M. R. Badger, D. Hanson & G. D. Price ; 2002 ; "Evolution and diversity of CO2 concentrating mechanism in cyanobacteria"journal : Functional Plant Biology], vol.29 : pages 161 à 175 Voir ; doi:10.1071/PP01213)
- R. W. Castenholz ; 1982 ; The biology of cyanobacteria, voir chapitre : Motility and taxes pages 413 à 439 ; éditeur : N. G. Carr & B. A. Whitton |publisher=University of California Press, Berkeley et Los Angeles ; (ISBN 0-520-04717-6)
- J. B. Waterbury, J. M. Willey, D. G. Franks, F. W. Valois & S. W. Watson; 1985 ; A cyanobacterium capable of swimming motility ; Science ; volume 30, pages 74–76 ; doi:10.1126/science.230.4721.74 ( Résumé)
- F. Partensky, J. Blanchot et D. Vaulot : 1999a ; chapitre : distribution différentielle et l'écologie de Prochlorococcus et Synechococcus dans les eaux océaniques : un avis ; Ed: Charpy L, Larkum TI in cyanobactéries marines. ; Bulletin de l'Institut océanographique de Monaco, NS Vol 19 ;, publié par le Musée océanographique, Monaco ; pages 457-475)
- W. K. W. Li ; 1995 ; Composition of ultraphytoplankton in the central North Atlantic ; journal : Marine Ecology Progress Series ; volume 122 ; pages=1 à 8 PDF ; doi:10.3354/meps122001
- R. J. Olson, S. W. Chisholm, E. R. Zettler & E. V. Armbrust ; 1990b ; Pigment size and distribution of Synechococcus in the North Atlantic and Pacific oceans ; journal: Limnology and Oceanography ; volume 35 ; page =45 à 58
- J. Blanchot, M. Rodier & A. LeBouteiller ; 1992 ; Effect of El Niño Southern Oscillation events on the distribution and abundance of phytoplankton in the Western Pacific Tropical Ocean along 165°E ; journal "J. Plank. Res"" ; volume=14 ; pages 137 à 156 |doi=10.1093/plankt/14.1.137 Résumé
- L. Campbell & D. Vaulot ; 1993 ; Photosynthetic picoplankton community structure in the stubtropical North Pacific Ocean new Hawaii (station ALOHA) ; journal : Deep Sea Research I ; volume 40 ; pages 2043 à 2060 ; doi=10.1016/0967-0637(93)90044-4
- J. Blanchot & M. Rodier ; 1996 ; Picophytoplankton abundance and biomass in the western tropical Pacific Ocean during the 1992 El Nino year: results from flow cytometry ; journal Deep-sea Research I ; Volume 43, pages 877 à 895 ; doi:10.1016/0967-0637(96)00026-X
Voir aussi
Articles connexes
Liens externes
- (en) Référence NCBI : Synechococcus (taxons inclus)
- (fr+en) Référence ITIS : Synechococcus Nageli, 1849
- (en) Référence AlgaeBase : genre Synechococcus