Merle noir
Turdus merula
%252C_%D0%91%D0%B8%D1%82%D1%86%D0%B5%D0%B2%D1%81%D0%BA%D0%B8%D0%B9_%D0%BB%D0%B5%D1%81.jpg.webp)

_-_Turdus_merula_(016f).jpg.webp)
Le Merle noir (Turdus merula), ou plus communément Merle, est une espèce de passereaux de la famille des turdidés.
Le merle niche en Europe, Asie et Afrique du Nord, et a été introduit en Australie et en Nouvelle-Zélande. Il existe plusieurs sous-espèces de Merle noir sur sa vaste aire de répartition dont certaines sous-espèces asiatiques sont considérées par certains auteurs comme des espèces à part entière. Selon la latitude, le Merle noir peut être sédentaire ou migrateur, partiellement ou entièrement.
Le mâle de la sous-espèce holotype, celle qui est la plus répandue en Europe, est entièrement noir, à part le bec jaune et un anneau jaune autour de l'œil, et possède un vaste répertoire de vocalisations tandis que la femelle adulte et les juvéniles ont un plumage brun. Cette espèce niche dans les bois et jardins, construisant un nid en forme de coupe aux formes bien définies, bordé de boue. Le Merle noir est omnivore et consomme une grande variété d'insectes, de vers et de fruits.
Mâle et femelle ont un comportement territorial sur le site de nidification, chacun ayant un comportement agressif distinct, mais sont plus grégaires lors de la migration ou sur les aires d'hivernage. Les couples restent dans leur territoire pendant toute l'année dans les régions où le climat est suffisamment tempéré. De nombreuses références littéraires et culturelles à cette espèce commune font cas de son chant mélodieux.
Morphologie
Mensurations
Le merle noir de la sous-espèce type (Turdus merula merula) a une longue queue (95 à 110 mm pour le mâle et 100 à 105 mm pour la femelle), mesure entre 23,5 et 29 cm de long pour une envergure de 34 à 38 cm, et pèse entre 80 et 125 grammes. Cette masse varie en fonction du sexe mais aussi des saisons et des contraintes physiologiques qui leur sont liées[1].
Les mâles (118 à 135 mm d'aile pliée, 28 à 33 mm de tarse et 20 à 23 mm de bec) tendent à être plus grands que les femelles (118 à 129 mm d'aile pliée, 28 à 29 mm de tarse et 20 à 21 mm de bec).
Aspect du mâle


Le plumage des mâles adultes est entièrement noir de jais et contraste vivement avec un anneau oculaire jaune ou jaune-orangé et avec un bec brillant jaune-orangé. Ce contraste coloré est probablement un indicateur de qualité du mâle (une couleur vive étant corrélée à sa condition physique, son âge, son succès reproducteur ou la qualité de son territoire)[2]. En hiver, le cercle autour de l'œil devient plus brun et le bec légèrement plus sombre[3]. Les pattes sont brun-noir[1].
Selon les sous-espèces et selon la saison (plumage nuptial, plumage postnuptial frais à la teinte noir glacé et plumage internuptial[note 1] aux plumes mates et usées à la fin du printemps), le noir du plumage est plus ou moins intense[4]. Il est assez brillant chez la sous-espèce-type T. m. merula. Chez quelques sous-espèces d'Inde et de Ceylan, la couleur du plumage des mâles tire vers le brun ou vers le gris-bleu. Ces caractéristiques permettent de le distinguer du plumage brun sombre ou noir constellé de blanc de la principale espèce européenne, l'étourneau sansonnet.
Aspect de la femelle

_female.jpg.webp)
Le dimorphisme sexuel est bien visible.
La femelle a un plumage brun roussâtre, dont les tons varient d'un individu à l'autre, présentant des zones plus noirâtres. Elle ne possède pas le bec et l'anneau orbital jaune brillant du mâle : son bec est marron, parfois avec une zone jaune pâle, et son cercle orbitaire[note 2] est brun clair. Sa gorge est plus claire que le reste de son plumage, pouvant présenter un aspect vaguement pommelé. Ses pattes sont brun foncé, sa poitrine brun clair.
Aspect des juvéniles

Les juvéniles possèdent un plumage brun similaire à celui de la femelle, mais moucheté de beige sur la poitrine et le dessous du corps. Chez eux aussi les tons de brun varient d'un individu à l'autre ; les plus sombres sont présumés être des mâles[1]. Ce plumage juvénile dure jusqu'à la première mue, entre août et octobre. Les mâles acquièrent alors le plumage noir luisant, mais leur bec est plus sombre et l'anneau jaune autour des yeux est moins visible ; l'aile garde encore une teinte plus brune que le corps[5]. Le bec des jeunes mâles n'atteint sa couleur jaune et leur corps un aspect noir uniforme qu'après une année complète.
Anomalies du plumage


Des anomalies de coloration du plumage sont occasionnellement observées chez les Merles noirs. Même si ces phénomènes demeurent rares en chiffres absolus, ils semblent moins exceptionnels que chez les autres espèces d'oiseaux. Selon des observations menées en Grande-Bretagne, sur l'effectif total d'oiseaux décolorés recensés de toutes espèces, 29 % appartiennent au genre Turdus et sont principalement des Merles noirs, en l'occurrence des merles blancs[6]. L'existence de merles blancs avait déjà été rapportée entre autres par Buffon[7].
Les anomalies s'expriment toutes par une décoloration plus ou moins prononcée mais sont de natures diverses et peuvent relever de l'albinisme véritable et total (l'albinisme est ou n'est pas, l'albinisme ne peut être partiel), de la canitie ou de diverses formes d'aberration (leucisme, dilutions, schizochroïsmes…)[8]. Alors que pour les vrais albinos la cause est purement génétique, d'autres facteurs, comme le vieillissement ou les carences alimentaires et vitaminiques, peuvent intervenir pour expliquer les déficiences de pigmentation[6].
Réputés plus vulnérables, les individus entièrement blancs ont de moindres chances de survie et de reproduction (les albinos ont une déficience visuelle qui les voue à une mort rapide, en général les albinos rencontrés sont donc toujours des sujets jeunes ; en revanche les merles leuciques n'ont pas d'atteinte oculaire et peuvent très bien atteindre l'âge adulte). Aussi la plupart des merles tout blancs que l'on peut observer actuellement, qu'il s'agisse de véritables albinos ou non, sont des animaux reproduits sous la protection des humains. Quant aux décolorations partielles qui surviennent chez des animaux réellement sauvages, il semble qu'elles soient nettement plus fréquentes en milieu urbain.
Espèces d'aspect similaire
En Europe, le Merle noir peut être confondu avec le juvénile du Merle à plastron (Turdus torquatus) lorsqu'il est dans sa première année, mais ce dernier a les ailes plus pâles. Le Merle noir présente également une ressemblance superficielle avec l'Étourneau sansonnet (Sturnus vulgaris)[1].
La sous-espèce T. m. kinsii du Sri Lanka ressemble à une autre espèce sri lankaise, le Merle siffleur de Ceylan (Myophonus blighi), mais cette dernière présente toujours du bleu dans son plumage, et à une espèce qui ne vit pas dans la même région du monde, le Merle unicolore (Turdus unicolor), qui a un ventre beaucoup plus pâle[5] - [9].
Un certain nombre d'espèces membres du genre Turdus, d'apparence assez similaires au Merle noir, vivent en dehors de l'aire de répartition de ce dernier, comme le Merle chiguanco (Turdus chiguanco) sud-américain[10].
La femelle Merle noir peut être confondue avec une Grive musicienne (Turdus philomelos), mais cette dernière a le dessous nettement plus pâle et ponctué de sombre.
Comportement
Alimentation

Le régime alimentaire des Merles noirs est omnivore. Ils se nourrissent d'une grande variété d'espèces d'insectes, de vers et de divers autres petits animaux et ils consomment également des fruits et parfois des graines.
Les merles recherchent principalement leurs proies à terre. Ils courent, sautillent, progressent par à-coups et penchent la tête de côté pour observer le sol. Ils chassent principalement à vue mais utilisent aussi parfois leur ouïe. Ce sont d'importants consommateurs de lombrics qu'ils attrapent en fouillant l'humus. Ils sauraient les faire émerger de leurs galeries en tapotant le sol avant de les en extirper[11]. Ils grattent aussi la litière des feuilles en décomposition, de façon bruyante et démonstrative, en faisant voleter les feuilles à la recherche de toutes sortes d'invertébrés : des insectes aussi bien à l'état de larves que d'imagos, des araignées, des myriapodes, des limaces, des petits escargots[12]… Exceptionnellement, ils se repaissent de petits vertébrés comme des têtards, de petits amphibiens adultes ou des lézards. Même s'ils sont surtout des chasseurs au sol, les merles n'hésitent pas à explorer les arbres et les buissons pour collecter les insectes qui y sont posés, notamment les chenilles.
Mais si les Merles noirs fréquentent les branchages pour s'alimenter, c'est d'abord à la recherche de fruits, généralement de petits fruits charnus : baies ou drupes[13]. La nature des fruits consommés dépend de ce qui est localement disponible, et peut inclure des espèces exotiques prises dans les jardins ou les vergers. Ils affectionnent les petits fruits qu'ils peuvent saisir et emporter dans leur bec mais ne dédaignent pas picorer de plus gros fruits tombés à terre comme des pommes.
_05.jpg.webp)
En Europe tempérée, ils se nourrissent de baies de troène, de sureau noir, d'argouses, de cornouilles, de cerises, de mûres de roncier… En hiver, ils trouvent, encore accrochés aux rameaux, des fruits d'aubépine, de lierre grimpant, des sorbes, des boules de houx, du gui, des cynorhodons, etc.[14]. Plus au sud, ils peuvent cueillir des olives, des myrtes, des fruits de micocoulier, des raisins… Dans le nord de l'Inde, les petites figues du Figuier des Banyans et les mûres de mûrier sont souvent consommées, alors que vers le sud de ce sous-continent, les petites baies noires des arbres du genre Trema font fréquemment partie de leur régime[5]. Comme d'autres turdidés, le merle noir peut régurgiter les graines non digérées de certaines de ces baies[15].
Les proies animales dominent et sont particulièrement importantes dans l'alimentation du merle pendant la saison de nidification, alors que les fruits tombés ou les baies prennent de l'importance en automne et en hiver.
Comportement territorial
Les Merles noirs ont une territorialité très affirmée et ne vivent pas en groupe. Chaque individu délimite son territoire propre dont l'étendue varie de 0,2 à 0,5 ha en forêt ou de 0,1 à 0,3 ha en ville. Le mâle établit son territoire au cours de sa première année d'existence et le garde sa vie entière. Durant la saison de nidification, un merle ne supporte aucun congénère, à l'exception de son partenaire.
Pour défendre l'exclusivité de son territoire, un mâle chasse les autres mâles par des postures de menace : une course brève vers l'intrus, la tête d'abord levée, puis penchée vers le bas au fur et à mesure que la queue s'abaisse. Si un combat s'ensuit, les deux mâles se font face et, voletant à quelques centimètres du sol en poussant des cris, les pattes tendues vers l'adversaire. Ces combats sont généralement de courte durée, plus démonstratifs que violents, et l'expulsion de l'intrus est rapide. La femelle aussi est agressive au printemps, quand elle entre en compétition avec d'autres femelles pour un partenaire ou un territoire de nidification. Bien que les combats de femelles soient moins fréquents, ils ont tendance à être plus violents[13].
En dehors de la période de reproduction, plusieurs merles peuvent partager un habitat commun qui leur procure nourriture et abri, et il arrive qu'ils se perchent pour la nuit en petits groupes, mais même dans ce cas, il n'y a guère de relations entre les individus.
Le territoire d'un merle, bien qu'essentiel à la formation des couples et à la nidification, ne fournit au mieux qu'une partie des ressources en nourriture[16].
Une étude semble montrer que l'apparence du bec est un facteur important dans les interactions entre Merles noirs. Le mâle qui défend son territoire réagit plus agressivement envers les intrus au bec orangé qu'envers ceux à bec jaune, mais il réagit moins aux becs bruns, caractéristiques des jeunes mâles de moins d'un an et des femelles. La femelle est au contraire relativement indifférente à la couleur du bec de l'intrus, mais semble sensible à la réflexion des ultraviolets sur le bec[17].
Vocalisations

On dit que le merle siffle, flûte, appelle ou babille[18].
Un Merle noir mâle d'un an de la sous-espèce Turdus merula merula peut déjà commencer à chanter dès le mois de janvier par beau temps, afin d'établir un territoire. Il est suivi fin mars par le mâle adulte. « Chaque mâle possède une grande variété de phrases. Sonores et émises sans hâte, on les reconnaît facilement grâce au timbre flûté de nombreuses syllabes. Mais les phrases se terminent souvent par des sons suraigus, moins agréables. Elles peuvent aussi comporter des syllabes empruntées à d'autres oiseaux, voire des sonneries de GSM[note 3] » (Metzmacher, 2008). Ce chant est lancé depuis le haut des arbres, le toit des maisons ou tout autre perchoir dominant les environs. Il chante de mars à juin, parfois début juillet. Une étude semble montrer que le chant dure plus longtemps lorsque le mâle est en meilleure forme, et lorsque sa femelle est dans une période de fertilité maximale[19]. Le mâle peut chanter à tout moment de la journée, mais le lever et le coucher du soleil sont les moments où les chants sont plus intenses. Le chant du Merle noir est considéré comme l'un des plus beaux chants d'oiseaux d'Europe. Sa richesse de répertoire, ses variations mélodiques et ses capacités d'improvisation distinguent le Merle noir européen de la plupart des autres oiseaux.
Il possède de nombreux autres appels, tel un agressif sriiii, un pök-pök-pök d'alarme désignant un prédateur terrestre (un chat par exemple), et divers tchink et tchouk, tchouk. Le mâle assurant un territoire réalise invariablement des appels de type chink-chink dans la soirée, dans une tentative (généralement vaine) de décourager les autres mâles de venir se percher pour dormir sur son territoire[13]. Comme les autres passereaux, il a un léger sriiiiii d'alarme haut perché pour désigner les oiseaux de proie, car ce son est rapidement étouffé par la végétation, et donc difficile à localiser[20]. En cas de vive inquiétude, il émet une série de cris gloussants, précipités et bruyants.
Au moins deux sous-espèces, T. m. merula et T. m. nigropileus, sont capables d'imiter d'autres espèces d'oiseaux, mais aussi des chats, des humains ou des alarmes, mais le son obtenu est généralement faible et difficile à détecter. Les grandes sous-espèces de montagne, particulièrement T. m. maximus, ont un chant comparativement de piètre qualité, avec un répertoire limité comparé à celui des sous-espèces occidentales, sri lankaises ou de l'Inde péninsulaire[5].
Bandes sons
- Nombreuses vocalisations différentes de Turdus merula sur le site xeno-canto.org
- D'autres solistes sur le site de Sonatura Turdus merula
Accouplement
La parade nuptiale du mâle se compose de courses obliques combinées à des hochements de tête, le bec ouvert, et un chant émis avec une voix grave et étranglée. La femelle reste immobile jusqu'à ce qu'elle lève la tête et la queue pour permettre l'accouplement[13]. Cette espèce est monogame, la fidélité étant généralement la règle jusqu'au décès d'un des partenaires[21]. La séparation des couples survient cependant dans 20 % des cas après une saison de reproduction ayant un faible taux de réussite[22]. De plus, bien que « socialement » monogame, des études ont montré que le taux de paternité adultérine peut atteindre 17 % chez cette espèce[23].
Nidification

La sous-espèce Turdus merula merula commence généralement à pondre en mars, mais les sous-espèces orientales et indiennes sont plus tardives, commençant au plus tôt en avril ou en mai. Les individus introduits dans l'hémisphère sud, eux, commencent à pondre en août[5] - [24].
Le couple nicheur recherche un emplacement convenable pour la nidification dans un buisson (arbustif ou grimpant), généralement à environ 2 m du sol, favorisant certaines espèces végétales comme le lierre, le houx, l'aubépine, le chèvrefeuille ou le pyracantha[25]. Le nid peut aussi être installé sur la fourche d'une branche d'arbre[26].
Bien que le mâle puisse aider à la construction du nid, principalement en apportant des matériaux de construction[27], la femelle construit presque seule un nid en forme de coupelle avec de la mousse, de l'herbe, de petites racines et des brindilles, qu'elle borde ensuite de boue ou de feuilles boueuses. Elle pond ensuite 2 à 6 œufs (généralement 4) de couleur bleu-vert, présentant des taches brun-rouge qui sont plus nombreuses sur le gros bout[13] - [24]. Les œufs de la sous-espèce T. m. merula ont des dimensions moyennes de 2,9 × 2,1 cm et pèsent généralement 7,2 grammes (6 % de cette masse correspond à la coquille)[28]. Les coquilles d'œufs des sous-espèces du sud de l'Inde sont plus pâles que celles des autres[5].
Incubation et élevage des petits



La femelle couve seule durant 12 à 14 jours avant l'éclosion, qui donne naissance à des oisillons nidicoles, nus et aveugles d'une masse de 5 à 6 g. Les parents s'occupent tous les deux des petits, les nourrissant et débarrassant le nid des sacs fécaux. La masse atteinte par le poussin à l'âge de huit jours est déterminante pour la survie ultérieure : la masse idéale serait de 35 à 45 g, en dessous de ces valeurs le poussin aurait très peu de chance de survivre[29]. En effet, la période qui suit le séjour au nid est primordiale pour la survie. Pendant trente jours, les jeunes sont particulièrement vulnérables : les plus lourds sont alors favorisés par rapport aux plus légers. À douze jours, les poussins pèsent entre 60 et 65 g.
Ils quitteront leur nid très tôt, au bout de 10 à 19 jours (13,6 jours en moyenne avec une masse de 70 à 80 g)[21], une semaine avant de savoir voler : ils rampent hors du nid, se laissent tomber en voletant, et vont se mettre à couvert à proximité[30]. Ils seront encore nourris par leurs parents pendant trois semaines après leur départ du nid et suivront les adultes, mendiant de la nourriture. Si la femelle commence une deuxième couvée, le mâle assurera seul le nourrissage des jeunes[13]. Une seconde couvée est en effet commune, la femelle réutilisant le même nid si la première couvée a été couronnée de succès et, dans le sud de l'aire de répartition de cette espèce, il peut ainsi y avoir jusqu'à trois couvées par an, voire davantage[5] - [18]. Pendant la période où les petits sont nourris par leurs parents, ils apprendront à choisir leur nourriture. À mesure que leur expérience et leur confiance augmentent, ils commencent à s'aventurer plus avant dans le territoire parental. Les jeunes finissent par prendre leur indépendance et s'envoler, toujours de leur propre chef : ils ne sont jamais chassés par leurs parents[30].
Les jeunes seront à leur tour capables de se reproduire à un an[31], après avoir choisi leur propre territoire.
En France, la prédation, les maladies, la chasse et les aléas climatiques provoquent une mortalité moyenne variant de 50 à 80 % selon les régions[14].
Cas de la sous-espèce T. m. maximus
Cette sous-espèce des régions montagneuses a une saison de reproduction plus courte et ne peut produire qu'une seule couvée par an. La femelle pond généralement moins d'œufs, de 2 à 4 (2,86 œufs en moyenne), mais de dimensions plus grandes que ceux de T. m. merula. La période d'incubation sera en moyenne plus courte (de 12 à 13 jours), mais les petits resteront plus longtemps au nid (durant 16 à 18 jours)[32].
Systématique
Descriptions anciennes et classification
Le merle noir, espèce communément répandue de l'Ancien Monde, est mentionné et décrit dans de nombreux textes anciens. Il est cité par Aristote sous le nom de Cottyphus (Κοττύφος) au dix-huitième chapitre du neuvième Livre des Animaux comme la principale espèce de merle. Nommé en latin merula, ce qui donnera directement en français merle[33], Varron fournit comme explication étymologique un diminutif de mera : Merula est le quasi mera, le « presque seul », celui qui ne vole pas en groupe, ce qui rend bien compte du caractère solitaire de cet oiseau[34].
En 1555, Pierre Belon dans l'Histoire de la nature des oiseaux en dit notamment que « Chacun sait qu'il est de couleur noire, et que son bec devient jaune en vieillissant… » et plus loin que « Les médecins tiennent qu'il engendre bonnes humeurs, acomparants la chair à celle de la Grive aussi ont maintenant coutume de concéder aux malades d'en manger, l'estimant de facile digestion[35] ».
Le très commun Merle noir est naturellement recensé par Carl von Linné dès 1746 dans son ouvrage sur la faune de Suède, Fauna Svecica. Il y est répertorié sous l'appellation Turdus ater, rostro palpebrisque fulvis[36] qui signifie « grive noire, au bec et aux paupières jaunes ». Il est d'ores et déjà regroupé avec les grives dans le genre Turdus, conformément à cet égard au sens de son nom en suédois koltrast, la « grive de charbon ».
Dans l'édition de 1758 de Systema Naturae, qui établit la généralisation de la nomenclature binominale, Linné lui donne enfin le nom scientifique qu'il a toujours conservé jusqu'à présent : Turdus merula[37], en apposant au nom de genre Turdus, la « grive » en latin, le nom d'espèce merula, le « merle » dans la même langue. Ce qui lui servait de longue appellation savante précédemment ne devient plus alors qu'une simple description. Linné ajoute que le Merle noir dissémine les graines de genévrier.
Le Merle noir appartient au genre Turdus, avec les grives et d'autres espèces de « merles ». La différenciation entre les merles et les grives ne repose pas sur des fondements biologiques ; elle est purement culturelle et linguistique, et diffère selon les langues.
Les oiseaux du genre Turdus ont été, dès les premières classifications de Linné, à l'origine de la création de la famille des Turdidae dont ils forment le genre-type. Mais sur la base d'une vaste étude génétique générale des oiseaux menée dans les années 1970 et 80, mesurant l'hybridation de l'ADN et menant à une nouvelle classification taxinomique dite de Sibley-Ahlquist, des ornithologues américains ont intégré ce groupe dans la famille des Muscicapidae. L'ancienne famille des Turdidae passe alors au rang de sous-famille, celle des Turdinae. Cependant la fiabilité de la méthodologie utilisée par Charles Gald Sibley et Jon Ahlquist et la pertinence des résultats déduits est contestée par une large part des spécialistes en ornithologie. Dans des classifications plus récentes, notamment celle de Jim Clements[38], la famille des Turdidae est pleinement rétablie.
Autres merles
Parmi les 65 espèces environ du genre Turdus, caractérisées par une taille moyenne, des têtes rondes, de longues ailes pointues et des chants généralement mélodieux, plusieurs sont aussi appelées en français « merles » comme le Merle à plastron (Turdus torquatus) ou le Merle d'Amérique (Turdus migratorius). Le Merle noir semble en particulier être très proche, au niveau phylogénique, du Merle des îles (Turdus poliocephalus), oiseau du sud-ouest de l'océan Pacifique, qui a probablement divergé au point de vue évolutif très récemment des populations de Turdus merula[5].
D'autres espèces de proche parenté sont également appelées couramment « merles » comme le merle de roche (Monticola saxatilis), mais d'autres « merles » appartiennent à des familles plus éloignées, comme le merle d'eau ou Cincle plongeur ou encore le merle des Indes ou Mainate et sont surnommés ainsi en raison de ressemblances avec le Merle noir par la taille, la couleur, le chant ou le régime alimentaire.
Sous-espèces
| Avibase | Peter Clement |
|---|---|
Selon Avibase, il existe 14 à 16 sous-espèces de Turdus merula :
Turdus simillimus et Turdus maximus, citées comme espèces à part entière, sont considérées comme sous-espèces par certains auteurs[39]. |
Selon Clement[5], il y en a 15 :
|
| Nom binominal | Aire de répartition | Image |
|---|---|---|
| Turdus merula merula | Europe |  |
| Turdus merula azorensis | Açores |  |
| Turdus merula cabrerae | Madère et Canaries | .jpg.webp) |
| Turdus merula mauritanicus | Maroc, Algérie et Tunisie |  |
| Turdus merula aterrimus | Hongrie, Grèce, Turquie, Iran, Irak et Égypte |  |
| Turdus merula syriacus | Turquie, Jordanie, Israël et Égypte | -Jerusalem.jpg.webp) |
| Turdus merula intermedius | Asie | _-_Turdidae_-_bird_skin_specimen.jpeg.webp) |
| Turdus merula mandarinus | Chine |  |
En fait, la taxonomie de cette espèce est assez complexe, surtout en ce qui concerne les sous-espèces asiatiques. Celles du sous-continent indien (T. m. simillimus, T. m. nigropileus, T. m. bourdilloni, T. m. spencei et T. m. kinnissi) sont de petite taille, seulement 19 à 20 cm de long, et les mâles ont un anneau oculaire large ; elles diffèrent aussi des autres sous-espèces de Turdus merula par leurs proportions, par leur surface alaire et leur envergure, par la couleur de leurs œufs et par leurs vocalisations. De fait, elles sont parfois considérées comme constituant une espèce séparée, le Merle indien (T. simillimus)[40] - [41].
La sous-espèce himalayenne T. m. maximus est très différente des sous-espèces indiennes (le groupe simillimus cité plus haut), car ses représentants sont plus grands (23 à 28 cm de long) ; elle diffère en fait de toutes les autres sous-espèces de Turdus merula par son manque total d'anneau oculaire et par ses piètres vocalisations. Elle est donc parfois considérée comme une espèce à part entière, le Merle tibétain (T. maximus)[42].
Les autres sous-espèces asiatiques, T. m. intermedius et T. m. mandarinus, relativement grandes, et T. m. sowerbyi, plus petite, sont elles aussi différentes par leur aspect et leurs vocalisations, et pourraient, selon certains auteurs, former une espèce distincte qui, une fois reconnue serait appelée Merle chinois et prendrait comme nom scientifique T. mandarinus[43]. Certains auteurs ont suggéré qu'on pourrait les considérer comme une sous-espèce de T. maximus[5], mais ces merles en diffèrent par leur aspect (notamment par leur anneau oculaire) et par leurs vocalisations[42] - [43].
Les sous-espèces européennes, tout comme celles d'Afrique du Nord et du Proche-Orient, se distinguent les unes des autres par des nuances de coloration du plumage. Le plumage des mâles des populations des Açores (Turdus merula azorensis), de Madère et des îles Canaries occidentales (Turdus merula cabrerae) et d'Afrique du Nord (Turdus merula mauretanicus) est d'un noir plus profond et plus brillant que celui des mâles d'Europe continentale (Turdus merula merula). De même, les femelles sont plus sombres puisque brun noir chez azorensis et cabrerae ou gris suie chez mauretanicus au lieu de brunes chez merula. Chez cette dernière sous-espèce, les oiseaux tendent à avoir des tailles un peu plus grandes et des ailes un peu plus longues du sud vers le nord. Les populations des îles méditerranéennes se singularisent par leur taille plus petite. En Suède, des mâles à gorge blanche et des femelles très rousses peuvent être observés. Dans le sud-est de l'Europe, les oiseeaux (Turdus merula aterrimus) sont plus pâles et plus gris. Du Proche-Orient jusqu'à l'Irak et l'Iran, les mâles de la sous-espèce syriacus sont pâles et les femelles grises.
Chorologie
Habitat
Commun dans les zones boisées sur la grande majorité de son aire de répartition, le Merle noir a une préférence pour les forêts décidues, à sous-bois dense. Cependant, les jardins leur fournissent le meilleur site de nidification, capables d'accueillir jusqu'à 7,3 couples par hectare, alors que les forêts ne peuvent soutenir que le dixième de cette densité de population (et les espaces ouverts et très urbanisés encore moins)[13]. On peut aussi le trouver dans des haies, des zones arbustives, en lisière de forêt, dans des parcs ou cultures, voire en zone urbaine.
En Europe, il est souvent graduellement remplacé par le Merle à plastron, espèce assez proche du point de vue taxonomique, quand on progresse en altitude[24]. On peut le trouver jusqu'à 1 000 m d'altitude en Europe, 2 300 m en Afrique du Nord, 800 m au Sri Lanka et 900 m dans la péninsule indienne, mais les grandes sous-espèces himalayennes peuvent atteindre des altitudes bien supérieures : T. m. maximus niche entre 3 200 et 4 800 m et demeure au-dessus de 2 100 m d'altitude même en hiver[5].
Répartition
Le Merle noir niche dans toute l'Europe tempérée, toujours en dessous du cercle polaire arctique, mais aussi en Afrique du Nord, sur certaines îles atlantiques (Madère, Açores, îles Canaries) et dans une grande partie de l'Asie du Sud.
Le Merle noir a été introduit dans de nombreuses parties du monde en dehors de son aire originelle. Par exemple, en Australie et en Nouvelle-Zélande, se trouvent des descendants de merles importés de Grande-Bretagne[5].
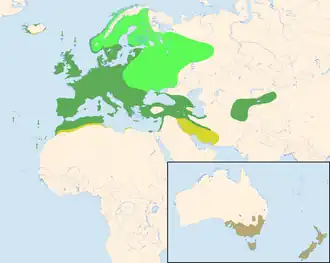
(les signalements rares ou erratiques en Amérique du Nord ne sont pas pris en compte)
- Vert foncé : zones de présence annuelle (reproduction et hivernage)
- Vert clair : zones de reproduction
- Jaune : zones d'hivernage
- Marron : zones où l'espèce a été introduite
Migration
Selon la latitude, le Merle noir peut être un oiseau sédentaire ou migrateur, partiellement ou entièrement[43]. Les populations du sud et de l'ouest de l'aire de répartition sont sédentaires, mais les merles les plus nordiques migrent vers le sud jusqu'à l'Afrique du Nord ou l'Asie tropicale en hiver[5].
Les mâles des populations urbaines sont plus à même de rester en hiver dans les climats frais que les mâles de campagne, adaptation rendue possible grâce à un microclimat plus clément et à une nourriture relativement abondante, qui permet à ces oiseaux d'établir un territoire et de commencer la reproduction plus tôt dans l'année[44]. Tant que de la nourriture est disponible en hiver, mâles et femelles resteront sur leur territoire tout au long de l'année.
Les individus migrateurs sont capables de couvrir de grandes distances. Ils sont plus sociables, voyageant en petits groupes, généralement de nuit et se nourrissant en groupe dispersé sur les aires d'hivernage. Le vol de migration, qui consiste en des séries de rapides battements d'ailes interrompues par des mouvements planés horizontaux ou plongeants, diffère du vol normal, rapide et agile, du Merle noir, mais aussi du vol de plus grands Turdidae, présentant souvent des mouvements plongeants plus accentués[18] - [21].
Quelques individus erratiques de cette espèce très répandue géographiquement sont occasionnellement apparus en de nombreux endroits d'Europe hors de leur aire normale de répartition, comme dans l'archipel de Svalbard et l'île de Jan Mayen, situés dans la région Arctique. Des individus erratiques ont été observés au Japon[45]. Les observations en Amérique du Nord sont généralement imputées à des individus captifs échappés, comme dans le cas du merle noir observé au Québec en 1971[46]. Cependant, une observation datant de 1994 à Bonavista, dans la province canadienne de Terre-Neuve-et-Labrador, a été reconnue comme une observation d'un individu vraiment sauvage[5] et l'espèce figure de fait sur la liste des oiseaux de l'Amérique du Nord[47].
Populations
La population mondiale du merle noir n'a pas été chiffrée, mais la population européenne est estimée entre 79 et 160 millions d'individus[48]. Cette espèce est particulièrement abondante en Allemagne (8 à 16 millions de couples), au Royaume-Uni (près de 5 millions de couples) et en France où les effectifs de merles sont estimés à plusieurs dizaines de millions de couples nicheurs[14]. Cette population y est considérée comme stable, et l'indice d'abondance des oiseaux nicheurs en France montre même une légère augmentation entre 1994 et 2003[14].
L'avenir de l'espèce dépendra essentiellement du maintien d'habitats diversifiés favorables lui apportant abri et ressources alimentaires. La population européenne semble globalement en accroissement depuis les années 1990, elle est donc considérée comme « sécurisée » par Birdlife International[49].
Répartition des sous-espèces
Ce paragraphe suivra la proposition de classification de Clement (voir paragraphe « Systématique »):

- T. m. merula, la sous-espèce type, niche communément dans la majorité de l'Europe, depuis l'Islande, les îles Féroé et les îles Britanniques jusqu'aux montagnes de l'Oural à l'est et au 70e parallèle au nord (où il est plutôt rare). Une petite population niche dans la vallée du Nil, dans le nord de l'Afrique. Les oiseaux du nord de l'Europe sont migrateurs et hivernent plus au sud en Europe et autour de la Méditerranée, entre autres à Chypre et en Afrique du Nord. Les populations introduites en Australie et en Nouvelle-Zélande appartiennent à cette sous-espèce[5].
- T. m. azorensis est une sous-espèce de petite taille qui niche aux Açores. Le mâle est plus sombre et plus luisant que T. m. merula[21] et la femelle brun noir.

- T. m. cabrerae, nommée d'après Ángel Cabrera, zoologiste espagnol, ressemble à la sous-espèce azorensis et niche à Madère et à l'ouest des îles Canaries[21].

- T. m. mauretanicus, une autre petite sous-espèce au mâle à plumage plus sombre et luisant et à la femelle gris suie, niche dans le centre et le nord du Maroc, sur la côte algérienne et le nord de la Tunisie[21].
- T. m. aterrimus niche en Hongrie, au sud et à l'est du sud de la Grèce, en Crète, dans le nord de la Turquie et au nord de l'Iran. Elle hiverne dans le sud de la Turquie, dans le nord de l'Égypte, en Irak et dans le sud de l'Iran. Les membres de cette sous-espèce sont plus petits que ceux de la sous-espèce merula ; le mâle est plus terne et la femelle plus pâle[21].
- T. m. syriacus niche de la côte méditerranéenne du sud de la Turquie jusque, vers le sud, la Jordanie, Israël et le nord du Sinaï. Cette sous-espèce est majoritairement sédentaire, mais une partie de la population se déplace vers le sud-ouest ou l'ouest pour hiverner dans la vallée du Jourdain ou dans le delta du Nil, au nord de l'Égypte, jusqu'au Caire approximativement. Mâles et femelles de cette sous-espèce sont l'un plus sombre et l'autre plus gris que la sous-espèce merula[5].
- T. m. intermedius est une sous-espèce asiatique qui niche du centre de la Russie jusqu'au Tadjikistan, à l'ouest et au nord-est de l'Afghanistan, et à l'est de la Chine. La majorité des individus sont résidents, mais certains réalisent une migration altitudinale au sud de l'Afghanistan et de l'Irak[5] Cette sous-espèce est de grande taille ; le mâle est d'un noir charbonneux et la femelle est brun-noir[43].
_1.jpg.webp)
- T. m. maximus est une sous-espèce de grande taille des régions montagneuses, observable à l'est de l'Afghanistan et, vers l'est, de l'Himalaya (de 3 200 à 4 800 m d'altitude) jusqu'au Sikkim, à l'Assam, au sud du Tibet et à l'ouest du Sichuan, en Chine. Elle réalise des migrations altitudinales. En hiver, on la trouve en dessous de 2 100 m au sud du Tibet, mais pas en dessous de 3 000 m plus à l'est. Le mâle est noir et la femelle d'un brun très sombre[9]. C'est la seule sous-espèce dont le mâle ne possède pas d'anneau oculaire[42].
- T. m. mandarinus niche dans la majorité du sud, du centre et de l'est de la Chine[50]. Ces merles sont des migrateurs partiels vers Hong Kong et le sud du Laos et du Viêt Nam. Le mâle est d'un noir charbonneux ; la femelle est similaire mais plus brune, et plus claire sur le dessous du corps[51]. Cette sous-espèce a une grande taille[43].
- T. m. sowerbyi, nommée d'après James Sowerby, naturaliste anglais et illustrateur, niche de l'est du Sichuan jusqu'au Guizhou, en Chine. Cette sous-espèce est partiellement migratrice ; certains individus passent l'hiver dans le sud de la Chine ou le nord de l'Indochine. Elle ressemble à la sous-espèce T. m. mandarinus, mais elle est plus petite, et le dessous de son corps est plus sombre[43].
- T. m. nigropileus est une sous-espèce résidente de l'Inde, pouvant se trouver en altitude jusqu'à plus de 1 820 m dans les Ghâts occidentaux de l'ouest indien et dans le nord et le centre des Ghâts orientaux. Le mâle est brun ardoisé avec un capuchon sombre, et la femelle est d'un brun moyen, plus pâle en dessous[9] C'est une petite sous-espèce, avec un anneau oculaire relativement large[40].
- T. m. spencei, nommée d'après l'entomologiste anglais William Spence, est très similaire à la sous-espèce T.m.nigropileus, mais présente un capuchon sombre moins distinct. C'est une sous-espèce résidente dans les hauts plateaux de l'est de l'Inde[5]. Cette sous-espèce, à la validité contestée, est souvent incluse dans la sous-espèce T.m.nigropileus[40].
- T. m. simillimus est une sous-espèce résidente commune dans les collines du Kerala et du Tamil Nadu, dans le sud de l'Inde. Elle est plus sombre que la sous-espèce T.m.spencei[5].
- T. m. bourdilloni, nommée d'après Thomas Fulton Bourdillon, Conservateur des forêts de ce qui était alors l'état princier de Travancore, dans les Indes britanniques, est une sous-espèce commune résidant dans les collines du sud du Kerala et du Tamil Nadu, au-dessus de 900 m. Elle ressemble à la sous-espèce T. m. simillimus, mais le mâle est d'un brun ardoisé uniforme[40].
- T. m. kinnisii, nommée d'après John Kinnis, chirurgien des forces militaires anglaises à Ceylan (ancien nom du Sri Lanka), niche dans les collines du Sri Lanka au-dessus de 900 m. Le mâle est d'un gris-bleu uniforme et la femelle est similaire, mais d'une teinte plus brune[9]. Sa taille est similaire à celle de T. m. nigropileus, mais son anneau oculaire est plus rouge-orangé.
Menaces naturelles et espérance de vie
Un Merle noir a une espérance de vie de 2,4 ans en moyenne[52], ce qui inclut la mortalité infantile. Les Merles noirs dépassant leur première année vivent 5 ans en moyenne[53], mais selon des résultats basés sur le marquage, cette espèce peut atteindre un âge record de 21 ans et 10 mois[31] - [54].

Le principal prédateur du Merle noir est le chat domestique, mais le renard, la fouine, l'hermine et les rapaces, comme les éperviers et les autours, chassent aussi cette espèce quand l'occasion se présente, et limitent ainsi les populations de Merle noir[55] - [56]. Par contre, il n'y a guère de preuves directes montrant que la prédation des œufs de Merle noir, des oisillons ou des adultes par les Corvidés, tels que la Pie bavarde, la Corneille noire, ou le Geai des chênes, ait un impact direct sur les effectifs des populations de merles[25].
Le Merle noir est occasionnellement l'hôte involontaire du Coucou gris (Cuculus canorus), espèce parasite qui pond ses œufs dans le nid d'autres espèces. Mais généralement, le coucou en est pour ses frais, car le merle sait reconnaître l'adulte de cette espèce, mais aussi ses œufs, plus gros que ceux des espèces qu'il parasite, et qui sont rejetés[57]. Le merle introduit en Nouvelle-Zélande, où le coucou ne vit pas, a depuis perdu la capacité à reconnaître le Coucou gris adulte, mais rejette toujours les œufs de ce dernier[58].
Comme chez tous les passereaux, les parasites sont communs chez le merle. Des études ont montré que 88 % des merles examinés présentaient des parasites intestinaux, le plus fréquemment du genre Isospora ou Capillaria[59], et plus de 80 % présentaient des hématozoaires parasites[60].
Les merles passent beaucoup de leur temps à chercher de la nourriture au niveau du sol. Ils sont souvent colonisés par des tiques, ou autres parasites externes, surtout au niveau de la tête[61]. Lors d'une étude en France, 74 % des merles examinés en milieu rural étaient infestés de tiques du genre Ixodes, contre seulement 2 % de ceux examinés en milieu urbain[61]. Ceci est dû au fait que dans les parcs et jardins des régions urbaines, les tiques ont davantage de difficultés à trouver d'autres hôtes, alors qu'en milieu rural, les hôtes sont plus nombreux et divers (renard, daim et chevreuil, sanglier, etc.)[61]. Bien que les tiques du genre Ixodes puissent transmettre des virus ou bactéries pathogènes, et soient réputées transmettre la bactérie Borrelia aux oiseaux[62], il n'y a aucune preuve que ceci affecte la santé du Merle noir, sauf lorsqu'ils sont épuisés et immunodéprimés après la migration[61]. Il semble par contre que le Merle noir soit malheureusement un réservoir à Borrelia, capable de retransmettre le parasite aux tiques[63].
En se nourrissant, ils peuvent aussi être contaminés par divers polluants du sol et de l'eau. Cette espèce a fait l'objet d'une étude de biomonitoring sur la zone-atelier de l'ancienne fonderie Métaleurop-Nord, afin de vérifier qu'un suivi des métaux lourds pouvait être fait avec des passeraux en n'utilisant que de petites quantités de sang pour les analyses[64].
Le merle semble être l'oiseau le plus vulnérable[65] à une maladie émergente virale due à un virus : le virus Usutu (ou USUV).
Le Merle noir et l'homme
Espèce invasive
Le Merle noir fut introduit en Australie à Melbourne dans les années 1850, mais s'est répandu depuis de Melbourne et Adélaïde, ses quartiers originels, à travers tout le sud-est de l'Australie mais aussi en Tasmanie et dans les îles du détroit de Bass[66]. Les populations introduites en Australie sont considérées comme nuisibles car elles causent des dommages sur une grande variété de baies et drupes dans les vergers, parcs et jardins, particulièrement sur le raisin et les cerises. Il est aussi accusé de répandre des « mauvaises herbes », telles que les ronces, et d'entrer en compétition avec le reste de l'avifaune locale en ce qui concerne la nourriture et les sites de nidification[67].
En Nouvelle-Zélande, le Merle noir et l'autochtone Zostérops à dos gris (Zosterops lateralis) sont les deux oiseaux disperseurs de graines les plus répandus de ce pays. Depuis son introduction en 1862, en même temps que la Grive musicienne (Turdus philomelos), il s'est répandu dans tout le pays, jusqu'à une altitude de 1 500 m, de même que sur les îles situées à quelques distances, telles que le groupe de l'île Campbell et les îles Kermadec[68]. Il mange une grande variété de fruits autochtones et exotiques, et il est un contributeur majeur du développement des communautés de plantes ligneuses naturalisées telle, encore une fois, la Ronce commune. Ces plantes fournissent des fruits plus appréciés par les oiseaux non endémiques (qu'ils soient autochtones ou introduits) que par les oiseaux endémiques[69].
Chasse en France
Dans le sud de la France, le merle paie aussi son tribut à la chasse à la grive, car de manière officielle, aucune distinction n'est faite entre merles et grives. De 1998 à 1999, les décès par la chasse ont été estimés à 985 000 Merles noirs par l'ONCFS ; les principales zones de chasse étaient alors la Gironde, l'Hérault, le Var et la Corse[14]. Dans la région Provence-Alpes-Côte-d’Azur, les décès liés à la chasse en 2000 ont été estimés à 200 000 individus[70].
Comme de nombreux autres oiseaux, il a été dans le passé chassé dans les zones rurales, en général trappé sur ses perchoirs nocturnes, afin d'améliorer le quotidien[71]. Il entre toujours actuellement dans la composition du pâté de merle, spécialité culinaire corse.
Le Merle noir se chasse à tir, devant soi sur les zones d'alimentation ou au poste fixe. Il peut être également capturé vivant avec des gluaux pour servir d'appelant à la chasse au poste. Cette capture d'oiseaux aux gluaux, utilisée dans les Alpes de Haute-Provence, les Alpes-Maritimes, les Bouches-du-Rhône, le Var et le Vaucluse, est réglementée par arrêté ministériel et soumise à autorisation préfectorale[14].
État des populations, statut légal et préservation de l'espèce en France
En tant qu'oiseau relativement ubiquiste (à la fois urbain et rural) il a été utilisé pour l'étude des effets de la pollution lumineuse sur les oiseaux (et plus précisément sur les cycles chronobiologiques nycthéméraux et saisonniers[72] ou la migration aviaire).
En particulier, une étude a été basée sur le suivi d'adultes mâles sauvages capturés pour les uns dans une forêt rurale, et pour les autres dans deux sites urbains, différents (du point de vue de leur degré de perturbation anthropique de l'environnement nocturne par l'éclairage urbain)[72]. Avant d'être relâchés dans leur milieu, ces merles ont tous été équipés d'un système de télémétrie associé à deux capteurs enregistrant simultanément les variations de la luminosité ambiante et l'état d'activité de l'oiseau (actif/non-actif). Les chercheurs ont ainsi pu étudier les relations entre la luminosité naturelle ou artificielle, les conditions météorologiques et les moments de début et de fin de l'activité de chaque individu. Ils ont aussi étudié l'activité de l'oiseau selon le niveau de bruit ambiant (qui variait entre la semaine et le week-end). Les enregistrements montrent que l'activité quotidienne du merle était considérablement plus précoce dans les deux sites urbains éclairés (par rapport au calendrier d'activité de la population rurale), alors que la fin de l'activité quotidienne ne variait pas entre les trois sites. Les oiseaux les plus éclairés en fin de soirée débutaient leur activité matinale plus tôt (alors que le degré d'illumination nocturne n'a pas influencé l'heure de fin de l'activité quotidienne)[72]. Le bruit variait entre la semaine et le week-end, mais sans effet apparent sur les moments et/ou durées d'activité des oiseaux[72]. Un effet saisonnier fort a été détecté dans les deux populations urbaines et rurales, montrant une durée d'activité allongée le matin et le soir (plus marqué en début de saison de reproduction qu'aux stades suivants)[72]. Les auteurs ont conclu que « la lumière artificielle nocturne est un facteur majeur de changement du calendrier de l'activité quotidienne » et que « des recherches futures devraient se concentrer sur les coûts/avantages d'une rythmicité quotidienne altérée chez les oiseaux des zones urbaines »[72]. Peu auparavant une autre étude avait montré que la pollution lumineuse réduit fortement la production de mélatonine chez les merles Turdus merula[73].
La combinaison d'une ambiance bruyante le jour et de la pollution lumineuse affecte fortement le merle urbain qui se met à chanter jusqu'à cinq heures plus tôt que ses homologues vivant en milieu rural[74].
Le Merle noir, ubiquiste et adaptable ne semble néanmoins pas menacé. Du fait de sa vaste aire de répartition (environ dix millions de km²), de son importante population, et de la relative stabilité en termes d'effectifs globaux, il a été classé dans la catégorie LC (préoccupation mineure) par l'UICN[45].
Dans l'ouest de la région paléarctique, les populations semblent plutôt stables ou en accroissement[21], mais il peut aussi y avoir des déclins localisés, en zones rurales notamment, peut être en raison de l'intensification de l'agriculture qui a poussé les agriculteurs à détruire de nombreuses haies, mares, prairies permanentes, prairies humides et des fossés et talus qui fournissaient aux merles gîte et nourriture. Dans le même temps, l'utilisation de pesticides a aussi pu nuire aux merles, directement (écotoxicité) et indirectement (diminution des invertébrés qui sont la ressource alimentaire du merle[56]).
Variétés domestiques
Oiseau peu craintif tout en restant prudent, il s'apprivoise si bien qu'on le voit dans les jardins et les faubourgs faire son nid dans des endroits quotidiennement fréquentés par l'homme. Il a ainsi pu être jadis élevé en cage[75]. Seul un individu des variétés albino ou blanche, issu d'élevage, est considéré comme étant un animal domestique en droit français. Les autres formes de cet oiseau relèvent donc de la législation concernant les animaux sauvages[76].
Symbolique historique
Le merle était considéré par les Grecs anciens comme un animal sacré, mais destructeur. Il était censé mourir s'il mangeait un fruit de grenadier[77].
Contrairement aux autres animaux noirs, le merle n'est généralement pas perçu comme un symbole de malheur[71].
Symbolique nationale et philatélie
Le Merle noir est l'oiseau national de la Suède[78], où la population de merles nicheurs compte entre un et deux millions de couples[21]. Il figure aussi sur les armoiries de la ville allemande de Krukow.
De nombreux pays ont émis des timbres à l'effigie de cet oiseau.
.jpg.webp)
Héraldique
Le merle, présent dans le blason de quelques villes, n'est pas un meuble très fréquent en héraldique.
Par contre, la merlette est très fréquente, mais c'est une figure héraldique étrange, petit oiseau de profil, sans bec ni patte, utilisé le plus souvent en nombre.

 Famille de Cesse
Famille de Cesse
(trois merlettes).
Dans la langue française
- Les bordées de cris gloussants émis par le merle lorsqu'il est inquiet lui ont valu l'appellation « merle moqueur », mais sont aussi à l'origine de l'expression « être un grossier merle », ces cris ressemblant à une bordée de jurons.
- « Siffler comme un merle » signifie siffler bien et gaiement.
- « C’est un fin merle » : c’est un homme fin et rusé.
- « Jaser comme un merle » : parler beaucoup.
- « Vilain merle » : homme très désagréable.
- « Beau merle » : se dit en manière d’interjection ironique, ex : Je vous reconnais là, beau merle.
- « Faute de grives, on mange des merles » : quand on n’a pas ce que l’on souhaitait, il faut savoir se contenter de choses moindres.
- « Si vous faites cela, je vous donnerai le merle blanc », « un merle blanc » : se dit pour défier quelqu’un de faire une chose qu’on regarde comme impossible ; se dit aussi de quelqu’un qui possède des qualités très difficiles à réunir (être un « oiseau rare »).
Musique
Le Merle noir est le nom d'une courte composition musicale d'Olivier Messiaen inspirée par le chant de cet oiseau. Ce chant a aussi inspiré Paul McCartney, qui faisait alors partie des Beatles, une de ses plus belles ballades, Blackbird. On y entend le chant d'un merle au dernier couplet.
« Blackbird singing in the dead of night,
Take these broken wings and learn to fly
All your life,
You were only waiting for this moment to arise[79]. »
ce qui peut se traduire par :
« Merle qui chante au cœur de la nuit
Prends ces ailes brisées et apprend à voler
Toute ta vie
Tu n'attendais que ce moment pour t'élever. »
Une chanson enfantine allemande intitulée Ein Vogel wollte Hochzeit machen (littéralement : Un oiseau voulait se marier) raconte le mariage d'un merle et d'une grive. Personne ne sait qui a écrit les paroles de cette chanson enfantine, ni quand la mélodie en a été composée[80].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Blackbird » (voir la liste des auteurs).
Notes
- Appelé parfois plumage hivernal ou d'éclipse. L'abrasion peut même donner des plumes brunes comme la femelle.
- Appelé aussi cercle orbital, il s'agit d'un anneau de peau nue entourant l'œil. À ne pas confondre avec le cercle oculaire, pourvu de minuscules plumes.
- Le terme GSM était couramment utilisé pour désigner les téléphones mobiles de première génération dont les sonneries étaient composées de quelques notes répétitives.
Références
- (en) Killian Mullarney, Lars Svensson, Dan Zetterstrom et Peter Grant, Birds of Europe, Princeton University Press, , 304–306 p.
- (en) Geoffrey E. Hill, « Plumage coloration is a sexually selected indicator of male quality », Nature, vol. 350, no 6316, , p. 337–339 (ISSN 0028-0836, DOI 10.1038/350337a0)
- R.T. Peterson, G. Mountfort, P.A.D. Hollom, P. Géroudet, Guide des oiseaux de France et d'Europe, douzième édition entièrement revue et augmentée, Delachaux et Niestlé, (ISBN 2-603-00940-0), p. 379-380
- (en) Peter Clement et Ren Hathway, Thrushes, A & C Black, , p. 351
- (en) Clement P., Hathway R., Wilczur J., Thrushes (Helm Identification Guides), Christopher Helm Publishers Ltd., (ISBN 0-7136-3940-7)
- (en) Royal Society for the Protection of Birds : Albinism
- Georges-Louis Leclerc de Buffon, Œuvres complètes de Buffon, compilées par Desmarest A.G. (1826), Verdiere et Ladrange, Paris, Oiseaux Tome IV, p.54
- (en) Hein van Grouw : Not every white bird is an albino: sense and nonsense about colour aberrations in birds
- (en) Grimmett R., Inskipp C., Inskipp T., Pocket Guide to Birds of the Indian Subcontinent, Londres, Christopher Helm Publishers Ltd, , 222–228 p. (ISBN 0-7136-6304-9)
- (en) Fjeldså, J., & N. Krabbe, The Birds of the High Andes., Zoological Museum, University of Copenhagen, Copenhagen, (ISBN 87-88757-16-1, présentation en ligne)
- Éducation à l'environnement : Capturer un ver de terre
- LPO : Mieux connaître le Merle noir
- (en) Snow D., A Study of Blackbirds, Muséum d'histoire naturelle de Londres, (ISBN 0-7136-3940-7)
- « L'animal du mois: le merle noir », sur oncfs.gouv.fr, Office National de la Chasse et de la Faune Sauvage, (consulté le )
- Réjection de graines par des Turdidés Jules Fouarge, Bulletin de l'association Aves, 2013, consulté le 12 avril 2020
- (en) « Territoire et vie sociale du Merle noir », sur site de la Royal Society for the Protection of Birds
- (en) Bright A., Waas J.R., « Effects of bill pigmentation and UV reflectance during territory establishment in blackbirds », Animal Behaviour, vol. 64, no 2, , p. 207–213 (résumé)
- (Oiseaux.net, consulté en 2008)
- (en) I.C. Cuthill et W.A. Macdonald, « Experimental manipulation of the dawn and dusk chorus in the blackbird Turdus merula », Behavioral Ecology and Sociobiology, Springer Berlin / Heidelberg, vol. 26, no 3, , p. 209-216 (résumé)
- Burton R., Bird behaviour, Granada, Londres, Bird behaviour, , 125 p. (ISBN 0-246-12440-7)
- (en) Snow D., Perrins C.M. (eds), The Birds of the Western Palearctic concise edition, vol. 2, Oxford University Press, , 1215–1218 p. (ISBN 0-19-854099-X)
- (en) Streif M., Rasa O., Anne E., « Divorce and its consequences in the Common blackbird Turdus merula. », Ibis, vol. 143, no 4, , p. 554-560 (DOI 10.1111/j.1474-919X.2001.tb04882.x)
- (en) László Zsolt Garamszegia et Anders Pape Møller, « Extrapair paternity and the evolution of bird song », Behavioral Ecology, vol. 15, no 3, , p. 508-519 (résumé)
- (en) Evans G., The Observer's Book of Birds' Eggs, London, Warne, , 78 p. (ISBN 0-7232-0060-2)
- (en) « Turdus merula »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur Natural England
- Garguil P., Goyaud C., Connaître les oiseaux du Sud-Ouest, France, éditions Sud Ouest, (ISBN 978-2-905983-22-0)
- (More info sur Arkive, 2008)
- (en) « Turdus merula [Linnaeus, 1758] », BTOWeb BirdFacts, British Trust for Ornithology
- (en) Magrath R.D., « Nestling weight and juvenile survival in Blackbird. », Journal Animal Ecology, vol. 60, , p. 335-351
- (en) « Nidification du Merle noir », sur site de la RSPB
- (en) « Turdus merula », sur AnAge
- (en) Xin Lu, « Reproductive ecology of blackbirds (Turdus merula maximus) in a high-altitude location, Tibet », Journal für Ornithologie, vol. 146, no 1, , p. 72–78 (résumé)
- Le Robert Paul, Le Grand Robert de la langue française, Dictionnaires Le Robert, (ISBN 2-85036-673-0)
- (la) Varro Marcus Terentius, De lingua latina, livre V, chapitre XI, 45 bc (lire en ligne)
- Belon Pierre, L'histoire de la nature des oiseaux, avec leurs descriptions, et naïfs portraicts retirez du naturel, écrite en sept livres, Paris, Gilles Corrozet, (lire en ligne), p. 320
- (la) Linnaeus Carolus, Fauna Svecica, Lugduni Batavorum, (lire en ligne), p. 70
- (la) Linnaeus Carolus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, Tomus I, Editio decima, reformata.. Holmiae. (Laurentii Salvii)., (lire en ligne), p. 170
- Liste des familles d'oiseaux selon Clements
- (Avibase 2008)
- (en) N.J. Collar, J. del Hoyo (dir.), A. Elliott (dir.) et D.A. Christie (dir.), Indian Blackbird (Turdus simillimus) [« Cuckoo-shrikes to Thrushes »], vol. 10, Barcelone, Lynx Edicions, coll. « Handbook of the Birds of the World », , 646 p. (ISBN 84-87334-72-5)
- (en) Rasmussen P.C., Anderton J.C., Birds of South Asia. The Ripley Guide, Barcelone, Lynx Edicions, (ISBN 84-87334-67-9)
- (en) N.J. =Collar, J. del Hoyo (dir.), A. Elliott (dir.) et D.A. Christie (dir.), Tibetan Blackbird (Turdus maximus) [« Cuckoo-shrikes to Thrushes »], vol. 10, Barcelone, Lynx Edicions, coll. « Handbook of the Birds of the World », , 646 p. (ISBN 84-87334-72-5)
- (Handbook of the Birds of the World, 2005)
- (en) Partecke, J. & E. Gwinner., « Increased sedentariness in European blackbirds following urbanization: a consequence of local adaptation? », Ecology, vol. 88, no 4, , p. 882–90 (résumé)
- BirdLife International 2004, Turdus merula sur le site de l'UICN, 12 April 2008
- McNeil R., Cyr A., « General Notes: European Blackbird (Turdus merula) in Quebec », The Auk, vol. 88, no 4, , p. 919–920 (lire en ligne)
- (en) « The A.O.U. Check-list of North American Birds »
- (en) « Turdus merula »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur Birdlife International,
- (en) « population européenne de Turdus merula »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) [PDF], Birdlife International
- (en) MacKinnon J., Phillipps K., A Field Guide to the Birds of China, Oxford University Press, (ISBN 0-19-854940-7)
- (en) Robson Craig, A Field Guide to the Birds of Thailand, New Holland Press, , 228 p. (ISBN 1-84330-921-1)
- (en) « Espérance de vie du Merle noir », sur garden-birds.co.uk
- Rob Hume, Guilhem Lesaffre et Marc Duquet (trad. de l'anglais), Oiseaux de France et d'Europe, Paris, Larousse, , 448 p. (ISBN 2-03-560311-0)
- (en) « European Longevity Records », sur euring.org, record sur un individu pris vivant en Allemagne
- (en) « Blackbird Action Plan »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur lambeth.gov.uk, Lambeth Council’s Parks and Greenspaces Business Unit
- (en) « Menaces pesant sur l'espèce Turdus merula », sur site de la Royal Society for the Protection of Birds
- (en) Davies N.B., « Cuckoo tricks with eggs and chicks », British Birds, vol. 95, no 3, , p. 101–115
- (en) Hale K., Briskie J.V., « Response of introduced European birds in New Zealand to experimental brood parasitism », Journal of Avian Biology, vol. 38, no 2, , p. 198–204 (DOI 10.1111/j.2007.0908-8857.03734.x)
- Misof K., « Eurasian Blackbirds (Turdus merula) and their gastrointestinal parasites: A role for parasites in life-history decisions ? »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Bonn, , Thèse de doctorat
- Hatchwell B.J., Wood, Anwar M.J.M.; Perrins C.M., « The prevalence and ecology of the haematozoan parasites of European blackbirds, Turdus merula »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), , p. 684–687
- Gregoire Arnaud; Faivre Bruno; Heeb, Philipp; Cezilly, Frank, « A comparison of infestation patterns by Ixodes ticks in urban and rural populations of the Common Blackbird Turdus merula »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) [PDF], the Ibis, , p. 640–645.
- (en) Kipp S., Goedecke A., Dorn W., Wilske B., VolkeFingerle, « Role of birds in Thuringia, Germany, in the natural cycle of Borrelia burgdorferi sensu lato, the Lyme disease spirochaete »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), , p. 125–128
- (en) Humair P.F., Postic D., Wallich R., Gern L., « An avian reservoir (Turdus merula) of the Lyme borreliosis spirochetes »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), , p. 521-538
- Michaël Cœurdassier, Clémentine Fritsch, Bruno Faivre, Nadia Crini, Renaud Scheifler (2012), « Partitioning of Cd and Pb in the blood of European blackbirds (Turdus merula) from a smelter contaminated site and use for biomonitoring »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) ; Chemosphere, Volume 87, Issue 11, June 2012, Pages 1368-1373
- « Des merles noirs terrassés par le virus Usutu », La Nouvelle République du Centre-Ouest (Deux-Sèvres), , p.2
- (en) « Turdus merula », sur site Birds in backyards, Australian Museum
- (en) « Blackbird », Département de l'agriculture de l'Ouest australien,
- Falla R.A., R.B. Sibson, and E.G. Turbott (1979) The new guide to the birds of New Zealand and outlying islands Collins, Auckland (ISBN 0002169282)
- (en) Williams P.A., « The role of blackbirds (Turdus merula) in weed invasion in New Zealand », New Zealand Journal of Ecology, vol. 30, no 2, , p. 285–291
- Roux D., « Relation entre abondance de fruits et de grands turdidés en milieux méditerranéens en automne-hiver. Les cas du Merle noir et de la grive mauvis », Rapport scientifique, ONCFS,
- Cocker M., Mabey R., Birds Britannica, Londres, Chatto & Windus, , 349-353 p. (ISBN 0-7011-6907-9)
- Dominoni DM1, Carmona-Wagner EO, Hofmann M, Kranstauber B & Partecke J. (2014=, Individual-based measurements of light intensity provide new insights into the effects of artificial light at night on daily rhythms of urban-dwelling songbirds ; J Anim Ecol. mai 2014 ;83(3):681-92. doi: 10.1111/1365-2656.12150. Epub 2013-10-30 (résumé)
- . Dominoni DM, Goymann W, Helm B, Partecke (2013), Urban-like night illumination reduces melatonin release in European blackbirds (Turdus merula): implications of city life for biological time-keeping of songbirds ; J. Front Zool. 2013-10-03; 10(1):60. Epub 2013 Oct 3.
- Nordt A & Klenke R (2013), Sleepless in town--drivers of the temporal shift in dawn song in urban European blackbirds ; PLoS One. Aout 2013 7;8(8):e71476. doi: 10.1371/journal.pone.0071476. Print 2013
- Roland Jussiau, Louis Montméas et Jean-Claude Parot, L'élevage en France : 10 000 ans d'histoire, Educagri Editions, , p. 122
- Arrêté du fixant la liste des espèces, races ou variétés d'animaux domestiques
- (en) Cooper J.C., Symbolic and Mythological Animals, Londres, Aquarian Press, , 38 p. (ISBN 1-85538-118-4)
- (en) « Background - Sweden sur Nationmaster »
- « Les paroles de Blackbird des Beatles sur le site Lyricsfreak »
- Paroles en allemand et en français
Voir aussi
Références externes
- (en) Référence Congrès ornithologique international :
- (fr+en) Référence Avibase : Turdus merula (+ répartition)
- (fr) Référence Oiseaux.net : Turdus merula (+ répartition)
- (en) Référence Fauna Europaea : Turdus merula Linnaeus, 1758 (consulté le )
- (en) Référence Animal Diversity Web : Turdus merula
- (en) Référence NCBI : Turdus merula (taxons inclus)
- (en) Référence UICN : espèce Turdus merula (consulté le )
Liens externes
- Galerie de photos Flickr sur le site Avibase
- Galerie de photos sur le site Natureblink
- Vidéo IBC : un mâle de la sous-espèce T. m. mauritanicus capturant trois vers de terre pour nourrir ses petits.
- Vidéo IBC : deux T. m. merula juvéniles impatients se font nourrir par leur père.
- (fr) « Le Merle noir », L'animal du mois, Office national de la chasse et de la faune sauvage.
Bibliographie
- (en) N. J. Collar, J. del Hoyo (dir.), A. Elliott (dir.) et D.A. Christie (dir.), Common Blackbird (Turdus merula) [« Cuckoo-shrikes to Thrushes »], vol. 10, Barcelone, Lynx Edicions, coll. « Handbook of the Birds of the World », , 645 p. (ISBN 84-87334-72-5).
- Paul Isenmann, Le Merle noir, Saint-Yrieix-sur-Charente, Éveil nature, coll. « Approche », , 72 p. (ISBN 978-2-84000-028-0).
- Maxime Metzmacher, Le Merle noir, Sonatura, revue no 11, .