Déclin des populations d'amphibiens
Bien que les scientifiques observent une diminution des populations de plusieurs espèces en Europe depuis les années 1950[2], la prise de conscience du fait que le déclin des populations d'amphibiens puisse entraîner des extinctions massives d'espèces dans le monde entier ne date que des années 1980. En 1993 déjà, plus de 500 espèces de grenouilles et de salamandres présentes sur les cinq continents présentaient un déclin de population[3]. Aujourd’hui, le phénomène de déclin des populations d'amphibiens affecte des milliers d’espèces dans tous les types d’écosystèmes et est ainsi reconnu comme une des menaces les plus sévères, en termes d'espèces disparues ou menacées, à l'encontre de la biodiversité de notre planète[4] - [5].

À l’origine, les rapports sur ce déclin n'étaient pas pris en considération par la totalité de la communauté scientifique. Certains scientifiques avançaient le fait que les populations animales, comme celles des amphibiens, connaissaient des fluctuations naturelles au cours du temps. Aujourd’hui, tous s’accordent à dire que ce phénomène de déclin prend une ampleur alarmante partout dans le monde[6] - [7] - [8] - [9] - [10] - [11], et l’on s’attend à ce qu’il persiste encore longtemps[12].
Ces extinctions et chutes de populations d’amphibiens sont un problème mondial, aux causes diverses et complexes. Parmi elles figurent des facteurs locaux comme la fragmentation et la destruction des habitats naturels, ainsi que l'introduction par l’homme de nouveaux prédateurs dans les écosystèmes en question, la surexploitation des amphibiens (nourriture, médecine…), l’augmentation de la toxicité et de l’acidité des milieux de vie des amphibiens, l’émergence de nouvelles maladies, le changement climatique, l’augmentation des radiations ultraviolettes (conséquence des atteintes portées à la couche d’ozone) et les interactions probables entre ces facteurs.
Devant le nombre croissant d'espèces menacées, une stratégie de conservation s'est mise en place au niveau international afin de combattre les multiples causes du déclin des amphibiens. Les principaux moyens de lutte employés sont la protection des habitats naturels, l'élevage conservatoire, la réintroduction et l'éradication de certaines espèces invasives.
Le fait que la majorité des amphibiens aient un mode de vie à la fois terrestre et aquatique, et que leur peau soit très perméable laisse à penser qu'ils pourraient être plus vulnérables que les autres espèces de vertébrés terrestres[6] - [13] aux toxines présentes dans l’environnement, ainsi qu’aux modifications de température, de précipitations et d'hygrométrie. Les scientifiques commencent donc à considérer la biodiversité amphibienne comme un indicateur précurseur de référence, révélateur de la pollution engendrée par les activités humaines et des effets qu’elle pourrait avoir sur les autres espèces animales.
Contexte du problème
Les amphibiens forment un groupe d’organismes vertébrés regroupant environ 6 000 espèces connues, rassemblant les anoures (grenouille, crapaud, sonneur, rainette…), les urodèles (salamandres et tritons) ainsi que les gymnophiones (apodes ou cécilies). Le groupe des amphibiens existe depuis environ 360 Ma, et il a déjà été décrit, dans la seule période 1970-2000, l’extinction probable d’environ 168 espèces. De plus, au moins 2 469 espèces connues (43 % des amphibiens) présentent un déclin avéré de leurs populations, ce qui indique que le nombre d’espèces menacées d'extinction continue probablement d’augmenter[12].
Une convention internationale de biologistes réunis en 2004 a indiqué que 32 % des espèces d’amphibiens du monde entier étaient en danger d’extinction (ce qui représente 1 856 espèces) et que plus de 120 espèces se seraient déjà éteintes depuis 1980[12].
Les déclins de populations ont été particulièrement intenses dans l’ouest des États-Unis, en Amérique centrale et en Amérique du Sud, ainsi que dans l’est de l’Australie. Ainsi en 2006, 16 des 45 espèces d'amphibiens du Canada (36 %) ont tellement diminué que celles-ci sont maintenant considérées en voie de disparition, menacées ou préoccupantes[14]. Cependant, des cas plus isolés d’extinctions massives d’amphibiens surviennent dans divers endroits du globe. Ainsi, l'UICN estimait en qu'un quart des amphibiens méditerranéens sont menacés d’extinction[15]. Alors que les activités humaines causent à présent des pertes considérables de biodiversité au niveau mondial, il apparaît que leurs conséquences sont nettement plus graves et intenses sur les amphibiens que sur d’autres groupes d’espèces[16].
Étant donné que les amphibiens ont généralement un cycle de vie composé de deux phases, la première aquatique (têtard) et la seconde terrestre (organisme adulte), ils sont naturellement sensibles à des dérèglements environnementaux tant terrestres qu’aquatiques. De plus, ils peuvent être, du fait de leur peau nue très perméable, plus vulnérables aux toxines présentes dans l’environnement que d’autres organismes comme les oiseaux ou les mammifères. De nombreux scientifiques sont d’ailleurs convaincus que le phénomène de déclin des amphibiens annonce la possibilité, dans un futur proche, d'un phénomène beaucoup plus large d’extinction massive de la biodiversité, s’étendant cette fois aux autres groupes d'êtres vivants, animaux et plantes[17] - [18].
Le phénomène de déclin des amphibiens a été pour la première fois largement reconnu fin 1980, lorsqu’une assemblée d’herpétologistes a rapporté avoir repéré une régression globale des populations d’amphibiens[13]. Parmi les espèces les plus touchées se trouvait le crapaud doré (Bufo periglenes) vivant dans la réserve de la forêt de nuage de Monteverde, qui était auparavant classé parmi les espèces communes du site. Le Bufo periglenes faisait à cette époque l’objet de nombreuses investigations scientifiques, jusqu’en 1987, date à laquelle sa population s’est mise à régresser pour finir par disparaître complètement en 1989[19]. D’autres espèces de Monteverde, comme la grenouille Atelopus varius (littéralement en espagnol Rana arlequin, Grenouille arlequin), ont également disparu à cette époque[20]. Ces individus étant localisés à l’intérieur d’une réserve naturelle, leur destruction ne pouvait être liée aux activités humaines de la région. Il fallait en chercher les causes à une échelle plus globale, ce qui a engendré une grande inquiétude chez les scientifiques concernés.
Fluctuations naturelles ou déclin problématique ?
Des années 1950 à la fin des années 1980, certains chercheurs ont remarqué un déclin des populations d’amphibiens. Ce déclin était, selon eux un indice précurseur de la dégradation des milieux naturels. La communauté scientifique s'est montrée sceptique sur ce critère et sur l'importance de ce déclin[7]. En effet, certains zoologistes avançaient que la population de la plupart des organismes, y compris celle des amphibiens, connaissait des variations naturelles. Le manque d’informations sur les fluctuations de populations sur un plus long terme ne permettait pas de déterminer si les observations faites étaient suffisantes pour conclure. Faute de consensus, il convenait donc d'attendre d'avoir les informations suffisantes pour mobiliser les ressources nécessaires à un programme de conservation.
Pour ce faire, on a amélioré les systèmes de surveillance des populations en affectant un nombre croissant d’étudiants aux projets d'observations directes de la mortalité des amphibiens pour déterminer le nombre et les causes des mortalités. Enfin, à la fin des années 1990, la communauté scientifique a reconnu dans son ensemble le déclin[21] des populations d’amphibiens au niveau mondial et la grave menace que cela constitue pour la biodiversité[12].
En effet, les amphibiens jouent un rôle déterminant dans le maintien de l’équilibre des écosystèmes. Ils sont tantôt les proies, tantôt les prédateurs de nombreuses autres espèces. Les œufs et les têtards sont une riche source de nourriture pour les oiseaux et les poissons. À leur tour, les amphibiens consomment d’énormes quantités d’insectes, et quelquefois même des rongeurs. Ils peuvent former une portion importante de la biomasse des vertébrés dans certaines régions, dépassant les biomasses combinées des oiseaux et des mammifères. En dépit de leur taille modeste, les amphibiens jouent un rôle majeur dans les écosystèmes. Lorsqu'une espèce d'amphibien disparaît, cela peut entraîner la disparition en cascade de plusieurs autres espèces, en commençant par les espèces commensales comme la mulette du Necturus (salamander mussel (en)), dont le développement larvaire dépend de la présence de son hôte, le necture tacheté[22].
Causes potentielles du déclin
En se basant sur les recherches de James P. Collins et Andrew T. Storfer, deux ensembles d'hypothèses sur le déclin ont été échafaudés[23].
Le premier inclut les facteurs généraux concernant la crise de la biodiversité planétaire : destruction, modification et fragmentation des habitats naturels, introduction d’espèces invasives et surexploitation des ressources. L’étude de ces menaces permet une meilleure compréhension du déclin des amphibiens, dans ses aspects liés aux mécanismes écologiques globaux. Cependant, le déclin touche aussi des populations d’amphibiens dans des environnements reculés sans perturbations apparentes.
Le second en appelle à des facteurs plus complexes et plus élusifs, et est vraisemblablement constitué par le changement climatique, l’augmentation des radiations UV-B, le rejet de polluants chimiques dans l’environnement, de nouvelles maladies infectieuses émergentes, ainsi que les déformations ou malformations des organismes. Les mécanismes sous-jacents à ces derniers facteurs sont complexes et peuvent s’additionner aux premiers facteurs, ainsi la destruction des habitats et l'introduction d'espèces étrangères introduites exacerbe le phénomène de déclin.
Il n’y a pas une seule cause isolée au déclin des amphibiens. Tous les facteurs susdits menacent ces populations à des degrés plus ou moins élevés. La plupart des causes de ce déclin sont finalement biens comprises et expliquées. Au-delà des amphibiens, d’autres groupes d’organismes souffrent des mêmes perturbations.
Destruction et fragmentation des habitats naturels

La modification ou la destruction des habitats naturels est le facteur qui, à l'échelle planétaire, affecte le plus les populations d’amphibiens. Comme les amphibiens ont généralement besoin d’habitats tant terrestres qu’aquatiques pour survivre, une menace pesant sur un seul des deux habitats peut avoir des conséquences graves sur leurs populations. Les amphibiens sont donc plus vulnérables à la modification des environnements naturels que les organismes ne requérant qu’un seul type d’habitat[24] - [25].
La fragmentation des habitats naturels survient quand les différentes zones propices à la vie des amphibiens sont isolées les unes des autres par des modifications à caractère physique, comme lorsqu’une aire boisée est entourée de toutes parts par des zones de cultures agricoles. Les petites populations qui subsistent dans ces fragments rémanents courent souvent un grand risque d’endogamie, de dérive génétique voire d’extinction dues à de faibles fluctuations de l’environnement.
Dans la plupart des pays européens, la disparition des zones humides porte sur des superficies très importantes. Ainsi en Suisse ces milieux se sont réduits de près de 90 % depuis 150 ans, voire de 100 % dans certains secteurs[26] - [27]. De 1953 à 1959, près de 66 % des habitats de reproduction du triton alpestre, du triton ponctué, du sonneur à ventre jaune, du crapaud commun, de la rainette verte, de la grenouille verte et de la grenouille rousse ont été détruits dans la partie supérieure de la vallée du Rhin par suite de remblayages et de constructions de routes[28].
Depuis les années 1950, beaucoup d'amphibiens de la région méditerranéenne deviennent très rares en raison de la destruction de leurs habitats[29] - [30].
La destruction des zones humides constitue la principale cause de la raréfaction de la grenouille rousse (plus de 99 % d'extinction dans certains secteurs) et du crapaud commun pendant les années 1950 et 1960 en Grande-Bretagne[31].
Certaines espèces ne vivant pas sur leurs lieux spécifiques de reproduction doivent migrer pour atteindre les zones humides. Les individus reproducteurs s'exposent alors, à passer à l'aller et au retour dans des zones où leur sécurité n'est pas assurée. C'est le cas pour les traversées de route. Lorsque les lieux de ponte ne sont plus accessibles, un muret peut parfois suffire pour que la population disparaisse.
Les vocalisations sont essentielles à la reproduction de bon nombre d'amphibien. Une augmentation du bruit de fond occasionné par les activités humaines est peut-être aussi la cause d'une baisse de fertilité qui, à terme, cause un déclin. Une étude en Thaïlande a montré que, soumis aux bruits des activités humaines, les appels des amphibiens diminuaient pour certaines espèces et augmentaient pour d'autres. La relation entre bruit et déclin n'a cependant pas été montrée[32].
Introduction d'espèces allochtones

Les espèces prédatrices et concurrentes étrangères aux écosystèmes affectent la viabilité des amphibiens dans leurs propres habitats naturels. On a détecté un déclin de population chez Rana muscosa, espèce commune des lacs de la Sierra Nevada, aux États-Unis, dû à l'introduction d’espèces de poissons, notamment des truites élevées pour la pêche sportive ou récréative. Un grand nombre de jeunes individus et de têtards sont la proie de ces poissons. Ces poissons causent une interférence dans le cycle trisannuel de métamorphose des têtards et provoquent finalement un sévère déclin de la population et, par ricochet, touchent l'ensemble de l'écosystème[34]. Ce phénomène est loin d'être unique, l'introduction du Lepomis gibbosus en Amérique du Nord a contribué à réduire les populations de Rana aurora et de Pseudacris regilla[35].
L'introduction de Gambusia pour lutter contre les moustiques, de la truite arc-en-ciel et de la truite fario pour la pêche est concomitante avec la baisse importante des effectifs de la Litoria spenceri dans le sud-est australien[36]. Les zones d'introductions correspondant aux zones de baisse ne laissent aucun doute sur le rôle des espèces introduites.
L'introduction du ouaouaron, une grosse grenouille américaine, dans divers endroits du monde comme l'Europe, les Antilles, l'Amérique du Sud, est aussi une menace pour les autres amphibiens[37]. En effet, le ouaouaron consomme directement des spécimens d'autres espèces plus petites que lui et est un concurrent efficace pour les autres.
Exploitation des amphibiens
Les amphibiens sont capturés, déplacés hors de leurs habitats naturels et vendus dans le monde entier comme aliments, comme animaux domestiques, ou pour approvisionner le marché pharmacologique. Pour plusieurs espèces, la récolte est présumée coresponsable de leur déclin[38]. En France, l'importation légale de grenouille l'est essentiellement pour des raisons alimentaires, en comparaison les importations d'anoures vivantes pour l'élevage ou la science sont négligeables. La récolte de certaines espèces comme animaux de compagnie, du fait de leur protection car se raréfiant dans leur milieu naturel, est très souvent illégale et engendre des trafics lucratifs[39].
Les amphibiens sur le marché alimentaire

Les anoures et plus particulièrement leurs cuisses sont consommées par l'Homme, même si les grenouilles comestibles ne représentent pas plus d'une cinquantaine d'espèces. La plupart sont en effet toxiques et certaines ont des propriétés hallucinogènes. Les cuisses de grenouille sont extrêmement populaires en Europe, au Canada et aux États-Unis. En 1990, l’Europe a importé près de 6 000 tonnes de cuisses de grenouilles en provenance d'Asie. Selon leur ministère de l'agriculture, les Français ont consommé 3 500 tonnes de cuisses en 1994 soit 8 000 tonnes ou environ 30 millions de grenouilles dont la majorité provient d'importations. Entre 1981 et 1984, les États-Unis ont importé plus de 3 000 tonnes de grenouille par an soit environ 26 millions de grenouilles[40].
L’Asie est le second marché alimentaire majeur d’amphibiens dans le monde, où l’espèce la plus consommée est Hoplobatrachus rugulosus[40]. En une année, plus de 6 millions de Hoplobatrachus rugulosus ont été exportés depuis la Thaïlande vers Hong Kong. On présume que toutes ces grenouilles sont capturées dans leur milieu naturel. Étant donné le nombre très élevé de grenouilles collectées, cette pratique pourrait en peu de temps mener à la destruction des populations sauvages restantes[41]. Selon les statistiques douanières françaises, sur les 6 400 tonnes de cuisses importées en 2002, 3 300 proviendraient d'espèces sauvages d'Indonésie[38]. Une étude menée entre 2012 et 2013 a montré que les cuisses surgelées disponibles en France dans les supermarchés étiquetées « Rana macrodon » (aujourd'hui appelée Limnonectes macrodon) étaient en réalité mal identifiées dans 99,4 % des cas. 206 échantillons sur 209 testés concernaient Fejervarya cancrivora, un autre était F. moodiei, et seuls deux échantillons concernaient réellement L. macrodon, une espèce possiblement en fort déclin et menacée d'extinction à l'état savage[42].
Une autre espèce surexploitée pour satisfaire le marché alimentaire américain est Rana draytonii, la Grenouille à pattes rouges de Californie, localisée dans l’ouest de la Californie. Bien que ces grenouilles soient actuellement sous protection fédérale, signalées comme espèce menacée, et que leur capture soit désormais interdite, leur population reste en danger du fait d'autres facteurs comme la concurrence d'espèces invasives introduites dans leur environnement naturel[40]. En outre, le braconnage peut perdurer, les grenouilles vivantes ou sauvages valant plus cher que les grenouilles d'élevage[38]. En France en 2005, quatre personnes ont été condamnées à des amendes pour pêche illégale[43]. En 2016, des pêcheurs sont verbalisés pour avoir pêché à la main dans une zone de frayère, des grenouilles rousses en dehors de la période de chasse (entre le 11 juin et le 18 septembre)[44].
Les amphibiens comme nouveaux animaux de compagnie (NAC)


Depuis longtemps, les enfants vont récolter des têtards dans les mares et les étangs avoisinants pour les élever chez eux et observer le processus de métamorphose au cours duquel ils deviennent adultes. Cependant, l'élevage des amphibiens comme NAC s’est popularisé ces dernières années, et il ne s’agit plus désormais des seuls enfants. De nombreux amphibiens sont vendus dans les magasins animaliers ; et certains payent très cher pour des grenouilles aux couleurs vives et brillantes dont bon nombre de spécimen sont prélevés directement dans la nature. En 2007, 16 espèces sont inscrites sur l'annexe I et 90 sur l'annexe II de la CITES[57]. Non inscrite à cette date, la Conraua goliath, la plus grosse grenouille du monde, qui ne se rencontre, à l’état naturel, que dans quelques fleuves isolés au Cameroun et en Guinée équatoriale, en Afrique occidentale, est concernée par la surexploitation[58]. Cependant le principal danger lié à la détention de NAC est la diffusion de maladies aux espèces locales lors de libération d'espèces exotiques.
L'utilisation des amphibiens en médecine et en pharmacologie
Certaines cultures asiatiques accordent aux amphibiens une place importante dans leurs thérapeutiques traditionnelles, certains amphibiens étant considérés avoir des vertus curatives ou aphrodisiaques. Les oviductes disséqués de Rana chensinensis et la peau de certains crapauds[40] sont deux exemples de préparations courantes vendues en herbologie chinoise.
De nombreux crapauds du genre Bufo produisent une toxine appelée bufoténine ayant des propriétés hallucinogènes. Il existe également d’autres toxines, comme la 5-MeO-DMT (5-méthoxy-diméthyltryptamine) produite par le Bufo alvarius (crapaud du désert du Sonora). De nombreux crapauds sont donc collectés dans leur milieu naturel pour en extraire des toxines intéressantes. L’extraction de ces dernières impliquant nécessairement de tuer les crapauds, ces pratiques ont des effets très négatifs sur le maintien des populations naturelles.
Il est difficile de déterminer si, globalement, l’utilisation des amphibiens sur le plan thérapeutique a des effets néfastes sur les populations naturelles.
Pollution chimique
Les agents polluants chimiques, surtout dans les bassins où les têtards se développent, interviennent largement dans l’apparition de malformations (membres supplémentaires, yeux mal formés)[59]. Ces polluants ont des effets variables sur les grenouilles : certains atteignent et altèrent le système nerveux central, alors que d’autres, comme l'atrazine, un herbicide, causent un arrêt du processus de production et de sécrétion des hormones entraînant ainsi la stérilité des adultes. Des études expérimentales ont montré que l’exposition à d'autres herbicides comme le Roundup ou à certains insecticides comme le malathion ou le carbaryl provoque une nette hausse de la mortalité chez les têtards[60]. Des études additionnelles indiquent que les amphibiens se développant en milieu terrestre sont également vulnérables au Roundup et plus particulièrement à l’un de ses composants, le POEA (Polyoxyéthylèneamine) qui est un agent tensioactif[61] - [62] mouillant (favorisant la dispersion des gouttelettes sur les plantes traitées) et non pas un pesticide.
Des années 1950 aux années 1970, les populations d'amphibiens de la région méditerranéenne, déjà très touchées par les destructions d'habitats, peuvent être fortement affectées par l'utilisation excessive d'insecticides. Après l'épandage d'insecticides dans les marais d'Aygade par la municipalité de Hyères, 5 000 rainettes méridionales ont été trouvées mortes le . Cette pulvérisation des localités touristiques françaises de la Côte d'Azur a pratiquement éliminé les populations locales de triton palmé, de triton marbré et de salamandre tachetée.
Dans la plaine hongroise, le crapaud commun est devenu une espèce rare dans les années 1960, ses populations ayant souffert d'un recours croissant aux herbicides[63].
En Angleterre, de 1965 à 1970, les populations de grenouilles se sont réduites dramatiquement dans les comtés d'Essex, du Surrey et du Kent principalement en raison de la pulvérisation au DDT des étangs et fossés[64]. Dans ce pays, le déclin de la grenouille rousse est également attribué à l'utilisation d'un herbicide[65].
Nitrates : Dans les années 1990, des chercheurs réunissent divers indices d'écotoxicité des engrais à base de nitrates sur les larves et adultes d'amphibiens[66]. Certaines espèces comme Rana temporaria ou Bufo bufo sont susceptibles d'y être directement exposées car vivant souvent à proximité de zones cultivées[67]. Cependant, en 1999 une étude confirme que la pollution par les nitrate est finalement déjà très généralisée : 20 % environ des bassins des états et des provinces bordant les Grands Lacs présentaient des teneurs en nitrates supérieures à celles qui peuvent causer des anomalies du développement et d'autres effets sublétaux chez les amphibiens, et 3 % une teneur en nitrates suffisante pour les tuer[14], et de nombreux composés azotés sont diffusés par l'homme dans l'environnement des amphibiens. À la fin des années 1990, on cherche à mieux comprendre leurs effets toxicologiques respectifs, et d'éventuels effets synergiques[68] - [69]. Les concentrations de nitrates requises pour tuer 50 % de têtards de certaines espèces d'amphibiens (études faites en Amérique du Nord) sont de 13 à 40 parties par million (ppm)[70]. De faibles concentrations (de 2 à 5 ppm) ont chez certaines espèces d'amphibiens des effets chroniques : nage réduite, malformations au cours du développement[70].
L'exposition de têtards à des nitrates affectent le développement de ces larves, mais aussi le comportement des futurs adultes[71].
Ils peuvent agir synergiquement avec l'atrazine notamment sur le développement des larves[72] notamment au moment de la métamorphose du têtard aquatique en petit adulte terrestre[73].
Pesticides : Ils s'étendent bien au-delà des zones cultivées, jusqu’à des zones vierges de toute activité humaine, comme on a pu l’observer dans le Parc national de Yosemite en Californie et ailleurs dans de nombreuses analyses de pluies. Outre l'empoisonnement direct par les pesticides (insecticides en particulier, souvent mortellement dangereux pour d'autres animaux à sang froid que les insectes), ces produits chimiques peuvent agir comme perturbateurs endocriniens. Ils imitent les hormones naturelles et peuvent produire de subtils effets sublétaux. Par exemple, certaines substances chimiques imitent l'œstrogène et empêchent les jeunes mâles de se développer normalement[14]. L'atrazine, mise sur le marché en 1958, est connue pour augmenter des maladies d'origines fongiques et virales chez les amphibiens depuis les années 1990. Elle entraîne un effet immunosuppresseur de 20 % sur certaines larves de salamandre lorsqu'elle est combinée à un engrais tel que le nitrate de sodium[74].
Acidification : Les pollutions acides sont nombreuses dans l'environnement et surtout des eaux. Les pluies acides, ou neiges acides dans le nord, ne menacent souvent pas directement les amphibiens qui sont capables de survivre dans des eaux passablement acides (pH 4), mais elles tuent certains insectes qui constituent leurs proies et pourraient favoriser certaines pathologies. De plus elles favorisent la circulation et la bioassimilation de métaux lourds autrement piégés dans le sol ou dans ses complexes argilo-humiques[14].
Ozone troposphérique : Plusieurs études ont montré qu’une exposition à la pollution par l’ozone troposphérique pouvait également être un facteur contribuant au déclin mondial des amphibiens[75].
L'effet de la pollution chimique est probablement souvent synergique, et peut être sous-estimé pour les doses sub-léthales et leurs effets différés : la mort d'adultes peut en effet survenir seulement au cours de la saison de reproduction du fait de la mobilisation de toxiques liposolubles stockés l'été précédent en consommant des aliments contaminés, ou ce sont les qualités physiques des générations suivantes qui peuvent être affectées, à la suite de l'exposition de larves à des perturbateurs endocriniens par exemple.
Parasites et maladies émergents
Beaucoup de pathologies sont reconnues comme facteurs responsables du déclin des populations d’amphibiens ou du moins responsables de morts massives d’individus. Parmi elles, citons la maladie dite « des membres rouges » (traduction littérale de l'anglais : red-leg disease) (provoquée par la bactérie Aeromonas hydrophila)[77], la nécrose hématopoïétique épizootique[78] (groupe des Iridoviridae) provoquée par les Ranavirus ainsi que d'autres maladies mal connues comme la Anuraperkinsus[79] et la chytridiomycose[78] aux États-Unis. On ne sait pas formellement pourquoi ces maladies ont touché si soudainement les populations d’amphibiens, mais on pense qu’elles ont pu être disséminées par l’Homme, notamment en relation avec l'importation de poissons rouges, ou encore qu’elles étaient des maladies animales initialement bénignes et devenues plus virulentes en conjonction avec d’autres facteurs environnementaux. Le déplacement de spécimens d'amphibiens, voire de poissons, même à titre conservatoire devient donc dangereux et des mesures prophylactiques sont prises pour éviter que ces maladies ne se diffusent[80]
- Trématodes
Des parasites appelés trématodes (embranchement des Plathelminthes) interviennent dans le développement d’anomalies chez les Amphibiens, et donc dans leur déclin[81]. Ces Trématodes, du genre Ribeiroia, ont un cycle de vie complexe puisqu’ils affectent successivement trois types d’espèces-hôtes. Les trématodes affectent tout d’abord certaines espèces aquatiques de gastéropodes pulmonés (escargots). Puis, arrivés au stade larvaire, ils se transmettent aux têtards où les métacercaires (larves) enkystées s'insinuent à l’intérieur des bourgeons de membres, ce qui engendre des anomalies post-métamorphiques chez les grenouilles adultes, à savoir l’absence de membres ou au contraire la présence de membres supplémentaires[12]. Ces anomalies affectent gravement la vulnérabilité des amphibiens par rapport à leurs prédateurs, et notamment aux oiseaux des zones humides, derniers hôtes des Trématodes.
- Chytridiomycose

En 1998, les équipes scientifiques ayant mené des recherches sur les causes de la mortalité à grande échelle d’amphibiens en Australie et en Amérique centrale sont arrivées aux mêmes conclusions : une espèce fongique pathogène qui n’avait jamais été décrite auparavant, Batrachochytrium dendrobatidis, était responsable d’infections mortelles[82]. On sait aujourd’hui que la plupart des extinctions des espèces de ces régions sont liées à ce champignon, lequel appartient à une famille de micro-organismes saprophytes connue sous le nom de Chytrides (Chytridiomycota) et qui, en règle générale, n’ont pas de propriétés pathogènes.
Cette maladie engendrée par Batrachochytrium dendrobatidis est appelée chytridiomycose. Les grenouilles infectées présentent des troubles neurologiques[78], des lésions cutanées et une hyperkératose[78], qui provoquent peu à peu l’impossibilité de respirer par la peau[83], et à terme la mort de l’animal. Des études expérimentales ont montré que le temps écoulé entre l’infection et la mort était de une à deux semaines.
Des recherches subséquentes ont montré que le champignon est présent en Australie depuis le milieu des années 1970[84] et en Amérique du Nord depuis 1974 sur Rana pipiens[85]. Il est présent en Espagne depuis la fin des années 1990[85]. Il a également été découvert en Allemagne sur des NAC amphibiens[85]. La première description connue de l’infection chytrique chez les Amphibiens a été faite chez une grenouille africaine, le Dactylère du Cap. Comme ces dernières sont vendues en animaleries et utilisées dans des laboratoires du monde entier, il est possible que le champignon se soit transmis depuis l’Afrique jusqu’aux Amériques et à l’Australie. En Australie, en 2006, il touchait 22 % des espèces[84].
- Bactérie Aeromonas hydrophila
Aeromonas hydrophila est répartie sur l'ensemble des eaux douces ou peu salines de la planète[77]. Les Aeromonas hydrophila sont plus abondantes au cours des saisons chaudes mais capables de se multiplier dès que les températures sont supérieures à 5 °C. Chez les amphibiens ces souches provoquent une flaccidité des muscles, des hémorragies, des ulcérations cutanées et parfois une septicémie foudroyante[77]. Elles ne sont pas seulement pathogènes pour les grenouilles, mais aussi pour les poissons, tortues, mammifères.
Il existe en fait plusieurs dizaines de souches d’Aeromonas hydrophila, dont A. h. subsp. hydrophila et A. h. subsp. ranae sont mortelles pour les amphibiens. Plusieurs études ont montré le potentiel d'effets interactifs ou synergétiques entre les pesticides et l’A.h., sur la réduction des populations[86].
Une des souches a été repérée pour la première fois chez Rana muscosa, dans le Parc national Kings Canyon en Californie. On pense qu’elle est responsable des morts massives de Rana muscosa en 1979[87], de même que de celles du Bufo boreas (Crapaud de l'ouest ou boréal)[88].
- La nécrose hématopoïétique épizootique
La nécrose hématopoïétique épizootique est une infection virale causée par un Iridoviridae[89], un virus à ADN. On pense que certains d'entre eux sont responsables ou coresponsables de taux de mortalité extrêmement élevés et localisés d'amphibiens comme sur une espèce de salamandre en 1995-1996, la plaçant en danger d'extinction[90]. En 1997 et 1998, des virus de cette famille ont provoqué la mort de salamandres tigrées et de Rana sylvatica en Saskatchewan et de salamandres tigrées au Manitoba[90] - [14].
Réchauffement climatique
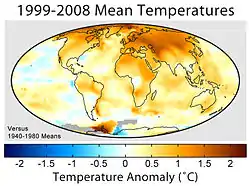
Une grande quantité d’écosystèmes sont détruits à un rythme accru, diminuant la disponibilité d'habitats naturels. Outre le fait que la pollution atmosphérique affecte directement ou indirectement les amphibiens très sensibles aux toxines, elle provoque également un réchauffement de la planète par effet de serre particulièrement nocif. En effet, la perméabilité de leur peau, la dualité aquatique-terrestre de leur cycle de vie biphasique et leurs œufs dépourvus de coquille protectrice les rendent extrêmement vulnérables même aux faibles écarts de température et d’hygrométrie[91].
La compréhension des mécanismes inhérents aux hypothèses de changement climatique présente une complexité majeure. Le changement climatique peut affecter une région directement ou bien engendrer une série d’événements successifs et avoir ainsi un effet indirect sur une région éloignée du foyer des anomalies climatiques[92]. Ainsi les hypothèses de changement climatique sont-elles intrinsèquement complexes car elles peuvent affecter les individus et les populations directement, ou bien indirectement en prenant dans ce cas parfois des années voire des décennies avant de se manifester[93]. Parmi les effets du réchauffement planétaire, nous pouvons citer, par exemple, la croissance ou la reproduction prématurée des individus de certaines espèces d’amphibiens vivant en climats tempérés[94] - [95], qui se retrouvent ainsi confrontés à un environnement hostile (absence de nourriture, ...), caractéristique de saisons plus froides pendant lesquelles ils sont censés hiberner.
Une série d’études menées dans des environnements tropicaux a prouvé l’existence d’une relation de cause à effet entre irrégularités climatiques et déclins populationnels. Au Brésil, on a décrit l’extinction de 5 espèces de crapauds, conséquence d’une série de gelées[96]. On a également détecté, toujours au Brésil, que les déclins des populations d’amphibiens pouvaient être reliés à des hivers plus secs[97]. À Porto Rico, on a également prouvé les connexions existant entre le dramatique déclin de la population d’Eleutherodactylus coqui (en espagnol Coquí) et le nombre croissant de longues périodes de sécheresse[98] (caractérisées par un niveau de précipitations inférieur à 3 mm). De la même manière, on a pu clairement relier l’extinction de l'Incilius periglenes (Sapo de Monteverde, crapaud doré) de Monteverde, et le déclin d’autres espèces d’amphibiens de la région, avec les irrégularités fréquentielles de l’indice d’hygrométrie du brouillard ambiant des forêts tropicales de Monteverde[99].
D’autres études ont montré la réduction, durant les périodes de grande sécheresse, de la profondeur des mares dans lesquelles certaines espèces d’amphibiens déposent leurs œufs. Cette diminution de profondeur d'eau engendre une plus forte exposition des embryons aux rayons UV-B, ce qui augmente la vulnérabilité aux maladies comme celle due au champignon Saprolegnia ferax qui provoque la mort des œufs[100] - [101] - [102]. Leur patrimoine génétique est alors altéré et leur système immunitaire déficient. Dans certaines mares où le niveau de l'eau est trop bas, la mortalité des embryons atteint 100 %. La diminution des réponses immunitaires chez les amphibiens entraîne également une plus grande sensibilité aux attaques de parasites comme le ver nématode Ribeiroia ondatrae, de champignons (dont Batrachochytrium dendrobatadis identifié en 1998 et provoquant de lésions de la peau) ou encore de virus du type Ranavirus[103].
Radiations UV-B
Les niveaux de radiation UV-B dans l’atmosphère ont augmenté de manière significative au cours des dernières décennies. Les chercheurs ont montré que les radiations UV-B peuvent tuer les amphibiens directement, en agissant conjointement avec la pollution, les agents pathogènes et le changement climatique, pour causer chez eux des effets secondaires comme des retardements de croissance ou des dysfonctionnements immunitaires, entraînant leur mort et donc leur déclin.
Il existe trois types de radiations ultraviolettes: les UV-A (de longueur d’onde comprise entre 315 et 400 nm) ; les UV-B (entre 280 et 315 nm) et les UV-C (entre 200 et 280 nm). La majorité des biomolécules n’absorbent pas les radiations de longueurs d’onde équivalentes à celles des UV-A, et une grande partie de la radiation UV-C est absorbée par l’ozone stratosphérique (couche d'ozone). Ne restent que les radiations UV-B, qui, à forte dose, ont des effets particulièrement nocifs sur les organismes vivants.
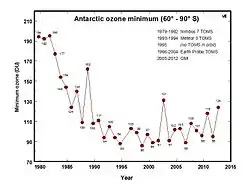
La radiation UV-B, à la suite du réchauffement climatique et de l'amincissement de la couche d’ozone stratosphérique, a augmenté de façon notable. Les amphibiens sont extrêmement vulnérables à la radiation UV-B du fait que leurs œufs sont dépourvus de coquille protectrice et que leur peau, chez les spécimens adultes comme chez les têtards, est fine et délicate. Il est hautement probable que cette augmentation de la radiation UV-B contribue de manière significative au déclin des amphibiens[104].
Des recherches menées sur plus de dix espèces d’amphibiens ont montré qu’une enzyme, la photolyase, était capable de réparer les dommages causés à l’ADN par les radiations UV-B. Des expériences faites en laboratoire sur des œufs de la salamandre Ambystoma gracile ont prouvé leur vulnérabilité aux radiations UV-B[105]. Il est probable que les espèces d’amphibiens disposant d’une importante activité enzymatique (de type photolyase) peuvent réparer les dommages causés à l’ADN par l’exposition aux UV-B de manière plus efficace que d’autres espèces ayant une faible activité enzymatique de ce type[101].
Difformités et malformations
On a noté depuis quelques années une augmentation des observations de difformités ou de malformations dans les populations naturelles d’amphibiens ; ce phénomène a récemment été classé parmi les plus importants problèmes environnementaux[106].
Au cours de l’été 1995, un rapport établi par un professeur d’une école de Le Sueur, Minnesota, à propos des déformations rares chez la grenouille léopard, a mené à l’ouverture d’une enquête par l’Agence de contrôle de la pollution du Minnesota, laquelle a montré que 30 % à 40 % des grenouilles présentes sur le lieu des observations présentaient des malformations. Par la suite, les biologistes ont compris que ces anomalies n’étaient pas circonscrites au Minnesota, et que l’on décrivait ce genre de malformations (grenouilles et tritons avec plus de quatre pattes ou seulement deux) chez des amphibiens du monde entier (près de 80 % dans les secteurs les plus touchés)[107].
Il y a déjà eu de grands débats sur les malformations survenues chez les amphibiens dans leur milieu naturel au cours desquels on s’est rendu compte qu’il était difficile d’en déterminer les causes. Il est relativement aisé de provoquer des malformations sur des embryons élevés en laboratoires, mais celles-ci ne correspondent pas toujours à celles qui sont observées dans la nature[108]. Par ailleurs, on ne sait pas vraiment si le taux de malformations observées chez les amphibiens a réellement augmenté au cours des dernières années, ou si l’augmentation du nombre d’observations est due tout simplement à la plus grande attention portée à ce sujet[109].
Malgré ces incertitudes, les malformations sont vues comme le résultat de causes multiples, qui ne se lient pas toutes aux dommages causés à l’environnement par les activités humaines[110]. L’hypothèse principale impute l’augmentation du nombre de malformations chez les amphibiens à une augmentation des niveaux de radiations ultraviolettes (UV), du taux de pollution chimique et des parasitoses.
Stratégies de conservation
Le Global Amphibian Assessment[111] a créé un plan d’action pour la conservation des amphibiens[112]. Ce plan s’articule autour de quatre objectifs à très court terme : l'amélioration de la compréhension des causes des déclins populationnels et des extinctions ; la diffusion d'informations sur la diversité biologique des Amphibiens et sur les changements qu’elle connaît ; le développement et l'implémentation de programmes de conservation sur le long terme ; l'apport de réponses d’urgence aux crises actuelles.
Voici quelques-uns des moyens pouvant renverser, atténuer ou prévenir le déclin des populations d’amphibiens :
- protection des habitats naturels : La perte et la dégradation des habitats naturels affectent 90 % des espèces d’amphibiens menacées. La majorité d’entre eux ont besoin de mesures de conservation de leur habitat pour s’assurer de pouvoir survivre. Par conséquent, la sauvegarde d’habitats-clés où les amphibiens menacés peuvent vivre et se reproduire en sécurité est la priorité la plus urgente pour la survie de beaucoup d’espèces. Plusieurs types de mesures sont souvent prises comme :

- aménagement de crapauducs, fermeture des routes ou pose de barrière durant les périodes de migration[114] ;
- élevage en captivité : Des programmes d’élevage en captivité de certaines espèces menacées sont mis en place en ce moment dans les parcs zoologiques. Les espèces ainsi élevées pourront être ultérieurement réintroduites dans leur environnement naturel même s'il se pose aujourd’hui un problème important de reproductibilité dans les élevages après plusieurs années sans que l'on comprenne pourquoi[38] ;
- réintroduction : Il existe des programmes de réintroduction d’amphibiens menacés élevés en captivité puis relâchés dans leur milieu naturel dans l’espoir de l’établissement de nouvelles populations. L’objectif des réintroductions est d’assurer le retour dans leur milieu naturel d’espèces d’amphibiens en déclin, par un apport d’individus plus viables et protégés (car élevés en parc zoologique). En effet, la seule diminution des menaces environnementales pesant sur les habitats ne suffit pas toujours à contrebalancer le déclin des populations ;
- opérations de retrait des espèces introduites : Ce type de projet est mis en place dans les endroits où les espèces introduites menacent les espèces endémiques, ce qui permet d’obtenir le maintien et la lente récupération des populations d’amphibiens de la zone ;
- surveillance des populations : Le déclin a été si rapide pour certaines populations, comme la Grenouille léopard dans l'Alberta dont les effectifs ont pratiquement disparu en une année seulement[115], qu'il est vital de pouvoir prendre des mesures immédiates.
L'organisation de la protection
C'est la Global Amphibian Assessment, une organisation issue de l'UICN, qui a essayé de dresser un bilan au début des années 2000, concernant les causes de disparition. Cette volonté a débouché sur une étude[12] qui étudiait trois zones protégées où la disparition « énigmatique » d’espèces a été enregistrée : le parc national de Yosemite, la réserve de Monteverde et le parc national d'Eungella. D'autres ont suivi, offrant des conclusions similaires, un déclin rapide et important.
Le , des scientifiques du monde entier se sont réunis à Atlanta, aux États-Unis, pour donner naissance à un groupe dénommé Amphibian Ark, dans l’optique de sauver plus de 6 000 espèces d’amphibiens de l’extinction possible causée par la chytridiomycose[116]. Cet organisme est un partenariat entre l'Association mondiale des zoos et des aquariums membre de l'UICN et plusieurs sections pour la conservation des espèces de l'UICN dont celle des amphibiens[117]. Le but de l'Ark est d'aider ses partenaires pour une conservation ex-situ et de protéger les sites naturels. Une autre de ses attributions est d'identifier les taxons réellement en danger puisqu'il existe une incertitude de menace sur près de 23 % des espèces[4]. Enfin, l'Ark organise des campagnes de presse à destination des pouvoirs publics et de la population pour faire prendre conscience du danger de l'extinction massive qui pèse sur les amphibiens, comme la campagne Year of the frog qui sera lancée en 2008.
État actuel des populations d'amphibiens
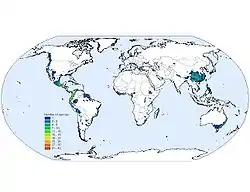
Grâce aux données obtenues par le Global Amphibian Assessment, jusqu’au début de l’année 2006, l'UICN estime[5] que :
- Près d'un tiers (32 %) des espèces d'amphibiens sont en danger d'extinction, ce qui représente 1 896 espèces. En comparaison, 12 % des espèces d'oiseaux et 23 % des espèces de mammifères sont menacées.
- Plus de 165 espèces d'amphibiens seraient déjà éteintes, parmi lesquelles on retrouve :
- 34 espèces d'amphibiens désormais irrémédiablement éteintes,
- 1 espèce éteinte dans son environnement naturel,
- au moins 130 autres espèces dont on a perdu toute trace au cours des dernières années et qui sont maintenant probablement éteintes.
- Au moins 43 % de toutes les espèces d'amphibiens présentent un déclin continuel de leurs populations, ce qui indique que le nombre d'espèces menacées va probablement augmenter dans l'avenir. Par opposition, moins de 1 % des espèces d'amphibiens présentent une augmentation de leurs populations.
- Les pays regroupant le plus d'espèces menacées sont ceux d'Amérique latine, comme la Colombie (209), le Mexique (198) et l'Équateur (163). Cependant, les taux les plus élevés d'espèces menacées sont rencontrés aux Caraïbes, où plus de 80 % des amphibiens présents sont en voie d'extinction en République dominicaine, à Cuba et à la Jamaïque, avec même un pic de 92 % à Haïti.
- Les familles les plus touchées sont le genre Rheobatrachus de la famille des Myobatrachidae (petites grenouilles australiennes), les Leptodactylidae (grenouilles tropicales américaines), les Bufonidae et les Ambystomatidae (salamandres nord-américaines).
- Bien que la destruction des habitats naturels soit clairement la menace la plus importante pour les amphibiens, on a encore récemment détecté l'existence d'une maladie causée par l'exposition aux fumigateurs et affectant sérieusement un nombre croissant d'espèces. Ce qui est peut-être le plus perturbant, c'est le fait que de nombreuses espèces d'amphibiens sont en déclin pour des raisons encore inconnues, ce qui complique les efforts faits pour concevoir et mettre en place des stratégies effectives de conservation.
Annexes
Bibliographie
- (en) Disappearing Jewels : The Status of New World Amphibians, NatureServe, 2004. (ISBN 0-9711053-1-6)[118].
- (en) Amphibian Declines : The Conservation Status of United States Specie, University of California Press, 2005, (ISBN 0520235924).
- (en) Amphibians in Decline : Canadian Studies of a Global Problem, Society for the Study of Amphibians and Reptiles, 1997 (ISBN 0916984400).
- (en) Amphibian Decline : An Integrated Analysis of Multiple Stressor Effects, SETAC Press, 2003, (ISBN 1880611554)
- Séminaire sur les projets de rétablissement d'espèces d'amphibiens et de reptiles (El Hierro, Îles Canaries, Espagne, 11-14 octobre 1993), Édition du Conseil de l'Europe, coll. « Rencontres Environnement n° 19 »,
- T. Langton, J.A. Burton, Amphibiens et reptiles - La sauvegarde des espèces et des habitats par la gestion, Édition du Conseil de l'Europe, coll. « Aménagement et gestion n° 4 »,
- (fr) Jean Rostan, La vie des crapauds. Paris, Stock, 1933, 221 p.
Sources
- (es) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en espagnol intitulé « Declive en las poblaciones de anfibios » (voir la liste des auteurs).
Notes
- (en) Référence UICN : espèce Bufo periglenes
- Honegger R.E. (1978) Amphibiens et Reptiles menacés en Europe. Strasbourg, Conseil de l'Europe, 127 p.
- (en) Vial JL, Saylor L., The Status of Amphibian Populations: a Compilation and Analysis., vol. Work. Doc. No. 1., IUCN/SSC Declining Amphibian Taskforce.,
- (en) « Frightening statistics! », amphibian Ark
- « Déclin critique des amphibiens », UICN,
- (en) Vitt LJ, Caldwell JP, Wilbur HM, Smith DC, « Amphibians as harbingers of decay », BioScience, vol. 40, , p. 418-18
- (en) Martha J. Groom, Gary K. Meffe, and C. Ronald Carroll, Principles of Conservation Biology, Sinauer associate, (réimpr. 2006), 699 p. (présentation en ligne), « Enigmatic declines and disappearances of amphibian populations. »
- (en) Blaustein AR, Wake DB, Sousa WP, « Amphibian declines: judging stability, persistence, and suceptibility of populations to local and global extinctions. », Conserv. Biol., vol. 8, , p. 60-71 (DOI 10.1046/j.1523-1739.1994.08010060.x).
- (en) Corn PS. 1994. What we know and don't know about amphibian declines in the west. Insustainable Ecological Systems: Implementing an Ecological Approach to Land Management, ed. LF DeBano, WW Covington, p. 59-67. Fort Collins, CO:USDA For. Serv. Rocky Mountain For. Range Exp. Station.
- (en) Kuzmin S., « The problem of declining amphibian populations in the Commonwealth of Independent States and adjacent territories. », Alytes, vol. 12, , p. 123-34 (résumé)
- (en) Waldman B, Tocher M. 1998. Behavioral ecology. generic diversity, and declining amphibian populations. In Behavioural Ecology and Conservation Biology, ed. T. Caro, pp. 394-443. Mew York: Oxford Univ. Press.
- (en) Stuart, S.N., J.S. Chanson, N.A. Cox, B.E. Young, A.S.L. Rodrigues, D.L. Fischman, and R.W. Waller, « Status and trends of amphibian declines and extinctions worldwide », Science, vol. 306, no 5702, , p. 1783-1786 (résumé)
- (en) Blaustein, A.R. and D.B. Wake. 1990. Declining amphibian populations: a global phenomenon? Trends in Ecology and Evolution 5:203-204.
- « Points saillants », Environnement Canada
- « Un quart des amphibiens méditerranéens sont menacés d’extinction », UICN,
- (en) Ross A. Alford, Atephen J. Richards, « Global Amphibian Declines: A Problem in applied ecology », Anual Review of Ecology and Systematics, vol. 30, , p. 133-165 (résumé).
- « Vers une période d'extinction massive des espèces ! », sur Actualité et perspective du Sénat,
- « Une extinction massive des espèces est annoncée pour le XXIe siècle », sur Le Monde,
- (en) Crump, M.L., F.R. Hensley, and K.I. Clark., « Apparent decline of the golden toad: Underground or extinct? », Copeia, vol. 1992, no 2, , p. 413-420 (résumé).
- Libération avec AFP, « Le crapaud doré du Costa Rica, première espèce à disparaître à cause du réchauffement climatique », sur liberation.fr, Libération,
- (en) Houlahan, J.E., C.S. Findlay, B.R. Schmidt, A.H. Meyer, and S.L. Kuzmin, « Quantitative evidence for global amphibian population declines », Nature, vol. 404, , p. 752-758 (résumé).
- (fr) « Mulette du Necturus », Pêches et Océans Canada
- (en) Collins, J. P., and A. Storfer, « Global amphibian declines: Sorting the hypotheses », Diversity & Distributions, vol. 9, , p. 89-98 (DOI 10.1046/j.1472-4642.2003.00012.x).
- (en) Green DM. 1997. Perspectives on amphibian population declines: defining the problem and searching for answers. In Amphibians in Decline. Canadian Studies of a Global Problem, ed. DM Green, pp. 291-308. Herpetological Conserv., Vol 1.
- Powerpoint sur la fragmentation et les amphibiens (expérience suisse)
- (de) Kessler E. (1969) Bedrohte Vielfalt. Pro Argovia, Aarau.
- (de) Imboden C.H. (1975) Warum verschwanden unsere Feuchtgebiete was bedrecht sie heute? Schweiz. Naturschutz, 41, 8 : 6-9.
- (de) Heusser H. (1961) Die Bedeutung der äusseren Situation im Verhalten einiger Amphibienarten. Rev. Suisse Zool., 68, 1 :1-39.
- (en) Dorst J., Animaux et végétaux rares de la région méditerranéenne, vol. 5, Meeting, Athènes, UICN, 7th Tech., , p. 3-8
- Petit G. & Knoepffler P.M., Sur la disparition des amphibiens et des reptiles, vol. 5, Meeting, Athènes, UICN, 7th Tech., , p. 50-53
- (en) Prestt I., Cooke A.S. & Corbett K.F., British Amphibians and Reptiles, Londres, , « The Changing Flora and Fauna of Britain », p. 229-254
- (en) Sun, Jennifer W.C., Peter M. Narins, « Anthropogenic sounds differentially affect amphibian call rate », Biological Conservation, vol. 121, , p. 419–427 (lire en ligne)
- (en) Référence UICN : espèce Rana muscosa
- (en) Elizabeth Daerr, « On the Rebound. », National Parks Magazine, , p. 49 (lire en ligne)
- (en) Michael J. ADAMS, « pond permanence and the effects of exotic vertebrates on anurans », Ecological Society of America, vol. 10, no 2, , p. 559–568 (lire en ligne [PDF])
- (en) Gillespie, G. R., « The role of introduced trout in the decline of the spotted tree frog (Litoria Spenceri) in south-eastern Australia », Biological Conservation, vol. 100, no 2, , p. 187-198
- (en) Stephen J. Hecnar, Robert T. M'Closkey, « Changes in the composition of a ranid frog community following bullfrog extinction », American Midland Naturalist, vol. 137, , p. 145-150 (résumé)
- (fr) « La raniculture est-elle une alternative à la récolte ? État actuel en France », INRIA
- « Saisie de plus de 600 Dendrobates (grenouilles venimeuses) cachées dans des rouleaux de films photos », presscenter.org, (lire en ligne [PDF]).
- (en) Jensen, J. B., and C. D. Camp. 2003. Human exploitation of amphibians: direct and indirect impacts. Pages 199-213 in R. D. Semlitsch, editor. Amphibian Conservation. Smithsonian Institution, Washington.
- (en) Wai-Neng Lau, M., G. Ades, N. Goodyer, and F.-s. Zou., « Wildlife Trade in Southern China including Hong Kong and Macao », in The Biodiversity Working Group: China Council for International Cooperation on Environment and Development, Beijing., (résumé)
- Annemarie Ohler, Violaine Nicolas, Which frog's legs do froggies eat? The use of DNA barcoding for identification of deep frozen frog legs (Dicroglossidae, Amphibia) commercialized in France
- « Démantèlement d’un trafic de grenouilles : La plaidoirie courageuse d’un magistrat », sur veganimal.info
- « Le braconnage de grenouilles, ça existe », sur ladepeche.fr,
- (en) Référence UICN : espèce Dendrobates azureus
- (en) Référence UICN : espèce Dendrobates leucomelas
- (fr+en) Référence CITES : espèce Dendrobates azureus Hoogmoed, 1969 (+ répartition) (sur le site de l’UNEP-WCMC)
- (fr+en) Référence CITES : espèce Dendrobates leucomelas Steindachner, 1864 (+ répartition) (sur le site de l’UNEP-WCMC)
- (en) Référence UICN : espèce Dendrobates azureus
- (en) Référence UICN : espèce Dendrobates leucomelas
- (fr+en) Référence CITES : espèce Dendrobates azureus Hoogmoed, 1969 (+ répartition) (sur le site de l’UNEP-WCMC)
- (fr+en) Référence CITES : espèce Dendrobates leucomelas Steindachner, 1864 (+ répartition) (sur le site de l’UNEP-WCMC)
- (en) Référence UICN : espèce Dendrobates azureus
- (en) Référence UICN : espèce Dendrobates leucomelas
- (fr+en) Référence CITES : espèce Dendrobates azureus Hoogmoed, 1969 (+ répartition) (sur le site de l’UNEP-WCMC)
- (fr+en) Référence CITES : espèce Dendrobates leucomelas Steindachner, 1864 (+ répartition) (sur le site de l’UNEP-WCMC)
- (fr) « Les espèces CITES », CITES
- (en) « Bushmen and herpetofauna: notes on amphibians and reptiles traded in bush-meat markets of local people in the niger delta (port harcourt, rivers state, nigeria) », Anthropozoologica, vol. 27, (résumé)
- (en) Blaustein, A. R., J. M. Romansic, J. M. Kiesecker, et A. C. Hatch, « Ultraviolet radiation, toxic chemicals and amphibian population declines », Diversity & Distributions, vol. 9, , p. 123-140 (DOI 10.1046/j.1472-4642.2003.00015.x)
- (en) Relyea, Rick A., « The impact of insecticides and herbicides on the biodiversity and productivity of aquatic communities », Ecological Applications, vol. 15, no 2, , p. 618–627 (lire en ligne [PDF])
- (en) Relyea, Rick A., « The lethal impact of Roundup on aquatic and terrestrial amphibians », Ecological Applications, vol. 15, no 4, , p. 1118–1124 (résumé).
- (en) Mae-Wan-Ho et Joe Cummins, « Glyphosate toxic and Roundup worse. », ISIS Press Release, (résumé)
- (de) Marian M. (1968) Die Amphibien- und Reptilienfauna des Kunfehero (Kunfehersodasee) in Ungarn. Vertebrate Hungarica, 10 : 143-161.
- Cooke A.S. (1973) The effects of DDT, when used as a mosquito larvicide, on tadpoles of the frog, Rana temporaria. Environ. Pollut., 5 : 259-273.
- (en) Hazelwood E. (1970) A frog pond contaminated. Brit. J. Herp., 4 : 177-185.
- SJ Hecnar (1995), Acute and chronic toxicity of ammonium nitrate fertilizer to amphibians from southern Ontario ; - Environmental toxicology and chemistry, Wiley Online Library
- Oldham, R. S., Latham, D. M., Hilton-Brown, D., Towns, M., Cooke, A. S., & Burn, A. (1997). The effect of ammonium nitrate fertiliser on frog (Rana temporaria) survival. Agriculture, ecosystems & environment, 61(1), 69-74.
- Schuytema, G. S., & Nebeker, A. V. (1999). Comparative toxicity of ammonium and nitrate compounds to Pacific treefrog and African clawed frog tadpoles. Environmental Toxicology and Chemistry, 18(10), 2251-2257
- Schuytema, G. S., & Nebeker, A. V. (1999). Effects of ammonium nitrate, sodium nitrate, and urea on red-legged frogs, Pacific treefrogs, and African clawed frogs. Bulletin of environmental contamination and toxicology, 63(3), 357-364.
- « La pollution par les nitrates : une menace invisible qui pèse sur les populations d'amphibiens », sur on.ec.gc.ca, Environnement Canada
- Burgett, A. A., Wright, C. D., Smith, G. R., Fortune, D. T., & Johnson, S. L. (2007),Effets sur la survie des larves, mais aussi sur le comportement des futures adultes ; Impact of ammonium nitrate on wood frog (Rana sylvatica) tadpoles: effects on survivorship and behavior. Herpetological Conservation and Biology, 2(1), 29-34. (résumé)
- Allran, J. W., & Karasov, W. H. (2000). Effects of atrazine and nitrate on northern leopard frog (Rana pipiens) larvae exposed in the laboratory from posthatch through metamorphosis. Environmental Toxicology and Chemistry, 19(11), 2850-2855.
- Sullivan, K. B., & Spence, K. M. (2003). Effects of sublethal concentrations of atrazine and nitrate on metamorphosis of the African clawed frog. Environmental Toxicology and Chemistry, 22(3), 627-635 (résumé)
- (en) Forson D., « Effects of atrazine and iridovirus infection on survival and life-history traits of the long-toed salamander (Ambystoma macrodactylum). », Environ Toxicol Chem., vol. 25, no 1, , p. 168-73 (résumé)
- (en) Dohm, M.R., et al., « Effects of ozone exposure on nonspecific phagocytic capacity of pulmonary macrophages from an amphibian, Bufo marinus », Environmental Toxicology and Chemistry, vol. 24, , p. 205-210 (résumé)
- (en) Référence UICN : espèce Bufo baxteri
- Dictionnaire de Bactériologie Vétérinaire, « Aeromonas hydrophila », sur Dictionnaire de Bactériologie Vétérinaire
- (en) Rick Speare, « summary of formidable infectious diseases of amphibians », The Amphibian Diseases Home Page, de l'Université James-Cook
- (en) « The Potential for Fish Stocking to Spread Disease to Aquatic Amphibians », Florida Integrated Science Center
- « Code sanitaire pour les animaux aquatiques », sur oie.org, organisation mondiale de la santé animale
- (en) Johnson, P.T.J., and J.M. Chase., « Parasites in the food web: linking amphibian malformations and aquatic eutrophication. », Ecology Letters, vol. 7, , p. 521-526 (résumé).
- (en) Joyce E. Longcore, Alan P. Pessier and Donald K. Nichols., « Batrochochytrium dendrobatidis gen. et sp. nov., a chytrid pathogenic to amphibians. », Mycologia, Université du Maine & Smithsonian Institution, vol. 91, , p. 219-227 (résumé)
- (en) Department of the Environment and Heritage, gouvernement australien, « Chytridiomycosis »,
- (en) Speare R, Berger L, « Chytridiomycosis in amphibians in Australia », The Amphibian Diseases Home Page, de l'Université James-Cook,
- (en) Speare R, Berger L, « Global Distribution of Chytridiomycosis in Amphibians », The Amphibian Diseases Home Page, de l'Université James-Cook,
- (en) Talor et al, « Effects of malathion on disease susceptibility in Woodhouse's toads », Journal of Wildlife Diseases, vol. 35, , p. 536-541 (lire en ligne [PDF])
- (en) Bradford, D. F., « Mass mortality and extinction in a high elevation population of Rana muscosa », Journal of Herpetology, vol. 25, no 2, , p. 174-177 (résumé)
- (en) Carey, C., « Hypothesis concerning the causes of the disappearance of boreal toads from the mountains of Colorado. », Conservation Biology, vol. 7, no 2, , p. 355–362 (DOI 10.1046/j.1523-1739.1993.07020355.x).
- « Code sanitaire pour les animaux aquatiques », Organisation Mondiale de la Santé Animale qui touchent les batraciens et les poissons
- Trent Bollinger, « Un besoin pressant d'informations sur les maladies affectant les amphibiens de la faune », Centre Canadien coopératif de la Santé de la Faune, University of Saskatchewan, vol. Bulletin 5 - 5, (lire en ligne)
- (en) Carey, C., and M. A. Alexander., « Climate change and amphibian declines: is there a link? Diversity and Distributions », Wiley-Blackwell, vol. 9, no 2, , p. 111-121 (résumé).
- (en) Stenseth, N.C., Mysterud, A., Otthers, G., Hurrell, J.W., Chan, K.-S. & Lima, M., « Ecological effects of climate fluctuations. », Science, vol. 297, no 5585, , p. 1292-1296 (résumé)
- (en) Whalter, G-R., Post, E., Convey, P., Manzel A., Parmesan, C., Beebee, T., Fromentin, J.-M., Hoegh-Guldberg, O. & Bairlein, F. (2002) Ecological responses to recen climate change. Nature 416, 389-395.
- (en) Beebee, T. J. C. 1995. Amphibian Breeding and Climate. Nature 374:219-220.
- (en) Andrew R. Blaustein, Lisa K. Belden, Deanna H. Olson, David M. Green, Terry L. Root, Joseph M. Kiesecker, « Amphibian Breeding and Climate », Conservation Biology, vol. 15, no 6, , p. 1804-1809 (DOI 10.1046/j.1523-1739.2001.00307.x)
- (en) Heyer, W. R., A. S. Rand, C. A. G. Dacruz, and O. L. Peixoto, « Decimations, Extinctions, and Colonizations of Frog Populations in Southeast Brazil and Their Evolutionary Implications. », Biotropica, vol. 20, no 3, , p. 230-235 (résumé).
- (en) Weygoldt, P. 1989. Changes in the Composition of Mountain Stream Frog Communities in the Atlantic Mountains of Brazil Frogs as Indicators of Environmental Deteriorations. Studies on Neotropical Fauna & Environment 24:249-256.
- (en) Stewart, M. M., « Climate Driven Population Fluctuations in Rain-Forest Frogs. », Journal of Herpetology, vol. 29, no 3, , p. 437-446 (résumé)
- (en) Pounds, J. A., and M. L. Crump., « Amphibian declines and climate disturbance: The case of the golden toad and the harlequin frog. », Conservation Biology, vol. 8, no 1, , p. 72-85 (DOI 10.1046/j.1523-1739.1994.08010072.x).
- (en) Kiesecker, J. M., A. R. Blaustein, and L. K. Belden., « Complex causes of amphibian population declines », Nature, vol. 410, no 6829, , p. 681-684 (résumé).
- (en) Blaustein, A. R., P. D. Hoffman, D. F. Hokit, J. M. Kiesecker, S. C. Walls, and J. B. Hays., « UV repair and resistance to solar UV-B in amphibians eggs: a link to population declines? », Procedings of the National Academy of Sciences (USA), vol. 91, , p. 1791-1795 (résumé)
- (en) J.B. Hays, A.R. Blaustein, J.M. Kiesecker, P.D. Hoffman, I. Pandelova, D. Coyle et T. Richardson, « Developmental responses of amphibians to solar and artificial UVB sources: a comparative study Photochem », Photobiol, no 64, , p. 449-55 (résumé).
- Dubois P.J. (2004) Vers l’Ultime Extinction. Éditions de la Martinière, Paris, 191 p.
- (en) Blaustein, A. R., and D. B. Wake., « The Puzzle of Declining Amphibian Populations », Scientific American, vol. 272, , p. 52-57 (résumé).
- (en) Andrew R. Blaustein, Brian Edmond, Jeseph M. Kiesecker, Joseph J. Beatty, and D. Grant Hokit, « Ambient Ultraviolet Radiation Causes Mortality in Salamander Eggs. », Ecological Applications, vol. 5, no 3, , p. 740-743 (résumé).
- (en) Ouellet, M., J. Bonin, J. Rodrigue, J. L. DesGranges, and S. Lair, « Hindlimb deformities (ectromelia, ectrodactyly) in free-living anurans from agricultural habitats. », Journal of Wildlife Diseases, vol. 33, no 1, , p. 95-104 (résumé)
- (en) Kiesecker, J. M., L. K. Belden, K. Shea and M. J. Rubbo., « Amphibian decline and emerging disease », American Scientist, no 92, , p. 138-147 (lire en ligne)
- (en) Sessions, S. K. 2003. What is causing deformed amphibians? Pages 168-186 in R. D. Semlitsch, editor. Amphibian Conservation. Smithsonian Institution, Washington.
- (en) P. T. J. Johnson, K. B. Lunde, D. A. Zelmer et J. K. Werner, « Limb deformities as an emerging parasitic disease in amphibians : Evidence from museum specimens and resurvey data », Conservation Biology, vol. 17, no 6, , p. 1724-1737 (DOI 10.1111/j.1523-1739.2003.00217.x).
- (en) Blaustein, A. R. and P. T. J. Johnson., « The complexity of deformed amphibians », Frontiers in Ecology and the Environment, vol. 1, no 2, , p. 87-94 (lire en ligne [PDF]).
- (en) « Site web officiel », The Global Amphibian Assessment
- (en)[PDF]Plan d'action pour la conservation des amphibiens [(en) lire en ligne]
- « Le lac des joncs », sur Site officiel de Châtel-St-Denis
- (fr) « Grenouilles et automobilistes », sur Site officiel du Canton de Vaud
- (en) « Seasonnal trend in frog call », Environnement Canada, Tendances saisonnières des coassements
- (en) « page d'accueil », sur amphibianark.org, Amphibian Ark
- (en) « AArk organization », amphibian Ark
- (en)[PDF] natureserve.org
Articles connexes
Liens externes
- En anglais
- Global Amphibian Assessment Informations sur le statut de conservation actuel de 5 918 espèces d'Amphibiens connues.
- AmphibiaWeb Base de données sur les Amphibiens et le phénomène de déclin.
- FrogWeb Informations sur le déclin des Amphibiens et les malformations.
- Conservation International Press Release - Développement par des experts d'un plan d'action global pour sauvegarder les Amphibiens en danger d'extinction.
- Amphibian Ark website Implementing the ex situ component of the Amphibian Conservation Action Plan.
- Partners in Amphibian and Reptile Conservation PARC s'emploie à la conservation des reptiles, des amphibiens et de leurs milieux de vie.
- Frogwatch USA Frog and toad monitoring program for general public.
- FrogWatch USA Amphibian Decline: Changing Climate Equals Decline.
- FrogWatch USA Amphibian Decline: Frogs still in a fix.
- Howstuffworks Are frogs on the brink of extinction?
- En espagnol
- Conservation International Press Release - Anfibios en Dramático Declive.
- eco2site Catastrófico declive de anfibios advierte significativa degradación ambiental.
- Museo de Zoología de la universidad Católica de Ecuador Información sobre Declinación de Anfibios en Ecuador.
- En français
- « Qu'advient-il des populations d'amphibiens et de reptiles? », Environnement Canada
- « Raison d'être des relevés de reptiles et d'amphibiens », sur Parcs Canada