Couleur de l'eau
La couleur de l'eau peut être très variée en milieu naturel, et ces variations sont d'origines multiples. Elle est naturellement bleue de par ses propriétés d'absorption en raison de sa vibration moléculaire.
.jpg.webp)
Alors que des quantités relativement faibles d'eau semblent incolores, l'eau pure présente une légère couleur bleue qui devient plus profonde à mesure que l'épaisseur de l'échantillon observé augmente. Les interactions des rayons lumineux avec les molécules d'eau, ainsi qu'avec la matière présente dans l'eau si elle est colorée et en quantité suffisante, confèrent à la surface une coloration. Cette matière peut être vivante, d'origine rocheuse ou organique.
La somme de toutes les interactions de l'eau avec son environnement explique la différence entre la « couleur apparente » qu'elle a en milieu naturel et la « couleur vraie » dans des conditions de laboratoire. La couleur de l'eau peut être mesurée grâce à l'échelle de couleur platine-cobalt.
Couleur intrinsèque
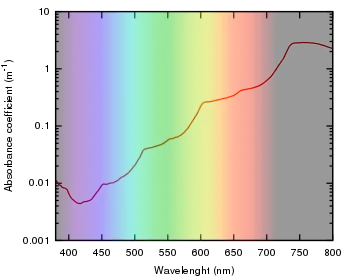
L'eau pure absorbe les rayons lumineux de haute longueur d'onde (rouge, orange, jaune…) et n'absorbe quasiment pas dans le domaine du bleu[1].
Les absorptions dans le spectre visible sont généralement attribuées à des excitations d'états d'énergie électronique dans la matière. L'eau est une simple molécule à trois atomes, H2O, et toutes ses absorptions électroniques se produisent dans la région ultraviolette du spectre électromagnétique et ne sont donc pas responsables de la couleur de l'eau dans la région visible du spectre. L'origine de sa couleur est liée à sa vibration moléculaire.
La molécule d'eau possède trois modes fondamentaux de vibration. Deux vibrations d'étirement des liaisons O-H se produisent à v1 = 3 650 cm−1 et v3 = 3 755 cm−1. L'absorption due à ces vibrations se produit dans la région infrarouge du spectre. La combinaison des modes de vibrations des molécules d'eau forme des harmoniques. L'absorption dans le spectre visible est due principalement à l'harmonique v1 + 3v3 = 14 318 cm−1, ce qui équivaut à une longueur d'onde de 698 nm. Cette longueur d'onde correspond au domaine de la lumière rouge. L'eau absorbe donc par sa vibration les rayons de couleurs rouges. Le domaine du bleu n'est pas absorbé par ce procédé, les longueurs d'onde étant trop faibles, et ainsi les rayons bleus sont diffusés jusqu'à l'organe visuel, ce qui explique sa couleur[2].
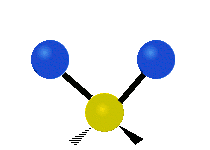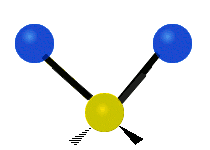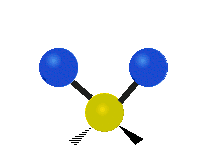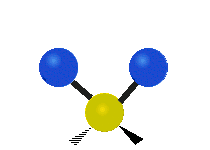
ν1=3657 cm−1 (2.734 μm)
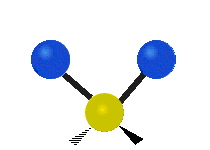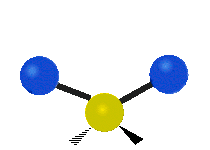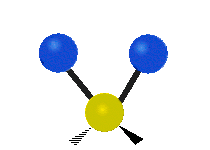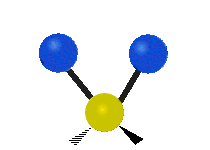
ν2=1595 cm−1 (6.269 μm)
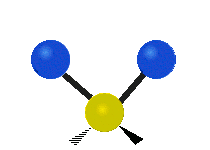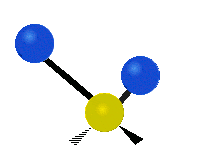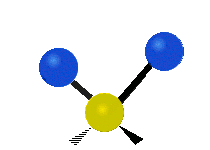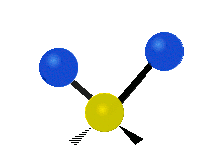
ν3=3756 cm−1 (2.662 μm)

L'eau bleue est le seul exemple connu d'une couleur naturelle causée par des transitions vibratoires[3]. Ceci est dû à la concentration unique en liaisons de l'eau. La plupart des molécules possèdent des énergies vibratoires dont la fréquence est inférieure à celle de l'eau, dans la gamme des vibrations infrarouges ou thermiques sans être dans la gamme de la lumière visible. Les atomes d'hydrogène dans l'eau sont très légers et les liaisons entre l'hydrogène et l'oxygène très fortes, ce qui leur confère des fréquences plus élevées, et permet ainsi l'accès à une vibration dans le spectre du visible.
Dans une eau parfaitement pure, la lumière ne pourra pas être diffusée vers la surface, donnant une couleur apparente noire à tous les plans d'eau. Comme la plupart des lacs et des océans contiennent de la matière vivante et des particules minérales en suspension, la lumière est réfractée sur cette matière et une partie de la lumière bleue est diffusée vers la surface. Dans de l'eau très pure, comme c'est le cas dans certains lacs de montagne, la diffusion des particules est très faible. Dans ce cas, la couleur bleutée, moins intense, est due à la réémission par les molécules d'eau elles-mêmes[4].
Cependant, en raison de sa transparence, l'eau n'absorbe que faiblement les rayons. En effet, l'intensité de l'absorption diminue nettement avec chaque harmonique successif, ce qui entraîne une absorption très faible pour le troisième harmonique. Il faut donc une certaine profondeur avant que le phénomène de coloration ne soit visible. Ainsi, l'eau dans un verre apparaît comme totalement incolore tandis que l'eau d'une piscine apparaît bleue car l'ensemble de la composante rouge du spectre a été absorbé.
Couleur apparente
Réflexion de l'environnement

En dehors des conditions de laboratoire, l'eau évolue dans un milieu coloré par la nature environnante.
Cet environnement se reflète sur la surface de l'eau. Pour une eau suffisamment peu profonde et limpide, la couleur en surface sera proche de celle du sol, les rayons pouvant se refléter sur le fond. Le ciel se reflète aussi sur l'eau, et accentue sa teinte bleue. Bien que la couleur bleue de l'eau s'explique en majorité par son agitation moléculaire, le reflet du ciel en est la cause principale à l'horizon. La contribution relative de la réflexion du ciel et de la lumière rétrodiffusée par les profondeurs dépend fortement de l'angle d'observation[2] - [5].
Lors du crépuscule, le ciel prend une coloration rouge et baisse en luminosité. Or, l'eau absorbe dans le domaine du rouge et est assombrie par la baisse de luminosité. Dans ces conditions, elle apparaît comme noire.
Tous les reliefs proches du plan d'eau peuvent se refléter. Leurs ombres peuvent aussi l'assombrir. Il est très commun pour les cours d'eau en milieu naturel d'avoir une couleur apparente verte en raison de la réflexion de la végétation environnante sur la surface[6].
Enfin, la réflexion n'est pas uniforme à la surface d'une eau en mouvement, créant des bandes de réflexion, et en cas d'écoulement turbulent, les bulles d'air formées renvoient les rayons lumineux blancs, donnant à la surface une couleur blanchâtre.
Sédiments en suspension
Dans la nature, l'eau interagit avec son milieu, en charriant de la matière avec laquelle elle réagit. Une première interaction possible est la mise en suspension de la matière.
Les sédiments en suspension, composés de sable très fin, de limon et d'argile, peuvent être responsables du changement de couleur et de turbidité de l'eau des rivières et des lacs. Ces particules minérales d'origine rocheuse sont issues des processus d'érosion du sol. Le changement de couleur de l'eau dû aux sédiments peut être temporaire, après une crue ou une tempête, ou permanent si la rivière transporte en permanence une quantité élevée de sédiments. La couleur de l'océan qui présente une concentration en matière en suspension (MES) de l'ordre de 10-2 mg par litre est très peu affectée par celle-ci. En revanche, la turbidité joue un rôle majeur dans la couleur d'une eau de rivière, dont la concentration en MES peut être estimée en moyenne à 102 mg par litre[7].

L'influence des MES en eau douce est particulièrement visible dans des zones naturelles ayant subi une forte érosion. Dans certains lacs de montagne, de très petites particules sédimentaires appelées communément « farine de roche », provenant de l'abrasion des glaciers sur la roche, confèrent une couleur aigue-marine à l'eau. Le glacier exerce son effet abrasif sur une petite portion du territoire, et celui-ci est plus élevé en son centre ou la masse est plus grande. Ainsi, les lacs présentent les mêmes sédiments en suspension, essentiellement du quartz ou du feldspath broyés, avec des concentrations différentes, et donc des colorations différentes[8].
Métaux lourds
La présence de certains métaux en solution dans la nature peut influencer la couleur de l'eau. Cette présence est négligeable dans les grands volumes d'eau. Les océans et les grands lacs ne sont donc que peu influencés par ces substances. Néanmoins, leur impact peut être visible dans un petit plan d'eau ou une rivière. Dans ces milieux, le métal le plus commun est le fer, suivi du manganèse, tous deux étant des métaux de transition issus de l'érosion des sols[9].
La forme sous laquelle se trouve le métal détermine la couleur de l'eau, un même métal pouvant fortement colorer l'eau ou n'avoir aucune influence en fonction de son état d'oxydation. Dans les aquifères, où la teneur en oxygène est faible, les formes réduites de fer et de manganèse prédominent sous des formes claires et incolores. Lorsque l'eau des aquifères contenant du fer et du manganèse est exposée à l'air, ces éléments sont oxydés en des formes moins solubles dans l'eau. Dans le cas du fer, il se forme des particules solides blanches, puis jaunes et enfin rouge-brun qui se déposent hors de l'eau[10]. Les particules d'oxyde de fer (la rouille) restent en suspension à cause de trois phénomènes : [1] le brassage de l'eau (causé par son déplacement), [2] la viscosité de l'eau et [3] la densité relative des particules par rapport à l'eau (proche de l'unité), ce qui confère à l'eau une teinte rouge, comme cela peut être visible dans le Río Tinto en Espagne.
Les formes oxydées du manganèse restent généralement dissoutes dans l'eau et sont à l'origine d'une teinte noire de l'eau. Le mélange des métaux peut aussi conférer une coloration unique. Le fer et le manganèse sont souvent présents conjointement dans les cours d'eau, et leur mélange confère à l'eau une couleur qui tend vers le jaune-marron.
Présence d'ions en solution
La présence d'ions dans l'eau peut provoquer la précipitation de minéraux qui colorent la surface.
Des composés à l'origine incolore en solution peuvent devenir des molécules colorées grâce à des réactions chimiques. Les rivières, avec une concentration moyenne en ions de 10 à 102 mg/L, sont surtout composées d'ions calcium (Ca2+), magnésium (Mg2+) et bicarbonate (HCO3−). Le calcium et le bicarbonate réagissent en milieu aquatique pour former du carbonate de calcium (CaCO3), suivant la réaction : Ca2+ + 2 HCO3− CaCO3+ H20 + CO2. Cette molécule se retrouve en grande quantité dans l'eau de certains lacs. En effet, des roches calcaires comme la craie ou la calcite s'érodent et libèrent des particules de carbonate de calcium dans l'eau. Ce composé chimique blanc et très peu soluble dans l'eau, de l'ordre de 15 à 20 mg/L à 25 °C, entre en suspension dans l'eau. Ces particules blanchissent l'eau, ce qui par synthèse additive avec le bleu de l'eau donne une teinte turquoise[11].
Les « événements de blanchissement » se produisent généralement à la fin de l'été, autant dans les eaux douces que salées, et sont causés par des changements de température de l'eau, ce qui permet à de fines particules de carbonate de calcium de se former dans la colonne d'eau. De plus, en milieu acide, le carbonate de calcium se convertit en un composé très soluble et incolore dans l'eau, le bicarbonate de calcium Ca(HCO)32. Le gaz carbonique dissous dans l'eau forme de l'acide carbonique H2CO3 suivant la réaction : CO2+ H2O H2CO3. Cet acide réagit avec le carbonate de calcium :CaCO3+ H2CO3 Ca(HCO3)2. Dans ces conditions, l'eau n'est pas colorée par le bicarbonate de calcium. Néanmoins, l'augmentation de la photosynthèse par le phytoplancton et d'autres espèces marines microscopiques en période chaude peut réduire la quantité de dioxyde de carbone(CO2) dans l'eau. Cela permet la transformation ponctuelle du bicarbonate de calcium en carbonate de calcium (CaCO3). Ces particules de carbonate de calcium provoquent un « blanchiment » de l'eau, c'est-à-dire l'éclaircissement ponctuel du plan d'eau[12].
.jpg.webp)
Présents dans les régions subissant un volcanisme actif, les lacs acides sont souvent très colorés. Cette couleur provient des gaz volcaniques qui se mélangent à l'eau. Les principaux composants des gaz volcaniques autres que la vapeur d'eau (H2O) et le dioxyde de carbone (CO2) sont les dérivés du soufre sous forme de dioxyde de soufre (SO2), de trioxyde de soufre (SO3) (gaz volcaniques de haute température) ou de sulfure d'hydrogène (H2S) (basse température). Un autre composé détecté dans les gaz volcaniques est le chlorure d'hydrogène (HCl). Lorsqu'ils sortent du fond du lac sous haute pression, ces gaz se dissolvent dans l'eau et forment des acides sulfureux, sulfurique et chlorhydrique. Les sulfures colorent l'eau avec une teinte verte vibrante comme dans le Devil's Bath en Nouvelle-Zélande, tandis que le chlorure d'hydrogène confère au lac acide une couleur cyan opaque[13].
Néanmoins, la présence d'ions n'entraîne pas nécessairement la coloration de l'eau. Le composé chimique le plus présent dans l'eau naturelle est le chlorure de sodium (NaCl), avec une concentration massique dans les mers et océans de 30 à 40 g par litre. Pourtant, ce composé dissous dans l'eau n'influence pas sa couleur, une solution saturée en sel ne pouvant pas être distinguée d'une eau pure à l'œil nu.
Matières organiques

Les carbones organiques dissous (COD), issus de la décomposition de la matière vivante, peuvent être présents en grande concentration en eau douce. Ils ne colorent pas toujours l'eau dans laquelle ils sont présents. Le CDOM, acronyme anglais de colored dissolved organic matter, est défini par la matière organique dissoute colorée. L'expression de « substance jaune » est aussi utilisée. En effet, le CDOM absorbe fortement la lumière à courte longueur d'onde allant du cyan au vert, tandis que l'eau pure absorbe la lumière rouge de plus grande longueur d'onde. Ainsi, la seule lumière qui n'a pas été absorbée est celle du milieu du spectre du visible, soit le jaune, ce qui justifie le nom de « substance jaune ». L'eau présentant une grande concentration en CDOM a une teinte qui tend généralement vers le brun. Les tanins sont le type de CDOM le plus abondant trouvé dans les lacs et les ruisseaux. Lessivés des racines des arbres et de la végétation en décomposition dans les eaux de ruissellement, ils confèrent à l'eau sa couleur jaune-brun semblable à celle du thé. Les substances humiques sont des composés organiques issus de l'humus, la couche supérieure du sol entretenue par la décomposition des végétaux. Des formes colloïdales de ces substances humiques se trouvent en abondance dans les cours d'eau, par exemple des forêts et des tourbières. L'acide humique désigne des substances organiques qui coagulent dans l'eau pour former de petites particules. Cet acide est un agent coloré très présent dans l'eau naturelle et responsable de la couleur brun-noir de certains plans d'eau stagnante. Une autre fraction de l'humus présente en solution est l'acide fulvique. Cet acide se trouve en majorité dans les grands cours d'eau en amont, réagissant ensuite pour former de l'acide humique. Présents dans certains fleuves en grande concentration, comme le Rio Negro au Brésil, les acides fulviques leur confèrent une couleur noire caractéristique[14].
La plupart des métaux sont à un certain degré susceptibles de former des complexes avec la matière organique, plus particulièrement avec les matières humiques en suspension dans l'eau. Le fer particulaire, et le manganèse particulaire en moins grande proportion, sont deux métaux qui réagissent avec l'acide humique dans les cours d'eau. La formation de complexes peut accroître énormément la solubilité du métal. Ceci explique la détection dans les eaux très colorées de quantités de fer excédant grandement sa solubilité ionique[10] - [15].
Présence de plancton
Le phytoplancton est un ensemble d'organismes microscopiques qui vit dans les milieux aquatiques. Certains phytoplanctons sont des bactéries, la plupart sont des plantes unicellulaires comme des algues. Parmi les espèces les plus courantes, on trouve les cyanobactéries, un type de bactérie qui tire son énergie de la photosynthèse, et les algues vertes.
Algues
Les algues sont des organismes vivants, généralement présents en milieu aquatique, capables de photosynthèse. Comme les « algues » ne forment pas un groupe naturel descendant d'un ancêtre commun, il est courant d'inclure les cyanobactéries dans ce groupe informel. Ces dernières sont abordées au paragraphe suivant. Le terme d'algae bloom (efflorescence d'algues en français) est employé pour décrire l'extension rapide du phytoplancton. Ces blooms sont naturels, concernent toutes les mers du globe, et peuvent conférer des couleurs multiples à l'eau. En effet, les algues possèdent des pigments, souvent colorés, pour permettre leur survie.

Tous les planctons photosynthétiques ont pour pigment principal la chlorophylle, qui possède une couleur naturellement verte. En concentration suffisante, cette couleur peut être visible à la surface de l'eau, créant des phénomènes de « marées vertes ». Le phytoplancton possède également des pigments secondaires qui lui permettent d'utiliser différentes longueurs d'onde de la lumière solaire pour sa croissance et sa nutrition cellulaire. Ces pigments peuvent avoir différentes couleurs entre le vert, le marron et le rouge. Les « marées rouges » sont causées par des microalgues, les dinophytes, qui possèdent un pigment rougeâtre appelé péridinine. L'espèce Noctiluca scintillans, qui fait partie des plus abondantes sur Terre, est responsable de marées rouges dans les régions côtières tempérées et subtropicales du monde, dans une large gamme de température d'environ 10 à 25 °C. Mais cette espèce, comme de nombreuses autres espèces d'algues, présente différentes formes. Le Noctiluca vert existe à une gamme de température différente du Noctiluca rouge, de 25 °C à 30 °C, et se trouve principalement dans les eaux tropicales d'Asie du Sud-est et de la mer d'Arabie. Il contient plus de chlorophylle qui lui donne une couleur verte. Ainsi, une même espèce peut conférer à l'eau une couleur différente, en fonction des conditions dans lesquelles elle évolue[16].
Le Noctiluca est aussi capable de bioluminescence, phénomène beaucoup plus rare chez les phytoplanctons car connu chez seulement quelques espèces d'algues et de cyanobactéries. Noctiluca scintillans produit des flashes lumineux lors de stress mécaniques, c'est-à-dire lors de l'agitation de l'eau, par exemple par les vagues sur les côtes. Cela a pour effet de faire scintiller l'eau en surface[17].

La présence d'algues explique aussi la corrélation entre des paramètres physico-chimiques et la coloration de l'eau. Par exemple, le sel, comme vu précédemment, est un minéral qui est incolore en solution aqueuse. Pourtant, les lacs salés présentent souvent une forte couleur apparente. Le lac salé Hillier présente une teinte rose vif due aux Dunaliella salina, des algues rouges qui confèrent à l'eau sa teinte[18].
Les phytoplanctons évoluent dans un milieu naturel, dans une eau présentant souvent de nombreux composés en solution. Cette matière peut interagir avec la vie, et les réactions chimiques résultant de ces interactions peuvent conférer à l'eau une nouvelle couleur. Le carbonate de calcium, une fois précipité en calcite responsable des événements de blanchissement précédemment abordés, ne pourrait pas conférer à l'eau une couleur turquoise sans se fixer sur les planctons. C'est après la fixation de ces microparticules que la lumière est diffusée sur les grains de calcite, et confère à l'eau sa couleur[19].
Bactéries, l'exemple du Grand Prismatic Spring
Les bactéries, micro-organismes procaryotes, se retrouvent dans tous les milieux, et peuvent aussi conférer à la surface des couleurs vives et multiples.
.jpg.webp)
La Grand Prismatic Spring (GPS) est une source chaude située au Parc national de Yellowstone aux États-Unis qui illustre ce phénomène. Elle tire son nom du large spectre de couleur à sa surface, ressemblant à celui dispersé par un prisme. L'eau des sources chaudes s'écoule de fissures dans la croûte terrestre, créant un cycle ininterrompu d'eau chaude qui monte, se refroidit et descend. Dans la GPS, ce cycle constant crée des anneaux de températures distinctes autour du centre, qui ont chacun une couleur différente. Les sources principales des couleurs des piscines thermales sont les communautés microbiennes thermophiles qui prospèrent dans ces eaux chaudes. Ces communautés forment souvent des tapis épais de plusieurs millimètres d'épaisseur recouvrant la paroi rocheuse des bassins, composés principalement de cyanobactéries, mais aussi d'autres bactéries et archées. Chaque anneau de température crée un environnement habité par différents types de bactéries, qui peuvent donner à l'eau une couleur apparente différente.
Au centre du bassin où la température est la plus élevée et la vie plus limitée, la couleur bleue profonde intrinsèque à l'eau peut être observée. La couleur vert turquoise est due à une moins grande profondeur et à la réflexion du soleil sur le fond. L'anneau de couleur jaune est dû à la présence d'un type de cyanobactérie nommé Synechococcus qui vit sous des facteurs de stress extrêmes. La température de cette eau est tout juste assez faible pour être habitable par des organismes utilisant la photosynthèse[20].
La plaine autour du GPS est pratiquement dépourvue d'arbres, ou de toute sorte d'ombre. Le Synechococcus ne peut pas échapper aux rayons ultraviolets du soleil et parvient à survivre grâce à un équilibre de pigments photosynthétiques. Ces composés chimiques ne reflètent que certaines longueurs d'onde de la lumière visible, ce qui leur donne différentes couleurs. Le pigment primaire de la photosynthèse est la chlorophylle, de couleur verte. Mais la couleur de la chlorophylle peut parfois être surpassée par d'autres pigments connus sous le nom de caroténoïdes. Les caroténoïdes sont rouges, orange ou jaunes, et protègent les cellules de la bactérie de la lumière du soleil, en capturant les longueurs d'onde dangereuses comme les ultraviolets. De plus, ils transmettent cette énergie captée aux pigments de chlorophylle, qui convertissent alors l'énergie lumineuse en énergie chimique, et les protègent des hautes températures de l'eau. Ainsi, puisque les Synechococcus vivent dans la bande de température élevée, ils produisent une grande quantité de caroténoïdes donnant à la bande sa couleur jaune. Comme la couleur des Synechococcus dépend beaucoup de la lumière du soleil, cela signifie également qu'en hiver, lorsque le soleil est moins fort, les bactéries produisent moins de caroténoïdes et ont donc une couleur moins jaune, qui tend vers le bleu-vert.
En se déplaçant vers l'extérieur de la bande jaune, la température de la source chaude commence à se refroidir et, à mesure que la température se refroidit, un ensemble plus diversifié de vie bactérienne peut s'épanouir. Les Synechococcus vivent toujours dans la bande orange qui avoisine les 60 °C ainsi que d'autres types de bactéries, appelées bactéries Chloroflexus et Chromatiaceae. Celles-ci produisent de l'énergie en utilisant différents types de chlorophylle et de caroténoïdes, qui se manifestent par des couleurs légèrement différentes. Le résultat de cette diversité de couleurs est la couleur orange. L'anneau le plus externe est le plus froid, à environ 55 °C, et celui qui abrite la communauté de bactéries la plus diverse. Comme de nombreux organismes peuvent vivre dans l'anneau extérieur, le mélange de leurs différents caroténoïdes produit des couleurs plus foncées, allant du rouge au brun[21]. Ainsi, la présence de bactéries peut donner à l'eau un large spectre de couleurs en milieu naturel.
Références
- (en) Robin M. Pope et Edward S. Fry, « Absorption spectrum (380–700 nm) of pure water II Integrating cavity measurements », Applied Optics, vol. 36, no 33, , p. 8710 (ISSN 0003-6935 et 1539-4522, DOI 10.1364/AO.36.008710, lire en ligne, consulté le )
- (en) Charles L. Braun et Sergei N. Smirnov, « Why is water blue? », Journal of Chemical Education, vol. 70, no 8, , p. 612 (ISSN 0021-9584 et 1938-1328, DOI 10.1021/ed070p612, lire en ligne, consulté le )
- (en) « Colors from vibrations | Causes of Color », sur www.webexhibits.org (consulté le )
- (en) Anclré Morel et Louis Prieur, « Analysis of variations in ocean color », Limnology and Oceanography, vol. 22, no 4, , p. 709–722 (ISSN 0024-3590, DOI 10.4319/lo.1977.22.4.0709, lire en ligne, consulté le )
- (en) Gilbert N. Plass, Terry J. Humphreys et George W. Kattawar, « Color of the ocean », Applied Optics, vol. 17, no 9, , p. 1432–1446 (ISSN 2155-3165, DOI 10.1364/AO.17.001432, lire en ligne, consulté le )
- (en) Arturo Rankin et Larry Matthies, « Daytime water detection based on color variation », 2010 IEEE/RSJ International Conference on Intelligent Robots and Systems, , p. 215–221 (DOI 10.1109/IROS.2010.5650402, lire en ligne, consulté le )
- (en) Doeke Eisma, « Transport of Suspended Matter », dans Suspended Matter in the Aquatic Environment, Springer Berlin Heidelberg, (ISBN 978-3-642-77724-0, lire en ligne), p. 78–130
- (en) W. D. Keller et A. L. Reesman, « Glacial Milks and Their Laboratory-Simulated Counterparts », Geological Society of America Bulletin, vol. 74, no 1, , p. 61 (ISSN 0016-7606, DOI 10.1130/0016-7606(1963)74[61:gmatlc]2.0.co;2, lire en ligne, consulté le )
- (en) J Nriagu, H Wong et R Coker, « Particulate and dissolved trace metals in Lake Ontario », Water Research, vol. 15, no 1, , p. 91–96 (ISSN 0043-1354, DOI 10.1016/0043-1354(81)90188-3, lire en ligne, consulté le )
- (en) Yi-Hua Xiao, Antti Räike, Helinä Hartikainen et Anssi V. Vähätalo, « Iron as a source of color in river waters », Science of The Total Environment, vol. 536, , p. 914–923 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2015.06.092, lire en ligne, consulté le )
- (en) John W. Morse, Rolf S. Arvidson et Andreas Lüttge, « Calcium Carbonate Formation and Dissolution », Chemical Reviews, vol. 107, no 2, , p. 342–381 (ISSN 0009-2665 et 1520-6890, DOI 10.1021/cr050358j, lire en ligne, consulté le )
- (en) Jacqueline S. Long, Chuanmin Hu, Lisa L. Robbins et Robert H. Byrne, « Optical and biochemical properties of a southwest Florida whiting event », Estuarine, Coastal and Shelf Science, vol. 196, , p. 258–268 (ISSN 0272-7714, DOI 10.1016/j.ecss.2017.07.017, lire en ligne, consulté le )
- (en) Alison M. Childs, Bruce W. Mountain, Ronan O'Toole et Matthew B. Stott, « Relating Microbial Community and Physicochemical Parameters of a Hot Spring: Champagne Pool, Wai-o-tapu, New Zealand », Geomicrobiology Journal, vol. 25, nos 7-8, , p. 441–453 (ISSN 0149-0451 et 1521-0529, DOI 10.1080/01490450802413841, lire en ligne, consulté le )
- (en) R. F. Christman et Masood Ghassemi, « Chemical Nature of Organic Color in Water », Journal - American Water Works Association, vol. 58, no 6, , p. 723–741 (ISSN 0003-150X, DOI 10.1002/j.1551-8833.1966.tb01631.x, lire en ligne, consulté le )
- (en) A. P. Black et Russell F. Christman, « Characteristics of Colored Surface Waters », Journal - American Water Works Association, vol. 55, no 6, , p. 753–770 (ISSN 0003-150X, DOI 10.1002/j.1551-8833.1963.tb01085.x, lire en ligne, consulté le )
- (en) P. J. Harrison, K. Furuya, P. M. Glibert et J. Xu, « Geographical distribution of red and green Noctiluca scintillans », Chinese Journal of Oceanology and Limnology, vol. 29, no 4, , p. 807–831 (ISSN 0254-4059 et 1993-5005, DOI 10.1007/s00343-011-0510-z, lire en ligne, consulté le )
- (en) Edward J. Buskey, « Growth and bioluminescence of Noctiluca scintillans on varying algal diets », Journal of Plankton Research, vol. 17, no 1, , p. 29–40 (ISSN 0142-7873 et 1464-3774, DOI 10.1093/plankt/17.1.29, lire en ligne, consulté le )
- (en) Jessica Delaney, Russell J. Shiel et Andrew W. Storey, « Prioritising wetlands subject to secondary salinisation for ongoing management using aquatic invertebrate assemblages: a case study from the Wheatbelt Region of Western Australia », Wetlands Ecology and Management, vol. 24, no 1, , p. 15–32 (ISSN 0923-4861 et 1572-9834, DOI 10.1007/s11273-015-9447-x, lire en ligne, consulté le )
- (en) Lech Kufel et Katarzyna Rymuza, « Comparing the Effect of Phytoplankton and a Charophyte on Calcite Precipitation in Lake Water: Experimental Approach », Polish Journal of Ecology, vol. 62, no 3, , p. 431–439 (ISSN 1505-2249, DOI 10.3161/104.062.0305, lire en ligne, consulté le )
- (en) Thomas D. Brock, « Stromatolites: Yellowstone Analogues », dans Springer Series in Microbiology, Springer New York, (ISBN 978-1-4612-6286-2, lire en ligne), p. 337–385
- (en) Paul W. Nugent, Joseph A. Shaw et Michael Vollmer, « Colors of thermal pools at Yellowstone National Park », Applied Optics, vol. 54, no 4, , B128 (ISSN 1559-128X et 2155-3165, DOI 10.1364/ao.54.00b128, lire en ligne, consulté le )


