Faune sous-marine de l'atoll de Baa
L'atoll de Baa est un archipel circulaire des Maldives situé dans la division administrative du même nom, et comprenant géographiquement la moitié sud de l'atoll Maalhosmadulu.

L'ensemble mesure environ 38 km sur 46 km, couvrant une superficie de 1 127 km2[1]. Cependant, l'atoll compte seulement 5,5 km2 de terres émergées, constituées d'îlots sableux ne dépassant pas 3,19 m d'altitude, et dont la moitié ne dépassent pas 10 hectares de superficie[1]. La subdivision administrative de Baa compte 11 910 habitants, répartis sur 13 des 75 îles incluses, 8 autres îles étant des îles-hôtels (pour un total de 1 704 lits en 2013, soit 7,2 % de la capacité nationale[2]) ; la capitale en est Eydhafushi.
L'archipel se trouve au cœur de la réserve de biosphère éponyme de l'UNESCO depuis 2011[3]. Les eaux peu profondes et particulièrement riches en corail et en poissons de cet atoll en ont fait un lieu privilégié pour le tourisme balnéaire et subaquatique[3]. L'écosystème y est caractérisé par un très fort taux de couverture corallienne, très diverse et dominée par plusieurs genres de coraux tabulaires, digités ou branchus du genre Acropora. Des études scientifiques suggèrent que les différents atolls des Maldives, même très proches, connaissent d'importantes variations en termes d'assemblages faunistiques, et les données de l'atoll de Baa ne sont donc que partiellement valables pour les autres atolls[4].
Cet article, loin d'être exhaustif, se propose d'illustrer les espèces les plus susceptibles d’être rencontrées dans les récifs de l'atoll pour chacun des principaux groupes d'animaux marins macroscopiques.
Vue générale
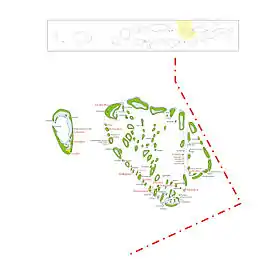 Plan de l'atoll de Baa. Le nord est à droite.
Plan de l'atoll de Baa. Le nord est à droite. Une vue aérienne de l'atoll de Baa.
Une vue aérienne de l'atoll de Baa. Vue de Fonimagoodhoo, avec les installations hôtelières du Reethi Beach Resort.
Vue de Fonimagoodhoo, avec les installations hôtelières du Reethi Beach Resort. L'atoll Maalhosmadulu vu de l'espace : l'atoll de Baa en est la moitié sud.
L'atoll Maalhosmadulu vu de l'espace : l'atoll de Baa en est la moitié sud. Une île déserte typique de l'atoll de Baa, avec son récif au premier plan.
Une île déserte typique de l'atoll de Baa, avec son récif au premier plan.
.JPG.webp) Un paysage sous-marin caractéristique de l'atoll de Baa, à Voavah.
Un paysage sous-marin caractéristique de l'atoll de Baa, à Voavah.
Mammifères marins
Un Mammifère marin est un mammifère vivant en mer ; on en compte environ 120 espèces dans le monde. Il ne s’agit pas d’un ensemble taxinomique bien précis : les baleines et les dauphins sont davantage apparentés aux hippopotames et aux ruminants qu'aux autres mammifères marins, les siréniens aux éléphants, tandis que les morses, phoques, loutres de mer et otaries sont apparentés aux ours. Comme chez les mammifères terrestres, la respiration est aérienne : ils ne peuvent vivre sans venir respirer régulièrement à la surface. De plus, ils ont le sang chaud (homéotherme ou endotherme), portent leurs petits dans leur ventre (vivipare) et pour finir, ils allaitent leurs petits. Les seuls mammifères marins présents aux Maldives sont des cétacés odontocètes (tels que les dauphins), même si des baleines font parfois halte dans la région pendant leurs migrations.
 Un dauphin à long bec (Stenella longirostris)
Un dauphin à long bec (Stenella longirostris) Un couple de grands dauphins (Tursiops truncatus)
Un couple de grands dauphins (Tursiops truncatus)
Reptiles
Les reptiles, au sens courant, regroupent des animaux terrestres à température variable (ectothermes) et au corps souvent allongé et recouvert d'écailles ; les reptiles marins, s'ils adoptent parfois un mode de vie pélagique, sont ainsi contraints de retourner sur la terre ferme pour pondre leurs œufs. Le groupe des reptiles n'est pas considéré comme un taxon valide par les scientifiques à moins d'y inclure également les oiseaux et les mammifères, qui en sont tous deux issus. Les reptiles marins aux Maldives sont principalement représentés par les tortues de mer, même si deux espèces de serpents marins y sont aussi signalées occasionnellement. La rareté des herbiers sous-marins dans l'atoll rend la tortue verte relativement rare : la plupart des tortues rencontrées sont des tortues imbriquées, plus adaptées à cet écosystème. Les tortues olivâtres vivent pour leur part au large, loin des côtes : on ne les y rencontre que pour la reproduction, ou surtout quand un problème de santé les fait s'y échouer, par exemple quand elles se retrouvent prises dans un filet dérivant.
 Une tortue verte (Chelonia mydas)
Une tortue verte (Chelonia mydas) Une tortue imbriquée (Eretmochelys imbricata)
Une tortue imbriquée (Eretmochelys imbricata) Une tortue olivâtre (Lepidochelys olivacea) prise dans un filet dérivant.
Une tortue olivâtre (Lepidochelys olivacea) prise dans un filet dérivant.
Poissons
De très nombreuses espèces de poissons trouvent refuge dans les récifs coralliens, qui leur donnent de multiples abris et une nourriture abondante et diversifiée. Certaines espèces ne s'y trouvent cependant que pendant leur stade juvénile, avant de rejoindre des eaux plus profondes à la maturité. D'un point de vue scientifique, la classe des Pisces (mot latin signifiant « poissons »), fonctionnelle dans la systématique héritée de Carl von Linné, a été abandonnée par les classifications modernes du vivant : cette classe a été divisée en trois classes de vertébrés marins (Agnathes, Chondrichthyens et Ostéichthyens), et il faut noter que pour la classification phylogénétique, le terme de poisson ne peut plus avoir aucun sens[5]. Les populations de poissons ne sont pas également réparties : on estime que 50 % des poissons occupent 17 % des océans[6].
Raies et requins (« chondrichtyens »)
La classe des chondrichthyens (Chondrichthyes) ou poissons cartilagineux regroupe des poissons assez différents morphologiquement les uns des autres, comme les raies et requins, très variés en taille comme le sagre elfe qui mesure 17 cm (adulte) et le requin baleine qui lui atteint 18 m de long. On trouve dans cette classe les différentes espèces de requins, de raies et de chimères.
- Raies
Le terme de raie est un nom vernaculaire ambigu qui correspond en français à de nombreuses espèces de poissons chondrichthyens, regroupées dans plusieurs ordres du super-ordre Euselachii. Les rajiformes sont quelquefois qualifiés de « Raies vraies » ; ce sont des requins au corps aplati. Ces ordres regroupent d'autres types de poissons cartilagineux comme le poisson scie, la torpille, le poisson guitares... Le terme raie dérive du latin raia, terme qui désignait ce type de poisson[7].
Les fonds sableux des Maldives sont particulièrement propices aux raies, et l'atoll de Baa est un point important dans la migration de la raie Manta du nord de l'Océan Indien, où elle vient se nourrir et se faire nettoyer pendant la saison humide. Elles fait l'objet d'un suivi scientifique conséquent, notamment de la part de l'association Manta Trust[8].
 Raie manta (Manta alfredi)
Raie manta (Manta alfredi) Une raie aigle (Aetobatus narinari)
Une raie aigle (Aetobatus narinari)_Baa_Atoll%252C_Maldives_(2018).jpg.webp) Raie chauve-souris (Aetomylaeus vespertilio)
Raie chauve-souris (Aetomylaeus vespertilio) Raie de Jenkins (Himantura jenkinsii)
Raie de Jenkins (Himantura jenkinsii) Une raie pastenague plumetée (Pastinachus sephen)
Une raie pastenague plumetée (Pastinachus sephen) Raie à taches noires (Taeniura meyeni)
Raie à taches noires (Taeniura meyeni) Une raie porc-épic (Urogymnus asperrimus)
Une raie porc-épic (Urogymnus asperrimus)
- Requins
Les requins (ou sélachimorphes) forment un super-ordre de poissons cartilagineux, possédant cinq à sept fentes branchiales sur les côtés de la tête et les nageoires pectorales qui ne sont pas fusionnées à la tête. Ils sont présents dans tous les océans du globe et dans certains grands fleuves. Les requins modernes sont classés au sein du clade Selachimorpha et constituent le groupe-frère des raies.
Les requins sont assez rares sur les côtes maldiviennes, mis à part le requin pointe noire, espèce inoffensive, dont on aperçoit souvent les juvéniles près des plages. Le requin-baleine peut être aperçu plus au large à certaines périodes de l'année, et fait lui aussi l'objet d'un suivi de la part du Manta Trust[9].
 Deux jeunes requins pointe noire (Carcharhinus melanopterus) sur un bord de plage
Deux jeunes requins pointe noire (Carcharhinus melanopterus) sur un bord de plage Un requin pointe noire adulte (Carcharhinus melanopterus), plus en profondeur.
Un requin pointe noire adulte (Carcharhinus melanopterus), plus en profondeur. Un requin-corail (Triaenodon obesus)
Un requin-corail (Triaenodon obesus) Un requin-citron faucille (Negaprion acutidens)
Un requin-citron faucille (Negaprion acutidens) Un requin léopard (Stegostoma fasciatum)
Un requin léopard (Stegostoma fasciatum) Un requin nourrice (Nebrius ferrugineus)
Un requin nourrice (Nebrius ferrugineus) Requin-baleine (Rhincodon typus)
Requin-baleine (Rhincodon typus)
Poissons téléostéens
L’infra-classe des Téléostéens[10] (du grec téléios, achevé, et osteon, os) regroupe les poissons osseux dont le squelette est entièrement ossifié. Ils sont caractérisés notamment par une nageoire caudale qui n’est qu’apparemment symétrique (la colonne vertébrale s’achève dans le lobe supérieur), et par une mâchoire dont l’articulation leur permet de projeter leur bouche vers la proie, créant ainsi un flux aspirant qui la gobe. Les téléostéens regroupent 96 % des espèces de poissons et 47 % des vertébrés actuels[5].
- Poissons serpentiformes (« Elopomorphes »
- anguilles, murènes, congres)
Comme l’indique l’adjectif, les poissons serpentiformes ont l’aspect morphologique et souvent le type de déplacement d’un serpent, mais là s’arrête leur rapport avec les reptiles ophidiens.
 Une murène zébrée (Gymnomuraena zebra)
Une murène zébrée (Gymnomuraena zebra) Murène léopard (Gymnothorax favagineus)
Murène léopard (Gymnothorax favagineus) Murène de Java (Gymnothorax javanicus)
Murène de Java (Gymnothorax javanicus) Une murène à tête jaune (Gymnothorax rueppelliae)
Une murène à tête jaune (Gymnothorax rueppelliae) Une murène à œil blanc (Gymnothorax thyrsoideus)
Une murène à œil blanc (Gymnothorax thyrsoideus) Une murène ondulante (Gymnothorax undulatus)
Une murène ondulante (Gymnothorax undulatus) Un groupe d'anguilles jardinières mouchetées (Heteroconger hassi)
Un groupe d'anguilles jardinières mouchetées (Heteroconger hassi)
- Poissons aulopiformes
Les poissons aulopiformes sont caractérisés par la structure de leurs branchies. Le nom de l’ordre est formé par le mot grec « aulos », qui signifie tuyau, flûte, et le mot latin « forma », forme, en référence à la forme allongée de certains d’entre eux. Ce sont tous des prédateurs.
 Un poisson-lézard à ligne bleue (Synodus dermatogenys)
Un poisson-lézard à ligne bleue (Synodus dermatogenys) Un poisson-lézard bigarré (Synodus variegatus)
Un poisson-lézard bigarré (Synodus variegatus)
- Poissons lophiiformes
Les poissons lophiiformes (du grec « lophos », crête) sont caractérisés par des morphologies plus ou moins difformes, par une ouverture branchiale de petite taille en forme de tube, et par la première vertèbre soudée au crâne[11]. Tous sont marins. De nombreux genres sont caractérisés par la modification de la première épine dorsale (l’illicium), libre et modifiée en un leurre (esca)[11] qui attire les proies vers la bouche. L'ordre comporte notamment les antennaires (poissons-crapauds, poissons-grenouilles, poissons-pêcheurs).
 Un antennaire géant (Antennarius commerson)
Un antennaire géant (Antennarius commerson)
- Poissons mugiliformes
Le radical du nom de l’ordre des mugiliformes est dérivé du mot latin « mugil », qui désigne un mulet. Il ne comprend qu’une famille, les Mugilidae. Certaines classifications récentes (comme celle suivie par FishBase) placent ces poissons parmi les Perciformes[12].
 Un groupe de mulets à queue bleue (Crenimugil crenilabis)
Un groupe de mulets à queue bleue (Crenimugil crenilabis)
- Poissons atheriniformes
Les atheriniformes sont des poissons au corps généralement fin et long et aux flancs argentés.
 Un banc d'athérines Atherinomorus lacunosus juvéniles.
Un banc d'athérines Atherinomorus lacunosus juvéniles.
- Poissons beloniformes
Beloniforme vient du mot grec « belone », qui signifie aiguille[13]. La plupart des familles de cet ordre ont un corps fuselé et argenté. Certaines vivent en eaux douces ou saumâtres. L’ordre des béloniformes contient les poissons-volants, abondants aux Maldives.
 Un banc de Platybelone argalus
Un banc de Platybelone argalus Une aiguille crocodile (Tylosurus crocodilus)
Une aiguille crocodile (Tylosurus crocodilus) Demi-becs Hyporhamphus dussumieri
Demi-becs Hyporhamphus dussumieri
- Poissons beryciformes
Le nom de cet ordre vient du grec « beryx », ou « berys »[14], qui désignait dans la Grèce antique un poisson dont l’identification précise n’a pas pu être faite[15]. Ces poissons sont caractérisés par leur morphologie crânienne et par la présence de canaux à mucus sous la peau de la tête, ainsi que par le nombre de rayons de la nageoire caudale[16]. Beaucoup de béryciformes sont nocturnes, et passent la journée dissimulés sous les plaques de corail.
 Un poisson-soldat pourpre (Myripristis adusta)
Un poisson-soldat pourpre (Myripristis adusta) Un poisson-soldat de Berndt (Myripristis berndti)
Un poisson-soldat de Berndt (Myripristis berndti) Un groupe de poissons-soldats à œillères (Myripristis murdjan)
Un groupe de poissons-soldats à œillères (Myripristis murdjan) Un poisson-soldat violacé (Myripristis violacea)
Un poisson-soldat violacé (Myripristis violacea) Un groupe de poissons-soldats bordés de blanc (Myripristis vittata)
Un groupe de poissons-soldats bordés de blanc (Myripristis vittata) Un poisson-écureuil argenté à bandes (Neoniphon opercularis)
Un poisson-écureuil argenté à bandes (Neoniphon opercularis) Un poisson-écureuil tacheté (Neoniphon sammara)
Un poisson-écureuil tacheté (Neoniphon sammara) Un poisson-écureuil diadème (Sargocentron diadema)
Un poisson-écureuil diadème (Sargocentron diadema) Un poisson-écureuil géant (Sargocentron spiniferum)
Un poisson-écureuil géant (Sargocentron spiniferum)
- Poissons syngnathiformes
Le radical du nom de l’ordre est formé à partir des mots grecs « sun », ensemble, et « gnathos », mâchoire[17], pour désigner des familles de poissons aux mâchoires soudées formant un museau tubulaire au bout duquel se situe une petite bouche. Parmi les familles représentées dans l'ordre des syngnathiformes, les Syngnathidae (syngnathes et hippocampes) sont couverts de plaques osseuses, et sont notamment caractérisés par le fait que ce sont les mâles qui incubent dans une poche ventrale les œufs pondus par les femelles.
 Un poisson-trompette de l'indo-pacifique (Aulostomus chinensis)
Un poisson-trompette de l'indo-pacifique (Aulostomus chinensis) Un syngnathe (Corythoichthys haematopterus )
Un syngnathe (Corythoichthys haematopterus ) Un poisson-flûte (Fistularia commersonii)
Un poisson-flûte (Fistularia commersonii)
- Poissons scorpaeniformes
Les scorpaeniformes sont des poissons à rayons épineux souvent pourvus d'un venin puissant : grondins, rascasses, poissons-scorpions, poissons-pierres. Le mot vient du grec « scorpios », qui signifie scorpion[18], probablement du fait que de nombreuses espèces groupées dans cet ordre possèdent des glandes à venin reliées aux rayons de certaines de leurs nageoires. Ils sont caractérisés par une cuirasse osseuse recouvrant la tête[19]. Aucun de ces poissons n’est agressif, mais les poissons scorpions et pierres se confondent souvent parfaitement avec leur environnement, et les rascasses sont presque toujours situées sous la partie haute d’une anfractuosité ou d’un massif de corail tabulaire : il est donc difficile de les voir et il vaut mieux faire attention à l’endroit où l’on pose ses mains ou ses pieds. ces poissons sont cependant relativement rares aux Maldives comparé à d'autres régions de l'océan Indien.
_Maldives.JPG.webp) Un poisson-scorpion à antennes (Pterois antennata)
Un poisson-scorpion à antennes (Pterois antennata) Un poisson-scorpion rayonné (Pterois radiata)
Un poisson-scorpion rayonné (Pterois radiata) Une rascasse volante (Pterois miles)
Une rascasse volante (Pterois miles) Un poisson-scorpion à houppe (Scorpaenopsis oxycephala)
Un poisson-scorpion à houppe (Scorpaenopsis oxycephala) Un poisson scorpion (Scorpaenopsis sp.)
Un poisson scorpion (Scorpaenopsis sp.).jpg.webp) Un poisson-feuille (Taenianotus triacanthus)
Un poisson-feuille (Taenianotus triacanthus) Un dangereux poisson-pierre (Synanceia verrucosa)
Un dangereux poisson-pierre (Synanceia verrucosa)
- Poissons perciformes
Le nom de cet ordre vient du mot grec « perke »[20], donnant le latin « perca », qui signifie perche. L'ordre des perciformes, qui regroupe presque un tiers des poissons marins, doit être compris comme provisoire en attendant que les relations de parenté entre les espèces qu’il inclut soient mieux comprises[21].
 Un barbier rouge (Pseudanthias squamipinnis)
Un barbier rouge (Pseudanthias squamipinnis) Un groupe de gros-yeux communs (Priacanthus hamrur)
Un groupe de gros-yeux communs (Priacanthus hamrur) Poissons-cardinaux Ostorhinchus cyanosoma
Poissons-cardinaux Ostorhinchus cyanosoma
 Un malacanthe bleu (Malacanthus latovittatus)
Un malacanthe bleu (Malacanthus latovittatus) Un groupe de fusiliers à bandes variées (Caesio varilineata)
Un groupe de fusiliers à bandes variées (Caesio varilineata) Un groupe mixte de fusilliers (Caesio varilineata et Pterocaesio tile)
Un groupe mixte de fusilliers (Caesio varilineata et Pterocaesio tile) Un banc de fusilliers à dos jaune (Caesio xanthonota)
Un banc de fusilliers à dos jaune (Caesio xanthonota) Une gerre (Gerres longirostris)
Une gerre (Gerres longirostris) Deux Kyphosus bigibbus
Deux Kyphosus bigibbus Un groupe de caligères bleus (Kyphosus cinerascens)
Un groupe de caligères bleus (Kyphosus cinerascens) Un groupe de rémoras (Echeneis naucrates)
Un groupe de rémoras (Echeneis naucrates) Un banc de maquereaux comète (Decapterus macarellus)
Un banc de maquereaux comète (Decapterus macarellus) Un banc de maquereaux indiens (Rastrelliger kanagurta)
Un banc de maquereaux indiens (Rastrelliger kanagurta) Une tonine orientale (Euthynnus affinis)
Une tonine orientale (Euthynnus affinis) Thon à dents de chien (Gymnosarda unicolor)
Thon à dents de chien (Gymnosarda unicolor) Une carangue à grosse tête (Caranx ignobilis)
Une carangue à grosse tête (Caranx ignobilis) Un couple de carangues noires (Caranx lugubris)
Un couple de carangues noires (Caranx lugubris) Une carangue bleue (Caranx melampygus)
Une carangue bleue (Caranx melampygus) Une carangue à gros yeux (Caranx sexfasciatus)
Une carangue à gros yeux (Caranx sexfasciatus) Un coureur arc-en-ciel (Elagatis bipinnulata)
Un coureur arc-en-ciel (Elagatis bipinnulata) Une sériole limon (Seriola rivoliana)
Une sériole limon (Seriola rivoliana) Un groupe de pompaneaux muscadins (Trachinotus baillonii)
Un groupe de pompaneaux muscadins (Trachinotus baillonii) Un pompaneau lune (Trachinotus blochii)
Un pompaneau lune (Trachinotus blochii) Barbet rayé (Upeneus taeniopterus)
Barbet rayé (Upeneus taeniopterus) Un rouget à ligne jaune (Mulloidichthys flavolineatus)
Un rouget à ligne jaune (Mulloidichthys flavolineatus) Un couple de rougets à nageoires jaunes (Mulloidichthys vanicolensis)
Un couple de rougets à nageoires jaunes (Mulloidichthys vanicolensis) Un rouget barbet rayé (Parupeneus barberinus)
Un rouget barbet rayé (Parupeneus barberinus) Un groupe de rougets-barbets dorés (Parupeneus cyclostomus)
Un groupe de rougets-barbets dorés (Parupeneus cyclostomus) Un rouget à longue barbe (Parupeneus macronemus) de nuit
Un rouget à longue barbe (Parupeneus macronemus) de nuit Un rouget-barbet à deux taches (Parupeneus trifasciatus)
Un rouget-barbet à deux taches (Parupeneus trifasciatus) Un Scolopsis aurata
Un Scolopsis aurata Un jeune happeur à deux lignes (Scolopsis bilineata)
Un jeune happeur à deux lignes (Scolopsis bilineata) Un gaterin arlequin ou diagramme à pois (Plectorhinchus chaetodonoides)
Un gaterin arlequin ou diagramme à pois (Plectorhinchus chaetodonoides) Un diagramme noir (Plectorhinchus gibbosus)
Un diagramme noir (Plectorhinchus gibbosus) Un gaterin géant (Plectorhinchus obscurus)
Un gaterin géant (Plectorhinchus obscurus) Un groupe de diagrammes orientaux (Plectorhinchus vittatus)
Un groupe de diagrammes orientaux (Plectorhinchus vittatus) Un groupe de jeunes platax orbiculaires (Platax orbicularis)
Un groupe de jeunes platax orbiculaires (Platax orbicularis) Platax à longues nageoires (Platax teira)
Platax à longues nageoires (Platax teira) Un couple de poissons-lapins tachetés (Siganus corallinus)
Un couple de poissons-lapins tachetés (Siganus corallinus) Un couple de poissons-lapins étoilés (Siganus stellatus)
Un couple de poissons-lapins étoilés (Siganus stellatus) Une perche de sable à tache noire (Parapercis millepunctata)
Une perche de sable à tache noire (Parapercis millepunctata) Idoles des Maures (Zanclus cornutus)
Idoles des Maures (Zanclus cornutus) Un barracuda (Sphyraena barracuda)
Un barracuda (Sphyraena barracuda) Un couple de poissons-lune argentés (Monodactylus argenteus)
Un couple de poissons-lune argentés (Monodactylus argenteus) Un poisson-comète à longues nageoires (Calloplesiops altivelis)
Un poisson-comète à longues nageoires (Calloplesiops altivelis)
- Mérous
Le nom vernaculaire « mérou » couvre une partie de l’importante famille des Serranidae. Cette famille, très diversifiée, contient des poissons d’aspect assez différent, comme les anthias, les loches ou les barbiers. Le principal groupe de mérous se trouve dans la sous-famille des Epinephelinae, qui regroupe 22 genres et 87 espèces[22]. On les rencontre dans les eaux tropicales et tempérées, de 1 à 300 mètres de profondeur. Ils sont tous carnivores : ils se nourrissent de poissons, de crustacés et de mollusques. La plupart des espèces sont hermaphrodites protogynes (ce qui signifie que tous les individus naissent femelles et que certains deviendront mâles quand la situation l’exigera).
 Un mérou à bouche rouge (Aethaloperca rogaa)
Un mérou à bouche rouge (Aethaloperca rogaa) Un mérou céleste (Cephalopholis argus)
Un mérou céleste (Cephalopholis argus) Un mérou fauve (Cephalopholis leopardus)
Un mérou fauve (Cephalopholis leopardus) Un mérou minium (Cephalopholis miniata)
Un mérou minium (Cephalopholis miniata) Un mérou à nageoires sombres (Cephalopholis nigripinnis)
Un mérou à nageoires sombres (Cephalopholis nigripinnis) Un mérou sanguin (Cephalopholis sexmaculata)
Un mérou sanguin (Cephalopholis sexmaculata) Un mérou à points blancs (Epinephelus coeruleopunctatus)
Un mérou à points blancs (Epinephelus coeruleopunctatus) Un mérou oriflamme (Epinephelus fasciatus)
Un mérou oriflamme (Epinephelus fasciatus) Un mérou marbré (Epinephelus fuscoguttatus)
Un mérou marbré (Epinephelus fuscoguttatus) Un mérou Risdael (Epinephelus macrospilos)
Un mérou Risdael (Epinephelus macrospilos) Un mérou gâteau de cire (Epinephelus merra)
Un mérou gâteau de cire (Epinephelus merra) Un mérou camouflage (Epinephelus polyphekadion)
Un mérou camouflage (Epinephelus polyphekadion) Un mérou à quatre selles (Epinephelus spilotoceps)
Un mérou à quatre selles (Epinephelus spilotoceps) Un mérou à queue carrée (Plectropomus areolatus)
Un mérou à queue carrée (Plectropomus areolatus) Un mérou sellé (Plectropomus laevis) juvénile
Un mérou sellé (Plectropomus laevis) juvénile Un mérou sellé (Plectropomus laevis)
Un mérou sellé (Plectropomus laevis) Un mérou croissant jaune (Variola louti)
Un mérou croissant jaune (Variola louti)
- Empereurs
 Un banc d'empereurs striés (Gnathodentex aureolineatus)
Un banc d'empereurs striés (Gnathodentex aureolineatus) Un bec de cane à nageoires orange (Lethrinus erythracanthus)
Un bec de cane à nageoires orange (Lethrinus erythracanthus) Un capitaine saint-Pierre ou empereur taché (Lethrinus Harak)
Un capitaine saint-Pierre ou empereur taché (Lethrinus Harak) Un empereur à raie orange (Lethrinus obsoletus)
Un empereur à raie orange (Lethrinus obsoletus) Un empereur à petites dents (Lethrinus microdon)
Un empereur à petites dents (Lethrinus microdon) Un empereur orné (Lethrinus ornatus)
Un empereur orné (Lethrinus ornatus) Un empereur à nageoires rouges (Monotaxis heterodon)
Un empereur à nageoires rouges (Monotaxis heterodon)
- Vivaneaux
 Un banc de vivaneaux du Bengale (Lutjanus bengalensis)
Un banc de vivaneaux du Bengale (Lutjanus bengalensis) Des vivaneaux à bande blanche (Lutjanus biguttatus)
Des vivaneaux à bande blanche (Lutjanus biguttatus) Un vivaneau chien rouge (Lutjanus bohar)
Un vivaneau chien rouge (Lutjanus bohar) Un vivaneau bossu (Lutjanus gibbus)
Un vivaneau bossu (Lutjanus gibbus) Vivaneaux à raies bleues (Lutjanus kasmira)
Vivaneaux à raies bleues (Lutjanus kasmira) Un vivaneau églefin (Lutjanus monostigma)
Un vivaneau églefin (Lutjanus monostigma) Un vivaneau minuit (Macolor macularis)
Un vivaneau minuit (Macolor macularis) Un groupe de vivaneaux noirs et blancs (Macolor niger)
Un groupe de vivaneaux noirs et blancs (Macolor niger)
- Poissons-papillons et poissons-cochers
Les expressions « poissons-papillons » et « poissons-cochers » sont des noms vernaculaires qui regroupent des poissons de la famille des Chaetodontidae. Cette famille contient 12 genres et 129 espèces, largement dominées par le genre Chaetodon (88 espèces)[23]. Leur livrée est le plus souvent jaune et blanche avec des lignes généralement obliques sur le corps et un « masque » noir traversant l’œil sur la face. Ils ont un dos élevé et le corps très comprimé latéralement. La majorité vit entre 0 et 30 m de profondeur. Ils se nourrissent de polypes coralliens, d’invertébrés, d’œufs de poissons et d’algues[24], certains sont des planctonivores facultatifs[25]. De nombreuses espèces sont considérées comme des bio-indicateurs de l’état de santé des coraux, notamment les corallivores stricts, et la famille dans son ensemble est utilisée pour évaluer le statut écologique d’un récif[26].
 Un poisson-papillon d'Andaman (Chaetodon andamanensis)
Un poisson-papillon d'Andaman (Chaetodon andamanensis) Un poisson-papillon cocher (Chaetodon auriga)
Un poisson-papillon cocher (Chaetodon auriga) Un Poisson-papillon de Bennett (Chaetodon bennetti)
Un Poisson-papillon de Bennett (Chaetodon bennetti) Un poisson-papillon citron (Chaetodon citrinellus)
Un poisson-papillon citron (Chaetodon citrinellus) Un poisson-papillon à collier (Chaetodon collare)
Un poisson-papillon à collier (Chaetodon collare) Un poisson-papillon peint (Chaetodon decussatus)
Un poisson-papillon peint (Chaetodon decussatus) Un poisson-papillon faucille (Chaetodon falcula)
Un poisson-papillon faucille (Chaetodon falcula) Un poisson-papillon très moucheté (Chaetodon guttatissimus)
Un poisson-papillon très moucheté (Chaetodon guttatissimus) Un poisson-papillon à larme de l'océan Indien (Chaetodon interruptus)
Un poisson-papillon à larme de l'océan Indien (Chaetodon interruptus) Un poisson-papillon de Klein (Chaetodon kleinii)
Un poisson-papillon de Klein (Chaetodon kleinii) Un couple de poissons-papillons raton-laveur (Chaetodon lunula)
Un couple de poissons-papillons raton-laveur (Chaetodon lunula) Un poisson-papillon malgache (Chaetodon madagaskariensis)
Un poisson-papillon malgache (Chaetodon madagaskariensis) Un poisson-papillon à dos noir (Chaetodon melannotus)
Un poisson-papillon à dos noir (Chaetodon melannotus) Un couple de poissons-papillons de Meyer (Chaetodon meyeri)
Un couple de poissons-papillons de Meyer (Chaetodon meyeri) Un poisson-papillon triangulaire (Chaetodon triangulum)
Un poisson-papillon triangulaire (Chaetodon triangulum) Un poisson-papillon à chevrons (Chaetodon trifascialis)
Un poisson-papillon à chevrons (Chaetodon trifascialis) Un couple de poissons-papillons à trois bandes (Chaetodon trifasciatus)
Un couple de poissons-papillons à trois bandes (Chaetodon trifasciatus) Un poisson-papillon à tête jaune (Chaetodon xanthocephalus)
Un poisson-papillon à tête jaune (Chaetodon xanthocephalus) Un poisson-pincette jaune (Forcipiger flavissimus)
Un poisson-pincette jaune (Forcipiger flavissimus) Un poisson-pincette à long nez (Forcipiger longirostris)
Un poisson-pincette à long nez (Forcipiger longirostris) Un groupe de poissons-papillons pyramide noirs (Hemitaurichthys zoster)
Un groupe de poissons-papillons pyramide noirs (Hemitaurichthys zoster) Deux poissons-cochers communs (Heniochus acuminatus)
Deux poissons-cochers communs (Heniochus acuminatus) un banc de poissons-cochers (Heniochus diphreutes)
un banc de poissons-cochers (Heniochus diphreutes) Un poisson cocher fantôme (Heniochus pleurotaenia)
Un poisson cocher fantôme (Heniochus pleurotaenia)
- Poissons-anges
Les poissons-anges appartiennent à la famille des Pomacanthidae, qui contient 8 genres et 90 espèces[27]. Ils ont un corps ovale et généralement de vives couleurs, et sont caractérisés par un long aiguillon situé à l’angle inférieur des opercules. Plusieurs espèces sont hermaphrodites protogynes (ce qui signifie que tous les individus naissent femelle et que certains deviendront mâles quand la situation l’exigera) et forment des harems[28]. D’autres sont monogames ou forment des aires de parade[29] en saison de reproduction[28]. Les poissons-anges se nourrissent, selon les genres, d’algues, d’invertébrés sessiles ou de plancton[30]. La livrée des juvéniles est souvent très différente de celle des adultes. Contrairement aux poissons-papillons ce sont des poissons farouches.
 Un poisson-ange à trois taches (Apolemichthys trimaculatus)
Un poisson-ange à trois taches (Apolemichthys trimaculatus) Un poisson-ange à queue blanche (Apolemichthys xanthurus)
Un poisson-ange à queue blanche (Apolemichthys xanthurus) Un poisson-ange impérial (Pomacanthus imperator)
Un poisson-ange impérial (Pomacanthus imperator) Un poisson-ange à front jaune (Pomacanthus xanthometopon)
Un poisson-ange à front jaune (Pomacanthus xanthometopon) Un poisson-ange duc (Pygoplites diacanthus)
Un poisson-ange duc (Pygoplites diacanthus)
- Poissons-éperviers
Les poissons-éperviers (ou poissons-faucons) appartiennent à la famille des Cirrhitidae, qui comprend 13 genres et 40 espèces[31]. Ils doivent leurs noms vernaculaires à leur technique de chasse, à l’affût sur une branche de corail. Ils sont caractérisés par les touffes de cirrhes qui se trouvent au sommet des rayons durs de leur nageoire dorsale. Les poissons-éperviers sont hermaphrodites protogynes[32] et peuvent être monogames et territoriaux, ou former des harems[33]. Tous sont carnivores et se nourrissent de petits poissons et de crustacés[32].
 Un poisson-épervier à points rouges (Cirrhitichthys oxycephalus)
Un poisson-épervier à points rouges (Cirrhitichthys oxycephalus) Un épervier strié (Paracirrhites arcatus)
Un épervier strié (Paracirrhites arcatus) Un poisson-faucon de Forster (Paracirrhites forsteri)
Un poisson-faucon de Forster (Paracirrhites forsteri)
- Poissons-demoiselles ;;
Les poissons-demoiselles sont regroupés dans la famille des Pomacentridae, qui comprend 29 genres et 387 espèces[34]. Ils sont caractérisés par une petite bouche et une ligne latérale incomplète et interrompue[34]. Les stratégies de reproduction sont très variables : polygamie mâle ou femelle, monogamie et partenariat multiple pour chaque sexe[35]. Ces espèces pondent dans des nids situés sur un substrat quelconque, le mâle s’occupant des œufs en les défendant et en les ventilant jusqu’à éclosion[36]. Les Pomacentridae incluent la sous-famille des Amphiprioninae, dits « poissons-clowns », qui vivent en symbiose avec des espèces d’anémones, parfois une seule, et sont hermaphrodites protandres (tous les individus naissent mâles et le plus âgé d’entre eux changera de sexe à la disparition de la femelle dominante)[37]. Les poissons-demoiselles peuvent être herbivores, omnivores ou planctonivores, les espèces territoriales sont très agressives[36].
 Poissons-clowns de Clark (Amphiprion clarkii)
Poissons-clowns de Clark (Amphiprion clarkii) Poisson-clown des Maldives (Amphiprion nigripes, endémique)
Poisson-clown des Maldives (Amphiprion nigripes, endémique) Un sergent-major bagnard (Abudefduf vaigiensis)
Un sergent-major bagnard (Abudefduf vaigiensis) Une Demoiselle à ventre jaune (Amblyglyphidodon leucogaster)
Une Demoiselle à ventre jaune (Amblyglyphidodon leucogaster) Une demoiselle bicolore (Chromis fieldi)
Une demoiselle bicolore (Chromis fieldi) Des demoiselles à queue d'hirondelle (Chromis ternatensis)
Des demoiselles à queue d'hirondelle (Chromis ternatensis) Groupe de demoiselles bleues (Chromis viridis)
Groupe de demoiselles bleues (Chromis viridis) Une demoiselle à deux ocelles (Chrysiptera biocellata)
Une demoiselle à deux ocelles (Chrysiptera biocellata) Une demoiselle bleu électrique (Chrysiptera brownriggii) juvénile
Une demoiselle bleu électrique (Chrysiptera brownriggii) juvénile Demoiselles à trois bandes (Dascyllus abudafur)
Demoiselles à trois bandes (Dascyllus abudafur) Une demoiselle obscure (Dascyllus carneus)
Une demoiselle obscure (Dascyllus carneus) Une demoiselle à barre noire (Plectroglyphidodon dickii)
Une demoiselle à barre noire (Plectroglyphidodon dickii) Une demoiselle à points bleus (Plectroglyphidodon lacrymatus)
Une demoiselle à points bleus (Plectroglyphidodon lacrymatus) Une demoiselle bleue et jaune (Pomacentrus caeruleus)
Une demoiselle bleue et jaune (Pomacentrus caeruleus) Une demoiselle à queue blanche (Pomacentrus chrysurus)
Une demoiselle à queue blanche (Pomacentrus chrysurus) Une demoiselle indienne (Pomacentrus indicus)
Une demoiselle indienne (Pomacentrus indicus) Une demoiselle des Philippines (Pomacentrus philippinus)
Une demoiselle des Philippines (Pomacentrus philippinus) Un grégoire noir (Stegastes nigricans)
Un grégoire noir (Stegastes nigricans)
- Labres, vieilles et girelles
Les labres, vieilles et girelles sont regroupés dans la famille des Labridae, qui comprend 71 genres et 517 espèces[38]. Leur morphologie est extrêmement variable, tout comme le sont leurs tailles et leurs couleurs. Une des particularités de la plupart est d’avoir des lèvres charnues nettement apparentes sur le museau, d’où vient leur nom vernaculaire et celui du premier genre décrit (Labrus), le mot « labrum » signifiant lèvre en latin[39]. De nombreuses espèces sont hermaphrodites protogynes, les unes diandriques (il y a des mâles qui le sont dès la naissance, et d’autres qui le sont devenus), les autres monandriques (tous les mâles sont des femelles ayant changé de sexe)[40]. Les femelles et les mâles, ainsi que les juvéniles, ont souvent des livrées, et parfois des morphologies, très différentes. Les gamètes des labres du domaine Indo-Pacifique sont libérés en pleine eau, les œufs sont donc pélagiques (les labres des régions tempérées pondent dans un nid le plus souvent aménagé sur le substrat). La majorité des espèces, carnivores, cherchent des invertébrés en fouillant le fond mais d’autres sont planctonivores[38]. Parmi les carnivores, certaines sont « nettoyeuses » : elles se nourrissent des parasites des autres poissons[41].
 Un labre à tirets (Anampses lineatus)
Un labre à tirets (Anampses lineatus) Un tamarin (Bodianus axillaris)
Un tamarin (Bodianus axillaris) Une girelle longue (Cheilio inermis)
Une girelle longue (Cheilio inermis) Une girelle bossue (Coris aygula)
Une girelle bossue (Coris aygula) Une girelle reine (Coris frerei)
Une girelle reine (Coris frerei) Un labre à long museau (Epibulus insidiator)
Un labre à long museau (Epibulus insidiator) Un labre oiseau (Gomphosus caeruleus) femelle
Un labre oiseau (Gomphosus caeruleus) femelle Trois labres échiquiers (Halichoeres hortulanus), dans deux livrées différentes.
Trois labres échiquiers (Halichoeres hortulanus), dans deux livrées différentes. Un tamarin à bandes noires (Hemigymnus fasciatus)
Un tamarin à bandes noires (Hemigymnus fasciatus) Un labre bicolore (Hemigymnus melapterus)
Un labre bicolore (Hemigymnus melapterus) Un labre-rasoir Iniistius aneitensis
Un labre-rasoir Iniistius aneitensis Un labre nettoyeur bicolore (Labroides bicolor)
Un labre nettoyeur bicolore (Labroides bicolor) Un labre nettoyeur (Labroides dimidiatus)
Un labre nettoyeur (Labroides dimidiatus).JPG.webp) Un labre vermiculé (Macropharyngodon bipartitus)
Un labre vermiculé (Macropharyngodon bipartitus) Un labre-rasoir masqué (Novaculichthys taeniourus)
Un labre-rasoir masqué (Novaculichthys taeniourus) Un labre des Moluques (Pseudodax moluccanus)
Un labre des Moluques (Pseudodax moluccanus) Une girelle arc-en-ciel à trois lignes Stethojulis trilineata
Une girelle arc-en-ciel à trois lignes Stethojulis trilineata Un banc de jeunes girelles-paons bigarrées (Thalassoma amblycephalum)
Un banc de jeunes girelles-paons bigarrées (Thalassoma amblycephalum) Girelle-paon à taches d'encre (Thalassoma hardwicke)
Girelle-paon à taches d'encre (Thalassoma hardwicke) Une girelle verte (Thalassoma lunare)
Une girelle verte (Thalassoma lunare) Un labre à six lignes (Pseudocheilinus hexataenia)
Un labre à six lignes (Pseudocheilinus hexataenia) Une vieille rayée (Cheilinus fasciatus)
Une vieille rayée (Cheilinus fasciatus) Un Napoléon (Cheilinus undulatus)
Un Napoléon (Cheilinus undulatus)
- Poissons-perroquets
Les poissons-perroquets appartiennent à la famille des Scaridae, qui comprend 10 genres et 100 espèces[42]. À quelques exceptions près ils ont des dents antérieures fusionnées en forme de bec de perroquet. Les Scaridae possèdent de larges écailles cycloïdes et ont généralement de vives couleurs. Ce sont des poissons herbivores, dont de nombreuses espèces raclent le corail pour se nourrir des algues qui le couvrent. Les éléments calcaires ainsi ingérés sont ensuite évacués et sont une des sources du sable corallien[43]. Les Scaridae dont le statut sexuel est connu sont tous hermaphrodites protogynes[44], à l’exception du perroquet des herbiers (Leptoscarus vaigiensis)[45]. Les livrées mâles et femelles, et souvent celles des juvéniles, sont très différentes, les femelles étant plus ternes. Depuis 2020, toutes les espèces de poissons-perroquets sont strictement protégées aux Maldives[46].
 Un poisson-perroquet bicolore (Cetoscarus ocellatus) en phase terminale (mâle)
Un poisson-perroquet bicolore (Cetoscarus ocellatus) en phase terminale (mâle) Un poisson-perroquet vert (Chlorurus enneacanthus)
Un poisson-perroquet vert (Chlorurus enneacanthus) Un poisson-perroquet brûlé (Chlorurus sordidus)
Un poisson-perroquet brûlé (Chlorurus sordidus) Un poisson-perroquet grand bleu (Chlorurus strongylocephalus), de nuit
Un poisson-perroquet grand bleu (Chlorurus strongylocephalus), de nuit Un poisson-perroquet jaune (Hipposcarus harid)
Un poisson-perroquet jaune (Hipposcarus harid) Un poisson-perroquet à six bandes (Scarus frenatus)
Un poisson-perroquet à six bandes (Scarus frenatus) Un poisson-perroquet brun (Scarus niger) en phase initiale (femelle)
Un poisson-perroquet brun (Scarus niger) en phase initiale (femelle) Un poisson-perroquet brun (Scarus niger) en phase finale (mâle)
Un poisson-perroquet brun (Scarus niger) en phase finale (mâle) Un poisson-perroquet à gorge verte (Scarus prasiognathos) en phase initiale (femelle)
Un poisson-perroquet à gorge verte (Scarus prasiognathos) en phase initiale (femelle) Un poisson-perroquet à gorge verte (Scarus prasiognathos) en phase finale (mâle)
Un poisson-perroquet à gorge verte (Scarus prasiognathos) en phase finale (mâle) Un poisson-perroquet commun (Scarus psittacus)
Un poisson-perroquet commun (Scarus psittacus) Un poisson-perroquet bicolore (Scarus rubroviolaceus) femelle (stade initial)
Un poisson-perroquet bicolore (Scarus rubroviolaceus) femelle (stade initial) Un perroquet bicolore (Scarus rubroviolaceus) mâle (stade final)
Un perroquet bicolore (Scarus rubroviolaceus) mâle (stade final) Scarus russelii en phase initiale (femelle)
Scarus russelii en phase initiale (femelle) Un poisson-perroquet à cinq selles (Scarus scaber) femelle
Un poisson-perroquet à cinq selles (Scarus scaber) femelle Un poisson-perroquet à cinq selles (Scarus scaber) mâle
Un poisson-perroquet à cinq selles (Scarus scaber) mâle Un poisson-perroquet tricolore (Scarus tricolor) femelle
Un poisson-perroquet tricolore (Scarus tricolor) femelle Un poisson-perroquet tricolore (Scarus tricolor) mâle
Un poisson-perroquet tricolore (Scarus tricolor) mâle Un poisson-perrouet à lèvres vertes (Scarus viridifucatus)
Un poisson-perrouet à lèvres vertes (Scarus viridifucatus)
- Blennies
Les blennies font partie de la famille des Blenniidae, qui comprend 57 genres et 396 espèces[47], dont certaines vivent en eaux saumâtres ou douces[48]. Elles sont notamment caractérisées par un corps effilé et sans écailles, un museau droit et des nageoires dorsale et pectorale particulièrement longues. Elles portent généralement des cirres au-dessus des yeux et sur la nuque. La plupart vivent sur le substrat (ce pourquoi ces espèces ne possèdent pas de vessie natatoire) et se nourrissent d’algues et d’invertébrés, ou de plancton. Les blennies à dents de sabre (regroupées dans 5 genres) vivent en pleine eau et se nourrissent des écailles, de la peau ou de morceaux de nageoires des poissons qu’elles attirent en imitant la livrée ou la danse des labres nettoyeurs[49]. Les femelles déposent leurs œufs dans un abri choisi par le mâle, qui les défendra jusqu’à l’éclosion[50].
 Un blennie Blenniella chrysospilos
Un blennie Blenniella chrysospilos Un blennie bicolore (Ecsenius bicolor)
Un blennie bicolore (Ecsenius bicolor) Une blennie de Midas (Ecsenius midas)
Une blennie de Midas (Ecsenius midas) Une blennie des Maldives (Ecsenius minutus), endémique
Une blennie des Maldives (Ecsenius minutus), endémique Une blennie de Smith (Meiacanthus smithi)
Une blennie de Smith (Meiacanthus smithi) Petroscirtes breviceps
Petroscirtes breviceps Une blennie dents de sabre à rayure bleue (Plagiotremus rhinorhynchos)
Une blennie dents de sabre à rayure bleue (Plagiotremus rhinorhynchos)
- Gobies
Les gobies appartiennent à la famille des Gobiidae, la plus vaste des familles de poissons, qui comprend 250 genres et 1 686 espèces[51], que l’on peut trouver en eaux douces, saumâtres ou marines. La plupart des gobies mesurent moins de 10 cm. Ils sont caractérisés par une tête large et aplatie, des lèvres charnues, la présence de deux nageoires dorsales et des pelviennes souvent soudées de façon à former une ventouse[52]. La majorité des gobies se nourrit de petits invertébrés, mais certains sont planctonivores. Certains sont en relation symbiotique avec une crevette, notamment du genre Alpheus, l’association pouvant être sélective entre une espèce de gobies et une ou deux espèces de crevettes[53], et certaines autres sont nettoyeuses[54]. Quelques espèces sont hermaphrodites protogynes. Les œufs sont fixés sous des pierres ou des coquilles, et seront gardés par le mâle jusqu’à éclosion[52].
 Un gobie magnifique (Amblyeleotris aurora)
Un gobie magnifique (Amblyeleotris aurora) Un gobie à demi-bandes (Amblygobius albimaculatus)
Un gobie à demi-bandes (Amblygobius albimaculatus) Un gobie des coraux noirs (Bryaninops loki)
Un gobie des coraux noirs (Bryaninops loki) Un gobie nain (Helcogramma maldivensis)
Un gobie nain (Helcogramma maldivensis) Deux gobies de Hector (Koumansetta hectori)
Deux gobies de Hector (Koumansetta hectori) Deux gobies fléchettes (Ptereleotris evides)
Deux gobies fléchettes (Ptereleotris evides)
- Poissons-chirurgiens et licornes
Les poissons-chirurgiens appartiennent à la famille des Acanthuridae, qui comprend 6 genres et 82 espèces[55]. Cette famille inclut les poissons-licornes ou nasons. Ils sont caractérisés par un dos élevé, un front bombé, des nageoires dorsale et anale longues et une petite bouche terminale. Une paire d’épines tranchantes, mobiles chez les chirurgiens et fixe chez les nasons, arme les flancs du pédoncule caudal (ce sont les « scalpels » qui justifient le nom vernaculaire du groupe). La majorité se nourrit d’algues, mais certaines espèces consomment du zooplancton, des détritus ou des invertébrés[56]. Les poissons chirurgiens sont territoriaux, certaines espèces forment des harems. La reproduction se fait par couples ou en groupes, ou les deux dans quelques espèces[57]. Les gamètes sont libérés en pleine eau, la fécondation est donc externe.
 Un banc de chirurgiens à queue rayée (Acanthurus blochii)
Un banc de chirurgiens à queue rayée (Acanthurus blochii) Un chirurgien à poitrine blanche (Acanthurus leucosternon)
Un chirurgien à poitrine blanche (Acanthurus leucosternon) Un poisson-chirurgien clown (Acanthurus lineatus)
Un poisson-chirurgien clown (Acanthurus lineatus) Un poisson-chirurgien à queue blanche (Acanthurus mata)
Un poisson-chirurgien à queue blanche (Acanthurus mata) Deux poissons chirurgiens à virgule noire (Acanthurus nigricauda)
Deux poissons chirurgiens à virgule noire (Acanthurus nigricauda) Un chirurgien brun foncé (Acanthurus nigrofuscus)
Un chirurgien brun foncé (Acanthurus nigrofuscus) Un poisson-chirurgien de Thmpson (Acanthurus thompsoni)
Un poisson-chirurgien de Thmpson (Acanthurus thompsoni) Un banc de chirurgiens bagnards (Acanthurus triostegus)
Un banc de chirurgiens bagnards (Acanthurus triostegus) Un poisson-chirurgien à nageoires jaunes (Acanthurus xanthopterus)
Un poisson-chirurgien à nageoires jaunes (Acanthurus xanthopterus) Un chirurgien strié (Ctenochaetus striatus)
Un chirurgien strié (Ctenochaetus striatus) Un chirurgien à cercle doré (Ctenochaetus strigosus)
Un chirurgien à cercle doré (Ctenochaetus strigosus) Un chirurgien Ctenochaetus truncatus
Un chirurgien Ctenochaetus truncatus Un couple de nasons bossus (Naso brachycentron)
Un couple de nasons bossus (Naso brachycentron) Un nason pointillé (Naso brevirostris)
Un nason pointillé (Naso brevirostris) Un couple de nasons gris (Naso hexacanthus)
Un couple de nasons gris (Naso hexacanthus) Un nason à éperons orange (Naso elegans)
Un nason à éperons orange (Naso elegans) Un nason à gros nez (Naso tuberosus)
Un nason à gros nez (Naso tuberosus)119.jpg.webp) Un nason à éperons bleus (Naso unicornis)
Un nason à éperons bleus (Naso unicornis) Un nason zébré (Naso vlamingii)
Un nason zébré (Naso vlamingii) Un chirurgien bleu (Paracanthurus hepatus)
Un chirurgien bleu (Paracanthurus hepatus) Un chirurgien voilier (Zebrasoma desjardinii) passant du stade juvénile au stade adulte.
Un chirurgien voilier (Zebrasoma desjardinii) passant du stade juvénile au stade adulte. Un poisson-chirurgien jaune (Zebrasoma flavescens)
Un poisson-chirurgien jaune (Zebrasoma flavescens) Un chirurgien à brosses (Zebrasoma scopas)
Un chirurgien à brosses (Zebrasoma scopas)
- Poissons pleuronectiformes
Les pleuronectiformes sont les poissons plats.
 Un turbot panthère (Bothus pantherinus)
Un turbot panthère (Bothus pantherinus)
- Poissons tetraodontiformes
Le radical du nom de l’ordre des tetraodontiformes est formé à partir des mots grecs « tetra », quatre, et « odous », dents[58] mais parmi les familles concernées, seuls les Tétraodontidés ont quatre plaques dentales. Ce groupe hétérogène est caractérisé par l’absence d’écailles imbriquées, des ouvertures branchiales de petite taille, une petite bouche et des pelviennes absentes ou transformées en épine enkystée dans une poche extensible[59].
 Un baliste ondulé (Balistapus undulatus)
Un baliste ondulé (Balistapus undulatus) Un baliste-clown (Balistoides conspicillum)
Un baliste-clown (Balistoides conspicillum) Un baliste titan (Balistoides viridescens)
Un baliste titan (Balistoides viridescens) Un baliste pélagique à grandes écailles (Canthidermis macrolepis)
Un baliste pélagique à grandes écailles (Canthidermis macrolepis) Un baliste à nageoires noires (Melichthys indicus)
Un baliste à nageoires noires (Melichthys indicus) Un baliste bleu (Odonus niger)
Un baliste bleu (Odonus niger) Un poisson-baliste à marges jaunes (Pseudobalistes flavimarginatus)
Un poisson-baliste à marges jaunes (Pseudobalistes flavimarginatus) Un baliste Picasso (Rhinecanthus aculeatus)
Un baliste Picasso (Rhinecanthus aculeatus) Un baliste boomerang (Sufflamen bursa)
Un baliste boomerang (Sufflamen bursa) Un baliste demi-lune (Sufflamen chrysopterum)
Un baliste demi-lune (Sufflamen chrysopterum) Un poisson-lime gribouillé ou bourse écriture (Aluterus scriptus)
Un poisson-lime gribouillé ou bourse écriture (Aluterus scriptus) Un groupe de poissons-lime à taches orange (Oxymonacanthus longirostris)
Un groupe de poissons-lime à taches orange (Oxymonacanthus longirostris) Un couple de monacanthes à selles noires (Paraluteres prionurus) en livrée nuptiale, mimétique de Canthigaster valentini
Un couple de monacanthes à selles noires (Paraluteres prionurus) en livrée nuptiale, mimétique de Canthigaster valentini_Huludhoo.JPG.webp) Un poisson-coffre pintade (Ostracion meleagris) mâle
Un poisson-coffre pintade (Ostracion meleagris) mâle Un Poisson-ballon à points bleus (Arothron caeruleopunctatus)
Un Poisson-ballon à points bleus (Arothron caeruleopunctatus) Un poisson-ballon à taches blanches (Arothron hispidus)
Un poisson-ballon à taches blanches (Arothron hispidus) Un poisson-ballon moucheté ou tétrodon pintade (Arothron meleagris)
Un poisson-ballon moucheté ou tétrodon pintade (Arothron meleagris) Un poisson-ballon moucheté (Arothron meleagris), livrée jaune
Un poisson-ballon moucheté (Arothron meleagris), livrée jaune Un poisson-ballon à taches noires (Arothron nigropunctatus)
Un poisson-ballon à taches noires (Arothron nigropunctatus) Un canthigaster alvéolé (Canthigaster janthinoptera)
Un canthigaster alvéolé (Canthigaster janthinoptera) Deux canthigasters à selles (Canthigaster valentini)
Deux canthigasters à selles (Canthigaster valentini) Un grand poisson porc-épic (Diodon hystrix)
Un grand poisson porc-épic (Diodon hystrix) Un poisson porc-épic à taches auréolées (Diodon liturosus)
Un poisson porc-épic à taches auréolées (Diodon liturosus)
Ascidies
Les ascidies (Classe Ascidiacea) sont des animaux marins qui appartiennent au sous-embranchement des tuniciers (Tunicata ou Urochordata). Les ascidies sont considérées comme un groupe évolutif à l'orée du groupe des vertébrés, et donc beaucoup plus proche de nous que des animaux pourtant plus évolués en apparence tels que les crustacés ou les céphalopodes (la larve est cependant pourvue d'une tête, perdue lors du passage au stade adulte). Elles se divisent en 2 groupes morphologiques différents : les ascidies dites solitaires et les ascidies coloniales. Le corps, le plus souvent en forme d'outre, est recouvert d'une tunique cellulosique. Fait rare dans le règne animal, ces animaux sont partiellement constitués de tunicine, une molécule proche de la cellulose, qui est caractéristique des végétaux. Ce sont des animaux qui filtrent l'eau à la manière des éponges, pourvus d'un gros pore terminal.
 Une colonie d'ascidies Atriolum robustum
Une colonie d'ascidies Atriolum robustum Un groupe d'ascidies molles ou grandes synascidies urnes (Didemnum molle)
Un groupe d'ascidies molles ou grandes synascidies urnes (Didemnum molle) Un groupe d'ascidies arabes (Phallusia arabica)
Un groupe d'ascidies arabes (Phallusia arabica) Didemnum sp.
Didemnum sp. Aplidium sp.
Aplidium sp. Pyura sp.
Pyura sp.
Échinodermes
Les échinodermes comprennent les étoiles de mer, holothuries, oursins, ophiures et crinoïdes : ces animaux sont généralement caractérisés par le fait que leur corps est structuré en une symétrie centrale (au lieu de bilatérale chez la plupart des animaux), généralement d'ordre 5 (« pentaradiale »), visible chez les étoiles de mer, les oursins et les ophiures, et plus discrète chez les holothuries et les crinoïdes. Les échinodermes sont relativement discrets sur les récifs de l'atoll de Baa, et les espèces les plus communes sont des étoiles de mer (principalement Linckia multifora et Culcita schmideliana) et l'holothurie Pearsonothuria graeffei ; de nuit des oursins comme l'oursin-crayon (Heterocentrotus mamillatus) sortent de leur cachette pour se nourrir, parfois en abondance[60].
Les échinodermes sont des animaux lents et non agressifs, cependant certaines espèces comme l'étoile Acanthaster planci et l'oursin Toxopneustes pileolus sont munis d'organes très venimeux pouvant s'avérer dangereux s'ils sont manipulés.
Étoiles de mer
La classe des Asteroidea (les étoiles de mer) comprend environ 1 800 espèces réparties dans tous les océans[61]. On peut en trouver à toutes les profondeurs, de la zone de balancement des marées à −6 000 mètres de fond[62]. Elles peuvent avoir cinq bras ou davantage, et jusqu’à plus de vingt pour Acanthaster planci[63]. Chez certaines (les « étoiles-coussins »), les bras sont à peine suggérés. Toutes ont un disque central portant en partie supérieure (face « aborale ») l’anus et le madréporite, et sur la face inférieure (face « orale ») une bouche dépourvue de dents mais par laquelle certaines astérides peuvent « dévaginer » leur estomac pour le projeter sur la proie et commencer ainsi à la digérer de façon externe. L'étoile Acanthaster planci se nourrit de corail et est recouverte de piquants venimeux, dont la piqûre provoque douleurs cuisantes, érythème et œdème ; elle est potentiellement envahissante aux Maldives[64], mais demeure rare dans l'atoll de Baa[60].
 Une étoile de la famille des Asterinidae (peut-être Aquilonastra halseyae)
Une étoile de la famille des Asterinidae (peut-être Aquilonastra halseyae)
 Une étoile de mer indienne (Fromia indica)
Une étoile de mer indienne (Fromia indica) Une étoile rouge poreuse (Fromia milleporella)
Une étoile rouge poreuse (Fromia milleporella) Une étoile de mer à nodules (Fromia nodosa)
Une étoile de mer à nodules (Fromia nodosa) Une étoile cloutée (Mithrodia clavigera), de nuit.
Une étoile cloutée (Mithrodia clavigera), de nuit. Une étoile de mer égyptienne (Gomophia egyptiaca)
Une étoile de mer égyptienne (Gomophia egyptiaca) Une étoile Leiaster speciosus
Une étoile Leiaster speciosus Comète de mer (Linckia guildingi)
Comète de mer (Linckia guildingi) Petite comète de mer (Linckia multifora)
Petite comète de mer (Linckia multifora) Une étoile Nardoa galatheae
Une étoile Nardoa galatheae Une étoile-coussin (Culcita schmideliana)
Une étoile-coussin (Culcita schmideliana) Une étoile-coussin granuleuse Choriaster granulatus
Une étoile-coussin granuleuse Choriaster granulatus
Ophiures
Les ophiures (du grec ophis, « serpent », et oura, « queue »[65]) ne sont pas des étoiles de mer, mais un groupe proche (toutes deux font partie de la sous-classe des Asterozoa). Parmi les différences on trouve des bras très fins et très souples, indépendants du corps, qui ne se touchent pas à leur base, et l’absence d’anus (les rejets se font par la bouche). Elles sont de surcroît beaucoup plus rapides, et se déplacent en se portant sur leurs longs bras. Le corps discoïdal est aplati sur la face inférieure, et généralement bombé en face supérieure. Il existe un ordre d’ophiures dont la morphologie est totalement différente, les Euryalida ou « gorgonocéphales », dont les nombreux et longs bras très ramifiés se déploient la nuit pour capturer le plancton.
 Une ophiure de Savigny (Ophiothrix purpurea)
Une ophiure de Savigny (Ophiothrix purpurea)
 Ophiothrix sp.
Ophiothrix sp. Ophiothrix sp. 2
Ophiothrix sp. 2 Ophiothrix sp. 3
Ophiothrix sp. 3 Une ophiure non identifiée (probablement aussi de la famille des Ophiotrichidae)
Une ophiure non identifiée (probablement aussi de la famille des Ophiotrichidae)
Crinoïdes
Les crinoïdes forment le plus ancien groupe d'échinodermes actuels, répartis entre les « crinoïdes vrais », qui comme les espèces du Paléozoïque sont attachées par une tige, et les « comatules », qui peuvent se déplacer sur des cirrhes, et qui forment l'essentiel des espèces de la zone euphotique. Leur corps se compose d'un « calice » d'où rayonnent de nombreux bras pourvus de pinnules (qui leur donnent un aspect plumeux), elles-mêmes couvertes de podia collants destinés à attraper le plancton dont se nourrit l'animal[66]. La plupart des espèces demeurent enroulées et dissimulées pendant la journée, et n'étendent leurs bras qu'à la nuit tombée.

 Une comatule noble (Comaster schlegelii)
Une comatule noble (Comaster schlegelii)

 Une comatule à longs bras (Alloeocomatella pectinifera)
Une comatule à longs bras (Alloeocomatella pectinifera)
Oursins
Le corps des oursins est protégé par une coque calcaire (appelée « test »), recouverte de solides piquants (appelés « radioles »). Chez les oursins dits « réguliers » le test a la forme d’une sphère ou demi-sphère plus ou moins aplatie dorsalement et armée de piquants de taille variable selon des familles. Ceux-ci sont articulés à leur base et servent à la défense et en partie à la locomotion (assistés par de petits pieds à ventouse appelés « podia »). Au centre de la face orale se trouve une bouche dotée d’un appareil masticateur à cinq dents nommé « lanterne d'Aristote ». Il existe aussi des oursins « irréguliers » qui peuvent être oblongs ou plats, et chez lesquels l'anus et parfois la bouche ont migré vers un bord du test ; ce sont des oursins fouisseurs, que l'on trouve généralement enterrés dans le sable.
Les oursins bien dissimulés peuvent provoquer des piqûres douloureuses chez les baigneurs imprudents, et certaines espèces (famille des Diadematidae et des Echinothuriidae) possèdent un léger venin dans leurs piquants, alors que chez l'oursin-fleur et d'autres Toxopneustidae le danger ne vient pas des piquants mais de ses pédicellaires en forme de fleur, qui délivrent un puissant venin pouvant provoquer des troubles respiratoires graves.
Les oursins de faible profondeur sont pour la plupart des brouteurs d'algues : la faible densité de couvert algal dans l'atoll de Baa explique ainsi la faible population d'oursins de la plupart des îles, qui sont par ailleurs presque tous nocturnes. L'assemblage est ainsi dominé dans l'atoll par une importante population nocturne de robustes oursins-crayons (Heterocentrotus mamillatus), ponctuée de non moins robustes oursins impériaux (Phyllacanthus imperialis) ; cependant, en regardant bien dans les trous et crevasses, deux espèces de petits oursins perforants sont également présentes : Echinometra mathaei et le sédentaire Echinostrephus molaris[60].
 Un oursin-diadème de Savigny (Diadema savignyi) juvénile
Un oursin-diadème de Savigny (Diadema savignyi) juvénile Un oursin à doubles piquants (Echinothrix diadema)
Un oursin à doubles piquants (Echinothrix diadema) Un oursin perforant (Echinometra mathaei)
Un oursin perforant (Echinometra mathaei) Un oursin à fins piquants (Echinostrephus molaris)
Un oursin à fins piquants (Echinostrephus molaris) Un oursin-crayon (Heterocentrotus mamillatus, forme violette) de nuit
Un oursin-crayon (Heterocentrotus mamillatus, forme violette) de nuit Un oursin impérial (Phyllacanthus imperialis) de nuit
Un oursin impérial (Phyllacanthus imperialis) de nuit Le « test » (squelette) lessivé d'un Metalia sternalis
Le « test » (squelette) lessivé d'un Metalia sternalis Des tests d'oursins minuscules du genre Fibularia
Des tests d'oursins minuscules du genre Fibularia Un oursin plat ou « dollar des sables » (Clypeaster humilis)
Un oursin plat ou « dollar des sables » (Clypeaster humilis)
Holothuries (« concombres de mer »)
La classe des Holothuroidea (du grec « holothoúrion», donné par Aristote à un animal qui n’a pu être déterminé[67]) regroupe des animaux marins au corps généralement cylindrique, plus ou moins mou selon les espèces, qui présentent une symétrie bilatérale apparente tout en conservant organiquement la symétrie pentaradiaire propre aux échinodermes. Autour de la bouche située en position antérieure, on observe une couronne de tentacules mobiles et rétractables chargés de prélever des particules de sédiment et de les porter à la bouche. En partie postérieure se trouve l’orifice cloacal servant à la respiration et à l’évacuation des déjections. C’est aussi par cet orifice que sortent, en situation de stress, de longs filaments blancs et collants appelés tubes de Cuvier chez les espèces qui en possèdent. Les holothuries se meuvent lentement, soit sur des centaines de podias terminés par une ventouse, soit, pour les Apodida qui n’en sont pas pourvus, en rampant.
Les holothuries sont les grands nettoyeurs du récif. Ils se nourrissent principalement de la matière organique en décomposition présente dans le substrat, et permettent ainsi de limiter la prolifération des bactéries et de constituer un sédiment épuré et homogène. Leur récolte industrielle a débuté aux Maldives en 1985 (principalement à destination de l'Asie du sud-est), et dans les années 1990 la plupart des espèces à forte valeur commerciale étaient déjà décimées[68]. En conséquence, les seules espèces observées fréquemment dans l'atoll de Baa sont actuellement Pearsonothuria graeffei et Stichopus chloronotus[60] (mais cette hiérarchie varie d'un atoll à l'autre[4]).
 Une holothurie bleue (Actinopyga caerulea)
Une holothurie bleue (Actinopyga caerulea) Une holothurie caillou (Actinopyga lecanora)
Une holothurie caillou (Actinopyga lecanora) Une holothurie noire (probablement Actinopyga miliaris)
Une holothurie noire (probablement Actinopyga miliaris) Holothurie à ocelles noires (Holothuria atra)
Holothurie à ocelles noires (Holothuria atra) Une holothurie rose (Holothuria edulis)
Une holothurie rose (Holothuria edulis) Une holothurie trompe d'éléphant (Holothuria fuscopunctata)
Une holothurie trompe d'éléphant (Holothuria fuscopunctata) Holothurie rayée (Pearsonothuria graeffei)
Holothurie rayée (Pearsonothuria graeffei) Holothurie verte (Stichopus chloronotus)
Holothurie verte (Stichopus chloronotus) Une holothurie de Herrmann (Stichopus herrmanni)
Une holothurie de Herrmann (Stichopus herrmanni) Holothurie verruqueuse (Stichopus cf. horrens)
Holothurie verruqueuse (Stichopus cf. horrens) Une holothurie royale (Thelenota anax)
Une holothurie royale (Thelenota anax) Une holothurie inconnue (famille des Stichopodidae)
Une holothurie inconnue (famille des Stichopodidae) Une holothurie-serpent miniature (Synaptula cf. lamperti)
Une holothurie-serpent miniature (Synaptula cf. lamperti).jpg.webp) Une holothurie serpentiforme du genre Synaptula
Une holothurie serpentiforme du genre Synaptula Une holothurie serpentiforme de la famille des Synaptidae
Une holothurie serpentiforme de la famille des Synaptidae
Mollusques
L’embranchement des Mollusques tire son nom du mot latin « mollis », qui signifie mou, de même que la science qui les étudie, la malacologie, tire le sien du grec « malakos », qui a le même sens. Le corps des mollusques est donc mou. Cet embranchement très hétérogène d’animaux marins et terrestres est unifié par l’existence d’un tégument (le manteau) fabriquant des spicules et capable, chez la majorité d’entre eux, de produire une coquille (mais pas chez les limaces de mer par exemple). La coquille protège la masse viscérale qui se situe au-dessus d’un pied musculeux et généralement locomoteur. Un repli du manteau (la cavité palléale) protège les branchies et les organes excréteurs et reproducteurs. La cavité buccale est armée d’une sorte de langue râpeuse couverte de minuscules dents chitineuses (la radula)[69]. Les Céphalopodes (poulpes, calmars et seiches) sont également des mollusques sans coquille apparente, que l'évolution a dotés de capacités très particulières[70].
Gastéropodes
Les gastéropodes (du grec « gastêr », ventre ou estomac et « pous, podos », pied) possèdent généralement une coquille univalve spiralée qui peut être d’aspect très variable et qui est ou non fermée par un opercule calcaire ou corné[71]. La coquille est absente, ou résiduelle et interne chez certains Opisthobranches (limaces de mer)[72]. La tête est le plus souvent munie de tentacules, portant des yeux à leur extrémité ou à leur base. Le « pied » ventral large permet la locomotion par reptation (parfois aussi la nage par ondulations). La masse viscérale se trouve dans la coquille. Les gastéropodes sont les seuls mollusques à contenir des espèces terrestres. Ils peuvent être brouteurs ou carnivores.
Au moins jusqu'au XVIe siècle, l'océan entourant les Maldives a fourni une ressource fondamentale à l'archipel du point de vue économique, à savoir les coquillages de la variété Monetaria moneta qui pendant des siècles, comme leur nom l'indique, ont constitué la principale monnaie d'échange le long des côtes asiatiques et africaines de l'océan Indien : depuis longtemps la monnaie officielle est devenue la roupie, mais les coquillages qui ont fait connaître les Maldives comme les anciennes « îles de l'argent » sont encore pêchés par les indigènes qui en font des colliers ou des souvenirs. La surpêche de certaines espèces comme les porcelaines ou le « Casque rouge » (Cypraecassis rufa) a cependant fait dramatiquement régresser leur abondance.
Certains animaux sont particulièrement cryptiques, et leur présence n'est parfois trahie que par la coquille vide échouée sur la plage, dans la laisse de mer. Ces spécimens sont parfois très usés, ce qui complexifie d'autant plus l'identification.
- Ordre des Neogastropoda
L’ordre des Neogastropoda contient les plus évolués des gastéropodes marins, répartis en sept superfamilles et 42 familles[73]. Ils sont caractérisés par un peigne respiratoire, un système nerveux concentré notamment sous forme de ganglions cérébroïdes, un siphon et un opercule. La radula montre dans de nombreuses espèces de trois à cinq dents par rangées mais elle peut être modifiée, comme chez les cônes par exemple. Plusieurs familles sont venimeuses[74]. La coquille présente un canal siphonal développé. Les sexes sont séparés. On les trouve des eaux tropicales au eaux polaires, et à toutes les profondeurs[75]. La majorité est carnivore ou nécrophage. Un très faible nombre d’espèces vit en eau douce.
- Les porcelaines
La famille des Cypraeidae comprend 48 genres et plus de 250 espèces. La coquille a une forme de demi-coque ovoïde avec ou sans bords calleux. Sur sa face inférieure se trouve une ouverture étroite aux lèvres denticulées. La majorité des espèces se trouve dans les mers chaudes, généralement à faible profondeur[76]. Elles peuvent être herbivores, mais la majorité, carnivore, se nourrit d’anémones, d’éponges, d’ascidies, de cadavres de mollusques ou d’œufs de gastéropodes[77].
 Une porcelaine tigre (Cypraea tigris).
Une porcelaine tigre (Cypraea tigris). Une Porcelaine érodée (Erosaria erosa), échoué sur la plage.
Une Porcelaine érodée (Erosaria erosa), échoué sur la plage. Trois coquilles d'Erronea caurica échouées sur la plage.
Trois coquilles d'Erronea caurica échouées sur la plage. Une porcelaine lynx (Lyncina lynx), échoué sur la plage.
Une porcelaine lynx (Lyncina lynx), échoué sur la plage. Une porcelaine (Mauritia histrio), échoué sur la plage.
Une porcelaine (Mauritia histrio), échoué sur la plage. Deux coquilles de Monetaria caputserpentis échouées sur la plage.
Deux coquilles de Monetaria caputserpentis échouées sur la plage. Deux porcelaines monnaie (Monetaria moneta), échoué sur la plage.
Deux porcelaines monnaie (Monetaria moneta), échoué sur la plage. Deux porcelaines non identifiées (Monetaria sp.), échoué sur la plage.
Deux porcelaines non identifiées (Monetaria sp.), échoué sur la plage.
- Les strombes
La famille des Strombidae comprend 23 genres et 89 espèces actuelles[78]. Leur coquille épaisse et lourde ménage deux plis pour les longs pédoncules oculaires, qui leur permettent de surveiller les alentours à l’abri. La majorité vit dans les mers chaudes, mais on en rencontre aussi dans des eaux tempérées[79]. À la différence des autres gastéropodes, ils progressent par petits sauts au moyen d’un opercule corné en forme de faux, denticulée ou non. Ils sont herbivores et détritivores occasionnels[80].
 Gibberulus gibberulus albus
Gibberulus gibberulus albus Une conque arthritique (Lambis chiragra arthritica)
Une conque arthritique (Lambis chiragra arthritica) Une conque araignée géante (Lambis truncata)
Une conque araignée géante (Lambis truncata) Une strombe lentigineuse (Lentigo lentiginosus)
Une strombe lentigineuse (Lentigo lentiginosus) Une conque de la famille des Strombidae
Une conque de la famille des Strombidae Un strombidae non identifié (peut-être Canarium sp.), échoué sur la plage.
Un strombidae non identifié (peut-être Canarium sp.), échoué sur la plage.
- Autres Neogastropoda
 Un gastéropode du genre Mammilla, échoué sur la plage.
Un gastéropode du genre Mammilla, échoué sur la plage. Cette ranelle géante (Tutufa bubo) consomme une Linckia multifora.
Cette ranelle géante (Tutufa bubo) consomme une Linckia multifora. Un casque rouge (Cypraecassis rufa), échoué sur la plage.
Un casque rouge (Cypraecassis rufa), échoué sur la plage. Deux coquilles de Malea pomum échouées sur une plage aux Maldives.
Deux coquilles de Malea pomum échouées sur une plage aux Maldives. Une coquille de Distorsio anus, échoué sur la plage.
Une coquille de Distorsio anus, échoué sur la plage. Un Monoplex aquatilis échoué sur la plage.
Un Monoplex aquatilis échoué sur la plage. Un vermet Ceraesignum maximum
Un vermet Ceraesignum maximum Un vermet Thylacodes grandis
Un vermet Thylacodes grandis
- Autres Caenogastropoda
La faune sous-marine de l'atoll de BaaLes comprend aussi des Caenogastropoda non assignés.
- Les cônes
La famille des Conidae comprend 145 genres validés qui regroupent plus de 2 300 espèces. Comme leur nom l’indique, ces gastéropodes possèdent une coquille conique dont l’aspect ainsi que les couleurs sont très variables. La grande majorité se trouve dans les mers chaudes, mais on en rencontre aussi dans des eaux tempérées[81]. Ils sont le plus souvent nocturnes, et tous sont carnivores et venimeux. Certains se nourrissent de vers, d’autres de mollusques et/ou de poissons. Les cônes piscivores peuvent mettre en danger la vie d'un humain[82] (notamment Conus geographus, C. textile, C.tulipa, C.aulicus et C. striatus)[83].
 Un groupe de cônes ponctués (Conus arenatus), échoués sur la plage.
Un groupe de cônes ponctués (Conus arenatus), échoués sur la plage. Un cône princier (Conus aulicus)
Un cône princier (Conus aulicus) Un cône (Conus sp., peut-être Conus bandanus)
Un cône (Conus sp., peut-être Conus bandanus) Un cône hébraïque (Conus ebraeus)
Un cône hébraïque (Conus ebraeus) Un cône ivoire (Conus eburneus), échoué sur la plage.
Un cône ivoire (Conus eburneus), échoué sur la plage. Une coquille de Conus lithoglyphus échouée sur une plage.
Une coquille de Conus lithoglyphus échouée sur une plage. Un cône livide (Conus lividus), échoué sur la plage.
Un cône livide (Conus lividus), échoué sur la plage. Un cône magnifique (Conus magnificus), échoué sur la plage.
Un cône magnifique (Conus magnificus), échoué sur la plage. Un cône soldat (Conus miles)
Un cône soldat (Conus miles) Un cône non identifié (conus sp.)
Un cône non identifié (conus sp.) Un cône non identifié (Conus sp., peut-être conus vexillum), échoué sur la plage.
Un cône non identifié (Conus sp., peut-être conus vexillum), échoué sur la plage. Un cône non identifié (Conus sp., peut-être Conus violaceus) échoué sur la plage.
Un cône non identifié (Conus sp., peut-être Conus violaceus) échoué sur la plage.
- Les murex
La famille des Muricidae, avec plus de 180 genres[84] et plus de 1 500 espèces[85], est une des plus grandes familles de gastéropodes marins. Les coquilles sont de forme et de taille très diverses. Leur forme fortement sculptée montre dans de nombreuses espèces des varices et des expansions formant des frondes, d’autres sont plus discrètes. La majorité des espèces se trouve dans les eaux tropicales et tempérées, mais certaines peuvent vivre jusque dans les eaux polaires[86]. Les murex sont carnivores, ils se nourrissent de gastéropodes et de bivalves dont ils percent la coquille avec leur radula, de bernacles et de vers marins[87].

 Chicoreus sp.
Chicoreus sp. Un coquillage des coraux (Coralliophila neritoidea)
Un coquillage des coraux (Coralliophila neritoidea) Drupa ricinus échoué sur la plage.
Drupa ricinus échoué sur la plage. Vasum ceramicum
Vasum ceramicum Un gastéropode non identifié (peut-être Vasum sp.)
Un gastéropode non identifié (peut-être Vasum sp.)
- Membres d’autres groupes
 Pollia fumosa
Pollia fumosa Une conque tulipe filamenteuse (Filifusus filamentosus)
Une conque tulipe filamenteuse (Filifusus filamentosus) Une vis tachetée (Oxymeris maculata)
Une vis tachetée (Oxymeris maculata) Terebra sp., échoué sur la plage.
Terebra sp., échoué sur la plage. Une mitre géante (Mitra mitra)
Une mitre géante (Mitra mitra) Une coriocelle des Maldives (Coriocella hibyae, espèce endémique)
Une coriocelle des Maldives (Coriocella hibyae, espèce endémique) Une troque (Tectus sp.), échoué sur la plage.
Une troque (Tectus sp.), échoué sur la plage. Une troque (Tectus sp.), échoué sur la plage.
Une troque (Tectus sp.), échoué sur la plage. Une troque Trochus maculatus
Une troque Trochus maculatus Trochus radiatus
Trochus radiatus Un turban à bouche d'argent (Turbo argyrostomus)
Un turban à bouche d'argent (Turbo argyrostomus) Un turban tapissé (Turbo petholatus)
Un turban tapissé (Turbo petholatus) Une coquille de gastéropode non identifié de la famille des Architectonicidae, échoué sur une plage.
Une coquille de gastéropode non identifié de la famille des Architectonicidae, échoué sur une plage. Un gastéropode non identifié de la famille des Cerithiidae (peut-être Cerithium sp.).
Un gastéropode non identifié de la famille des Cerithiidae (peut-être Cerithium sp.).
Limaces de mer
Les limaces de mer ne sont pas les cousines marines des limaces terrestres. Elles forment le groupe des Opistobranches, caractérisé notamment par la position des branchies en arrière du cœur (le mot grec « opisthos » signifie postérieur). Ce groupe contient cinq ordres principaux (Cephalaspidea, Sacoglossa, Anaspidea, Notaspidea et Nudibranchia), le dernier regroupant le plus grand nombre d’espèces[88], dont beaucoup sont présentes à La Réunion[89]. Certaines, comme la danseuse espagnole, peuvent nager par ondulations des bords du manteau. Les aplysies, de l’ordre des Anaspidea, portent le nom vernaculaire de « lièvres de mer » en raison de leurs rhinophores érigés qui font penser à des oreilles de lapin. Elles peuvent nager au moyen des expansions latérales du manteau[90]. La majorité des Opisthobranches sont carnivores, les éponges étant la proie élective de nombreuses espèces.
- « Lièvres de mer (Anaspidea, famille des Aplysiidae) »
- Nudibranches
 Un dendrodoris noir (Dendrodoris nigra)
Un dendrodoris noir (Dendrodoris nigra)

 Une phyllidie verruqueuse (Phyllidia varicosa)
Une phyllidie verruqueuse (Phyllidia varicosa) Une phyllidie rose (Phyllidiella rosans)
Une phyllidie rose (Phyllidiella rosans) Un tambja à lignes orange (Tambja affinis)
Un tambja à lignes orange (Tambja affinis) Un tambja morose (Tambja morosa)
Un tambja morose (Tambja morosa)
- Autres Opisthobranches
 Une coquille de Bulla sp., échouée sur la plage.
Une coquille de Bulla sp., échouée sur la plage.
Céphalopodes
La classe des Céphalopodes (du grec « képhalé », tête, et « pous, podos », pied) comprend des animaux strictement marins dont le corps est composé d’un manteau en partie antérieure duquel se trouve une tête armée de huit ou dix bras (huit pour les poulpes, dix pour calmars et seiches), exception faite des nautiles, qui en possèdent environ 90[91]. Les bras, très musculeux et munis de ventouses puissantes, rayonnent à partir de la bouche. Celle-ci possède des mandibules cornées en forme de bec de perroquet derrière lesquelles se trouve une radula. Les yeux et le système nerveux sont extrêmement développés. La coquille est soit modifiée à l’intérieur du manteau (la « plume » des calmars et « l’os » des seiches) soit absente, comme chez les poulpes. Un entonnoir orientable placé à l’ouverture de la cavité palléale permet la respiration, l’élimination des déchets et la propulsion au moyen de contractions[92]. Les nautiles sont les seuls céphalopodes à avoir une coquille externe et des bras sans ventouses[93].
 Un poulpe de récifs commun (Octopus cyanea)
Un poulpe de récifs commun (Octopus cyanea) Une seiche (Sepia latimanus)
Une seiche (Sepia latimanus) Un jeune calmar de récifs (Sepioteuthis lessoniana)
Un jeune calmar de récifs (Sepioteuthis lessoniana) Une coquille de spirule (Spirula spirula)
Une coquille de spirule (Spirula spirula)
Bivalves
Les bivalves sont une classe de mollusques de mer et d'eau douce caractérisée par une coquille divisée en deux parties (les valves) plus ou moins symétriques et articulées. Ils possèdent un pied puissant quand ils sont fouisseurs, mais les espèces fixées développent une touffe de fibres appelée byssus, qui leur permet de s’ancrer sur un substrat dur. Ce sont majoritairement des animaux filtreurs qui se nourrissent des particules organiques en suspension dans l’eau[94], même si certains comme les bénitiers sont capables de photosynthèse grâce à des algues symbiotiques, comme les coraux. Les fouisseurs disposent d’un siphon qui leur permet de se nourrir alors qu’ils sont cachés dans le sédiment. Les bivalves sont les seuls mollusques à n’avoir pas de tête différenciée, mais certains possèdent quand même des « yeux » photorécepteurs[95].
 Une huître alvéolée (Hyotissa hyotis)
Une huître alvéolée (Hyotissa hyotis) Un bénitier Tridacna maxima
Un bénitier Tridacna maxima Un bénitier géant (Tridacna gigas)
Un bénitier géant (Tridacna gigas) Un bénitier gaufré (Tridacna squamosa)
Un bénitier gaufré (Tridacna squamosa) Un bénitier (Tridacna sp.)
Un bénitier (Tridacna sp.) Des huîtres aile de pingouin (Pteria penguin)
Des huîtres aile de pingouin (Pteria penguin)
 Un spondyle variable (Spondylus varius)
Un spondyle variable (Spondylus varius) Une valve de Spondylus sp.
Une valve de Spondylus sp. Une valve de Spondylus sp.
Une valve de Spondylus sp. Une valve de Spondylus sp.
Une valve de Spondylus sp. Une nacre (Pinna sp.)
Une nacre (Pinna sp.) Une huître corallicole (Pedum spondyloideum)
Une huître corallicole (Pedum spondyloideum) Une colonie d'huîtres non identifiées sur un ponton
Une colonie d'huîtres non identifiées sur un ponton Un bivalve non identifié recouvert par une éponge sans doute symbiotique.
Un bivalve non identifié recouvert par une éponge sans doute symbiotique. Un bivalve non identifié trouvé dans un massif de corail Pocillopora
Un bivalve non identifié trouvé dans un massif de corail Pocillopora
Crustacés
Les crustacés sont des arthropodes (animaux à pattes articulées) marins recouverts d’un exosquelette chitineux (la carapace, pour ce qui concerne la partie céphalo-thoracique), ce pourquoi leur croissance impose des mues. On estime leur nombre total entre 65 000 et 80 000 espèces, qui sont le plus souvent marines[96]. Leur taille adulte peut aller de 0,2 mm pour le plus petit des copépodes planctoniques[97] à une taille de carapace de plus de 40 cm[98] pour le Crabe de cocotier. La majorité est carnivore et/ou nécrophage. Ils jouent un rôle important dans les écosystèmes récifaux[99].
Crabes
Les « vrais crabes » sont des crustacés décapodes (à dix pattes), essentiellement représentés par l’infra-ordre des Brachyura. Leur première paire de pattes est modifiée pour porter des pinces à fonction de préhension, de défense et de communication. Ces pinces, de taille et de morphologie très variable, peuvent être dissymétriques. Certains sont capables de nager grâce à une dernière paire de pattes adaptée. Un certain nombre d’espèces vit en association avec d’autres organismes, soit pour se camoufler (éponges, algues, gorgones, etc.) ou se défendre (anémones), soit dans le cadre d’une relation symbiotique, comme les Trapeziidae avec les coraux Pocillopora, soit en parasite, comme le crabe Hapalocarcinus marsupialis (famille des Cryptochiridae), dont la femelle forme des galles dans les mêmes coraux, et trouve protection dans cette prison à vie[99].
 Un crabe trapézie (Trapezia bidentata) dissimulé dans une colonie d'Acropora
Un crabe trapézie (Trapezia bidentata) dissimulé dans une colonie d'Acropora Trapezia rufopunctata dans un Pocillopora
Trapezia rufopunctata dans un Pocillopora Percnon guinotae
Percnon guinotae Un crabe-fantôme (Ocypode pallidula)
Un crabe-fantôme (Ocypode pallidula) Grapsus albolineatus
Grapsus albolineatus
 Un crabe splendide (Etisus splendidus)
Un crabe splendide (Etisus splendidus) Pseudoliomera speciosa
Pseudoliomera speciosa Un petit Cymo quadrilobatus
Un petit Cymo quadrilobatus_Landaagiraavaru.JPG.webp) Un crabe araignée de la famille des Majoidea (peut-être Cyclocoeloma tuberculata)
Un crabe araignée de la famille des Majoidea (peut-être Cyclocoeloma tuberculata).JPG.webp) Un crabe araignée de la famille des Majoidea (peut-être Naxioides taurus)
Un crabe araignée de la famille des Majoidea (peut-être Naxioides taurus) Un crabe porcelaine (Neopetrolisthes maculatus)
Un crabe porcelaine (Neopetrolisthes maculatus)
Pagures
Les pagures, ou bernard-l’ermite, habitent en permanence dans une coquille vide de gastéropode qu’ils abandonnent pour une autre plus grande quand leur croissance l’exige. Leur abdomen, mou et asymétrique, est spiralé pour pouvoir se loger dans les coquilles. La nécessité et le danger de changer de coquille provoquent un comportement social appelé « chaîne de vacances » : de nombreux pagures de taille différente se réunissent autour d’une coquille vide adaptée à la croissance du plus gros d’entre eux, et chacun passe ensuite dans la coquille de l’autre, la plus petite restant vide[100]. Plusieurs espèces sont en association symbiotique avec des anémones.
 Un bernard-l’ermite Aniculus ursus
Un bernard-l’ermite Aniculus ursus Un bernard-l'ermite des récifs (Dardanus lagopodes)
Un bernard-l'ermite des récifs (Dardanus lagopodes) Un bernard-l'ermite à points blancs (Dardanus megistos)
Un bernard-l'ermite à points blancs (Dardanus megistos) Un bernard-l'ermite terrestre (Coenobita rugosus)
Un bernard-l'ermite terrestre (Coenobita rugosus)
Squilles, langoustes et cigales de mer
Les squilles font partie de l’ordre des Stomatopoda. Le terme, qui vient du grec « stóma », bouche, et « pous, podos », pied, est justifié par les cinq premières paires d’appendices thoraciques, qui servent chez eux de « pattes mâchoires »[101], les trois dernières paires de pattes étant seules locomotrices. La deuxième paire distingue deux groupes fonctionnels, les squilles aux pattes ravisseuses, armées de dents longues et aigues, et celles dont la base du dernier segment est une sorte de massue[102]. La vitesse de frappe de cette paire de pattes est telle (elle peut atteindre 23 m/s[103]) qu’elle produit une détonation et des bulles par cavitation au contact de la proie[104], capable de briser une paroi d’aquarium. La vision des squilles est une des plus élaborées du règne animal[105]. Les cigales de mer appartiennent à la famille des Scyllaridae, elles sont caractérisées par l’absence de pinces, une morphologie aplatie et de courtes antennes composées de plusieurs articles en feuillets. Les langoustes sont des décapodes sans pinces appartenant pour l’essentiel à la famille des Palinuridae. Leur pêche est particulièrement facile, ce qui en fait les proies d'un braconnage intense. Squilles et langoustes sont présentes dans les eaux des Maldives mais elles sont rarement visibles, les premières parce qu’elles sont discrètes, les secondes parce qu’elles ne sortent de leur abri que la nuit (mais on aperçoit souvent les antennes sortant du trou pendant la journée).
 Une langouste à pattes rayées (Panulirus femoristriga)
Une langouste à pattes rayées (Panulirus femoristriga) Des langoustes bleues (Panulirus versicolor)
Des langoustes bleues (Panulirus versicolor) Une cigale de mer savate (Parribacus antarcticus)
Une cigale de mer savate (Parribacus antarcticus)
Crevettes
La majorité des « vraies crevettes » est regroupée dans l’infra-ordre des Caridea, le plus grand nombre d’espèces étant marines. Elles sont caractérisées par un corps long et hydrodynamique équipé d’appendices natatoires biramés sous l’abdomen (ce qui leur permet de nager), par de petites pinces au bout des deux premières paires de pattes (et de la troisième paire chez les Stenopodidae) et généralement par un rostre denticulé à l’extrémité du céphalothorax[106]. La plupart des crevettes sont carnivores, détritivores ou omnivores, mais certaines, dont les pinces sont remplacées par des soies en éventail, sont filtreuses. De nombreuses espèces vivent en association avec des coraux dont beaucoup sont dépendantes (hôtes obligatoires)[99]. Elles peuvent aussi être associées à des poissons (gobies), des anémones, des bivalves, des éponges, des oursins et même des vers polychètes comme le ver de feu[99].
 Une crevette danseuse aux yeux verts (Cinetorhynchus reticulatus)
Une crevette danseuse aux yeux verts (Cinetorhynchus reticulatus) Une grande crevette nettoyeuse (Stenopus hispidus)
Une grande crevette nettoyeuse (Stenopus hispidus) Un couple de crevettes Alpheus lottini séparées de leur corail symbiotique Pocillopora
Un couple de crevettes Alpheus lottini séparées de leur corail symbiotique Pocillopora Une crevette marbrée (Saron inermis femelle)
Une crevette marbrée (Saron inermis femelle) Une crevette des astérides ou "petite sœur des étoiles" (Periclimenes soror) sur une étoile-coussin Culcita schmideliana
Une crevette des astérides ou "petite sœur des étoiles" (Periclimenes soror) sur une étoile-coussin Culcita schmideliana Une crevette Harpiliopsis beaupresii
Une crevette Harpiliopsis beaupresii Une crevette sexy (Thor amboinensis)
Une crevette sexy (Thor amboinensis) Une crevette transparente du genre Cuapetes
Une crevette transparente du genre Cuapetes Une crevette de la famille des Alpheidae (peut-être Synalpheus tumidomanus)
Une crevette de la famille des Alpheidae (peut-être Synalpheus tumidomanus) Une crevette non identifiée
Une crevette non identifiée Une crevette non identifiée
Une crevette non identifiée Du krill déposé sur une plage.
Du krill déposé sur une plage.
Autres types de crustacés
 Un crabe-taupe (Hippa granulatus, groupe des Hippoidea)
Un crabe-taupe (Hippa granulatus, groupe des Hippoidea) Des anatifes (Lepas sp., groupe des Cirripedia)
Des anatifes (Lepas sp., groupe des Cirripedia)
Vers marins
Les vers marins se répartissent en huit embranchements : les Annélides, les Plathelminthes, les Sipunculiens, les Némertes, les Acanthocéphales, les Phoronidiens, les Nématodes et les Nématophores. Ces embranchements ne manifestent pas de liens de parenté directs[107]. Le plan d’organisation qui fait leur unité se situe dans la structure et le développement des embryons[108]. Ils ne sont pas nécessairement « vermiformes ».
Vers polychètes
Les polychètes (sous-ordre des Polychaeta, du grec « poly », plusieurs, et « chet- », soies) sont des vers annélides segmentés très majoritairement marins. Ils comprennent environ 10 000 espèces[109]. Ils ont une tête différenciée porteuse de mâchoires qui apparaissent quand le pharynx est dévaginé[110]. Chaque segment du corps porte des parapodes qui leur permettent de marcher rapidement, et à l’occasion de nager[111]. Ces parapodes sont équipés de soies chitineuses, qui sont urticantes chez certaines espèces. Ils peuvent être fixés (vers tubicoles) ou errants, soit sur le fond, soit en pleine eau. Les vers fixés sont microphages et capturent les particules alimentaires contenues dans l’eau au moyen d’appendices ramifiés divers, les errants sont carnivores[112]. Leur taille peut aller de quelques dixièmes de millimètres[110] à trois mètres (Eunice aphroditois[113]).
 Un groupe de vers "arbre de Noël" (Spirobranchus giganteus) dans une colonie de corail du genre Porites.
Un groupe de vers "arbre de Noël" (Spirobranchus giganteus) dans une colonie de corail du genre Porites. Une sabelle (Sabellastarte sp.)
Une sabelle (Sabellastarte sp.) Un ver Lanice sp.
Un ver Lanice sp. Deux vers polychètes de la famille des Polynoidae présents sur une holothurie Thelenota anax, comme parasites ou symbiotes.
Deux vers polychètes de la famille des Polynoidae présents sur une holothurie Thelenota anax, comme parasites ou symbiotes.
Vers plathelminthes
Les plathelminthes (du grec « platus », plat et « helmins », ver) sont des vers plats dont de nombreuses espèces sont des parasites[114]. Les vers les plus connus de la classe des Turbellaria (vers plats non exclusivement parasites) sont les planaires, vers libres, nageurs ou rampants, dont l’épaisseur du corps peut mesurer moins d’un millimètre[115]. Elles peuvent se reproduire de façon sexuée (les planaires sont hermaphrodites, la reproduction est croisée) ou par scissiparité. Leur corps étant extrêmement fragile, elles sont capables de régénérer une de ses parties amputées, y compris la tête, qui contient un réseau organisé de neurones[116]. Ce sont des êtres complexes, qui sont capables d’apprentissage et donc de mémoire, les contenus mémorisés restant intacts après décapitation et régénération de la tête[117].
 Un ver plat Pseudobiceros bedfordi
Un ver plat Pseudobiceros bedfordi Un ver plat Pseudoceros sp. 32[118]
Un ver plat Pseudoceros sp. 32[118] Un ver plat du genre Pseudobiceros
Un ver plat du genre Pseudobiceros Un ver plat de Suzane (Pseudoceros susanae)
Un ver plat de Suzane (Pseudoceros susanae)
Autres types de vers
 Un ver échiurien (Achaetobonellia maculata).
Un ver échiurien (Achaetobonellia maculata).
Cnidaires
L’embranchement des cnidaires (du grec knidê, ortie de mer) regroupe les anémones de mer, les méduses et les coraux. Ils comprennent des formes fixées (corail, anémones de mer), et des formes libres (méduses, siphonophores...). Ils possèdent tous des cellules urticantes, les cnidoblastes (cellules spécialisées comportant un appareil venimeux muni d’une sorte de harpon) à usage défensif ou de prédation[119]. Leur symétrie est radiaire (d’ordre 4 ou 6, ce qui détermine notamment le nombre des tentacules) et se distribue autour d’un orifice central, à la fois bouche et anus. Ils sont tous carnivores. Les coraux chassent le zooplancton la nuit en utilisant leurs cnidoblastes[120], les anémones et les méduses capturent de petits animaux (des poissons, des crustacés, des vers, etc.) en pleine eau au moyen de leurs filaments.
À l’échelle mondiale, les coraux, qui représentent moins de 0,15 % de la surface des océans, abritent cependant plus du quart de la biodiversité marine[121]. Les coraux durs du genre Acropora dominent les récifs des Maldives, mais la diversité spécifique demeure très importante, et de nombreux autres genres cohabitent, ainsi que des coraux « mous », « noirs » ou « bleus ». Les méduses et les anémones de mer sont beaucoup moins nombreuses dans les lagons.
Coraux
Les coraux sont des scléractiniaires caractérisés par un squelette calcaire protégeant un polype. Ils comprennent des espèces coloniales et des espèces solitaires. Les espèces coloniales, constructrices des récifs, vivent en symbiose avec des algues unicellulaires (« zooxanthelles »[122]) qui assurent par photosynthèse une grande partie de la nourriture des polypes hôtes et leur fournissent de l’oxygène[123]. Ce pourquoi la vie des coraux est dépendante de la lumière : ils ne peuvent pas vivre au-delà de 50 m de profondeur[124], sauf pour les espèces ne dépendant pas de ces algues. Les algues photosynthétiques donnent aussi leurs couleurs aux coraux : le Blanchissement des coraux provient de leur expulsion, qui peut être due à une augmentation de la température de l’eau ou à la pollution, le recouvrement par des sédiments terrigènes, etc. Si les zooxanthelles ne peuvent pas revenir dans les coraux assez rapidement, ils meurent[125]. En 1998, les Maldives ont été particulièrement touchées par le grand phénomène de blanchissement des coraux qui toucha tout l'océan Indien : les séquelles en sont encore visibles, mais la repousse fut relativement importante comparé à d'autres régions.



























 Acropora valencianesi
Acropora valencianesi

 Pachyseris sp.
Pachyseris sp.
 Une colonie de corail Turbinaria
Une colonie de corail Turbinaria Une colonie de corail Lobophyllia sp.
Une colonie de corail Lobophyllia sp.



 Une colonie de corail de la famille des Faviidae
Une colonie de corail de la famille des Faviidae Corail-cerveau (Platygyra sinensis)
Corail-cerveau (Platygyra sinensis) Corail verruqueux (Pocillopora damicornis)
Corail verruqueux (Pocillopora damicornis)

 Goniopora sp.
Goniopora sp.

 Corail champignon (Fungia fungites)
Corail champignon (Fungia fungites)
 Une colonie de corail à bulles (Plerogyra sinuosa)
Une colonie de corail à bulles (Plerogyra sinuosa) Corail bleu (Heliopora coerulea)
Corail bleu (Heliopora coerulea) Une gorgone éventail (Annella mollis)
Une gorgone éventail (Annella mollis) Une colonie de corail Astrogorgia sp.
Une colonie de corail Astrogorgia sp. Une gorgone réticulée (Melithaea variabilis)
Une gorgone réticulée (Melithaea variabilis) Une colonie de gorgone Melithaea sp.
Une colonie de gorgone Melithaea sp. Une colonie de corail Siphonogorgia sp.
Une colonie de corail Siphonogorgia sp. Une colonie de corail Siphonogorgia sp.
Une colonie de corail Siphonogorgia sp. Une colonie de corail Dendronephthya sp.
Une colonie de corail Dendronephthya sp. Une colonie de corail Dendronephthya sp.
Une colonie de corail Dendronephthya sp. Une colonie de corail Scleronephthya sp.
Une colonie de corail Scleronephthya sp. Une colonie de corail rose Cladopsammia gracilis
Une colonie de corail rose Cladopsammia gracilis Une colonie de corail Tubastraea faulkneri
Une colonie de corail Tubastraea faulkneri Une colonie de tubastrée verte (Tubastraea micranthus)
Une colonie de tubastrée verte (Tubastraea micranthus) Une colonie de corail-flambeau (Euphyllia glabrescens)
Une colonie de corail-flambeau (Euphyllia glabrescens) Un corail noir « virgulaire » (Cirrhipathes sp.)
Un corail noir « virgulaire » (Cirrhipathes sp.) Une colonie de corail Lobophytum sp.
Une colonie de corail Lobophytum sp. Lobophytum sp.
Lobophytum sp. Lobophytum sp.
Lobophytum sp. Corail mou (ou « corail cuir », Sarcophyton sp.)
Corail mou (ou « corail cuir », Sarcophyton sp.) Sarcophyton sp.
Sarcophyton sp. Une pennatule
Une pennatule
Hydrozoaires
La classe des hydrozoaires comprend des animaux fixés ou libres, généralement coloniaux. Pour en rester à ceux qu’on peut observer dans les lagons de La Réunion, certains produisent un squelette calcaire, comme les « coraux de feu », d’autres passent leur vie en pleine eau, comme les méduses, d’autres encore sont des colonies de milliers de polypes organisés en quatre spécialisations, comme le siphonophore qu’est la physalie. La plupart sont munies de cnidoblastes très urticantes pour l’homme : les espèces les mieux armées provoquent des douleurs violentes, et certaines comme la physalie sont potentiellement dangereuses[126].
 Une méduse Cephea cephea
Une méduse Cephea cephea Une méduse Thysanostoma loriferum
Une méduse Thysanostoma loriferum Une colonie de corail de feu en plaques (Millepora platyphylla)
Une colonie de corail de feu en plaques (Millepora platyphylla) Une colonie d'hydraires du genre Zygophylax
Une colonie d'hydraires du genre Zygophylax Une colonie d'hydraire du groupe des Plumularioidea
Une colonie d'hydraire du groupe des Plumularioidea Une colonie d'hydraire non identifié.
Une colonie d'hydraire non identifié.
Anémones
Les anémones de mer font partie de la classe des Anthozoa (du grec « anthos », fleur, et « zoon », animal) qui présentent une symétrie d’ordre six, ou un multiple de six. Leurs tentacules peuvent être très nombreux, jusqu’à près de 200[127]. Outre leurs cnidoblastes, certaines espèces peuvent projeter des filaments urticants (les aconties). Elles sont solitaires ou coloniales[128] et se fixent au substrat au moyen d’une ventouse, mais elles peuvent se déplacer si nécessaire. De nombreuses espèces hébergent des zooxanthelles. Dix espèces[129] sont en association symbiotique avec des espèces de poisson-clown, protégées de leur venin par un mucus[130] : le poisson-clown Amphiprion nigripes, endémique des Maldives, vit ainsi en symbiose avec l'anémone Heteractis magnifica. D’autres anémones le sont avec des pagures[131], et le « crabe-boxeur » Lybia tessellata en agite deux au bout de ses pinces dès qu’il est inquiété.
 Une anémone collier de perles (Heteractis aurora)
Une anémone collier de perles (Heteractis aurora) Anémone magnifique (Heteractis magnifica)
Anémone magnifique (Heteractis magnifica) Une anémone du feu de l'enfer (Actinodendron arboreum)
Une anémone du feu de l'enfer (Actinodendron arboreum) Une anémone adhésive (Cryptodendrum adhaesivum)
Une anémone adhésive (Cryptodendrum adhaesivum) Une anémone du genre Boloceroides
Une anémone du genre Boloceroides
Autres cnidaires hexacoralliaires
 Une anémone (Corallimorphe) oreille d'éléphant, autres cnidaires hexacoralliaires (Amplexidiscus fenestrafer)
Une anémone (Corallimorphe) oreille d'éléphant, autres cnidaires hexacoralliaires (Amplexidiscus fenestrafer) Une zoanthide encroûtante (Palythoa caesia)
Une zoanthide encroûtante (Palythoa caesia) Une zoanthide (Zoanthus mantoni)
Une zoanthide (Zoanthus mantoni)
Éponges
Les spongiaires (éponges) sont regroupés dans l’embranchement des Porifera (du latin « porus », trou, et « ferre », porter). L’absence de système nerveux qui les caractérise les fait souvent prendre pour des algues ou des végétaux. Elles peuvent avoir des formes, des couleurs et des tailles très diverses. Leur rigidité est due à la présence de millions d'ossicules calcaires ou siliceux indépendants présents sous le derme (les spicules), mais certaines espèces les remplacent par des fibres de spongine[132]. Elles respirent et se nourrissent en filtrant de grandes quantités d’eau au moyen d’une multitude de pores inhalants et d’un pore exhalant, appelé oscule. Une éponge carnivore a cependant été découverte en 1992[133]. Les éponges se reproduisent par voie sexuée ou par bourgeonnement[134]. Le contact avec certaines espèces peut provoquer des irritations ou des brûlures. Chez de nombreuses éponges, la variabilité morphologique est telle que la détermination de l’espèce ne peut se faire qu’à l’issue d’un examen microscopique des spicules : l'identification par photographie est donc souvent très délicate. En conséquence, ce chapitre illustre des formes observables, mais la détermination précise de l'espèce n'a pas toujours été possible.
 Dysidea granulosa
Dysidea granulosa Haliclona nematifera
Haliclona nematifera Une éponge lobée jaune (Leucetta chagosensis)
Une éponge lobée jaune (Leucetta chagosensis) Lamellodysidea herbacea?
Lamellodysidea herbacea? Monanchora unguiculata
Monanchora unguiculata Carteriospongia cf. foliascens
Carteriospongia cf. foliascens Acarnus sp.
Acarnus sp. Une éponge non identifiée
Une éponge non identifiée Une éponge non identifiée
Une éponge non identifiée Une éponge non identifiée
Une éponge non identifiée Une éponge non identifiée
Une éponge non identifiée Une éponge non identifiée
Une éponge non identifiée
Notes et références
- (en) Paul S. Kench et al., « The geomorphology of Baa (south Maalhosmadulu) atoll and its reef islands », dans Andréfoüet, Biodiversity, resources, and conservation of Baa atoll (Republic of Maldives) : a UNESCO Man and Biosphere Reserve, Washington DC, Atoll Research Bulletin, (ISSN 0077-5630, lire en ligne).
- (en) Ministry of Tourism, Tourism Yearbook 2014, Statistics & Research Section, .
- (en) « Baa Atoll, Maldives: UNESCO World Biosphere Reserve », sur visitmaldives.com.
- (en) Frédéric Ducarme, « Field observations of sea cucumbers in Ari Atoll, and comparison with two nearby atolls in Maldives », SPC Bêche-de-mer Information Bulletin, vol. 36, (lire en ligne).
- Guillaume Lecointre, Cyril Gallut, Bruno Chanet et Agnès Dettaï, « Évolution : du rififi chez les poissons », Pour la Science, no 390, (lire en ligne).
- (en) R.W. Wilson et al., « Contribution of fish to the marine inorganic carbon cycle », Science, vol. 323, no 359, (DOI 10.1126/science.1157972, lire en ligne).
- Informations lexicographiques et étymologiques de « Raie » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- (en) « The Manta Trust », sur Marinesavers.com.
- (en) « Manta Trust - Maldives », sur http://www.mantatrust.org.
- « Teleostei », sur ITIS.
- (en) « Order Summary for Lophiiformes », sur FishBase.
- (en) « Family Mugilidae », sur http://newfoundpress.utk.edu..
- (en) « Beloniformes », sur FishBase.
- (en) « Beryciformes », sur FishBase.
- (en) « Beryx decadactylus », sur FishBase.
- (en) « beryciformes », sur encyclopedia.com.
- (en) « Syngnathiformes », sur FishBase.
- (en) « Scorpaeniformes », sur FishBase.
- Bernard Le Garff, « Les Poissons », sur le site de l'université Rennes-1.
- (en) « Perciformes », sur FishBase.
- (en) « Perciformes », sur http://newfoundpress.utk.edu.
- (en) Froese, R. and D. Pauly, « Epinephelinae », sur World Register of Marine Species.
- WoRMS (2013), Chaetodontidae. In: Froese, R. and D. Pauly. Editors. (2013) FishBase, via World Register of Marine Species (lien)
- « Famille Chaetodontidae », sur aquasystematique.com.
- (en) Philip Jay Motta, « Tooth attachment, replacement and growth in the butterfly fish, Chaetodon miliaris, (Chaetodontidae, Perciformes) », Can. J. Zool., vol. 62, , p. 183-189 (lire en ligne).
- (en) Michel Kulbicki et Y.M. Bozec, « The use of butterflyfish (Chaetodontidae) species richness as a proxy of total species richness of reef fish assemblages in the Western and Central Pacific », Aquatic Conservation: Marine and Freshwater Ecosystems, vol. 15, , p. 127-141 (lire en ligne).
- WoRMS (2013) : Pomacanthidae, In: Froese, R. and D. Pauly. Editors. (2013) FishBase, through World Register of Marine Species (lire en ligne).
- (en) « Family Pomacanthidae - Angelfishes », sur FishBase.
- « Aire de parade », sur babylon.com.
- Michel Kulbicki, « Les Chaetodons et les Pomacanthidae », sur com.univ-mrs.fr.
- Cirrhitidae, dans Froese, R. and D. Pauly (Editors), 2013, FishBase via World Register of Marine Species.
- (en) « Family Cirrhitidae - Hawkfishes », sur FishBase.
- (en) Tatsuru Kadota, Jun Osato, Hiroaki Hashimoto et Yoichi Sakai, « Harem structure and female territoriality in the dwarf hawkfish Cirrhitichthys falco (Cirrhitidae) », Environmental Biology of Fishes, vol. 92, no 1, , p. 79-88 (lire en ligne).
- (en) « Family Pomacentridae - Damselfishes », sur FishBase.
- (en) « Pomacentridae Damselfishes », sur animaldiversity.ummz.umich.edu.
- Sophie Jugant, « Importance des récifs coralliens pour les poissons récifaux : exemple des Demoiselles (Pomacentridae), dans l’archipel des Maldives. », Thèse d'exercice, Médecine vétérinaire, Ecole Nationale Vétérinaire de Toulouse, , p. 142 (lire en ligne).
- « POISSON-CLOWN BISTRÉ », sur ifrecor.nc.
- (en) « Family Labridae - Wrasses », sur FishBase.
- « Labre », sur le Trésor de la Langue Française.
- (en) Yvonne Sadovy De Mitcheson et Min Liu, « Functional hermaphroditism in teleosts », Fish and fisheries, vol. 9, no 1, , p. 1-43 (DOI 10.1111/j.1467-2979.2007.00266.x, lire en ligne).
- « Labroides dimidiatus (Valenciennes, 1839) », sur DORIS, .
- (en) « Family Scaridae - Parrotfishes », sur FishBase.
- (en) Daniel M. Russell, « Parrotfish and sand production (part 2) », sur searchresearch1.blogspot.fr.
- (en) Hawaii Cooperative Fishery Research Unit, « Biology of parrotfishes in Hawaii », Report prepared for the Western Pacific Regional Fishery Management Council, (lire en ligne).
- (en) E. Lieske et R. Myers, Coral Reef Fishes : 2nd edition, Princeton University Press, .
- Mariyam Malsa, « Maldives adds Parrotfish to list of protected species », sur edition.mv,
- (en) « Family Blenniidae - Combtooth blennies », sur FishBase.
- (en) « Blennidae - Habitat », sur Encyclopedia of Life.
- (en) « Blennidae - Details », sur Encyclopedia of Life.
- (en) « Blennidae - Reproduction », sur Encyclopedia of Life.
- (en) « Family Gobiidae - Gobies », sur FishBase.
- (en) « Gobiidae », sur ftp.fao.org.
- (en) J. Lynn Preston, « Communication systems and social interactions in a goby-shrimp symbiosis », Animal Behaviour, vol. 26, , p. 791 -802 (lire en ligne).
- (en) Elizabeth A. Whiteman et Isabelle M. Côté, « Sex differences in cleaning behaviour and diet of a Caribbean cleaning goby », Journal of the Marine Biological Association of the UK, vol. 82, no 4, , p. 655-664 (lire en ligne).
- (en) « Family Acanthuridae - Surgeonfishes, tangs, unicornfishes », sur FishBase.
- (en) Francesco Santini, « A multi-locus timetree of surgeonfishes (Acanthuridae, Percomorpha), with revised family taxonomy », Molecul arPhylo genetics and Evolution, vol. 68, (lire en ligne).
- (en) « Acanthuridae : Surgeonfishes, tangs, unicornfishes », sur Animal Diversity Web.
- (en) « Tetraodontiformes », sur FishBase.
- Bernard Seret, « Poissons de mer de l'ouest africain tropical », sur www.aprapam.org.
- (en) Frédéric Ducarme, « Field observations of sea cucumbers in the north of Baa atoll, Maldives », SPC Beche de Mer Information Bulletin, vol. 35, , p. 26–31 (lire en ligne).
- (en) Christopher Mah, « How many starfish species are there ? Where do they Live ? How long have they been around ? Five Points about Sea Star Diversity », sur The Echinoblog, .
- (en) Christopher Mah, « Asteroidea », sur MarineSpecies.org.
- (en) Larissa Ault et al., « Acanthaster planci », sur Animal Diversity.
- (en) Maldives Marine Research Center, « Crown of Thorns Starfish (COTS) outbreaks reporting », sur www.mrc.gov.mv, .
- « Ophiure », sur Dictionnaire de l'cadémie Française, 9e édition.
- « Les Crinoïdes », sur Cosmovisions.com (consulté le ).
- (en) Alexander M. Kerr, « A Philology of Òλοθóυριου : From Ancient Times to Linnaeus, including Middle and Far Eastern Sources », University of Guam Marine Laboratory Technical Report, no 151, (lire en ligne).
- (en) Leslie Joseph, « Review of the Bêche-de-mer (sea cucumber) fishery in the Maldives », Bay of Bengal Programme - Reef Fish & Resources Survey, .
- « Classifications des Mollusques », sur mglebrusc.free.fr.
- « Céphalopode », sur Larousse.
- J.M. Gaillard, « Gastéropodes », sur ftp.fao.org.
- « Classification des gastéropodes », sur Univ-LeHavre.fr.
- (en) Serge Gofas, « Neogastropoda », sur World Register of Marine Species.
- (en) Maria Vittoria Modica et Mande Hölford, « The Neogastropoda: Evolutionary Innovations of Predatory Marine Snails with Remarkable Pharmacological Potential », Evolutionary Biology – Concepts, Molecular and Morphological Evolution, (DOI 10.1007/978-3-642-12340-5_15, lire en ligne).
- « Neogastropods », sur http://neogastropodtol.org/.
- (en) T.C. Foin, « Plate Tectonics and the Biogeography of the Cypraeidae (Mollusca: Gastropoda) », Journal of Biogeography, vol. 3, no 1, (lire en ligne).
- (en) (coll.), « Cowries », dans International Wildlife Encyclopedia (lire en ligne).
- (en) Serge Gofas, « Strombidae », sur World Register of Marine Species.
- (en) Barry Wilson, « Strombidae », dans The Biogeography of the Australian North West Shelf (lire en ligne).
- (en) « Strombidae », sur Encyclopedia of Life.
- (en) Des Beechey, « Conidae », sur seashellsofnsw.org.au, .
- (en) R. Endean et Clare Rudkin, « Further studies of the venoms of Conidae », Toxicon, vol. 2, no 4, , p. 225–249 (DOI 10.1016/0041-0101(65)90021-8, lire en ligne).
- Maurice Jay, « Famille des conidae : genre Conus représenté à la Réunion », sur Vie océane (consulté le ).
- (en) Serge Gofas, « Muricidae », sur World Register of Marine Species.
- (en) « Muricidae », sur oupacademic.tumblr.com.
- (en) M.G. Harasewich et Guido Pastorino, « Trophonella (Gastropoda: Muricidae), a New Genus from Antarctic Waters, with the Description of a New Species », The Veliger, vol. 51, no 1, , p. 85-103 (lire en ligne).
- (en) Tan Koh-Siang, « Feeding ecology of common intertidal Muricidae (Mollusca: Neogastropoda) from the Burrup Peninsula, Western Australia », The Marine Flora and Fauna of Dampier, Western Australia, (lire en ligne).
- Philibert Bidgrain, « Les limaces de mer », sur VieOcéane, .
- Philibert Bidgrain, « Site des Nudibranches du Sud-Ouest de l'océan Indien », sur SeaSlugs.Free.fr.
- François Cabane, « Aplysie ou lièvre de mer, ou limace de mer », sur le site de l'IFREMER.
- « Nautilus pompilius », sur U-Bordeaux.
- « Céphalopodes », sur ftp.fao.org.
- « Céphalopodes », sur Larousse.
- « Notice et résumé de "Les diatomées marines à l'origine de la croissance des bivalves dans une lagune méditerranéenne" », sur bibliomer.com.
- « Les mollusques », sur univ-montp2.fr.
- « Les arthropodes mandibulates », sur mon.univ-montp2.fr.
- Stéphane Gasparini, « Les copépodes », sur le site de l'Observatoire océanologique de Villefranche.
- (en) « Coconut crab : the largest land arthropod on earth », sur le site du Kenya Wildlife Service (consulté le ).
- Joseph Poupin, Systématique et Écologie des Crustacés Décapodes et Stomatopodes de Polynésie Française., Université de Perpignan, Mémoire d'HDR, (lire en ligne).
- (en) Randi D. Rotjan, Jeffrey R. Chabot et Sara M. Lewis, « Social context of shell acquisition in Coenobita clypeatus hermit crabs », Behavioral Ecology, vol. 21, no 3, , p. 639-646 (lire en ligne).
- « La classification des crustacés », sur www.cosmovisions.com.
- (en) R.B. Mannings, « Stomatopods », sur ftp.fao.org.
- (en) Alex Rose, « The science behind stomatopods », sur www.coralscience.org.
- (en) S. N. Patek, W. L. Korff et R. L. Caldwell, « Biomechanics: Deadly strike mechanism of a mantis shrimp », Nature, vol. 428, , p. 819-820 (DOI 10.1038/428819a, lire en ligne).
- Maurice Mashaal, « Optique de haute technologie chez la crevette-mante », sur Pour la Science, .
- « Caridea », sur le petit Buffon électronique (site de l'université Jussieu).
- « Les vers ».
- Herman Denis, Alain Collenot, « Taxinomie et embryologie : une connexion ancienne et fructueuse », sur ipubli-inserm.inist.fr.
- (en) « Polychaeta », sur Encyclopedia of Life.
- « Les annélides », sur http://mon.univ-montp2.fr.
- Antoine Morin, « Les Annélides », sur le site de l'Université d'Ottawa.
- « Polychètes », sur Ecosociosystemes.fr.
- (en) Bec Crew, « Eunice aphroditois is rainbow, terrifying », sur blogs.scientificamerican.com.
- (en) Ben Waggoner, B. R. Speer, « Introduction to the Platyhelminthes », sur ucmp.berkeley.edu.
- (en) « Marine flatworms », sur wildsingapore.com.
- Clément Lamy, « Les planaires », sur efor.fr.
- (en) Tal Shomrat et Michael Levin, « An Automated Training Paradigm Reveals Long-term Memory in Planaria and Its Persistence Through Head Regeneration », Journal of Experimental Biology, vol. 216, , p. 3799-3810 (DOI 10.1242/jeb.087809, lire en ligne).
- Selon le Marine Flatworms APP.
- « Description des cnidaires », sur www.univ-lehavre.fr.
- « Aspects de la nutrition des coraux (scléractiniaires) », sur vieoceane.free.fr.
- Base de connaissance sur les coraux des Mascareignes, La Réunion, IREMIA.
- Pierre-André Bourque, « L'animal corail », sur www2.ggl.ulaval.ca.
- Paola Furla et Denis Allemand, « Relation de couple au soleil : l’endosymbiose Cnidaires-Dinoflagellés », Dossiers endosymbiose, sur www.sb-roscoff.fr, .
- « Corail », sur Larousse.fr.
- Jean-Pascal Quod et Loïc Charpy, « Le blanchissement corallien », sur www.com.univ-mrs.fr.
- Jean-Paul Poirier, « Les envenimations marines », sur http://www.camip.info.
- « Les anémones, des polypes solitaires », sur www.centrescientifique.mc.
- « Taxonomie et biologie des coraux », sur www.centrescientifique.mc.
- (en) Daphne G. Fautin, « Field guide to anemone fishes and their host sea anemones », sur www.nhm.ku.edu.
- (en) Dapnhe Gail Fautin, « The anemonefish symbiosis : What is known and what is not », Symbiosis, vol. 10, , p. 23-46 (lire en ligne).
- « Pagure », sur Larousse.
- « Spongiaires », sur www.ecosociosystemes.fr.
- « Découverte d’éponges originales dans une grotte sous-marine », sur www.cnrs.fr.
- « Biologie des Spongiaires », sur www.univ-lehavre.fr.
Voir aussi
Sources
Le symbole ![]() indique les sources privilégiées dans l'élaboration de cette page.
indique les sources privilégiées dans l'élaboration de cette page.
- Référence scientifique principale
- (en) « Biodiversity, resources, and conservation of Baa atoll (Republic of Maldives) : a UNESCO Man and Biosphere Reserve », Atoll Research Bulletin, Serge Andréfouët, , p. 247 (ISSN 0077-5630, lire en ligne).

- Bibliographie
- Andrey Ryanskiy (trad. Frédéric Ducarme), Les récifs de corail des Maldives : Livre d’identification, Malé, , 163 p. (ISBN 978-1-7268-5421-4, lire en ligne).

- E. Lieske et R.F. Myers (trad. de l'anglais), Guide des poissons des récifs coralliens : région Caraïbe, océan Indien, océan Pacifique, mer Rouge, Lausanne, Delachaux et Niestlé, , 400 p. (ISBN 2-603-00982-6).

- Neville Coleman (trad. Thomas Le Berre), La Vie marine des Maldives, Apollo Bay, Atoll, , 257 p. (ISBN 1-876410-54-X).

- (en) Rudie H. Kuiter, Photo guide to fishes of the Maldives, Apollo Bay, Atoll, , 257 p. (ISBN 1-876410-18-3).

- (en) Jen Veron, Corals of the world, Townsville, Australie, ed. Mary Stafford-Smith, (ISBN 0-642-32236-8).

- Sites de référence en identification d'espèces marines
- « FishBase », sur http://FishBase.MNHN.fr, site co-géré par le MNHN.

- « Données d'observations pour la reconnaissance et l'identification de la faune et de la flore subaquatiques », sur DORIS, site partenaire du MNHN géré par la CNEBS de la FFESSM.

- « Sous Les Mers », sur www.souslesmers.fr, administré par François Cornu.

- (en) « Marine Species Identification Portal », sur species-identification.org.
- « Nudibranches et planaires du sud-ouest de l’océan Indien », sur SeaSlugs.free.fr, administré par Philibert Bidgrain.

- Sites spécialisés sur la région
- * (en) « Liste d'espèces de poissons pour la région Maldives », sur FishBase.

- Bases de données taxinomiques
- (en) « World Register of Marine Species », sur World Register of Marine Species.

- (en) « Catalog of Fishes », sur http://research.calacademy.org.

- (en) « Corals of the World », sur coral.aims.gov.au.

- (en) « Algae Base », sur AlgaeBase.

- (en) « Système d'information taxonomique intégré », sur ITIS.
- (en) « Sea Life Base », sur Sealifebase.org.
- Sites d'images libres de droit