Loutre de mer
La loutre de mer (Enhydra lutris) est une grande loutre (famille des mustélidés) vivant dans le Pacifique Nord, du nord du Japon (île de Hokkaidō) à la Californie, en passant par le Kamtchatka, les îles Aléoutiennes et l'Alaska. C'est la plus aquatique et la plus massive des loutres (elle peut atteindre jusqu'à 45 kg), mais aussi la seule à pouvoir vivre en permanence dans la mer.
La loutre de mer ne doit pas être confondue avec la loutre marine, Lontra felina, encore appelée chat de mer ou chungungo, qui vit le long des côtes du Pérou et du Chili et qui a besoin d'abris terrestres. Il arrive aussi quelquefois que certaines loutres d'eau douce, comme la loutre d'Europe, fassent des incursions en mer (le cas est même assez fréquent dans certains pays comme en Irlande), mais leur organisme n'est pas adapté à des séjours prolongés.
Les loutres de mer forment la seule espèce du genre Enhydra.
Chassées intensivement à compter de 1741 pour leur fourrure (la plus dense de tous les mammifères avec jusqu'à 170 000 poils par centimètre carré), les populations de loutre de mer ont été considérablement réduites, disparaissant même de nombreuses régions de leur zone de répartition historique. En 1911 on a estimé que leur population mondiale était tombée entre 1 000 et 2 000 individus. Bien que plusieurs sous-espèces soient encore en danger, les loutres marines, qui sont légalement protégées, ont vu leur population fortement augmenter. Les efforts de réintroduction ont également montré des résultats positifs.
Enhydra lutris

Sous-espèces de rang inférieur
- Enhydra lutris kenyoni Wilson, 1990
- Enhydra lutris lutris (Linnaeus, 1758)
- Enhydra lutris nereis (Merriam, 1904)
Répartition géographique



EN A2abe : En danger
Statut CITES
Statut CITES

Description physique
Les loutres de mer sont les plus lourdes des loutres (entre 25 et 30 kg), mais pas les plus grandes (entre 0,80 et 1,5 m)[1].
Avec leurs longs corps profilés, les loutres de mer sont adaptées à la vie en mer, une mer tempérée (Californie) à froide (Alaska, Kamtchatka) dont la température oscille souvent entre 1 et 13 °C seulement. La loutre a dû développer des adaptations très particulières pour survivre dans un tel milieu, en particulier au niveau de sa fourrure.
Celle-ci varie d'un brun rougeâtre au noir. Particulièrement dense (140 000 à 170 000 poils par centimètre carré), elle isole l'animal et maintient une couche d'air sous les poils, créant une barrière efficace entre l'eau et la peau. Le pelage comporte des poils longs, brillants, épais et résistants : les jarres. Il comporte aussi des poils courts, très denses, plus fins : la bourre. La loutre enduit ses poils avec la sécrétion de glandes cutanées huileuses, qui les imperméabilisent temporairement, et doit régulièrement être réappliquée. Le temps passé à imperméabiliser sa fourrure par la loutre de mer est de plusieurs heures par jour.
Le poil imperméabilisé (surtout la bourre), retient de nombreuses bulles d’air qui assurent l’isolation thermique (la peau reste plus ou moins sèche). Chez les jeunes, la quantité d’air est telle que ceux-ci ne peuvent ni plonger ni couler, ce qui est essentiel dans la mesure où ils ne savent pas nager à la naissance.
Les loutres ne possèdent pas de couche de graisse isolante comme les autres mammifères marins. L’eau provoquant une perte de chaleur 25 fois plus rapide que l’air, les animaux à sang chaud qui vivent dans l’eau doivent s’isoler, mais aussi produire plus de chaleur. L’isolation est fournie chez la loutre de mer par la fourrure, la production de chaleur par un métabolisme environ deux fois plus élevé que chez un mammifère terrestre de même taille. Ce métabolisme explique que la loutre de mer doive manger près de 25 % de son poids chaque jour pour maintenir sa température interne de 35 degrés Celsius (10 % seulement chez la loutre d'Europe, qui passe beaucoup moins de temps dans l’eau).
Il existe d'autres adaptations à la vie aquatique :
- les narines et les oreilles se ferment hermétiquement pendant la plongée ;
- l'apophyse épineuse (les « épines » qui sortent de la colonne vertébrale) est très développée, comme chez d’autres mammifères marins, ce qui offre un meilleur ancrage aux muscles du dos ;
- la circulation sanguine a la particularité (dite rete mirabile)[2] d’être constituée (sous le derme) par un mélange de petites veines et de petites artères, les veines étant structurées pour bénéficier de la chaleur dégagée par les artères, ce qui réduit les pertes de chaleur ;
- les poumons sont 2,5 fois plus larges que ceux d’un mammifère de même taille, pour favoriser les plongées (la loutre n’a en effet pas les couches de graisse épaisses des autres mammifères marins, qui leur servent à l’isolation thermique, mais aussi à stocker de l’oxygène pour les plongées) ;
- le taux d’hémoglobine est plus important que chez un mammifère terrestre, facilitant le stockage de l’oxygène en plongée ;
- le sang des loutres de mer a une grande capacité régulatrice qui aide ces animaux à supporter les excès de CO2 accumulés sous la pression durant la plongée ;
- les naissances peuvent être reportées en cas de climat marin trop perturbé (voir le chapitre reproduction) ;
- la lèvre supérieure, le nez et le dessus des yeux sont entourés de longues vibrisses (ressemblant aux « moustaches » des chats) qui repèrent les mouvements de l’eau, ce qui permet à l’animal de se diriger et de chasser dans des milieux aquatiques à faible visibilité ;
- les yeux, les oreilles et les narines sont situés sur le dessus du crâne, comme chez beaucoup d’animaux aquatiques à respiration aérienne, ce qui permet à la loutre de rester dissimulée dans l’eau tout en respirant et en surveillant les alentours ;
- les pattes avant ont des griffes rétractiles, alors que les pattes/nageoires postérieures sont plus longues, largement aplaties et palmées : ce sont surtout ces dernières qui servent à la propulsion.
- Les reins sont plus gros que ceux des autres espèces de loutres, semble-t-il pour mieux éliminer l'accumulation de sel marin de l'organisme[3].
Sous chacune des puissantes pattes avant se trouve une poche de peau, employée pour stocker temporairement la nourriture ramassée pendant les plongées au fond, ou les pierres qu’elles utilisent volontiers comme outils[4].
Les loutres ont une queue assez courte, épaisse et musculeuse, qui leur sert de gouvernail.
Les loutres mâles peuvent atteindre un poids maximum de 45 kg et une longueur allant jusqu'à 1,5 m. La moyenne est cependant plutôt d'une trentaine de kilogrammes pour les mâles. Les femelles sont plus petites (un peu plus d'1 m), avec parfois seulement 70 cm, pour un poids moyen d’environ 23 kg.
Les femelles ont deux mamelles seulement.
Les deux canines supérieures sont très puissantes, et sensiblement plus grosses que les autres dents. Les deux canines inférieures sont également de bonnes tailles, mais plus petites. Les molaires sont robustes, sans doute une adaptation à une nourriture partiellement constituée d'animaux à coquilles ou carapaces[5].
Les loutres mènent des vies relativement longues : jusqu'à 23 ans dans la nature[6] (quinze - vingt ans en moyenne).
Comportement et reproduction

Les loutres de mer peuvent être solitaires ou vivre en groupes. Ces animaux sont en général plutôt sociaux, et on a relevé en Alaska des groupes comptant jusqu’à 2 000 individus. En Californie, où la population est moins importante, les groupes font plutôt de 10 à 100 individus. Les groupes sont souvent sexuellement séparés, les groupes de mâles étant en général plus importants que ceux des femelles.
En surface, les loutres de mer nagent souvent sur le dos. On peut supposer qu’il s’agit d’une adaptation à la vie en eau froide. Cette position permet de maintenir le bout du museau et les pattes hors de l’eau. Ces zones du corps sont en effet dépourvues de fourrure (mais ne représentent qu’1 % de la surface corporelle). Les loutres passent en posture ventrale quand elles souhaitent nager plus vite, par exemple en situation de fuite. Elles se reposent sur le dos en s'enroulant dans les frondes géantes du kelp, ce qui leur évite de dériver pendant qu'elles mangent ou pendant leur sommeil.
Les femelles ont une durée de vie plus importante que celle des mâles, avec 15 à 20 ans d'espérance de vie[7], tandis que les mâles ne vivent que de 10 à 15 ans[3].
Les loutres de mer dorment sur le dos dans l'eau. En groupe, elles se donnent souvent la main en dormant pour ne pas dériver et rester ensemble[8].
Les forêts de kelp

Les forêts de kelp sont de véritables forêts d'algues géantes formant le kelp et pouvant mesurer plus de 30 m de long. Ces algues sont ancrées sur le sol et flottent jusqu'à la surface grâce aux flotteurs qui se trouvent à la base des feuilles. Ces forêts sont un habitat privilégié pour les loutres de mer grâce à l’ancrage qu'elles fournissent (les loutres s'enveloppent dans les feuilles flottant en surface), les protégeant des tempêtes et des courants et grâce à l'abondance de la nourriture qui s'y trouve. Cependant, les loutres de mer ne sont pas strictement inféodées aux forêts de kelp, et certains groupes vivent dans des zones sans kelp.
On a montré que la loutre de mer avait un impact favorable sur l’extension des forêts de kelp : les loutres mangent énormément d’oursins, qui sont des brouteurs de kelp. Là où les loutres reviennent, le kelp se porte mieux et ses forêts se développent, permettant à toutes sortes d’animaux (invertébrés mais aussi poissons) de s’y développer. Là où les loutres sont absentes, les forêts de kelp sont dégradées et plus restreintes[9].
Cette action sur le kelp peut d’ailleurs jouer en faveur des loutres. Les pêcheurs californiens d’ormeaux ont en effet longtemps considéré les loutres comme des concurrentes, car les loutres sont des prédateurs des ormeaux. Bien qu’interdit, les tirs des loutres par ces pêcheurs ne sont donc pas rares. Mais les ormeaux dépendent des forêts de kelp où ils vivent, forêts que les loutres contribuent à étendre. Les loutres ont donc un impact positif à long terme sur les populations d'ormeaux. Certains espèrent que la découverte de cet impact positif contribuera à détendre l’atmosphère entre pêcheurs californiens et loutres.
Déplacements et recherche de nourriture


La loutre de mer vient à terre là où cela est possible, surtout pour se protéger des tempêtes, mais n'en a pas vraiment besoin, pas même pour la reproduction, qui est largement aquatique, de la conception à la naissance (voir le chapitre reproduction). Près des zones très habitées (comme en Californie), certaines populations de loutres ne viennent jamais ou presque jamais à terre.
Les données contradictoires concernant les déplacements des loutres de mer suggèrent que ceux-ci (ou leur absence) dépendent de la disponibilité des ressources alimentaires. Elles ne bougent généralement que de 1 à 2 km par jour, et ont des territoires qui peuvent dépasser 5 km².
La loutre de mer est un animal diurne. La majeure partie de sa journée est consacrée au toilettage et à la recherche de nourriture.
Le toilettage est essentiel : dépourvue de graisse isolante, la loutre de mer dépend pour sa survie de la protection offerte par sa fourrure. Celle-ci doit être régulièrement nettoyée et graissée (voir le chapitre description physique) pour conserver son efficacité, sous peine d'hypothermie.
La recherche de nourriture est plus intense le matin et le soir (alimentation crépusculaire).
La loutre prélève ses proies sur le fond de la mer. Les plongées sont assez courtes, ne durant généralement pas plus de 90 secondes, mais elles peuvent atteindre 4 ou 5 minutes.
La nourriture est largement constituée de diverses espèces de bivalves, d’escargots, de chitons, de crabes, d’étoiles de mer, d'oursins et même parfois de poissons[10]. Il y a semble-t-il des variations géographiques dans le régime de l'animal. Si les poissons semblent un apport relativement marginal dans les eaux nord-américaines, ils seraient au contraire importants « dans certaines parties des îles Aléoutiennes et du Commandeur ainsi que dans les Kouriles[11] »
Dans les eaux obscures ou sales, elle détecte ses proies à l'aide de vibrisses, moustaches sensibles qui ornent ses joues.
Du fait de cette nourriture, qui vit essentiellement sur le fond, la loutre de mer n'a pas vraiment de saison de reproduction, mais on note des pointes entre mai et juin dans les populations nordiques, et entre janvier et mars dans les populations méridionales.
Les femelles adultes lavent et (au besoin) ouvrent leurs proies avec une roche qu'elles gardent dans leur poche. La roche peut être utilisée comme enclume : l'animal fait la planche, pose la pierre sur son ventre, et frappe le coquillage dessus. Elle peut aussi être utilisée comme marteau. Les loutres de mer présentent ainsi un exemple d'utilisation d'outil par un mammifère non humain[12] - [13].
Reproduction

Il n'y a pas vraiment de saison de reproduction, mais on note des pointes entre mai et juin dans les populations nordiques, et entre janvier et mars dans les populations méridionales.
Les mâles ont des partenaires féminines multiples, mais sans vie commune. Les mâles et les femelles se rapprochent pendant les chaleurs de la femelle. Les femelles évitent les mâles en dehors de cette période. Durant la période des chaleurs, les mâles défendent leurs territoires ; il n'y a que très rarement des combats réels, la plupart des conflits se réglant par intimidation. Les femelles adultes ont des cicatrices caractéristiques de l'habitude qu'ont les mâles de leur tenir la tête entre leurs mâchoires pendant la reproduction.
Quand les mâles et les femelles se font la cour, ils nagent rapidement et plongent ensemble, le mâle faisant des tire-bouchons dans l'eau. Pendant l'accouplement, le mâle mord la femelle sur la nuque, le cou ou le nez, lui laissant des cicatrices.
La gestation est de 4 à 6 mois[14], bien qu'elle puisse être prolongée de plusieurs jours à une année si l'œuf fertilisé ne s'enfonce pas immédiatement dans la paroi utérine. Pendant cette période de suspension, l'œuf ne se développe pas. Ceci se produit en particulier quand l'agitation de la mer (tempêtes) perturbe l'implantation. Il s'agit sans doute d'une adaptation qui optimise la reproduction et la protection des jeunes dans le milieu rude d'un océan froid aux tempêtes fréquentes.
La gestation finit habituellement par une naissance simple. Les jumeaux sont une rareté, et habituellement seul l'un d'entre eux survit. Les nouveau-nés font 1,5 à 2,3 kg, ont les yeux ouverts et une fourrure déjà épaisse, pour flotter et survivre dans l'eau froide. La grosse taille des petits est tout à fait inhabituelle chez un mustélidé. D'après James Bodkin et Daniel Monson, de l’Alaska Science Center[15], cette taille importante est une adaptation aux rigueurs de la vie océanique. Ils notent à ce propos que le rapport entre le poids de la mère et celle du petit Enhydra lutris est beaucoup plus proche de celui existant chez les pinnipèdes que chez les mustélidés en général.
Les naissances peuvent se faire à terre avec transport rapide des jeunes vers l'eau, ou directement en mer. Le nombre des naissances en mer serait plus important chez les loutres de Californie (même si on y trouve des naissances terrestres d'après R. J. Jameson)[16] que chez les 2 sous-espèces nordiques.
En cas de décès du petit, la femelle entre souvent en chaleur dans les jours qui suivent, et retombe enceinte presque aussitôt. Les décès des petits étant plus fréquents l'hiver, compte tenu des conditions climatiques, cette particularité assure une naissance à un moment statistiquement plus favorable, c’est-à-dire le printemps ou l'été.
Les petits peuvent assimiler de la nourriture solide très peu de temps après leur naissance. Ils sont jaune brunâtre, et restent en permanence près de la mère, dont ils sont dépendants six mois ou plus. La mère enseigne aux petits comment chasser, plonger, et se toiletter efficacement. Elle a en général un petit tous les ans ou tous les deux ans. Ceux-ci commencent à plonger vers l'âge de 2 mois. Ils restent avec la mère 5 à 8 mois après la naissance[17].
La plupart des femelles sont sexuellement matures vers trois ou quatre ans, parfois même deux ans : « Une petite proportion des femelles a son premier petit à 2 ans, environ 50 % se reproduisent pour la première fois à l'âge de trois ans, et la plupart des femelles ont eu un petit à l'âge de 4 ans »[15].
Les mâles se reproduisent rarement avant 5-6 ans, bien que la maturité sexuelle physique puisse être atteinte plus tôt[3].
Taxinomie et systématique
L'espèce Enhydra lutris a été décrite pour la première fois en 1758 par le naturaliste suédois Carl von Linné (1707-1778) et le genre monotypique Enhydra en 1822 par le zoologiste et géologue écossais John Fleming (1785-1857).
Les auteurs identifient traditionnellement trois sous-espèces.
Liste de genre, espèce et sous-espèces
Selon Mammal Species of the World (version 3, 2005) (22 mai 2013)[18], Catalogue of Life (22 mai 2013)[19] et World Register of Marine Species (22 mai 2013)[20] :
- Enhydra Fleming, 1822
- Enhydra lutris (Linnaeus, 1758)
- sous-espèce Enhydra lutris kenyoni Wilson, 1991
- sous-espèce Enhydra lutris lutris (Linnaeus, 1758)
- sous-espèce Enhydra lutris nereis (Merriam, 1904)
- Enhydra lutris (Linnaeus, 1758)
La destruction de la loutre
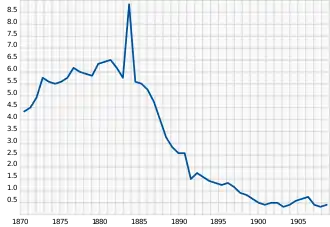
L’habitat de la loutre de mer allait à l’origine du nord du Japon (Hokkaidō) au nord du Mexique (péninsule de Basse-Californie), en suivant la cote nord-asiatique, les îles Aléoutiennes puis la cote pacifique de l’Amérique du Nord.
La population originelle comptait sans doute des centaines de milliers d’individus (de 150 000 à un million, selon les estimations). Le nombre des sous-espèces est difficile à déterminer, mais il y en a trois aujourd’hui. Eu égard à l’importance de la destruction des populations, il est possible que certaines sous-espèces aient disparu avant d’avoir été décrites.
Les populations de son aire de répartition pratiquaient une chasse traditionnelle, qui est attestée archéologiquement, et a peut-être entraîné des disparitions locales anciennes[11]. C'est cependant la grande chasse qui s'organise entre 1741 et 1911 qui entraînera la quasi-disparition de l'espèce.
Aux XVIIe et XVIIIe siècles, la Russie a été fortement impliquée dans le commerce de la fourrure de zibeline. Le tsar Pierre le Grand souhaitait développer cette activité économique, et trouver de nouvelles populations à chasser. Les chasseurs russes s’installèrent donc de plus en plus loin en Sibérie, jusqu’au Kamtchatka, presqu’île riche en zibeline, mais où on trouvait aussi des loutres de mer.
En 1741 et 1742, Vitus Béring et Alexei I. Chirikov furent chargés par le gouvernement russe d’explorer le Pacifique nord et de tracer une route maritime vers l’Amérique à partir des nouvelles possessions russes d’Extrême-Orient. Lors de leur hivernage de 1741-1742, les équipages récoltèrent des peaux de loutre. En 1742, les survivants de l’expédition (Bering était mort) revinrent en Russie avec 900 peaux de loutres, qui intéressèrent vivement les marchands de fourrure. Avec près de 170 000 poils par cm², la fourrure de loutre de mer est en effet particulièrement dense et soyeuse. Ce fut le début de la grande chasse.
Les Russes envoyèrent de nombreux bateaux chasser la fourrure de loutre. Après l’épuisement des populations nord-asiatiques de loutres, la prise des îles Aléoutiennes puis de l’Alaska par la Russie fut largement motivée par la volonté d’étendre les territoires de chasse à la loutre, devenue une activité particulièrement rentable.
En 1784, les Russes établirent des comptoirs de traite sur les îles Aléoutiennes et sur la côte de l'Amérique, en Alaska. Des postes côtiers furent construits à Attu, Agattu et Unalaska, dans les îles Aléoutiennes, ainsi que dans l'île de Kodiak, au large de l'embouchure de l'anse Cook (Alaska). Dix-huit mois plus tard, une colonie fut établie sur le continent, en face de l'anse Cook.
Les populations indigènes furent souvent férocement traitées. Des Aléoutes furent réduits en esclavage, et d’autres auraient été pris en otages pour forcer la population indigène à chasser la loutre pour le compte des marchands russes. On comptait environ 25 000 Aléoutes avant l’arrivée des Russes, mais ils n’étaient plus que 3 892 en 1885[21].
La fourrure de loutre se vendait non seulement en Europe, mais aussi à prix d'or sur les marchés chinois.
Si les Russes furent les premiers à industrialiser la chasse, les Britanniques puis les Américains les suivirent rapidement. En 1776, le capitaine James Cook explora le Pacifique nord pour le compte de la Grande-Bretagne. C’est lors de cette expédition que la fourrure de loutre fut identifiée par les Britanniques comme un commerce à fort potentiel, attirant dès la fin du XVIIIe siècle de nouveaux chasseurs dans la région, en particulier Britanniques, Espagnols puis Américains.
Rien qu'entre 1785 et 1809, 55 000 peaux furent débarquées en Colombie-Britannique par les navires de chasse ou les marchands, en provenance de diverses régions d'Amérique du Nord[11].
« En 1850, la loutre de mer canadienne était considérée comme disparue sur le plan commercial et était peut-être déjà disparue sur le plan écologique[11] ». Quelques loutres subsistaient au Canada (la dernière recensée y sera tuée en 1929[11]), mais sans impact environnemental.
L'Alaska ayant également été presque totalement vidé de ses populations de loutres de mer, la région devint économiquement peu intéressante pour le gouvernement russe, amenant celui-ci à vendre ce territoire et les Aléoutiennes aux États-Unis en 1867.
Vers la fin du XIXe siècle, la chasse cessa d’être rentable. Les populations de loutre avaient presque totalement disparu. La dernière loutre connue de l'État américain de l'Oregon fut ainsi tuée en 1906. Les expéditions de chasse ne pouvaient plus ramener assez de peaux pour se financer.
Seules quelques petites populations résiduelles et très fragmentées avaient survécu. « On estime que seulement 2 000 individus, soit plus ou moins 1 % de la population initiale, auraient survécu dans les 13 populations qui subsistaient en 1911[11] ». Certaines de ces 13 populations, trop petites ou victimes de braconnages, finiront d'ailleurs par disparaître, comme celle des îles de la Reine-Charlotte[22].
Protection
La pression des marchands de fourrure ayant disparu avec l’intérêt commercial de la chasse, la loutre de mer fut protégée en 1911 par le « traité international sur le phoque à fourrure », ratifié par les États-Unis, la Russie, le Japon et la Grande-Bretagne (pour le Canada[11]), à un moment où beaucoup pensaient qu’elle était déjà condamnée. Ce traité était un des premiers à organiser une protection d'espèce au niveau international[23].
Les survivants
Bien que la chasse de loutre ait été officiellement interdite, et que les animaux soient devenus très difficiles à trouver, des braconniers ont continué à les chasser.
Ainsi, « la dernière loutre de mer dont la prise a été confirmée au Canada a été abattue en 1929 près de Kyuquot, en Colombie-Britannique[11] ».
Les braconniers japonais étaient également sur le point d'éliminer totalement les loutres restantes dans les îles Aléoutiennes (possession américaine depuis 1867) lors du déclenchement de la Seconde Guerre mondiale. La zone fut militarisée par les deux parties. Il y eut une occupation partielle des îles par le Japon et le renforcement de la présence militaire américaine dans le reste de la zone. Du fait de cette militarisation et des dangers liés à l'état de guerre, le braconnage cessa.
Avec le groupe des Aléoutiennes, d’autres petites populations ont survécu de justesse, en particulier en Alaska ou au Kamtchatka. Un groupe a été identifié au large de Carmel, en Californie en 1938, dans une zone où on pensait que les loutres avaient totalement disparu. Une estimation de 1976 considère qu'il devait y avoir une cinquantaine de survivants de E. lutris nereis vers 1914[24]. D'autres estimations parlent de 10 à 30 survivants seulement.
Ces différents survivants ont permis aux 3 sous-espèces de se reconstituer naturellement, colonisant progressivement les zones se trouvant autour d'eux.
Un exemple de recolonisation ayant été assez largement étudié est celui d'Enhydra lutris nereis, la sous-espèce californienne :
 Recolonisation de la côte californienne par Enhydra lutris nereis entre 1938 et 1998. |
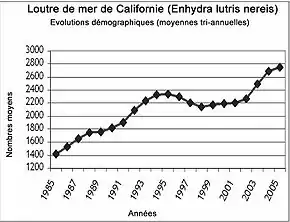  Fortement peuplée, la Californie entraîne des cohabitations forcées. |
Réintroductions
En plus de la croissance naturelle des populations, des réintroductions couronnées de succès ont été réalisées le long des côtes nord-américaines pour accélérer la recolonisation, en particulier au Sud-Est de l'Alaska, dans l’État de Washington (États-Unis) et en Colombie-Britannique (Canada).
Par exemple, 89 loutres de mer d’Alaska (« provenant de l’île Amchitka et du détroit du Prince William[11] ») ont été introduites en plusieurs étapes en Colombie-Britannique en 1969 et 1972, « dans la baie Checleset, sur la côte ouest de l’île de Vancouver[11] ». Comme souvent, la translocation a entraîné une surmortalité, et la population a rapidement diminué, peut-être jusqu'à seulement 28 individus[25]. Cette petite population s'est ensuite adaptée, et a dès lors rapidement augmenté, puisqu’elle atteignait déjà 1 500 individus en 1995 et 3 185 en 2004[11].
Ainsi aussi, 59 loutres des Aléoutiennes ont été implantées en 1969 et 1970 dans les eaux de l’État de Washington (États-Unis). Après un démarrage assez lent (100 animaux en 1987), une enquête de 2001 en recensait 555[26], et 814 en 2005[27].
Des réintroductions de loutre d'Alaska dans le sud-est de l'Alaska ont également réussi, les autorités ayant déplacé entre 1965 et 1969 412 loutres provenant du sud-ouest de l’Alaska[28].
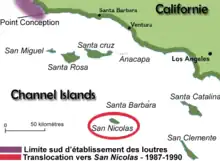
Certaines réintroductions, ont par contre échoué, ou ont connu des succès partiels. C'est ainsi qu'une population de 140 membres de la sous-espèce Enhydra lutris nereis a été installée entre 1987 et 1990 autour de l'Île San Nicolas, en face de Los Angeles, un peu au sud de la zone recolonisée naturellement par la loutre de Californie. Le succès a été très partiel, la population peinant à se développer vraiment. Cet échec partiel est sans doute en partie le fait de la stratégie choisie. En effet, devant l'opposition des pécheurs, une « zone exempte de loutres de mer » a été instituée au sud de la pointe conception, la limite sud de recolonisation naturelle par les loutres. Les animaux entrant dans cette zone (dont la seule exception était l'île San Nicolas) devaient être capturés et ramenés dans la zone réservée, au nord. « En , le USFWS[29] a décidé que le confinement des loutres de mer en tentant de maintenir la zone exempte de loutres de mer mettait en péril le rétablissement de la population de loutres de mer du Sud et a arrêté de retirer les loutres de mer présentes dans la zone d’exclusion[11] ». Cette nouvelle politique devrait favoriser la descente des populations du nord vers Los Angeles, et sécuriser la population de San Nicolas. Mais le développement à long terme de cette nouvelle population reste en 2007 incertain.
De son côté, la réintroduction de population dans l'Oregon a été un échec total[28].
La situation des différentes sous-espèces
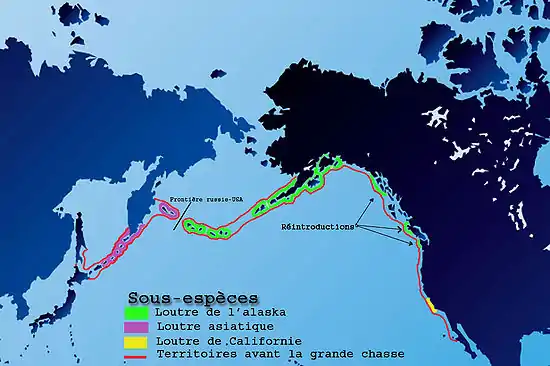
Il y a aujourd’hui 3 sous-espèces reconnues (voir Wilson sur l'histoire de la taxonomie de l'espèce - 1991) :
- La loutre de mer d’Asie (Enhydra lutris lutris ou E. l. gracilis, selon les classifications) est la plus petite. Elle vit sur la côte ouest du Kamtchatka (fédération de Russie) et autour des Îles Kouriles. Elles seraient entre 15 et 20 000 en 2006. Cette sous-espèce a totalement disparu du Japon, mais une recolonisation à partir des Kouriles est possible, et l'observation d'au moins un individu en 1997 a été rapportée par Gorbics[30].
- La loutre de mer d’Alaska (Enhydra lutris kenyoni ou E. l. lutris, selon les classifications), vit sur les îles Aléoutiennes, sur les côtes de l’Alaska. Des groupes ont été réintroduits en Colombie-Britannique (Canada) et dans l'État de Washington (États-Unis). Elles seraient en 2006 une centaine de milliers, surtout présentes en Alaska. La population des Aléoutiennes semble en forte baisse, et le Pages liées à Center for Biological Diversity a demandé en 2000 un statut de protection renforcé[31].
- La loutre de mer de Californie (Enhydra lutris nereis) est la moins nombreuse. Elle a une taille intermédiaire entre E. l. gracilis et E. l. lutris. À l’origine, on la trouvait sur toutes les côtes du sud-ouest de l’Amérique du Nord. Déjà rare dès 1830, elle était exterminée au début du XXe siècle. Seules quelques dizaines d’animaux ont survécu près de Carmel en Californie, à mi-chemin entre Los Angeles (au sud) et San Francisco (au nord). Limité à une petite zone autour de Big Sur (Carmel), l'animal s'est progressivement développé jusqu'à coloniser presque tout le territoire entre les deux grandes métropoles californiennes (voir ci-dessus pour une carte de ce développement). Ils seraient en 2006 2 800 animaux sur 400 km de côte.
« Une analyse génétique récente indique [...] qu’un certain flux génétique s’est produit entre les individus de la Californie et du détroit du Prince-William, en Alaska, avant la traite des fourrures marines[32] ». La séparation entre les sous-espèces, ici Enhydra lutris nereis et Enhydra lutris kenyoni n'empêche donc pas des croisements ponctuels.
Il existe un problème de nom, puisque certains scientifiques appellent la sous-espèce asiatique Enhydra lutris lutris (et non Enhydra lutris gracilis), et la sous-espèce aléouto-alaskane Enhydra lutris kenyoni (et non Enhydra lutris lutris).
Protections légales
Les loutres sont aujourd’hui présentes dans la quasi-totalité de leur ancienne zone de présence, mais de façon beaucoup moins dense, avec un habitat en taches de léopard. En pratique, seule la moitié des eaux où elles habitaient ont actuellement une présence de loutres, et la sous-espèce de Californie reste fortement menacée.
Aujourd'hui, les différentes populations sont stables, en lente augmentation ou en régression (selon les zones). La tendance globale en 2007 semble être une lente augmentation. Là ou des régressions sont constatées, une des hypothèses avancées est celle d'une prédation beaucoup plus forte des orques[33], ainsi que diverses menaces humaines.
Malgré son retour relatif, la loutre de mer est toujours protégée. Elle l’est au niveau international (la CITES a placé la sous-espèce de Californie (E. lutris nereis) en annexe I : protection maximale, et les 2 autres sous-espèces en annexe II), mais aussi par des lois des pays concernés, comme la Loi sur les espèces en péril et la Loi sur les pêches du Canada[11] ou l'U.S. Marine Mammal Protection Act de 1972 aux États-Unis.
Au Canada, la loutre de mer était « désignée comme étant « en voie de disparition » en [11] », un statut confirmé en 1986. L'animal a obtenu un « réexamen du statut et [une] désignation en tant qu’espèce « menacée » en et en [11] ». « Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a procédé, en , à la réévaluation de la situation de la population de loutres de mer et l’a désignée en tant qu’espèce préoccupante [...] du fait qu’elle avait repeuplé de 25 à 33 % de son aire de répartition historique et que la population est en croissance et en expansion. Toutefois, on considère que l’effectif demeure peu élevé (< 3 500 individus) et que la population est particulièrement vulnérable aux déversements de pétrole en raison de sa fragilité aux hydrocarbures et de la proximité des principales routes maritimes empruntées par les pétroliers[11] ».
Prédateurs et menaces

Causes naturelles
Les prédateurs naturels[34] - [35] de la loutre sont les orques (ou épaulards), les requins, mais aussi certains oiseaux, comme le pygargue (qui s’attaque surtout aux jeunes), voire exceptionnellement des prédateurs terrestres, comme le coyote (quand elles viennent à terre).
« Les épaulards ne seraient pas une cause de mortalité importante en Colombie-Britannique [...]. Par contre, la prédation par les épaulards peut être importante dans l’ouest de l’Alaska, où des déclins spectaculaires touchent présentement la population de loutres de mer[35] avancent l’hypothèse que, en raison des déclins spectaculaires dans les populations de phoques et de lions de mer résultant d’un changement à grande échelle au niveau de l’écosystème, les épaulards s’alimentant de mammifères auraient commencé à s’attaquer aux loutres de mer et seraient la cause du déclin observé dans la population de celles-ci. La prédation par le grand requin blanc est une cause importante de mortalité chez les loutres de mer du Sud [en Californie] et s’est accrue au fil du temps, particulièrement pendant la période de déclin récent et actuel touchant cette population de loutres de mer[36] »[11].
Les tempêtes et le manque de nourriture peuvent aussi causer des pertes importantes au sein des groupes.
Causes artificielles
Dans certaines zones, la pollution et les filets des pêcheurs (prises accidentelles) représentent un risque important. On estime que la marée noire de l’Exxon Valdez, en Alaska en 1989, a tué environ 800 à 5 000 loutres (selon les estimations).
Chez les loutres de Californie, le problème vient d'une proximité très forte avec les humains, les côtes de la Californie étant particulièrement peuplées. « Au milieu des années 1970, on a décelé un déclin d’environ 5 % par année, lequel a été attribué à des mortalités provoquées par les filets de pêche submergés. La tendance s’est inversée à la suite de l’imposition de restrictions sur l’utilisation des filets et, en 1995, les relevés indiquaient une population d’au moins 2 377 individus[11] ». Bien que la tendance, soit actuellement satisfaisante, on a cependant noté une forte mortalité chez les loutres de Californie du fait de maladies infectieuses ou parasitaires favorisées par la pollution. De fait, des études ont montré une contamination notable par des pesticides organochlorés chez des animaux retrouvés morts le long de la côte de Californie[37]. « en général, on ne croit pas que les maladies soient une cause de mortalité importante dans la plupart des populations de loutres de mer, excepté celles de la Californie. En Californie, les maladies sont en effet responsables de 40 % mortalités d’individus dont les carcasses ont été retrouvées sur les plages et contribuent à maintenir un faible taux de croissance démographique, comparativement à d’autres populations de loutres de mer[11] ».
Dans les eaux territoriales russes (Kouriles et Kamtchatka), « la population est menacée par le braconnage, la contamination de l’habitat et les conflits avec les pêches. Le braconnage est particulièrement important du fait que l’on croit qu’un marché noir existe en Russie et qu’il permet d’exporter illégalement des fourrures vers la Chine, la Corée et le Japon (Burdin[38], 2000)[11] ».
Dans l'océan Arctique, le déclin de la glace dû au réchauffement climatique et à la formation des voies de navigation maritimes menace[39] les populations d'Enhydra lutris kenyoni. Le remodelage radical des glaces aurait permis le contact, auparavant impossible, entre différentes espèces de phoques, dont une partie était infectée par le virus Phocine morbillivirus. Ce dernier est responsable d’une épidémie de la maladie de Carré des phoques ayant entraîné la mort de milliers de phoques dans l’Atlantique Nord en 2002[40] - [41] et a également été relevé chez la loutre de mer en Alaska[42]. La disparition des glaces pousse la faune marine à se déplacer et s’alimenter dans de nouveaux habitats, ce qui la rend susceptible de contracter de nouvelles maladies infectieuses. C'est ainsi que le virus s’est introduit dans le nord de l’océan Pacifique et a pu contaminer les espèces le peuplant.
Conséquences
Les menaces actuellement enregistrées n'empêche pas la population des loutres de mer d'être en lente augmentation, mais cette augmentation ne vaut pas pour toutes les zones, et certaines connaissent des baisses de populations.
La diminution la plus spectaculaire est celle des loutres des Aléoutiennes. Alors que les autres populations sont plus ou moins en expansion, la population des Aléoutiennes s'est effondrée, passant d'un fourchette entre 55 et 73 000 individus en 1985 à moins de 9 000 animaux en 2000[11]. Cet effondrement est mal compris, mais l'hypothèse d'une prédation croissante par les orques est souvent avancée, sans preuve formelle.
Estimation de populations
La compilation des estimations des populations locales est difficile, sachant que les méthodes utilisées sont différentes selon les équipes scientifiques, et que les années d'observation ne sont pas les mêmes.
La principale différence vient de l'utilisation de la méthode du comptage des seuls animaux vus, ou de la méthode du comptage estimé, qui ajoute aux animaux observés une hypothèse sur une proportion d'animaux non observés.
Le total des estimations ci-dessous peut-être considéré comme un minimum, beaucoup de ces estimations ne reposant que sur les observations directes, lesquelles ne peuvent espérer être exhaustives. Le total des animaux vivants en 2007 peut donc être estimé entre 100 000 et 150 000 bêtes.
| REGIONS | NOMBRE DE LOUTRES | ANNEE DE L'ESTIMATION | SOURCES[11] |
|---|---|---|---|
| États-Unis – Californie | 2 026 (a) | 2007 | USGS, 2007[43] |
| États-Unis - État de Washington | 814 (a) | 2005 | Jameson et Jeffries, 2005[44] |
| Canada – Colombie-Britannique | 3 185 (a) | 2001, 2004 | Nichol et al., 2005 |
| États-Unis – Sud-est de l’Alaska | 10 563 (b) - En baisse. | 2000, 2002, 2003, 2005 | Compilation USFW, 2008[45] |
| États-Unis – Centre sud de l’Alaska | 15 090 (b) - En baisse. | 2000, 2002, 2003 | Compilation USFW, 2008[46] |
| États-Unis – Sud-ouest de l’Alaska et Aléoutiennes | 47 676 (b) - en hausse | 2000, 2001, 2002, 2004 | Compilation USFW, 2008[47]; Doroff et al., 2003[48] |
| Russie – Îles du Commandeur | 5 546 (a) | 2002 | A. Burdin[49] |
| Russie – Péninsule du Kamtchatka et îles Kouriles | 16 910 (a) | 1997 | Gorbics et al., 2000[30] |
| Japon – Cap Nosappu | 1 (a) | 1997 | Gorbics et al., 2000[30] |
| TOTAL | 101 811 | 1996 à 2007 |
(a) Comptage direct des seuls animaux observés.
(b) Estimations corrigées en fonction des animaux non observés.
Voir aussi
Articles connexes
- Mammifère marin#Animaux partiellement liés à l'eau
- Loutre marine (chat de mer ou chungungo)
- Loutre d'Europe
- Palette natatoire
Bibliographie
- The sea otter (ENHYDRA LUTRIS): behavior, ecology, and natural history. Un document du U.S. Fish and Wildlife Service Biological Report, 126 pages, par M L Riedman et J. A. Estes, 1990.
- « Accumulation pattern of organochlorine pesticides and polychlorinated biphenyls in southern sea otters (Enhydra lutris) found stranded along coastal California, USA » [PDF], par Nakata, Kannan, Jing, Thomas, Tanabe et Giesy, article publié dans Environmental Pollution (103:45-53), 1998.
- Programme de rétablissement de la loutre de mer (Enhydra lutris) au Canada, Loi sur les espèces en péril, Série des Programmes de rétablissement, ministère des pêches et des océans du Canada, .
- BD
Liens externes
Bases de référence taxonomiques
- (en) Référence Animal Diversity Web : Enhydra lutris (consulté le )
- (en) Référence Catalogue of Life : Enhydra lutris (Linnaeus, 1758) (consulté le )
- (en) Référence CITES : espèce Enhydra lutris (Linnaeus, 1758) (+ répartition sur Species+) (consulté le )
- (fr) Référence CITES : taxon Enhydra lutris (sur le site du ministère français de l'Écologie) (consulté le )
- (fr+en) Référence ITIS : Enhydra lutris (Linnaeus, 1758) (consulté le )
- (en) Référence Mammal Species of the World (3e éd., 2005) : Enhydra lutris Linnaeus, 1758 (consulté le )
- (en) Référence North American Mammals : Enhydra lutris (consulté le )
- (en) Référence NCBI : Enhydra lutris (taxons inclus) (consulté le )
- (fr) Référence SeaLifeBase : (consulté le )
- (en) Référence Paleobiology Database : Latax lutris Linnaeus 1758 (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- (en) Référence UICN : espèce Enhydra lutris (Linnaeus, 1758) (consulté le )
- (en) Référence World Register of Marine Species : espèce Enhydra lutris (Linnaeus, 1758) (consulté le )
Autres liens externes
- (fr) Un article, avec des vidéos de loutres de mer
- (en) info natura
- (en) un article scientifique au Format PDF
- (en) Un article scientifique au format PDF de James Bodkin et Daniel Monson, du Alaska Science Center, Anchorage, Alaska
- (en) James A. Estes, « Enhydra lutris », Mammalian species, N° 133, publication de The american society of Mammalogists, 1980.
Notes et références
- La plus grande des loutres est Pteronura brasiliensis, la loutre géante de l’Amazonie, qui peut atteindre 1,8 mètre. Cette loutre est par contre moins grosse que la loutre de mer, qui avec des maximums à 45 kg reste la plus lourde des loutres.
- Scholender, 1966 ; Tétry et al., 1974
- (en) M. L. Riedman et J. A. Estes, « The sea otter (Enhydra lutris): Behaviour, ecology and natural history », US Fish and Wildlife Service, vol. 90, no 14, (lire en ligne)
- « La loutre de mer » (consulté le )
- Voir les photos de crânes sur le site skullsite.co.uk.
- (en) Ronald Nowak, Walker's Mammals of the World, Johns Hopkins University Press, (ISBN 0-8018-5789-9)
- « Reproduction, survival and tag loss in California sea otters », D. B. Siniff et K. Ralls, 1991, publié dans le volume 7 (issue 3) de Marine Mammal Science, pages 211-229.
- « VIDEO. Deux loutres se tiennent la patte pour dormir », sur Sciences et Avenir (consulté le )
- J.A. Estes et D. Duggins (1995) Sea otters and kelp forests in Alaska: generality and variation in a community ecological paradigm. Ecological Monographs 65: 75-100.
- Food selection and some foraging tactics of sea otters, par J. A. Estes, Ronald Jameson et A. M. Johnson, 1981, rapporté dans Worldwide furbearers conference proceedings, Éditions J. A. Chapman et D. Pursley, pages 606-641.
- Programme de rétablissement de la loutre de mer (Enhydra lutris) au Canada, Loi sur les espèces en péril, Série des Programmes de rétablissement, ministère des pêches et des océans du Canada, décembre 2007.
- « Tool using behavior of the California sea otter », K. Hall et G.B. Schaller, article publié dans le Journal of Mammalogy, pages 287 à 298, 1964.
- L'intelligence de l'animal, Jacques Vauclair, Éditions du Seuil, collection Points Sciences, 224 pages, 1995, (ISBN 2-02-025840-4).
- Comparative placentation, sur le site de l'université de Californie de San Diego, School of Medicine, citant Nowak (1999).
- James Bodkin et Daniel Monson, Alaska Science Center, Anchorage, Alaska. Sea Otter Population Structure and Ecology in Alaska. Article en PDF ici.
- R. J. Jameson Evidence of birth of a sea otter on land in central California - 1983
-
- McShane et. al. 1995 ;
- Estes 1980 ;
- Walker's Mammals of the World, Ronald Nowak, 1999, publié aux Johns Hopkins University Press, (ISBN 0-8018-5789-9) ;
- « Breeding patterns and reproductive success of California sea otters », M.L. Riedman, et al., article publié dans le Journal of Wildlife Management (58:391-399), 1994.
- Mammal Species of the World (version 3, 2005), consulté le 22 mai 2013
- Catalogue of Life Checklist, consulté le 22 mai 2013
- World Register of Marine Species, consulté le 22 mai 2013
- Angie Debo, Histoire des Indiens des États-Unis, éditions Albin Michel, Collection : Terre Indienne, 12/01/1998, page 93.
- « The sea otter in the eastern Pacific Ocean », K.W. Kenyon, North American Fauna N°68, 1969.
- « Du régional à l’universel : la généralisation des préoccupations environnementales », Alexandre KISS, article publié initialement dans la Revue Internationale et stratégique, n°60, hiver 2005.
- (California Department of Fish and Game - 1976)
- Growth and equilibrium in sea otter populations, J. A. Estes, Journal of Animal Ecology N°59, 1990, pages 385-401.
- Source : Marine Mamal Commission (États-Unis) - Rapport 2002 [PDF].
- Results of the 2005 survey of the reintroduced sea otter population in Washington State, Ronald Jameson et S. Jeffries, 2005, rapport non publié, 6 pages, cité par le « Programme de rétablissement de la loutre de mer (Enhydra lutris) au Canada » de 2007.
- « History and status of translocated sea otter populations in North America », par Ronald Jameson, K. W. Kenyon, A. M. Johnson et H. M. Wright, article publié en 1982 dans le Wildlife Society Bulletin N° 10, pages 100-107.
- United States Fish and Wildlife Service.
- Sea otter conservation, rapport du sixième atelier conjoint États-Unis – Russie sur la loutre de mer, par C.S. Gorbics, G. R. VanBlaricom, B. E.Ballachey, N. J. Thomas et M. M. Staedler, novembre 1997, publié en 2000, Forks, Washington, 61 pages.
- (en) Demande de protection pour la population des aléoutiennes par le center for biological diversity - Voir aussi l'étude de Doroff, J. A. Estes, M. T. Tinker, D. M. Burn, et T. J. Evans en 2003 : Sea otter population declines in the Aleutian archipelago. Journal of Mammalogy 84:55-64.
- « Programme de rétablissement de la loutre de mer (Enhydra lutris) au Canada », 2007, citant Microsatellite DNA and mitochondrial DNA variation in remnant and translocated sea otter (Enhydra lutris) populations, de S. Larson, R. Jameson, J. Bodkin, M. Staedler et P. Bentzen, dans Journal of Mammalogy, Volume 83 (Issue 3), août 2002, pages 893–906.
- Source : Marine Mamal Commission (États-Unis) - Rapport 2002 [PDF].
- J.E. Estes, N.S. Smith et J.F. Palmisano, « Sea otter predation and community organization in the western Aleutian Islands, Alaska », Ecology, vol. 59, , p. 822-833 (lire en ligne [PDF])
- J.A. Estes, M.T. Tinker, T.M. Williams et D.F. Doak, « Killer whale predation on sea otters linking oceanic and nearshore ecosystems », Science, vol. 282, , p. 473-476 (lire en ligne [PDF])
- J.A. Estes, B.B. Hatfield, K. Ralls et J. Ames, « Causes of mortality in California sea otters during periods of population growth and decline », Marine Mammal Science, vol. 19, no 1, , p. 198-216 (lire en ligne [PDF])
- « Accumulation pattern of organochlorine pesticides and polychlorinated biphenyls in southern sea otters (Enhydra lutris) found stranded along coastal California, États-Unis » [PDF], par Nakata, Kannan, Jing, Thomas, Tanabe et Giesy, article publié dans Environmental Pollution (103:45-53), 1998.
- Status of sea otter populations in Russia, A.M. Burdin, 2000, cité dans Sea otter conservation, par C.S. Gorbics, VanBlaricom, Ballachey, Thomas et M. M. Staedler, 2000, Rapport du sixième atelier conjoint États-Unis – Russie sur la loutre de mer. Novembre 1997, Forks, Washington. 61 pages.
- E. VanWormer, J. A. K. Mazet, A. Hall et V. A. Gill, « Viral emergence in marine mammals in the North Pacific may be linked to Arctic sea ice reduction », Scientific Reports, vol. 9, (ISSN 2045-2322, PMID 31700005, PMCID 6838065, DOI 10.1038/s41598-019-51699-4, lire en ligne, consulté le )
- (en) Duignan Pj et Nielsen O, « Epizootiology of Morbillivirus Infection in Harp, Hooded, and Ringed Seals From the Canadian Arctic and Western Atlantic », sur Journal of wildlife diseases, 1997 jan (PMID 9027686, consulté le )
- (en) Ailsa J. Hall, Paul D. Jepson, Simon J. Goodman et Tero Härkönen, « Phocine distemper virus in the North and European Seas – Data and models, nature and nurture », Biological Conservation, infectious Disease and Mammalian Conservation, vol. 131, no 2, , p. 221–229 (ISSN 0006-3207, DOI 10.1016/j.biocon.2006.04.008, lire en ligne, consulté le )
- (en) Goldstein T et Mazet Ja, « Phocine Distemper Virus in Northern Sea Otters in the Pacific Ocean, Alaska, USA », sur Emerging infectious diseases, 2009 jun (PMID 19523293, consulté le )
- USGS 2007. Spring 2007 California Sea Otter Surveys, United States Geological Survey. Site Web : http://www.werc.usgs.gov/otters/ca-surveyspr2005.htm. (consulté en octobre 2007).
- R.J. Jameson et S. Jeffries, 2005, Results of the 2005 survey of the reintroduced sea otter population in Washington State, Rapport non publié, 6 pages, cité par le « Programme de rétablissement de la loutre de mer (Enhydra lutris) au Canada » de 2007.
- United States Fish and Wildlife Service, 2008, Stock Assessment Report: Sea otters (Enhydra lutris): Southeast Alaska stock, 5 pages, Site web : http://alaska.fws.gov/fisheries/mmm/stock/southeast_sar_2008.pdf (consulté en avril 2008).
- United States Fish and Wildlife Service, 2008, Stock Assessment Report: Sea otters (Enhydra lutris): Southcentral Alaska stock, 5 pages, site web : http://alaska.fws.gov/fisheries/mmm/stock/southcentral_sar_2008.pdf (consulté en avril 2008).
- United States Fish and Wildlife Service, 2008, Stock Assessment Report: Sea otters (Enhydra lutris): Southwest Alaska stock, 6 pages, site web : http://alaska.fws.gov/fisheries/mmm/stock/southwest_sar_2008.pdf (consulté en avril 2008).
- « Sea otter population declines in the Aleutian archipelago », A.M. Doroff, J. A. Estes, M. T. Tinker, D. M. Burn et T. J. Evans, Journal of Mammalogy, 2003, N°84, pages 55-64.
- A. Burdin, communication personnelle, 2003, cité par le « Programme de rétablissement de la loutre de mer (Enhydra lutris) au Canada » de 2007.